依达拉奉对大鼠星形胶质细胞水通透性的影响
2014-08-15赵兴敏
李 颖,赵兴敏
0 引言
心脏骤停(Cardiac arrest,CA)后脑损害既是心肺复苏(Cardiopulmonary resuscitation,CPR)后的表现[1],也是导致病情加重直至死亡的主要原因之一[2]。大多数幸存者复苏后表现为昏迷和意识障碍并最终出现慢性伤残[3]。水通道蛋白家族(Aquaporins,AQPs)是一组与水电解质运输平衡密切相关的选择性细胞膜转运蛋白。星形胶质细胞是大脑主要的细胞,心脏骤停复苏后会出现水肿。本研究通过构建缺氧复氧模型,观察依达拉奉对星形胶质细胞模型水通透性和水通道蛋白4(AQP4)的影响,以探讨依达拉奉是否在心脏骤停复苏后的水肿中具有抑制作用。
1 材料与方法
1.1 大鼠星形胶质细胞原代培养 新生1~2 d Wistar大鼠乳鼠,经75%酒精消毒,断头处死,取脑放入冷的D-Hanks平衡盐溶液,去除脑膜及大血管。分离两侧大脑皮质并剪成1 mm3大小,加入0.25%胰蛋白酶37 ℃空气浴震荡消化10 min,用含10%FBS的DMEM培养基终止消化,1 000 rpm离心 10 min,去上清,再用含10%FBS的DMEM培养基重悬沉淀。经75 m筛网过滤,收集滤液,1 000 rpm离心 10 min,收集沉淀用含10%FBS的DMEM培养基重悬,调整细胞密度至1.5×106/mL,种植于75 cm2培养瓶,经1 h差速黏附去除成纤维细胞后,将细胞悬液转移到一新的75 cm2培养瓶继续培养,2 d换液1次。7 d后将培养瓶放入水平摇床,37 ℃,260 rpm 2 h,换液弃除小胶质细胞,放入培养箱平衡1 h,重新置于水平摇床,37 ℃,260 rpm 18 h,换液弃除少突胶质细胞,用新鲜培养基洗2遍,加入0.25%胰蛋白酶与0.02%EDTA 1∶1混合液消化、传代备用。采用GFAP兔抗大鼠多克隆抗体进行星形胶质细胞纯度鉴定(GFAP阳性率达95%以上)。
1.2 实验分组 将GFAP阳性率为95%以上细胞经胰酶消化后,用新鲜DMEM稀释至1×104细胞/mL浓度。将细胞悬液分装至96孔板内,并将平板放于5%CO2培养箱中,37 ℃培养至平板底部60%有细胞为止。更换新鲜的10%FBS的DMEM培养基,置37 ℃、5%(体积分数) CO2、95%(体积分数) N2的培养箱内进行缺氧培养8 h,8 h后即刻将接入95%(体积分数)N2的接口断开,重新接入95%(体积分数)的空气进行复氧培养9 h。将96孔板分成如下各组:空白组:细胞直接培养至实验结束;对照组:细胞直接培养,直接进行缺氧和复氧操作;刺激组:在缺氧处理前,向细胞中加入依达拉奉至终浓度为0.1、1、10、100 μg/mL,然后进行缺氧和复氧操作。
1.3 细胞水通透性检测 取出不同时间(通氧前、缺氧8 h、通氧3 h、通氧6 h和通氧9 h)各组3个孔的细胞,检测细胞对[3H]water (200 mCi/mL,Sigma)的通透性(Pd),结果以cm/sec表示。
1.4 Real time PCR 取出不同时间(通氧前、缺氧8 h、通氧3 h、通氧6 h和通氧9 h)各组3个孔的细胞,胰酶消化细胞,用PBS洗脱,400×g或1 700 rpm离心5 min,去上清,收集细胞。使用TRIzol Reagent试剂盒抽提细胞的总mRNA,并用DEPC水定量至5 μg/μL。使用PrimeScript One Step RT-PCR Kit将总mRNA拟转录成cDNA,并定量。特异性引物为:GAPDH-F:5′-TGGTGAAGGTCGGTGTGAAC-3′,GAPDH-R:5′-GCTCCGGAAGATGGTGATGG-3′;AQP4F:5′-TGGTTCAGTGCTTCGGCCAC-3′;AQ-P4R5′-CCAGCAGTGAGGTTTCCATG-3′,均为上海生工合成。以GAPDH为内参,使用SYBR Green荧光定量PCR试剂盒和伯乐的IQ5 PCR系统扩增cDNA中的组织因子基因片段和GAPDH基因片段,反应条件设置为:95 ℃变性5 min,94 ℃变性30 s,57 ℃退火1 min,72 ℃延伸30 s,30个循环,72 ℃延伸10 min。计算每个样品TF和GAPDH的△Ct,并采用△△Ct法计算每个样品中TF的mRNA转录倍数[14]。
1.5 Western Blot 取出不同时间(通氧前、缺氧8 h、通氧3 h、通氧6 h和通氧9 h)各组3个孔的细胞,胰酶消化细胞,用PBS洗脱,400×g或1 700 rpm离心5 min,去上清,用缓冲溶液[50 mM Tris-HCl,pH 7.4,150 mM NaCl,1%Nonidet P-40,0.5%deoxycholic acid,0.1%sodium dodecyl sulfate(SDS),5 mM ethylenediaminetetraacetic acid(EDTA),2 mM phenylmethylsulfonyl fluoride(PMSF),20 μg/mL aprotinin,20 μg/mL leupeptin,10 μg/mL pepstanin A,and 150 mM benzamidine]重悬细胞至5×1010个。破碎后12 000 rpm离心20 min后取上清进行电泳。使用5%浓缩胶和15%分离胶进行电泳分离,并使用电转将蛋白转至PVDF膜上。10%牛奶封闭PVDF膜1 h,37度孵育一抗1 h,然后PBST清洗3次,每次5 min,然后用37度孵育二抗稀释液,并用PBST清洗3次,每次5 min。最后用ECL+plusTM Western blotting system kit (Amersham,USA)配置显光液,使用3490 photo gel imaging systems (Epson,Japan)拍照并记录,并用Image Pro PLUS软件分析每个蛋白与GAPDH的相对量。
1.6 统计学分析 采用SPSS 16.0软件进行统计学分析,所有计量资料比较均采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 缺氧和复氧过程中星形胶质细胞水通透性和AQP4表达 对原代培养的细胞缺氧8 h处理,然后复氧12 h,检测缺氧复氧过程中0 h、8 h、复氧后4 h、复氧后6 h和复氧后8 h星形胶质细胞水通透性和AQP4表达情况,结果见图1~图3。结果显示,缺氧阶段对照组和空白组水通透性、AQP4 mRNA和蛋白表达量差异均无统计学意义,复氧6 h和8 h时对照组水通透性、AQP4 mRNA和蛋白表达量均显著高于空白组。说明缺氧8 h和复氧6 h或8 h均可构建出星形胶质细胞水肿模型,且细胞水肿后AQP4表达量会上升。选择缺氧8 h和复氧6 h作为复氧模型构建方法。

图1 缺氧和复氧过程中星形胶质细胞水通透性变化情况
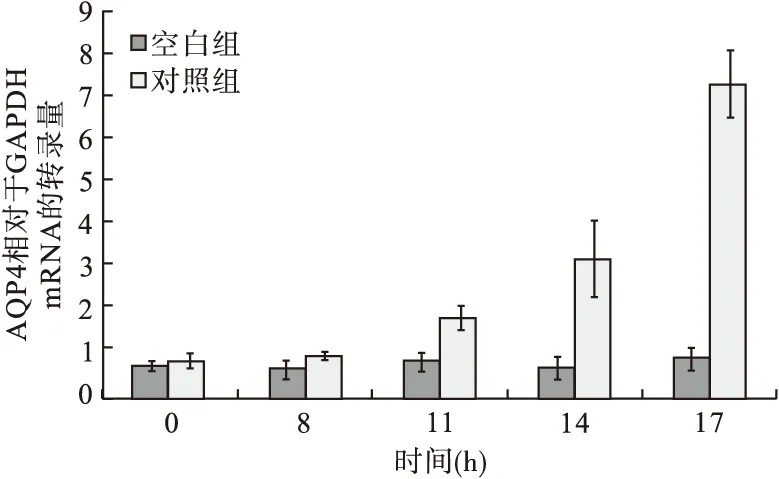
图2 缺氧和复氧过程中星形胶质细胞AQP4 mRNA表达情况

图3 缺氧和复氧过程中星形胶质细胞AQP4蛋白表达情况
2.2 依达拉奉对星形胶质细胞水通透性和AQP4表达的影响 取缺氧8 h和复氧6 h的星形胶质细胞作为缺氧复氧模型的构建方法。按照“1.2”中的方法对细胞进行刺激,在复氧6 h时检测各组细胞水通量、AQP4 mRNA水平和蛋白表达水平,结果见图4~图6。0.1 μg/mL依达拉奉刺激后,细胞水通量、AQP4 mRNA水平和蛋白表达量与对照组比较差异无统计学意义(P均>0.05),1、10或100 μg/mL依达拉奉刺激后,细胞水通量、AQP4 mRNA水平和蛋白表达量显著低于对照组(P均<0.05),与空白组比较差异无统计学意义(P均>0.05)。

图4 不同浓度依达拉奉刺激后星形胶质细胞水通量变化情况

图5 不同浓度依达拉奉刺激后星形胶质细胞AQP4 mRNA水平变化情况
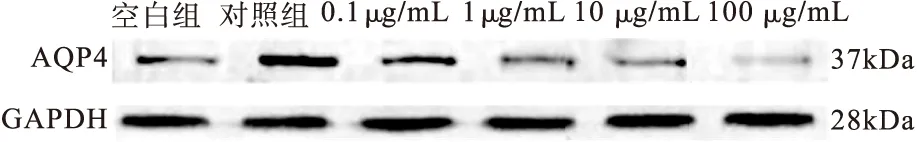
图6 不同浓度依达拉奉刺激后星形胶质细胞AQP4蛋白变化情况
3 讨论
本文探讨依达拉奉对缺氧和复氧后的星形胶质细胞AQP4表达以及细胞水肿的影响,结果如下:(1)缺氧8 h和复氧6 h或8 h可显著增加星形胶质细胞水通量以及细胞内AQP4 mRNA水平和蛋白表达,引起细胞水肿;(2)0.1 μg/mL依达拉奉刺激无法显著改变细胞水肿情况;(3)1、10或100 μg/mL依达拉奉刺激后,细胞水通量、AQP4 mRNA水平和蛋白表达量均显著下降。上述结果说明,1、10或100 μg/mL依达拉奉可通过抑制AQP4 mRNA水平和蛋白表达来达到显著抑制细胞水肿的效果。
依达拉奉是一种可以清除脑部自由基的药物,用于治疗脑梗死引起的神经病变[4-5]。大鼠实验显示,在缺血/缺氧再灌注后静脉给予依达拉奉,可阻止脑水肿和脑梗死的进展,并缓解所伴随的神经症状,抑制迟发性神经元死亡[6]。临床研究显示,依达拉奉可清除自由基,抑制脂质过氧化,从而抑制脑细胞、血管内皮细胞、神经细胞的氧化损伤[6-7]。另外,大量的研究表明,脑梗死过程中会伴随脑水肿,主要表现为胶质细胞的水肿。胶质细胞水肿是一种常见的脑部损伤后再复苏的症状,是在脑部剧烈损伤后表现的一种脑部损伤。临床研究表明,药物可以抑制胶质细胞水肿,进而达到保护神经病变的作用[8]。内源性H2S抑制脑水肿是常见的临床现象,药物刺激也会抑制[9]。因此,依达拉奉很可能也会表现为抑制星形胶质细胞水肿的临床效果。本文的结果显示,1、10或100 μg/mL依达拉奉会抑制AQP4 mRNA水平和蛋白表达,从而达到显著抑制细胞水肿的效果。黄亮等[10]评价了依达拉奉干预后大鼠心肺复苏后脑AQP4表达与脑水肿动态变化,结果得出,心肺复苏后大脑水肿的同时,组织AQP4 mRNA和蛋白表达量均显著升高,但依达拉奉干预后大鼠脑水肿减轻,且AQP4表达量均下降,说明依达拉奉可通过降低脑组织内AQP4的表达量来达到减轻脑水肿的作用。尹泽黎等[11]发现,依达拉奉可通过清除自由基而发挥抑制脑水肿的作用。并且在临床上,依达拉奉联合血塞通注射液治疗可明显减轻脑水肿[12]。屈家虎等[13]使用亚低温联合依达拉奉也可使颅脑外伤后脑水肿减轻。张衍等[14]进一步阐述了依达拉奉抑制水肿的分子机制,明确了AQP4被抑制后细胞水肿也被抑制。本研究发现,依达拉奉可直接作用大脑主要的神经细胞星形胶质细胞,且与上述脑水肿类似的是,依达拉奉通过抑制AQP4表达,发挥抑制神经细胞星形胶质细胞的水肿。
本研究观察到依达拉奉对星形胶质细胞的水肿具有抑制作用,但尚未证明依达拉奉是通过抑制星形胶质细胞水肿来抑制脑部水肿,如需证明这一结论,需要在脑部组织检测组织内星形胶质细胞AQP4表达以及水肿情况。另外,由于本文是直接药物刺激,机体内依达拉奉是否直接刺激细胞或者通过相关途径发挥作用,还需要进一步去研究分析。
参考文献:
[1] Fink EL,Panigrahy A,Clark RS,et al.Regional brain injury on conventional and diffusion weighted MRI is associated with outcome after pediatric cardiac arrest[J].Neurocrit Care,2013,19(1):31-40.
[2] Zanatta P,Messerotti BS,Baldanzi F,et al.Pain-related somatosensory evoked potentials and functional brain magnetic resonance in the evaluation of neurologic recovery after cardiac arrest:a case study of three patients[J].Scand J Trauma Resusc Emerg Med,2012,20:22.
[3] Wang T,Tang W,Sun S,et al.Intravenous infusion of bone marrow mesenchymal stem cells improves brain function after resuscitation from cardiac arrest[J].Crit Care Med,2008,36(11):S486-S491.
[4] Miyazawa K,Miyagi S,Maida K,et al.Edaravone,a free radical scavenger,improves the graft viability on liver transplantation from non-heart-beating donors in pigs[J].Transplant Proc,2014,46(4):1090-1094.
[5] 王国印,侯婧.依达拉奉联合丁苯酞治疗急性脑梗死疗效观察及对血清C反应蛋白的影响[J].中国医药,2013,8(8):1079-1080.
[6] Cheng XL,Zhang JJ.Effect of edaravone on apoptosis of hippocampus neuron in seizures rats kindled by pentylenetetrazole[J].Eur Rev Med Pharmacol Sci,2014,18(6):769-774.
[7] 李文成,王刚,陈解元,等.依达拉奉对气腹大鼠肝内胆管上皮细胞凋亡、Bcl-2表达的影响[J].实用医学杂志,2013,29(7):1058-1060.
[8] 姚惠亚,张连生,伍进,等.依达拉奉对急性脑梗死患者神经元特异性烯醇化酶和C反应蛋白水平及预后的影响[J].中国医师杂志,2012,14(3):411-413.
[9] Minamishima S,Bougaki M,Sips PY,et al.Hydrogen sulfide improves survival after cardiac arrest and cardiopulmonary resuscitation via a nitricoxide synthase 3-dependent mechanism in mice[J].Circulation,2009,120(10):888-896.
[10] 黄亮,刘雪兰,曹春水,等.依达拉奉对心肺复苏后脑水通道蛋白-4表达的影响[J].中华急诊医学杂志,2008,17(7):696-700.
[11] 尹泽黎,许宏伟,袁宁.依达拉奉治疗急性脑出血后脑水肿变化及清除自由基的临床观察[J].中风与神经疾病杂志,2008,25(3):313-315.
[12] 张勇,张秀芝.依达拉奉联合血塞通注射液治疗脑出血后期顽固性脑水肿的作用研究[J].甘肃中医,2009,22(7):15-16.
[13]屈家虎,胡观成.亚低温联合依达拉奉治疗颅脑外伤后脑水肿的疗效[J].医学临床研究,2010,27(12):2331-2332.
[14]张衍,王焕成,宋明爱.依达拉奉改善大鼠血脑屏障损伤的AQP-4机制研究[J].中国实用神经疾病杂志,2010,13(2):5-7.
