猕猴B病毒gB蛋白胞外区基因片段的合成和真核表达
2014-08-14刘慧芳孙书芳易思萌马雨楠范君文孙兆增
刘慧芳,孙书芳,曾 林,易思萌,游 颖,马雨楠,范君文,孙兆增,王 新
(1. 军事医学科学院实验动物中心,北京 100071;2.青岛农业大学,山东 青岛 266109;3. 山东省青岛市中心血站,山东 青岛 266071)
猕猴B病毒又称为猴疱疹病毒Ⅰ型(cercopithecine herpesvirusⅠ),是目前发现的唯一可以感染人的动物源性疱疹病毒。感染猕猴B病毒的猴终生携带病原,并不定期的向外排毒传染性较强。当病毒侵入人神经系统,治疗基本失去意义[1-4]。检测B病毒的传统方法是病毒的分离培养及血清学实验。由于B病毒操作的危险性、分离培养耗时较长、实验条件要求较高,因此仅仅局限在少数实验室进行。以B病毒作检测抗原,由于它与人的单纯疱疹病毒Ⅰ型(HSV-1)和人的单纯疱疹病毒Ⅱ型(HSV-2)病毒具有较强的抗原交叉性,而难以保证检测的准确性[5]。找到B病毒特异性抗原是对B病毒准确诊断的关键所在。
一般用猴子和人血清中的IgG 来作为B病毒的诊断蛋白,在评估诊断效果时,对囊膜蛋白gB,gC,gD,gE,进行比较发现gB囊膜蛋白的灵敏性和特异性都达到100%[6]。故本实验对gB囊膜蛋白基因序列进行了合成。B病毒囊膜蛋白gB包括信号肽、胞外区、跨膜区、胞内区4个部分。猕猴B病毒囊膜蛋白蛋白的胞外区部分比胞内区和跨膜区有更好的免疫原性和反应原性,是刺激机体产生抗体的有效抗原成分[7],故本实验采用基因合成的方法合成胞外区部分基因序列,以便获得重组抗原。为了新生蛋白在位于N端的信号肽的指引下到达细胞膜表面表达[8],在gB蛋白的胞外区部分序列前加入MHC分子的Mamu-B*007:03基因序列。在合成的序列中也加入了Myc标签的基因序列,以便于检测gB蛋白的胞外区表达情况。
1 材料和方法
1.1 材料
猕猴B病毒合成基因(军事医学科学院实验动物中心提供),DH5α感受态细胞、质粒回收试剂盒、胶回收试剂盒、DNA Marker 2000、DNA Marker 10000、2xTaqmix购自北京博迈德生物公司。T4连接酶、限制性内切酶BamHⅠ和NotⅠ等,购自 NEB公司。转染试剂Lipofectamine 2000购自 Invitrogen 公司。细胞培养试剂购自 Hyclone 公司。Myc标签一抗购自AB-mart公司。辣根过氧化物酶标记的山羊抗小鼠IgG,购自中杉金桥公司。
1.2 方法
1.2.1 gB基因合成
从GenBank 上获得 B 病毒的gB 蛋白胞外区序列,在序列前加入MHC分子的一段序列,使gB蛋白序列在细胞膜表面表达,然后加入信号肽序列引导该序列的表达。在序列两端加入BamHⅠ和NotⅠ酶切位点。合成序列总长度为1762 bp,命名为gB合。然后根据gB合基因的碱基序列,设计猕猴gB合基因的鉴定引物,上游引物5’- ggcccctcgttccgcttctcctc-3’,下游引物5’- cagcttgcgggcctcgttccacag-3’,扩增片段为494 bp,以上均由北京博迈德生物有限公司合成。由于绿色荧光蛋白可能会对新构建的融合蛋白有影响,因此首先利用基因工程的方法将载体中的绿色荧光蛋白基因去掉。
1.2.2 pEGFP-N3-gB合重组质粒的构建
将合成的gB基因提取质粒,用BamHⅠ和NotⅠ进行双酶切,对于pEGFP-N3质粒进行相同的酶切,然后用T4连接酶进行连接,连接产物转化于DH5α感受态细胞,用PCR的方法选出阳性克隆,对于PCR阳性的质粒,利用酶切的方法进一步鉴定。
1.2.3 细胞培养和重组质粒的转染
用含有10%胎牛血清的DMEM于37℃ 5% CO2培养箱培养293细胞,传代于6孔板。当6孔板的密度在对数期且密度在70%,用Lipofectamine 2000 转染重组质粒。转染后的细胞于37℃ 5% CO2培养箱培养24~48 h,收集细胞做以下实验。
1.2.4 Western blot 免疫印迹实验
根据普利莱基因公司的细胞核-胞浆-胞膜制备试剂盒提取蛋白。取50 μL总蛋白进行10%SDS-PAGE蛋白电泳,然后转移到PVDF膜上进行Western-blot检测。对PVDF膜用5%脱脂奶粉封闭2 h,加入Myc一抗4℃摇床孵育12 h,清洗后加入山羊抗鼠的二抗,室温孵育2 h,用TBST缓冲液清洗3次后加入发光剂显色于暗室进行X-光片曝光、显影。
1.2.5 细胞表达定位实验
连续培养24 h后,利用4%多聚甲醛固定15 min对细胞进行固定,0.3%Triton X-100透化处理。加入10%的BSA封闭后再孵育myc标签一抗,FITC(fluorescein isothiocyanate isomer I, 异硫氰酸荧光素)荧光二抗。接着用浓度为1 ug/mL的Rase(1 mL/孔)消化RNA然后加入PI,600 uL染色10 min。然后加入抗荧光猝灭封固液,固定封片,最后利用共聚焦显微镜,观察、拍照。
2 结果
2.1 基因合成结果分析
利用BamHⅠ和NotⅠ对gB合基因进行酶切鉴定,得到目的片段(图1)。基因片段大小在1000 bp~2000 bp之间,与预期结果1762 bp基本相符。
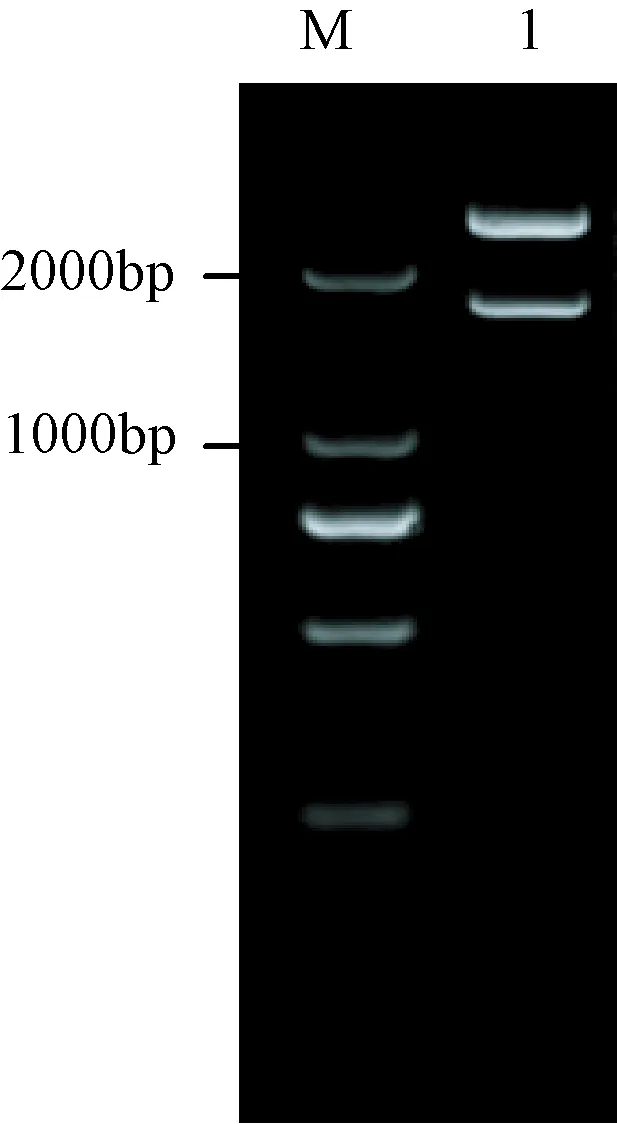
注:M:2000 DNA marker; 1:重组质粒PMD18-T-gB合的BamHⅠ和NotⅠ双酶切结果。
2.2 pEGFP-N3-gB合重组质粒的构建结果分析
将gB合从基因合成的质粒上切下,利用T4连接酶将片段定向连接到pEGFP-N3载体。将连接后产物转化到DH5α感受态细胞,用PCR的方法选出阳性克隆,对于PCR阳性的质粒,利用酶切的方法进一步鉴定(图2)。
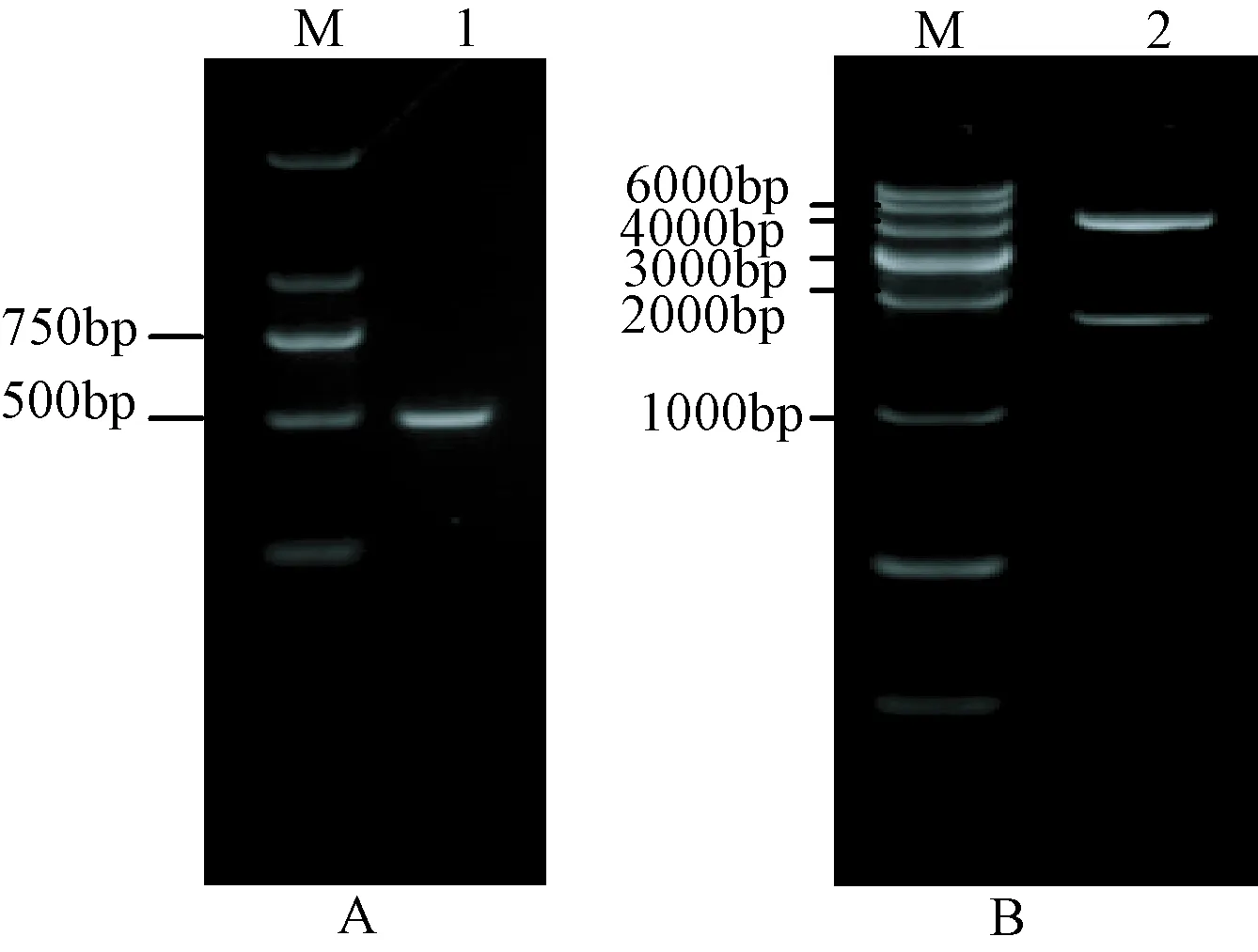
注:A(PCR) M:DNA分子量标准;1 重组质粒pEGFP-N3-GB合的PCR鉴定结果;B(酶切)M:DNA分子量标准;2 重组质粒pEGFP-N3-GB合的BamHⅠ和NotⅠ双酶切结果。
2.3 pEGFP-N3-gB合的Western-Blot鉴定
利用Western-Blot对pEGFP-N3-gB合的表达情况进行鉴定。蛋白分子量大小预测为65.2×103,Western-Blot结果显示目的蛋白分子量大小接近70×103(图3),与预期结果65.2×103基本相符。

注:1.质粒pEGFP-N3对照;2.重组质粒pEGFP-N3-gB合的蛋白表达,M,低分子量蛋白质标准。
2.4 pEGFP-N3-gB合在细胞内的定位表达
对含有Myc标签的pEGFP-N3-gB合重组质粒转染到293细胞,在激光共聚焦显微镜下观察发现myc标记的蛋白发出明亮的绿色荧光,细胞核为红色球形(图4,彩插2)。进一步观察重组蛋白在细胞内的定位情况进行研究发现,重组蛋白在细胞膜上表达,这与预期加入MHC分子引导序列在细胞膜上的表达相一致。
3 讨论
随着对猕猴B病毒结构的研究不断深入,特别是猕猴B病毒的全基因组测序的完成,囊膜糖蛋白(glycoprotein)逐渐成为猕猴B病毒诊断和防治研究的主要靶点。国内已利用基因工程技术产生猕猴B病毒囊膜重组蛋白,隋丽华等[9],利用原核表达系统产生gB蛋白特异性表位重组抗原,严翔等[10]用杆状病毒作为表达载体构建了gB合成基因的杆状病毒质粒。段博芳等[11]用猕猴B病毒gB基因在昆虫细胞中表达,以上证实重组蛋白具有较好的抗原性。
为了进一步观察gB重组蛋白的在细胞内的表达情况,本实验合成gB胞外区基因,构建了pEGFP-N3-GB合重组质粒,在真核细胞中进行表达并观察在细胞内的定位情况。结果显示,pEGFP-N3-GB合重组质粒在细胞内高效表达,利用亚细胞定位技术证明了gB蛋白的胞外区基因序列能在细胞膜表面高效表达重组蛋白,为获得猕猴B病毒灵敏性和特异性较好的重组蛋白提供好的方法,为下一步检测试剂盒的制备奠定的基础。
参考文献:
[1] 肖镜,付瑞,贺争鸣,等. 猴B病毒gD-多肽ELISA 检测方法的建立[J]. 实验动物科学,2008,25(2): 20-23
[2] Weigler B J. Biology of virus in macaque and human hosts a review [J]. Clin Iect D is, 1992,14: 555-567.
[3] Xuan X, Kojima A, Murata T,etal. Analysis of canine herpes virus gB, gC and gD expressed by a recombinant vaccine virus[J]. Arch Virol, 1997, 142: 1003-1010.
[4] Besecher M I, Harden H E, Li G,etal. Discovery of herpes Bvirus-encoded micro RNAs[J]. Virology, 2009, 83(7): 3413-3416.
[5] 盘宝进. 用 B病毒 ELISA 和人单纯疱疹病毒Ⅰ型酶免疫法检测食蟹猴血清中 B 病毒相关抗体的研究[J]. 广西畜牧兽医, 2005, 21(1): 10-12.
[6] Perelygina L, Patrusheva I, Hombaiah S,etal. Production of herpes B virus recombinant glycoproteins and evaluation of their diagnostic potential[J]. Journal of clinical microbiology, 2005, 43(2): 620-628.
[7] 张小飞,叶华虎,赵彦斌,等. 猴 B病毒囊膜蛋白gB特异性抗原表位的筛选与表达鉴定[J]. 中国比较医学杂志, 2010 (10): 10-14.
[8] 彭佳师,龚继明. 信号肽与蛋白质的分选转运[J]. 植物生理学报,2011,47(1):9-17.
[9] 隋丽华,刘一,赵彦斌,等. 猕猴 B病毒gB蛋白特异性抗原表位的合成和表达[J]. 中国比较医学杂志,2013 (3):4-7.
[10] 严翔, 曹玉华, 刘慧芳, 等. 猕猴 B病毒gB和gC合成基因重组杆状病毒质粒的构建[J]. 实验动物科学,2013, 30(6).
[11] 段博芳,王琼,锻纲,等. 猴B病毒gB基因在昆虫细胞中的表达[J].中国人兽共患病学报,2012,28(7):674-678.
