Fah-/-小鼠对NTBC的药物依赖性观察
2014-08-14彭雨婷孔祥平李绍林刘光泽
彭雨婷,武 昕,孔祥平,李绍林,刘光泽
(1. 解放军第458医院全军肝病中心转基因工程室,广州 510602;2.沈阳药科大学生命科学与生物制药学院,沈阳 110016)
延胡索酰乙酰乙酸水解酶(fumarylacetoacetate hydrolase, Fah)基因敲除小鼠,简称Fah-/-小鼠,是由Grompe等[1]建立的酪氨酸血症Ⅰ(tyrosinemia type I, HT1)小鼠模型。该模型由于Fah的缺失,导致酪氨酸代谢受阻,毒性代谢产物蓄积,引起肝、肾的严重损伤[2-3]。2-(2-硝基-4-三氟甲基苄基)-环己烷-1,3-二酮(NTBC)药物能够抑制酪氨酸降解通路中4-对羟基苯丙酮酸双氧化酶(4-HPPD)的活性,减少有毒代谢产物产生,临床上用于治疗高酪氨酸血症[4]。Fah-/-小鼠存在广泛而持续的肝损伤,可用于细胞移植、肝脏持续损伤、肝再生及肝癌的研究中[5-9]。本研究观察Fah-/-小鼠对NTBC的药物依赖性,更详尽的掌握该模型的生物学特征,使该模型得以更有效的利用。
1 材料和方法
1.1 材料
1.1.1 实验动物
SPF级balb/c品系Fah-/-小鼠,体重23~25 g,10周龄公鼠24只,10周龄孕鼠51只,受赠于厦门大学,由解放军第四五八医院动物实验中心饲养繁殖,饲养时饮用水中添加8 mg/L NTBC;SPF级balb/c品系野生型小鼠8只,体重23~25 g,10周龄,购自南方医科大学实验动物中心【SCXK(粤)2011-0015】,由解放军第四五八医院动物实验中心提供及饲养【SYXK(军)2012-0059】。正常进食。
动物饲养条件为:12h光照/12h黑暗节律,所有动物都用标准饲料和饮水饲养。实验过程中对动物的处置符合动物伦理学标准。
1.1.2 主要试剂和仪器
2-(2-硝基-4-三氟甲基苄基)-环己烷-1,3-二酮 (NTBC)购自上海瑞博化学有限公司(CAS:104206-65-7);苏木素、伊红购自福州迈新生物科技有限公司;中性树脂封片剂购自武汉博士德公司;石蜡切片机购自德国Leica公司;恒温烤箱购自北京医疗设备厂;正置显微镜购自日本Olymphas公司;不锈钢高压锅购自福州迈新生物科技有限公司;显微专业数码图像系统购自日本Olympus公司;十万分之一天平购自日本岛津公司。
1.2 方法
1.2.1 观察NTBC对Fah-/-小鼠形态学和体重的影响
将24只10周龄Fah-/-小鼠分为三组:a.对照组(n=8),服用NTBC;b.实验组1(n=8),间歇停药,具体是停药3周后,持续给药2周,继续停药;c.实验组2(n=8),停药不重复给药。记录小鼠生存状态,形态学变化,每周称重两次,取各组体重均值,绘制体重曲线。
1.2.2 血清学检测
Fah-/ -小鼠停药组在第1,2,3,4,5,6周眼眶采血,离心分离获得血清,检测血清中ALB,AST,ALT,ALP水平[10]。
1.2.3 肝脏病理学检测
1.2.3.1 制备组织切片
分别取Balb/c野生小鼠和NTBC停药第0,1,2,3,4,5,6周的Fah-/-小鼠小鼠的肝脏相同部位(0.8 cm × 0.8 cm × 0.3 cm),生理盐水清洗,4%多聚甲醛固定24 h,常规石蜡包埋、切片。
1.2.3.2 苏木素、伊红(HE)染色
60℃烤片1 h,常规脱蜡水化,苏木素染色5~10 min,水中返蓝5~10 min,1%盐酸酒精溶液分化 3~10 s,水洗2 min,伊红复染5~10 min,水洗2 min,切片常规脱水透明干燥,中性树胶封片,显微镜下观察。
1.2.4 NTBC对Fah- / -小鼠繁殖情况影响
统计2013年4月至2014年4月一年内Fah- / -小鼠每窝产仔数量,与野生型窝产仔数进行统计学比较[11]。
1.2.5 数据处理及统计分析
利用spss19.0统计分析软件对数据进行分析,统计分析采用重复测量方差分析和单因素方差分析。以α=0.05为检验水准,P< 0.05为差异有统计学意义。
2 结果
2.1 NTBC对Fah- / -小鼠形态学和体重的影响
对照组:Fah-/-小鼠饮用水中一直给予NTBC,体重稳步增长,健康存活。实验组1:Fah-/-小鼠第一次停药,体重进行性下降,3周后体重为初始体重的70%~80%,有显著性差异(P< 0.05),第3周饮用水中给与NTBC,第5周体重回升到初始体重后再次停药,体重维持一周后再次呈进行性下降,小鼠最终存活时间为7~10周。实验组2:从实验开始,Fah-/-小鼠停止给予NTBC,体重呈进行性下降,小鼠最终存活时间5~7周。体重曲线见图1。
Fah-/-小鼠停药后活力逐渐降低,3周后出现弓背,毛刺,连续停药5周后肢体行动不协调,易呈昏睡状,且体重明显减轻(P< 0.05);如果再次给药,其状态、体重可逐渐恢复,生活状态也有所改善;死亡时体重约为初始体重的60%~70%。

注:对照组:持续给药NTBC;实验组1:间歇停药NTBC。实验组2:持续停药NTBC。
2.2 血清学指标检测
停药后,Fah-/-小鼠从第2周后ALB持续降低,ALT、AST、ALP指标逐渐升高,从第3周开始有明显的统计学差异(P< 0.01)(见图2)。
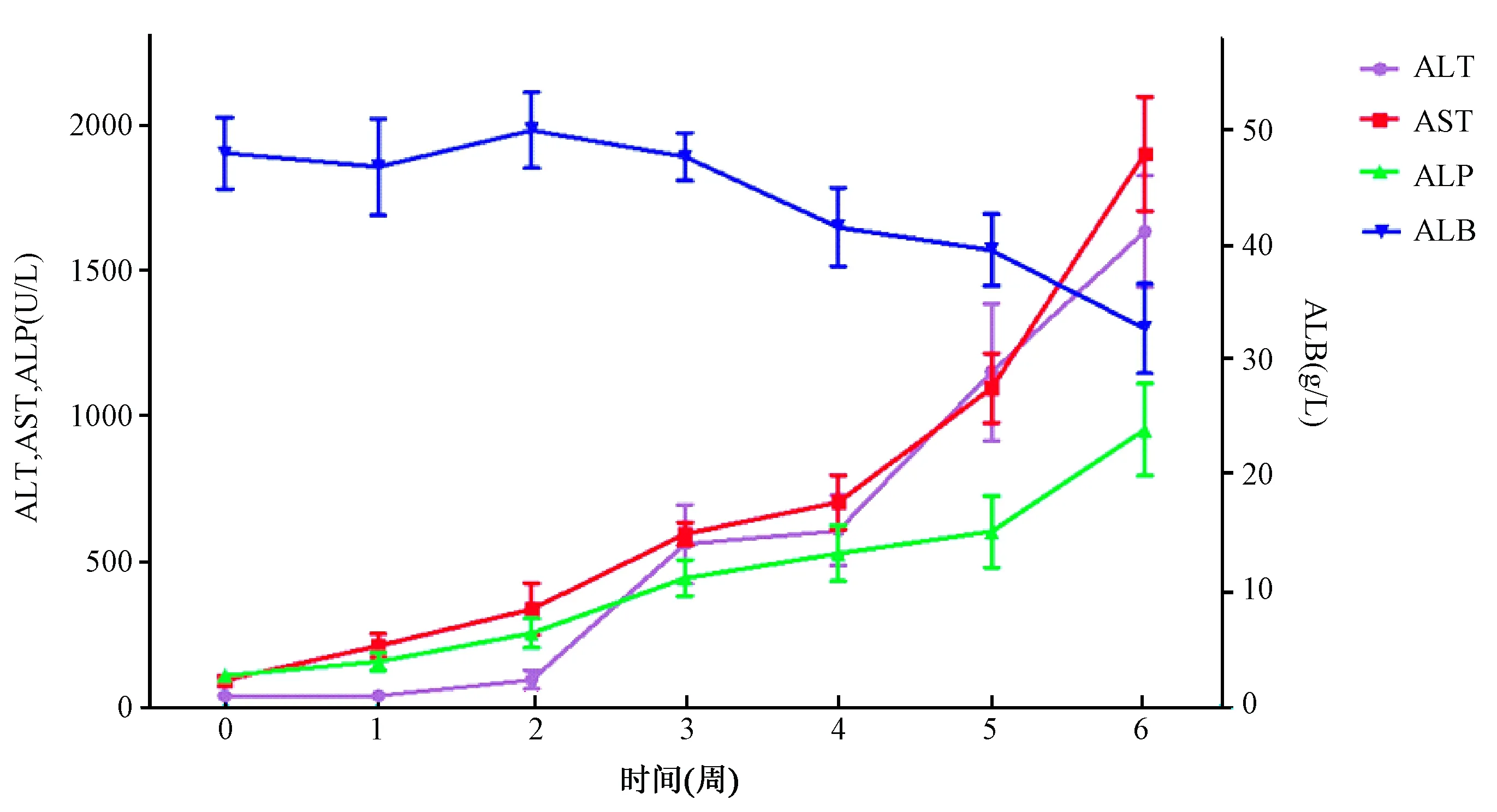
图2 Fah-/-小鼠去除NTBC后血清学指标随时间的变化曲线
2.4 肝组织病理学观察
对照组1:Balb/c野生型小鼠肝脏,肝组织结构完整,肝小叶轮廓清晰,细胞排列紧密有序,细胞形态饱满,胞浆充盈。对照组2:给药NTBC,Fah-/-小鼠肝脏病理学形态与野生型相似,无炎性病症。实验组:随着停用NTBC的时间的增加,肝脏正常组织结构消失,中性粒细胞、淋巴细胞等炎性细胞逐步浸润,肝细胞由点状坏死向灶状、片状坏死发展,肝细胞索排列紊乱,细胞界限不清晰,体积增大,核收缩,胞浆疏松。4周后胞质内可见大量的脂肪空泡和气球样变性,肝细胞大量坏死并伴有严重的炎性病症和细胞凋亡(见图3,彩插1)。
2.5 NTBC对Fah- / -小鼠繁殖情况影响
2013年4月到2014年4月,一年中繁殖Fah-/-小鼠51窝,平均窝产仔7.29只,Balb/c野生鼠平均窝产仔7.56只。P> 0.05,Fah-/-小鼠窝产仔情况与Balb/c野生型无统计学差异。终身服药NTBC对Fah- / -小鼠繁殖能力无明显影响。
3 讨论
Fah-/-小鼠肝损伤原理同酪氨酸血症Ⅰ型的发病机制。酪氨酸血症Ⅰ型是一种少见的常染色体隐性遗传病,又称肝肾型酪氨酸血症,患病率约为1/2000至1/10 000。其发病机制主要是由于肝、肾组织中延胡索酰乙酰乙酸水解酶(Fah)活性降低或缺失,导致酪氨酸代谢途径的终端代谢发生障碍,不能正常代谢延胡索酸和乙酰乙酸。延胡索酰乙酰乙酸积累,其上游代谢物酪氨酸、4-羟基苯丙酮酸升高,使中间代谢产物马来酰乙酰乙酸进一步积累,刺激产生旁代谢途径。马来酰乙酰乙酸和延胡索酰乙酰乙酸经旁代谢生成琥珀酰乙酰乙酸,后又再生成琥珀酰丙酮(SA)。这两种旁代谢产物可以与蛋白质的巯基结合,二者含量增高造成严重的肝损伤及肾小管缺陷[13-14],肝细胞和肾小管上皮细胞的细胞凋亡是这种疾病的主要特征。目前,临床上通过琥珀酰丙酮诊断酪氨酸血症Ⅰ型。
2-硝基-4-三氟甲苯-1,3环乙垸碘(NTBC),又称尼替西农,能够抑制酪氨酸降解通路第二步4-对羟基苯丙酮酸双氧化酶(4-HPPD)的活性,从而减少下游旁代谢途径中的有毒代谢产物,起到治疗作用。同时,NTBC抑制了酪氨酸向4-羟基苯丙酮酸的代谢,血酪氨酸增高,需控制蛋白质的摄取。总的来说,NTBC是替代肝肾移植治疗酪氨酸血症Ⅰ型最直接有效的方法。1992年,NTBC应用于临床治疗,生存率>90%。
Fah-/-小鼠通过敲除Fah基因,模拟酪氨酸血症Ⅰ型症状,肝损伤原理来自酪氨酸血症Ⅰ型的发病机制。Fah-/-小鼠在饲养过程中饮用水中添加8 mg/L的NTBC,不出现酪氨酸血症Ⅰ型病症,健康存活,生物学特性同野生型,是能够稳定遗传、易繁殖的小鼠模型。当NTBC停供,小鼠体重进行性降低,可低至初始体重的60%~70%,5~7周死亡,损伤持续稳定并未见自然恢复。生命活力3周后明显降低,并伴有弓背、毛刺的现象;5周后开始,精神不济,肢体不勤,弓背程度加重。肝损伤发生后重新喂药,损伤停止加剧,体重逐渐恢复。说明Fah-/-小鼠对NTBC有严重药物依赖性,不给与NTBC,Fah-/-小鼠不能存活,Fah-/-小鼠出现酪氨酸血症Ⅰ型症状。但有实验指出对Fah-/-小鼠进行多次的停药喂药实验,反复的肝脏损伤和再生还可以诱导肝癌的发生[15-16]。
血清学指标检测结果反映出肝脏呈持续性损伤。ALT与AST存在于肝细胞膜,能够反映出肝实质细胞膜通透性的变化。停药过程中,肝细胞逐渐坏死、凋亡,细胞膜破裂的同时释放ALT与AST到血液,使血清中二者水平升高。ALT、AST、ALP水平与肝损伤程度呈正相关,ALP水平变化不如ALT、AST显著;ALB水平与肝损伤程度呈负相关[12],ALB降低呈现肝损伤加重。
停药后肝组织病理学和形态学特征变化具有阶段性,规律性,反映出不同阶段的细胞损伤情况,小鼠肝脏损伤的时间和程度可以通过NTBC药物的系统调节来进行控制。在连续给药的情况下,Fah-/-小鼠的各项生理指标、生物学特性和生殖情况与野生型小鼠基本一致。当对小鼠进行断药处理后,逐渐有炎性细胞侵润,发生炎症反应,肝细胞开始大规模坏死,胞质内形成大块脂肪空泡和气球样变性,停药后期肝细胞坏死伴随大量细胞凋亡,肝细胞发生细胞凋亡导致肝脏损伤。
Fah-/-小鼠对NTBC有依赖性,需终身服用,NTBC能通过抑制下游旁代谢途径中的有毒代谢产物产生来阻止Fah-/-小鼠肝损伤;Fah-/-小鼠模型可以很好的模拟人类酪氨酸血症Ⅰ型产生的各种症状,是研究该遗传病的理想模型;同时,该模型形成的持续性不可逆的肝损伤,也适用于研究外源细胞在小鼠体内的定植状况。因此,Fah-/-小鼠模型被广泛应用于相关的肝病基础研究、肝病细胞治疗、肝脏持续损伤、肝再生及肝癌的研究领域。
参考文献:
[1] Grompe M, Al-Dhalimy M, Finegold M,etal. Loss of fumarylacetoacetate hydrolase is responsible for the neonatal hepatic dysfunction phenotype of lethal albino mice[J]. Genes & development, 1993, 7(12a): 2298-2307.
[2] Orejuela D, Jorquera R, Bergeron A,etal. Hepatic stress in hereditary tyrosinemia type 1 (HT1) activates the AKT survival pathway in thefah-knockout mice model[J]. Journal of hepatology, 2008, 48(2): 308-317.
[3] Qi Z, Wang X, Wei H,etal. Infiltrating neutrophils aggravate metabolic liver failure in fah‐deficient mice[J]. Liver International, 2014,DOI: 10.1111/liv.12594.
[4] Masurel-Paulet A, Poggi-Bach J, Rolland M O,etal. NTBC treatment in tyrosinaemia type I: long-term outcome in French patients[J]. Journal of inherited metabolic disease, 2008, 31(1): 81-87.
[5] Su B L, Liu C C, Xiang D,etal. Xeno-repopulation of Fah-/-Nod/Scid mice livers by human hepatocytes[J]. Science China Life Sciences, 2011, 54(3): 227-234.
[6] Buitrago‐Molina L E, Marhenke S, Longerich T,etal. The degree of liver injury determines the role of p21 in liver regeneration and hepatocarcinogenesis in mice[J]. Hepatology, 2013, 58(3): 1143-1152.
[7] Alison M R, Lovell M J. Liver cancer: the role of stem cells[J]. Cell proliferation, 2005, 38(6): 407-421.
[8] Kubo S, Sun M, Miyahara M,etal. Hepatocyte injury in tyrosinemia type 1 is induced by fumarylacetoacetate and is inhibited by caspase inhibitors[J]. Proceedings of the National Academy of Sciences, 1998, 95(16): 9552-9557.
[9] 苏宝亮, 刘长城, 李帅, 等. Fah 基因剔除小鼠在肝细胞移植中的应用及其病理学变化[J]. 中国药科大学学报, 2009 9, 40(6): 553 - 558.
[10] Wilber A, Wangensteen K J, Chen Y,etal. Messenger RNA as a Source of Transposase for Sleeping Beauty Transposon-mediated Correction of Hereditary Tyrosinemia Type I[J]. Molecular Therapy, 2007, 15(7): 1280-1287.
[11] 张洪, 鲍波. 浅谈国内BALB/c小鼠及KM小鼠的基本生物学特性[J]. 中国实用医药, 2010 (3): 252-254.
[12] 魏立,张丽娟, 张跃新. 肝病患者血清学指标与肝纤维化程度的关系[J]. 标记免疫分析与临床, 2009, 16(4): 205-208.
[13] Fernandes J, Saudubray J M, Van Den Berghe G,etal. Inborn metabolic diseases: diagnosis and treatment[M]. Springer, 2006:233-243.
[14] 杨楠, 韩连书, 叶军, 等. 尼替西农治疗2例酪氨酸血症Ⅰ型的效果分析并文献复习[J]. 临床儿科杂志, 2012, 29(12): 1178-1181.
[15] Nieto N, Friedman SL, Cederbaum Al. Stimulation and proliferation of primary rat hepaticstellate cells by cytochrome P450 2E1-derived reactive oxygen species[J]. Hepatology,2002, 35 (1): 62-73.
[16] Nieto N. Ethanol and fish oil induce NFkappaB transactivation of the collagen alpha2(l)promoter through lipid peroxidation-driven activation of the PKC-PI3K-Akt pathway [J].Hepatology, 2007, 45 (6): 1433-1445.
