锌冶炼含镉烟尘制备高纯镉粉的新工艺
2014-08-13郑雅杰孙召明
刘 远,郑雅杰,孙召明
(中南大学 冶金与环境学院,长沙 410083)
镉因其独特的物理和化学性质,使镍镉电池以高功率系数、长循环寿命、快速充电能力在军用无人机、通信电台和夜视仪等电子产品中得到广泛应用[1−2],近年来,镉在光电半导体材料[3−5]方面的应用前景使高纯镉粉的制备研究受到广泛重视。 镉资源在自然界中存在于锌矿、铅锌矿和铜铅锌矿中,在浮选时大部分进入锌精矿,在焙烧过程中富集于烟尘和高镉锌中[6−7]。我国火法炼锌厂和铜铅冶炼厂含镉物料经焙烧脱除砷、锑等杂质,得到浸出性能良好的焙砂,再用硫酸浸出[8−11],浸出液经氧化水解脱除铁、砷等杂质,净化后含镉溶液用锌粉置换得到海绵镉[12],在铸铁锅内于熔融烧碱保护下,铸成粗镉锭。此法存在工艺流程繁琐、生产周期长、能耗高且锌粉消耗量大,而回收的镉纯度低,限制了镉的生产和应用[13]。精镉是由粗镉经电解精炼法[14]或蒸馏法[15−16]进一步提纯得到。电解精炼法生产精镉其电流效率低、电耗大、周期长、成本高、电解沉积物不稳定,仍需进一步火法精炼[17]。蒸馏法采用精馏塔分离高沸点杂质制备粗镉,再进行碱性精炼得到精镉,其设备简单,生产控制方便,在我国锌冶炼厂普遍采用,但其精镉产出率低,镉与残渣分离不彻底,存在二次污染和镉中毒隐患[18]。精镉制备镉粉的方法有等离子还原法[19]、电化学法[20−21]、蒸发法[22]等。这些方法生产镉粉制备工艺周期长、温度高,镉粒在此过程中易长大,通常得不到超细镉粉。本文作者以锌冶炼含镉烟尘为原料,采用硫酸浸出,氧化中和除杂,氢氧化钠沉淀,氢气还原氢氧化镉制备球形高纯镉粉,与其他制备高纯金属镉方法相比,该工艺流程简单、环境友好、产品纯度高,且直接得到微米级球形镉粉,其市场应用广泛。
1 实验
1.1 实验原料
以河南某公司锌焙烧烟尘为原料,其主要元素含量如表1所列。硫酸(AR)、H2O2(AR)、FeCl3(AR)、氢氧化钠(AR)、氢气(高纯,w(H2)>99.99%)。
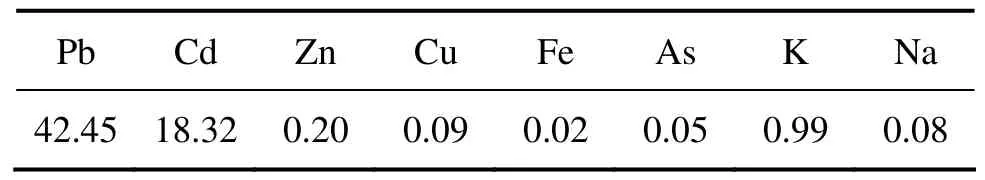
表1 锌焙烧烟尘主要元素含量Table 1 Main chemical components of roasting dust (mass fraction, %)
1.2 实验步骤
浸出:将去离子水与硫酸按比例配好置于三口烧瓶中,启动加热套加热至所需温度,在搅拌下将锌焙烧烟尘缓慢加入,反应一定时间后过滤,得到硫酸浸出液。
除杂:在浸出液中加入 H2O2使 As(Ⅲ)氧化为As(Ⅴ),按照一定的n(Fe)/n(As)加入FeCl3溶液,在搅拌下将NaOH加入到浸出液中,调节溶液pH,使As、Fe、Cu和Pb沉淀除去,得到硫酸浸出净化液,即硫酸镉溶液。
氢氧化镉粉体的制备:以净化液为原料配制0.5mol/L的硫酸镉溶液,在连续搅拌下向硫酸镉溶液中加入NaOH溶液,发生如下反应:
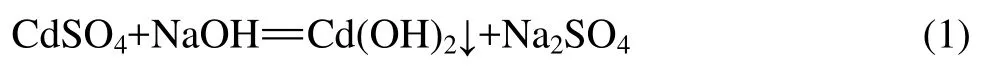
在室温下反应一段时间后,将沉淀物过滤,多次洗涤,在75 ℃下干燥10 h,得到氢氧化镉微粉。
镉粉的制备:将氢氧化镉粉体置于程控管式炉中,通入N2保护,控制一定温度,在氢气中还原得到镉粉。锌冶炼含镉烟尘制备高纯镉粉流程如图1所示。
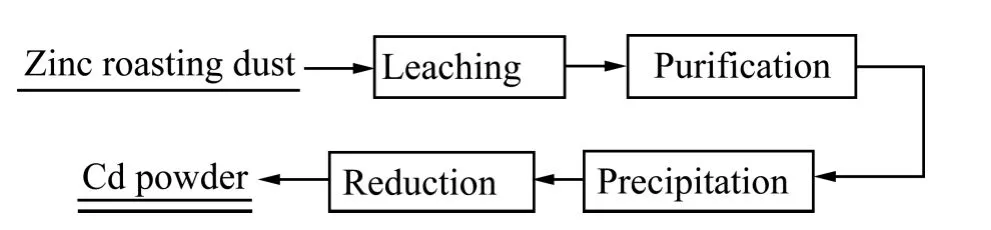
图1 锌冶炼烟尘制备高纯球形镉粉工艺流程图Fig. 1 Flow chart for preparation of spherical Cd powder from roasting dust of zinc smelting
1.3 分析与检测
采用电感耦合等离子光谱仪(Intrepid Ⅱ XPS)分析物料中杂质含量;采用日本Rint−2000型X射线衍射仪分析样品的物相组成;采用扫描电镜(SEM、JEOL、JSM−5600LV)对样品的形貌进行分析表征;采用激光粒度分析仪(Mastersizer 2000)对产物的粒度进行分析表征。
2 结果与讨论
2.1 锌焙烧烟尘硫酸浸出除杂
实验采用硫酸浸出含镉烟尘,反应温度为65 ℃,液固比为 6:1,硫酸浓度为 110 g/L,反应时间为 30 min。在此条件下硫酸浸出滤液中各元素含量如表 2所列,镉的浸出率达到99.63%。
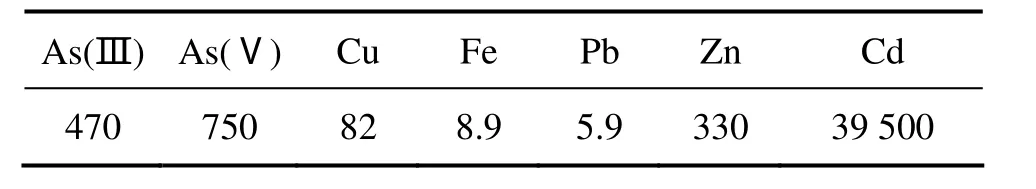
表2 锌焙烧烟尘硫酸浸出液中元素的含量Table 2 Elements content in sulfuric acid leaching solution of zinc roasting dust (mg/L)
氧化镉溶于硫酸的反应方程式为

当氧化镉溶解反应达到平衡时,其平衡常数如下:

在标准状态下,反应的标准吉布斯自由能变化为


热力学计算表明,氧化镉在酸性溶液中反应趋势很大,反应在达到平衡状态时,在较小的H+浓度下,可以存在很高浓度的Cd2+。铅主要以硫酸铅存在,在硫酸介质中不溶解,大部分进入渣中,As、Zn、Fe、Cu主要以氧化物存在,在酸性条件下易溶解进入溶液,为得到纯净的硫酸镉溶液,需深度除杂。
2.2 锌焙烧烟尘硫酸浸出液除杂
在室温下加入理论量10倍的30%双氧水,反应5 min后加入 FeCl3溶液,溶液中 n(Fe)/n(As)=3,加入NaOH调节溶液pH为5.5,反应时间30 min,过滤得硫酸镉滤液,砷的脱除率达 99.5%。滤液中杂质含量如表3所列。
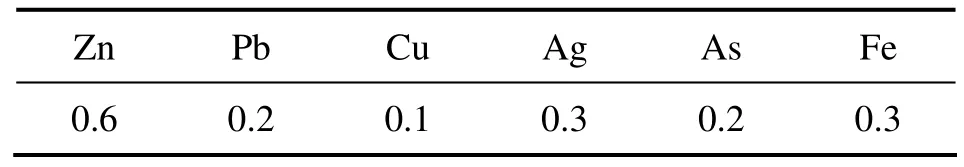
表3 硫酸浸出净化液中杂质含量Table 3 Impurities of purification sulfuric acid leaching solution (mg/L)
将浸出液中和到一定的 pH,则发生以下水解反应:

水解平衡时:

而

所以
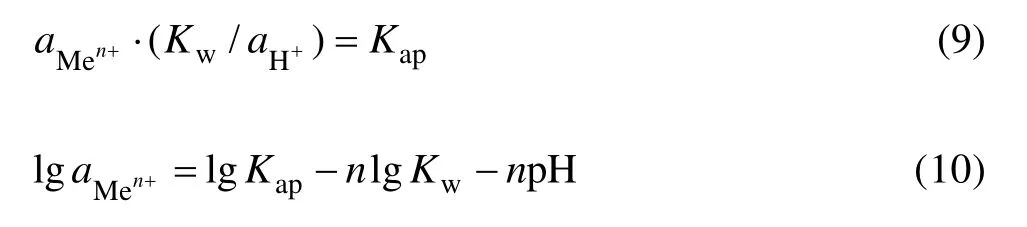
式中:Kap为水溶液中Men+与OH−的活度积;Kw为水的离子积,常温下近似等于 1×10−14。氢氧化物沉淀时,杂质离子的平衡pH值如表4所列[23]。

表4 25 ℃时杂质离子的平衡pH值[23]Table 4 Equilibrium pH value of impurity ions at 25 ℃[23]
在pH=5.5时,大部分杂质元素水解沉淀而除去,在砷酸盐沉淀过程中,发生如下反应:
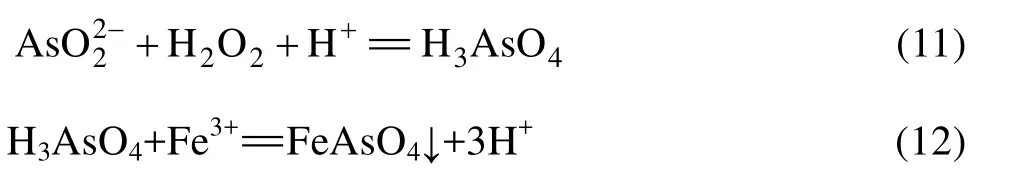
对水解沉淀而言,同一变价金属的高价离子比低价离子容易水解,改变其价态可以改变其在水解过程的行为,因此加 H2O2使 As(Ⅲ)氧化为 As(Ⅴ),促使溶液中砷离子完全沉淀,FeAsO4的溶度积为5.7×10−21,Fe(OH)3的溶度积为 4×10−38,调节溶液pH可实现砷和铁同时去除,而 Fe3+水解生成的Fe(OH)3胶体沉淀,也能吸附部分杂质元素。
2.3 氢氧化镉粉体的制备
慢速加料法是在反应开始前,将0.5 mol/L的硫酸镉溶液以5 mL/min的流量通过蠕动泵加入2 mol/L的NaOH溶液中,搅拌速度为400 r/min,控制反应终点pH=10,反应结束后,过滤、洗涤得到氢氧化镉粉体。快速加料法是将0.5 mol/L硫酸镉溶液和2 mol/L氢氧化钠溶液快速混合加入反应器中,之后操作与慢速加料法相同。图 2(a)所示为快速混料方式得到的氢氧化镉粉体形貌。图2(b)所示为缓慢加料方式得到的氢氧化镉粉体形貌。
由图2(a)可以看出,氢氧化镉呈絮状,分散性差,团聚严重,使一部分颗粒粒径很大,另一部分颗粒粒径又很小。从图2(b)可以看出,缓慢加料法得到的氢氧化镉分散性好,粒径分布集中,团聚不严重。表明通过缓慢加料法得到的氢氧化镉具有更好的形貌,因为在缓慢加料过程中,反应物的加入速度很慢,反应产物过饱和度较低,不利于晶粒的生长和晶核的形成,整个反应过程中形成的晶核数量较少[23]。
慢速加料法得到Cd(OH)2的XRD谱如图3所示。由图3可看出,通过化学沉淀法制备的Cd(OH)2为六方晶系,并且从谱图上观察不到杂相峰存在,产物为Cd(OH)2晶体。

图2 不同加料方法得到的氢氧化镉SEM像Fig. 2 SEM images of Cd(OH)2 prepared by different feeding rates: (a)Rapid feeding method; (b)Slow feeding method
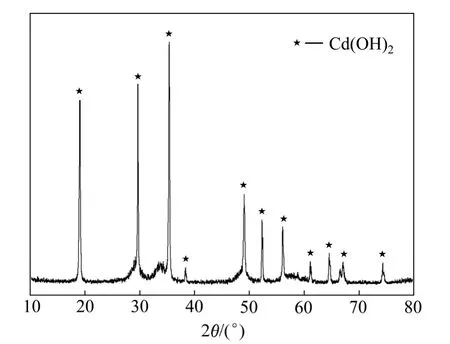
图3 氢氧化钠沉淀制备Cd(OH)2的XRD谱Fig. 3 XRD patterns of Cd(OH)2 prepared by sodium hydroxide precipitation
2.4 氢气还原氢氧化镉制备高纯镉粉
2.4.1 还原温度对还原产物及其形貌的影响
称取烘干的Cd(OH)2粉末置于程控管式炉中,通入 N2赶走空气后通入 H2,在一定温度下反应时间为120 min。不同反应温度时,产物XRD实验结果如图4所示。
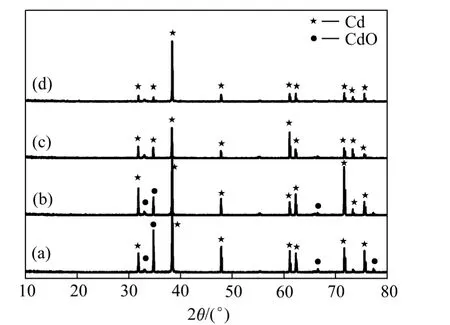
图4 不同温度还原产物的XRD谱Fig. 4 XRD patterns of products at different reduction temperatures: (a)250 ℃; (b)280 ℃; (c)310 ℃; (d)340 ℃
由图4可知,产物的衍射峰尖锐,随着温度的升高,Cd粉衍射峰逐渐变窄,且峰强逐渐增强,Cd晶粒沿某一晶面高度生长,结晶从无序趋向有序,温度的升高使晶粒长大。在温度低于310 ℃时,除含有主物相Cd(密排六方结构)外,产物中混有粒径不同的呈现黄灰色的CdO,CdO的产生是由于还原温度未达到Cd粉的还原温度,因此,一部分CdO尚未完全反应还含有 CdO相,说明在还原温度比较低的时候Cd(OH)2前驱体粉一部分转换为CdO,且并未完全还原。在310 ℃以上还原得到的Cd粉纯度高,在温度为310 ℃和340 ℃时, CdO相消失,Cd(OH)2粉末完全还原,产物为纯净的 Cd粉。当还原温度超过镉的熔点后,镉粉熔化长大成镉粒,粒径显著增加,为了得到粒径均匀的镉粉,采用还原温度应控制在300~310 ℃。
图5所示为不同还原温度得到产物的SEM像。由图5可知,氢气还原Cd(OH)2得到的产物呈球形,表面光滑,温度310 ℃比340 ℃时得到的颗粒细小,无团聚现象。
对还原温度为 310和 340 ℃的样品进行粒度分析,当还原温度为310和340 ℃时,镉粉平均粒径分别为49.61和76.09 µm,随着还原温度的升高,分布在粗粒区的颗粒增多,说明温度升高促进还原产物Cd晶粒的长大,与SEM像结果一致。
氢气还原Cd(OH)2粉末的过程就是Cd晶粒形核、长大、生长的过程。在还原过程中,先形成Cd晶核,随着还原的进行,新核不断生成,旧核不断长大,尺寸小的晶粒具有的应变能比尺寸大的晶粒的应变能大得多,为了尽可能地减小体系的总自由能而使结构趋于稳定,尺寸小的晶粒就自发合并成尺寸大的晶粒,在外界提供热量的情况下,界面附近的晶核发生扩散生长而使晶粒长大,当反应温度过低时,提供晶核扩散生长的能量不足,不能将其完全还原,产物中存在CdO物相,因此,需要升高还原温度使反应完全,但是随着反应温度的升高,晶粒的生长和镉的融化使其形成较大的颗粒,为了减小产物粒径,应严格控制还原温度。

图5 不同还原温度产物的SEM像Fig. 5 SEM images of products at different reduction temperatures: (a)310 ℃; (b)340 ℃
2.4.2 还原时间对产物及粒度的影响
在其他条件不变,当还原温度为310 ℃时,还原时间对产物物相的影响如图6所示。从图6可知,当还原时间小于 120 min时,还原产物中除了含有 Cd外,还含有CdO相,说明CdO未还原完全;当还原时间大于120 min时,各还原产物的XRD谱均显示出单一的密排六方型 Cd的衍射峰,且峰形尖锐。还原时间对制备纯净的 Cd粉有较大的影响,随着还原时间的增加,烧结的作用越来越明显,其衍射峰高增加,峰宽变窄,镉粉的结晶度更好。
激光粒度仪分析表明,还原时间为60、120和180 min时产物平均粒径分别为38.76、49.61和73.25 µm。在一定的还原温度下,晶粒的尺寸符合Dt=ct1/2,即晶粒的平均直径与时间的平方根成正比,产物的平均尺寸随着反应时间的增加而增加,由晶粒聚集的颗粒也增大,随着还原时间的延长,细颗粒发生团聚,粗粒区的颗粒逐渐增加,镉粉的粒径明显变大,在保证镉粉质量的同时应尽量减少反应时间控制镉粉粒径。

图6 不同还原时间产物的XRD谱Fig. 6 XRD patterns of products at different reduction times:(a)30 min; (b)60 min; (c)120 min; (d)180 min
3 结论
1) 以锌冶炼含镉烟尘为原料,采用硫酸浸出得到含镉浸出液,加入理论量10倍双氧水,n(Fe)/n(As)=3,调节 pH=5.5,过滤得到净化的硫酸镉溶液。将 0.5 mol/L的硫酸镉溶液以5 mL/min的缓慢加料速度加入2 mol/L的NaOH溶液,终点pH=10,过滤洗涤烘干,得到平均粒径为10.56 µm的氢氧化镉粉体。
2) 采用H2还原 Cd(OH)2前驱体制备高纯镉粉,还原温度和还原时间对产物结构和粒径影响较大,在还原条件为还原温度310 ℃,还原时间120 min,氢气流量40 L/h时,成功制备平均粒径为49.61 µm的球形镉粉。
[1]ZHU Jian-xin, LI Jin-hui, NIE Yong-feng, YU Bo. Recovery of cadmium by high temperature vacuum evaporation from Ni-Cd batteries[J]. Transactions of Nonferrous Metals Society of China,2003, 13(2): 254−257.
[2]张 金, 王伯雄, 叶丽娜. 便携式军用镍镉电池智能检测与充电装置设计与实现[J]. 电子测量与仪器学报, 2010, 24(4):359−364.ZHANG Jin, WANG Bo-xiong, YE Li-na. Design and development of portable intelligent testing and charging equipment for nickel-cadmium battery[J]. Journal of Electronic Measurement and Instrument, 2010, 24(4): 359−364.
[3]HU Bao-yun, JING Zhen-zi, HUANG Jian-feng, YUN Jun.Synthesis of hierarchical hollow spherical CdS nanostructures by microwave hydrothermal process[J]. Transaction of Nonferrous Metals Society of China, 2012, 22(S1): s89−s94.
[4]曹维良, 张凯华, 张敬畅. 纳米硫化镉制备条件对光催化活性的影响[J]. 北京化工大学学报, 2004, 31(1): 66−70.CAO Wei-liang, ZHANG Kai-hua, ZHANG Jing-chang. Effects of conditions for preparation of nano-CdS on photocatalysis activity[J]. Journal of Beijing University of Chemical Technology, 2004, 31(1): 66−70.
[5]WANG Tao, JIE Wan-qi, XU Ya-dong, ZHA Gang-qiang, FU Li.Characterization of CdZnTe crystal grown by bottom-seeded Bridgman and Bridgman accelerated crucible rotation techniques[J]. Transactions of Nonferrous Metals Society of China, 2009, 19(S3): s622−s625.
[6]SADEGH S M, BAFGHI M S, MORADKHANI D, OJAGHI I M. A review on hydrometallurgical extraction and recovery of cadmium from various resources[J]. Minerals Engineering, 2007,20: 211−220.
[7]何 静, 唐谟堂, 刘 维. 氨法浸出提镉新工艺[J]. 化工学报,2006, 57(7): 1727−1731.HE Jing, TANG Mo-tang, LIU Wei. New process for extracting cadmium by ammonium-ammonia method[J]. Journal of Chemical Industry and Engineering, 2006, 57(7): 1727−1731.
[8]成应向, 刘喜珍, 漆 燕, 王强强, 许友泽, 钟振宇. 有色冶炼铜镉渣中镉的提取工艺研究[J]. 环境工程, 2012, 30:331−334.CHENG Ying-xiang, LIU Xi-zhen, QI Yan, WANG Qiang-qiang, XU You-ze, ZHONG Zhen-yu. Process research of extracting cadmium from non-ferrous copper and cadmium slag[J]. Environmental Engineering, 2012, 30: 331−334.
[9]齐美富, 乐红燕, 方小刚. 次氧化锌烟尘中镉的硫酸浸出动力学研究[J]. 能源与环境, 2009(5): 14−15.QI Mei-fu, LE Hong-yan, FANG Xiao-gang. Study of cadmium sulfuric acid leaching kinetics from zinc oxide dust[J]. Energy and Environment, 2009(5): 14−15.
[10]WANG De-quan, JIANG Lan, LIN Mao-shen. Treatment of cadmium dust with two-stage leaching process[J]. Transactions of Nonferrous Metals Society of China, 2000, 20(2): 267−269.
[11]JHA M K, KUMAR V, SINGH R J. Review of the hydrometallurgical recovery of zinc from industrial wastes[J].Resources, Conservation and Recycling, 2001, 33: 1−22.
[12]范兴祥, 杨 卜. 某含锌镍镉烟尘元素分离及其产品制备工艺研究[J]. 矿产综合利用, 2009(4): 14−15.FAN Xing-xiang, YANG Bo. Research on the technologies for separating valuable elements from the fly ash bearing Zn, Ni and Cd and preparing relative products[J]. Multipurpose Utilization of Mineral Resources, 2009(4): 14−15.
[13]彭容秋. 有色金属提取冶金手册(锌镉铅铋)[M]. 北京: 冶金工业出版社, 1992.PENG Rong-qiu. Hand-book on extractive metallurgy of No-ferrous metals (Zn, Cd, Pb, Bi)[M]. Beijing: Metallurgical Industry Press, 1992.
[14]邹小平, 汪胜东, 蒋训雄, 蒋应平, 王海北, 刘三平. 铜镉渣提取镉绵工艺研究[J]. 有色金属: 冶炼部分, 2010(6): 2−5.ZOU Xiao-ping, WANG Sheng-dong, JIANG Xun-xiong,JIANG Ying-ping, WANG Hai-bei, LIU San-ping. Process optimization research of extracting cadmium sponge from copper and cadmium residue[J]. Nonferrous Metals: Extractive Metallurgy, 2010(6): 2−5.
[15]杜新玲, 张 欣, 马科友. 精镉的工业化生产[J]. 中国有色冶金, 2010(1): 25−29.DU Xin-ling, ZHANG Xin, MA Ke-you. Industrialized production of pure cadmium[J]. China Nonferrous Metallurgy,2010(1): 25−29.
[16]虢振强. 真空蒸馏工艺生产镉的实践及改造[J]. 矿业工程,2006, 26(3): 50−52.GUO Zhen-qiang. Practices and transformation of production of cadmium by vacuum distillation process[J]. Mining and Metallurgical Engineering, 2006, 26(3): 50−52.
[17]HIRSCH H E, LIANG S C, WHITE A G. Chapter 2 preparation of high-purity cadmium, mercury, and tellurium[J].Semiconductors and Semimetals, 1981, 18: 21−45.
[18]邹学付, 陈卫华. 火法生产精镉工艺[J]. 技术与设备, 2007(9):22−23.ZOU Xue-fu, CHEN Wei-hua. Preparation of refined cadmium by pyrometallurgical process[J]. Technology and Equipment,2007(9): 22−23.
[19]FUTAKI S, SHIRAISHI K, UEMURA M. Ultrafine refractory metal particles produced by hybrid plasma process[J]. Journal of the Japan Institute of Metals, 1992, 56(4): 4−64.
[20]VISWANATH S G, SAJIMOL G. Electrowinning of cadmium powder from glycerol and sulphuric acid—Study of morphology and nano-nature of the powder[J]. Metallurgija, 2010, 16(1):25−38.
[21]JAVIER M G, JOSE M B. Removal of cadmium and production of cadmium powder using a continuous undivided electrochemical reactor with a rotating cylinder electrode[J].Journal of Chemical Technology and Biotechnology, 2002, 77(4):465−472.
[22]HATA Y, ONOUE M, SASAKI M, SENZAKI H, SUMIDA M,TANAKA J. Process for preparing metallic cadmium powder:US 5505761 A[P]. 1996−04−09.
[23]李洪桂. 冶金原理[M]. 北京: 科学出版社, 2007: 329.LI Hong-gui. Metallurgical theory[M]. Beijing: Science Press,2007: 329.
