二甲双胍对糖尿病非酒精性脂肪性肝病大鼠G-6-Pase表达的影响
2014-08-13陈其荣张安星田浩明
陈其荣 ,张安星,田浩明,高 琳,王 茜 ,张 晗
(1.遵义医学院附属医院 内分泌科,贵州 遵义 563099;2.四川大学华西医院 内分泌科,四川 成都 610041)
非酒精性脂肪性肝病(NAFLD)以肝脏脂质异位沉积为主要病理特征,已成为严重危害人们健康的三大肝脏病之一,其病因仍未明确,许多研究表明其与代谢综合征关系密切,尤其是与肥胖、2型糖尿病和胰岛素抵抗(IR)有关[1]。本实验研究高糖高脂喂养联合小剂量链脲佐菌素(STZ)诱导糖尿病大鼠,并用二甲双胍干预糖尿病模型组,探讨SD大鼠不同糖代谢状态下G-6-Pase mRNA的表达,同时观察二甲双胍对于糖尿病非酒精性脂肪性肝病的影响。
1 材料与方法
1.1 实验动物 雄性SD大鼠60只(第三军医大学大坪医院动物实验中心),体重为(180±20)g。动物许可证号:SCXK(渝)2007-0005。
1.2 实验方法
1.2.1 造模及分组 60只SD大鼠,普通饲料喂养1周后:随机选取15只为空白对照组,用普通饲料喂养,其余45只分为肥胖组(15只)、糖尿病组(15只)、二甲双胍治疗组(15只),均以高脂高糖饲料喂养(配方为普通饲料62.5%,炼猪油20%,葡萄糖5%,蛋黄10%,胆固醇粉2%,胆酸钠粉0.5%)。喂养12周后,禁食12h称重,体重高于空白对照组平均体重20%为造模成功,成模12只。糖尿病组、二甲双胍治疗组高脂高糖喂养8周后禁食12 h,40 mg/kg一次性腹腔注射STZ(溶于0.1 mmol/L柠檬酸缓冲液,pH4.4,终浓度1%)。1周后用强生稳步倍加型血糖仪断尾取血测空腹血糖,2次空腹血糖均≥16.7 mmol/L为糖尿病模型,共成模10只。二甲双胍治疗组予以盐酸二甲双胍(施贵宝公司)灌胃(100 mg/kg.d)2周,空腹血糖<11.1mmol/L为有效标准,共计9只。
1.2.2 相关指标测定 血清游离脂肪酸、甘油三酯、总胆固醇用全自动生化分析仪检测(Olympus AU2700型),胰岛素用放射免疫法测定(美国LINCO公司)。
1.2.3 RT-PCR检测 G-6-Pase mRNA的表达 腹腔注射10%水合氯醛麻醉后,取出肝脏约50 mg置于800 μL Trizol中,-80 ℃冰箱冻存。使用美国BIO-RAD公司icycler荧光定量PCR仪,G-6-Pase mRNA上游引物5′-AACGTCTGTCTGTCCCGGATCTAC-3′,下游引物5′-ACCTCTGGAGGCTGGCATTG3′,β-actin上游引物5′-CCACAGACACAGGCACTGATGA-3′,下游引物5′-GACTCATCGTACTCCTGCTTGCTG-3′。结果分析采用相对定量法,以PCR扩增过程中荧光信号强度达到阈值所需要的循环数(cycle threshold Ct值)为统计参数,平均Ct值=(Ct1+Ct2)/2,dCt=平均Ct值-中间值,目的基因的表达=2-dCt,相对定量值=目的基因的表达/内参基因的表达。
1.2.4 肝脏病理学观察 取相同部位小块肝脏,4%多聚甲醛固定,脱水,石蜡包埋,切片,HE染色。以《非酒精性脂肪性肝病诊疗指南》[1]为病理诊断参考标准。
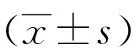
2 结果
2.1 4组大鼠血液学指标比较(见表1)
2.2 G-6-Pase mRNA表达 比较肥胖组大鼠肝脏G-6-Pase mRNA较空白对照组显著降低(P<0.01),差异有统计学意义;糖尿病组G-6-Pase mRNA较肥胖组显著增高(P<0.05),差异有统计学意义;二甲双胍治疗组G-6-Pase mRNA较糖尿病组显著降低(P<0.05),差异有统计学意义(见表2)。
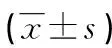

组别例数 FBG(mmol/L)FFA(mmol/L)TG(mmol/L)TC(mmol/L)HDL(mmol/L)LDL(mmol/L)Fins(mIU/L)ISI正常对照组10 4.28±1.05375±1630.24±0.091.20±0.320.54±0.150.37±0.1310.40±3.250.03±0.01 肥胖组12 5.31±0.57479±1511.13±0.48△1.59±0.410.65±0.130.44±0.2224.45±8.77△0.01±0.005△糖尿病组10 25.52±2.75△●1260±588△#6.65±3.07△●6.71±3.27*1.04±0.29△●3.66±1.57*#38.18±9.11△● 0.001±0.0002△●二甲双胍组9 6.97±1.35★ 646.56±192.97* 1.55±0.61△★ 1.80±0.33△ 0.75±0.19*★ 0.47±0.19☆——
FBG:空腹血糖;FFA:游离脂肪酸;TG:甘油三酯;TC:总胆固醇;HDL:高密度脂蛋白胆固醇;LDL:低密度脂蛋白胆固醇;Fins:空腹胰岛素;ISI:胰岛素敏感指数vs.GroupA,*P<0.05, △P<0.01;vs.GroupB,#P<0.05,●P<0.01;vs.GroupC, ☆P<0.05,★P<0.01;vs.GroupD,◇P<0.05,★P<0.01。
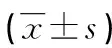
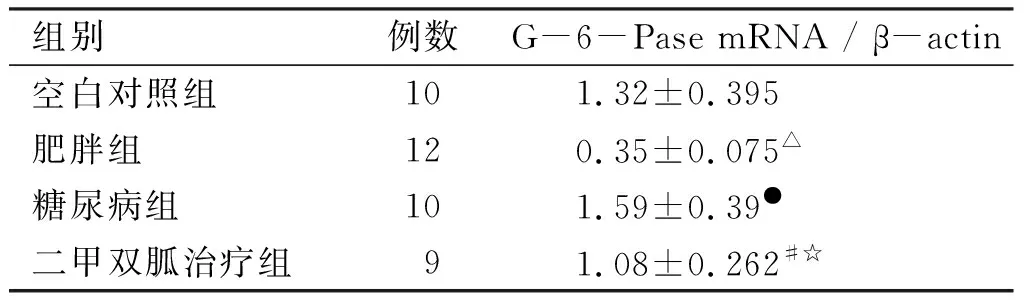
组别例数G-6-Pase mRNA / β-actin空白对照组101.32±0.395肥胖组120.35±0.075△糖尿病组10 1.59±0.39●二甲双胍治疗组91.08±0.262#☆
与空白组比较,*P<0.05,△P<0.01;与肥胖组比较,#P<0.05,●P<0.01;与糖尿病组比较,☆P<0.05,★P<0.01。
2.3 肝脏病理学变化 正常组大鼠肝脏组织小叶形态正常,无肝细胞水肿、脂肪变性及炎细胞浸润;肥胖组大鼠肝组织小叶形态完整,但出现肝细胞水肿(肝细胞胞质疏松、气球样变)、脂肪变性(肝细胞胞质出现脂滴空泡);糖尿病组大鼠出现肝细胞弥漫性水肿,广泛性脂肪变性,即为糖尿病非酒精性脂肪肝病。二甲双胍治疗组见少量肝细胞脂肪变性及肝细胞水肿(见图2)。

A:正常组;B:肥胖组;C:糖尿病组;D:二甲双胍组。图2 4组大鼠肝脏病理图片(HE×200)
3 讨论
非酒精性脂肪性肝病(NAFLD)被认为是最常见的肝脏疾病之一,包括从简单的脂肪变到非酒精性脂肪性肝炎,最终导致肝硬化[2]。尽管NAFLD的病理生理机制尚未完全弄清,但公认胰岛素抵抗和炎症反应在其发生发展中起了关键作用,到目前为止,“二次打击”学说为学者们广泛接受。
本实验糖尿病组血糖、血脂、游离脂肪酸及空腹胰岛素均较空白组升高,胰岛素敏感指数明显降低,说明糖尿病大鼠存在明显的胰岛素抵抗。并且糖尿病大鼠肝组织G-6-Pase mRNA含量较空白组增加,二甲双胍干预后,G-6-Pase mRNA含量明显降低,肝组织病理结果表明DM组大鼠出现明显的脂肪变性合并炎症细胞的浸润及纤维化,与之对应的是G-6-Pase在糖尿病大鼠肝组织中表达增高,与肝脏病变的程度一致,提示可能与NAFLD的发展相关,我们的结果支持 G-6-Pase可能与糖尿病非酒精性脂肪性肝病的发生发展有关,与Kim、Lee等人研究相符[3-4],二甲双胍可能通过降低G-6-Pase的表达,抑制糖异生,从而改善脂肪肝。研究证实二甲双胍通过腺苷酸活化蛋白激酶(AMPK)途径上调SHP基因表达,同时增加的SHP基因抑制G-6-P 的表达,减低糖异生。多项研究表明,二甲双胍作为胰岛素的增敏剂,改善糖脂代谢紊乱,有效地改善NAFLD及其代谢状态[5]。二甲双胍能改善NAFLD,主要通过减少肝细胞脂肪沉积和抑制炎症反应[6],也可能与二甲双胍下调分泌磷脂酶A2 mRNA的表达, 从而降低炎症反应和保护线粒体功能有关[7]。本实验空白组无肝脏脂肪变,二甲双胍治疗组有轻微脂肪变,然而空白组G-6-Pase mRNA含量却高于二甲双胍治疗组,考虑G-6-Pase只是非酒精性脂肪肝的一个因素,目前国内外学者的研究中公认的因素有:①胰岛素抵抗;②体内氧化应激;③库普弗细胞与细胞因子;④脂代谢紊乱。
本实验肥胖组大鼠肝组织G-6-Pase mRNA的表达较正常对照组显著下降,与一些文献不符,考虑其原因与机体的肝X 受体(LXR)有关,董莹等认为在非糖尿病阶段,LXR 可能作为糖代谢的保护性受体,通过调节肝糖代谢酶,即机体调节G-6-Pase、PEPCK的表达,使肝脏糖异生作用减弱,肝糖输出减少,是机体的一种保护性代偿,以达到延缓糖尿病的发生、发展的目的[8]。进入糖尿病阶段后,其胰岛素分泌严重不足,从而无法抑制肝内G-6-Pase的转录,此时LXR 的保护作用并不能逆转因胰岛素不足所致的糖代谢相关酶的异常改变,血糖不能恢复正常。本实验中糖尿病组大鼠肝脏G-6-Pase mRNA的表达较肥胖组显著增高,说明糖尿病大鼠已不能依靠自身的生理性调节保证血糖稳定,导致糖尿病的发生。
总之,二甲双胍可改善糖尿病大鼠的糖脂代谢紊乱,增加胰岛素敏感性,减轻非酒精性脂肪肝的病理损害, 对糖尿病及NAFLD患者积极予二甲双胍进行干预,可能有助于改善和延缓糖尿病合并非酒精性脂肪性肝病的发生发展。
[参考文献]
[1] 中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].胃肠病学和肝病学杂志,2010,19(6):483-487.
[2] Day C P. Clinical spectrum and therapy of non-alcoholic steatohepatitis[J].Dig Dis,2012,30(1):69-73.
[3] Kim Y D, Park K G, Lee Y S, et al. Metformin inhibits hepatic gluconeogenesis through AMP-activated protein kinase-dependent regulation of the orphan nuclear receptor SHP[J]. Diabetes, 2008, 57(2): 306-314.
[4] Lee J M, Seo W Y, Song K H, et al. AMPK-dependent repression of hepatic gluconeogenesis via disruption of CREB· CRTC2 complex by orphan nuclear receptor small heterodimer partner[J].J Biol chem,2010, 285(42): 32182-32191.
[5] Rouabhia S, Milic N, Abenavoli L. Metformin in the treatment of non-alcoholic fatty liver disease: safety, efficacy and mechanism[J]. Expert Rev Gastroenterol Hepatol,2014, 8(4): 343-349.
[6] Spruss A, Kanuri G, Stahl C, et al. Metformin protects against the development of fructose-induced steatosis in mice: role of the intestinal barrier function[J]. Lab Invest,2012,92(7):1020-1032.
[7] Huang Y, Fu J F, Shi H B, et al.Metformin prevents non-alcoholic fatty liver disease in rats: role of phospholipase A2/lysophosphatidylcholine lipoapoptosis pathway in hepatocytes[J]. Chinese Jouunal of pediatrics,2011,49(2):139-145.
[8] 董莹, 刘伟. 不同糖代谢状态下大鼠肝 X 受体的表达及其对肝糖代谢的影响[J].中国内分泌代谢杂志, 2011, 27(2):148-151.
