紫花苜蓿对铜胁迫生理响应的傅里叶变换红外光谱法研究
2014-08-11余顺慧黄怡民邓洪平
付 川,余顺慧,黄怡民,邓洪平
(1. 重庆三峡学院,三峡库区水环境演变与污染防治重庆高校市级重点实验室, 重庆 404100;2. 西南大学生命科学学院,三峡库区生态环境教育部重点实验室, 重庆 400715)
紫花苜蓿对铜胁迫生理响应的傅里叶变换红外光谱法研究
付 川1,余顺慧1,黄怡民1,邓洪平2,*
(1. 重庆三峡学院,三峡库区水环境演变与污染防治重庆高校市级重点实验室, 重庆 404100;2. 西南大学生命科学学院,三峡库区生态环境教育部重点实验室, 重庆 400715)
为阐明紫花苜蓿(MedicagosativaL.)对铜胁迫的耐性机理,采用准确度好、分辨率高和简便快捷的傅里叶变换红外光谱法(FTIR)研究在不同铜浓度(0、1、5、20、100 mol/L)处理时紫花苜蓿根、茎、叶化学组分的变化。结果表明:随着铜处理浓度的增加,紫花苜蓿根、茎、叶生物量变化不大。其根组织在2924 cm-1处峰高处呈现出先下降后上升的趋势,反映了在低铜(<5 mol/L)处理条件下紫花苜蓿分泌的有机酸不断螯合Cu,造成羧酸O—H的减少,但随着Cu 含量的升高,其羧酸螯合力变弱,有机酸含量渐渐升高;根组织在1381 cm-1处峰高先下降后上升,反映了含油脂化合物含量先下降后升高。可能与植物在细胞壁结构上增强抗逆性有一定关系,即低Cu处理下细胞壁可能通过提高阳离子交换能力(CEC),增强了耐 Cu性;茎组织在2924,1643,1381,1064 cm-1等处峰高无明显变化;叶组织所有峰值在低浓度(<5 mol/L)Cu 处理下变化不明显,高浓度(>5 mol/L)Cu 处理下所有峰值先升后降,随着这可能与可溶性糖及可溶性蛋白质等物质含量都呈现先升后降的趋势有关。这表明紫花苜蓿通过根部有机酸含量的变化和提高细胞壁阳离子交换能力,将吸收的Cu 大部分积累在根部,阻止Cu 向地上部分运输,有效地保护了植物地上部分组织。
紫花苜蓿; 铜胁迫; 化学组分;傅里叶变换红外光谱法(FTIR)
Cu是植物生长发育所必需的微量营养元素。过量的铜会抑制植物根的生长,抑制叶绿素的合成,使植物生理代谢紊乱,生长缓慢[1]。铜矿的开采和冶炼厂三废的排放、含Cu 农业化学物质和有机肥的施用,以及生活污水的排放,使农田土壤含Cu量显著增加,使农作物产量大幅度下降,对农业生产及环境质量构成极大威胁。有关Cu 污染的植物修复受到广泛关注[2],研究铜污染土壤和水体修复新技术具有重要意义。利用超积累植物对重金属的富集特性而进行植物修复,具有廉价、高效和安全等特点,已经成为土壤、水体重金属污染研究领域的一项新兴技术[3]。Bert[4]认为大多数的超积累植物都生长在金属富集的土壤上,对重金属具有超积累的特性,同时具有金属耐性的特征。Clemens[5]认为植物忍耐和抵抗重金属毒害的生理机制,包括重金属元素的控制吸收、体内螯合固定、细胞内分隔、生化忍耐策略以及其它体内平衡机制等。其中体内螯合作用固定金属离子或者降低其生物毒性是植物对细胞内重金属解毒的主要方式。Baker[6]认为,植物体内螯合作用是以蛋白质类、有机酸等物质与重金属形成螯合物,如与Cu 反应形成螯合物和沉淀降低自由态的Cu。
植物在受到重金属胁迫时,体内重金属积累特征以及生长发育都会产生相应变化,同时微观响应机制也会产生变化[7]。傅里叶红外光谱(FTIR)是一种基于化合物中官能团和极性键振动的结构分析技术,已广泛应用于大分子化合物结构分析以及蛋白质的二级结构解析,并且具有相对稳定的[8]。任利民等应用 FTIR 技术研究美洲商陆对锰毒的生理响应,认为植物化学组份的变化有助于揭示超富集植物的锰耐性机理[9]。薛生国等采用 FTIR 法探讨紫茉莉对铅胁迫生理响应的影响,发现紫茉莉通过根系有机物含量的变化,将植物吸收的Pb 大部分积累在根部,阻止Pb 向地上部分运输,有效的保护了植物地上部分[10]。但国内研究材料多为野生品种(有的是外来入侵植物),多存在植株矮小,生物量低,生长缓慢等不足,很难在实际中大面积应用,而入侵植物虽然生物量大,但具有生态风险。紫花苜蓿是一种原产于伊朗的多年生豆科草本植物,分布于世界各地,我国也有大面积种植。研究表明,紫花苜蓿对铜有很强的积累作用,其(地上和地下部分)富集系数大于1,达到了超积累植物的标准。具有生长迅速、适应性强、生物量大等特点,很适合作为各地的重金属修复植物[11]。由此,探讨不同铜处理条件下其化学组成上的差异将有利于揭示其耐铜机制。目前,国内外对铜耐性植物不同组织器官化学组分进行 FTIR 的研究较少,对紫花苜蓿的相关研究未见报道,因此,本研究将探讨不同铜处理条件下,利用 FTIR 对紫花苜蓿根、茎、叶的化学组分进行研究,以便为研究铜对牧草的毒害机制提供新的研究方法,对铜污染环境修复提供参考依据,对应用牧草进行铜污染水体及土壤修复等都具有指导意义。
1 试验材料与方法
1.1 试验材料及仪器
紫花苜蓿(MedicagosativaL.)种子购自重庆市万州区宏远市场。CuCl2·2H2O(分析纯)。所用仪器为IRPrestige- 21红外光谱仪。
1.2 试验方法
1.2.1 实验材料预处理
挑选大小均匀饱满的紫花苜蓿种子100粒,用0.1%的HClO 溶液消毒10 min,用水洗净,均匀播种在装有培养基质(河沙)的育苗盘中,浇透水,在室内条件下培养,待小苗长出第2片真叶时,挑选长势一致的幼苗45株,移入水培装置中,每瓶3株苗。先采用1/4 Hoagland 营养液预培养1周,再更换为含不同浓度Cu的培养液进行处理。
1.2.2 试验处理
配置CuCl2·2H2O 母液,分别稀释成Cu2+浓度梯度为0、1、5、20、100 mol/L的培养液。每个浓度处理设3瓶。试验期间每天补水1次,3 d 换1次溶液,24 h 通气培养,所有处理溶液的pH值保持在(6.5±0.1)。试验在实验室内进行,水培容器放在靠近窗边的试验台上,先采用1/4 Hoagland 营养液预培养1周,再更换为含不同浓度Cu2+的培养液进行处理,处理45 d后收获。
1.2.3 傅里叶红外光谱(FTIR)采集
分别取紫花苜蓿植株105 ℃下杀青0.5 h,80 ℃烘箱里干燥24 h, 将粉末样品和KBr一起用玛瑙研钵研碎。并压成薄片,然后置于FTIR光谱仪的IRsolution Chinese采样器下,按照所设定的测试条件。在室温下直接测定样品的FTIR,测试条件:光谱范围4000—400cm-1,分辨率16 cm-1,扫描累加次数20次,动镜速度2.8,获得所需紫花苜蓿植株的光谱信息。
1.2.4 植物生长的分析
将收获的紫花苜蓿全株用蒸馏水洗净后放入105 ℃下杀青0.5 h,80 ℃烘干至恒重,分别称取根、茎、叶的干生物量。
1.2.5 数据分析及结果处理
实验数据采用Microsoft Excel 2003进行统计分析和处理,并应用Origin (7.0) 进行红外光谱数据图谱处理。
2 结果与分析
2.1 不同浓度铜处理对紫花苜蓿生长的影响
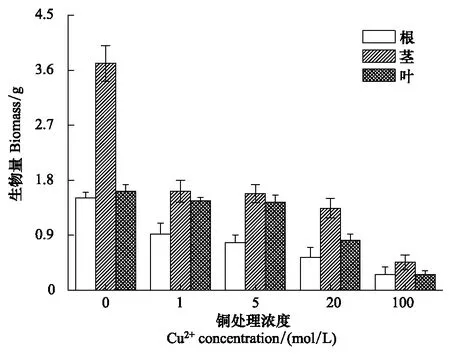
图1 不同浓度铜处理对紫花苜蓿生物量的影响Fig.1 Effects of different concentrations of Cu on the biomass of Medicago sativa L.
如图1 所示,随着Cu2+处理浓度的增加,紫花苜蓿根、茎、叶的生物量呈现出递减趋势。但不同铜处理条件下紫花苜蓿都能生长正常(能完成植物的生长发育过程),不同铜处理条件下生物量差异不显著(P>0.05)。这表明紫花苜蓿对铜有较强的耐性。铜是植物生长发育所必需的微量营养元素,低浓度的Cu2+会促进植物的生长,但高浓度的Cu2+会抑制植物的生长。然而,受植物遗传学特性、生态学特性等因素所决定,不同植物对Cu污染的忍耐性是不同的。因此,对植物生长有利的铜浓度范围要根据植物的种类而定[12]。有研究表明Cu2+处理浓度低于15.6 μmol/L时促进烟草的生长,高于15.6 μmol/L 时抑制烟草的生长[13]。研究表明,在Cu2+处理浓度为1 mol/L时就开始抑制紫花苜蓿的生长,高浓度铜(100 mol/L)处理下紫花苜蓿根部出现发黑,叶稍微卷曲的特征;呈现出随着培养液中Cu2+浓度的增加,紫花苜蓿的生物量越来越小的特征。但Cu2+处理浓度与这种牧草的生物量差异不显著。
2.2 紫花苜蓿根的FTIR分析
3410 cm-1的自由羟基的伸缩振动峰主要来自于紫花苜蓿根系中多糖、纤维素、半纤维素等碳水化合物( 图2)[9],由图3可以看出随着Cu浓度的升高,处理峰高呈现先降后升的趋势。在低浓度Cu处理条件下,处理峰吸光度下降,在5 mol/L达到最低,随Cu处理浓度的继续提高,该峰吸光度上升。这可能是根外表皮细胞壁的羟基吸附结合Cu2+形成稳定的化合物,使细胞表面的氢键减少;而高浓度Cu2+处理下可能破坏了根外表皮细胞壁的羟基吸附结合Cu2+的机制[7],导致根外表皮细胞壁的羟基不能结合Cu2+,峰值升高。
2924 cm-1附近是羧酸O—H 与甲基伸缩振动重叠峰[7,14],主要来自于维生素、各种膜及细胞壁的组织等成分。随着Cu浓度的增加,该处峰高呈现先下降后上升的趋势,如图3所示,这可能是在低浓度Cu 的胁迫下,紫花苜蓿的根部由于抗性机制分泌的有机酸不断螯合Cu,造成羧酸O—H的减少,导致羧酸谱带下降,但随着Cu的处理浓度继续升高,Cu对紫花苜蓿的毒害加重,其羧酸螯合力变弱,有机酸含量渐渐升高,故其峰值开始上升。
1381 cm-1处为含油脂化合物(各种膜和胞壁)的组织中甲基的吸收带[15- 16]。随着Cu处理浓度的升高,峰高表现出先下降后升高的趋势(如图3所示),反映了含油脂化合物含量先下降后升高。可能随着Cu处理浓度的升高(1—5mol/L),细胞壁通过降低果胶甲基化程度,使阳离子交换能力提高,从而吸收更多的Cu,即通过细胞壁中积累Cu来增强抗逆性,峰高逐渐下降,但高浓度的Cu(>5 mol/L)已对紫花苜蓿产生了胁迫,甲基化程度又开始升高,峰值又呈上升态势。
1064 cm-1附近的峰是醇、酯基、醚基或酚类等碳水化合物的C—O 基团的伸缩振动峰(图2)[9,17- 18]。随着Cu处理浓度的增加,峰高先降后升(图3)。说明随着Cu处理浓度的升高(1—5 mol/mL),这类物质运输通道受到一定影响,致使部分这类物质无法运输到根部,峰高逐渐下降,但高浓度的Cu(>5 mol/L)已对紫花苜蓿产生了胁迫,导致膜脂过氧化程度加深,脂肪族酮类化合物过氧化产物在根部积累,峰值又呈上升趋势。
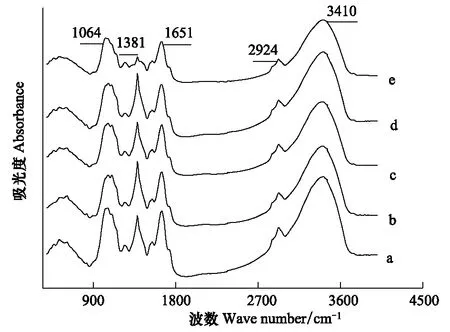
图2 不同铜处理下紫花苜蓿根系的傅里叶红外光谱图(400—4000 cm-1)Fig.2 Absorption FTIR spectra in the 400 to 4000 cm-1region in the roots of M.sativa L. a: control; b: 1 mol/L ; c: 5 mol/L ;d:20 mol/L ; e: 100 mol/L

图3 不同铜处理下紫花苜蓿根系的特征峰(1064 cm-1,1381cm-1,1651 cm-1,2924 cm-1and 3410 cm-1)变化谱图Fig.3 The band height changes of 1064 cm-1,1381cm-1,1651 cm-1,2924 cm-1and 3410 cm-1 in the roots of M. sativa L.
2.3 紫花苜蓿茎的 FTIR 分析
图4为不同铜浓度处理条件下紫花苜蓿茎组织的红外光谱图,图5为不同铜浓度下紫花苜蓿茎组织的特征峰变化图。1064 cm-1附近的峰是醇、酯基、醚基或酚类等碳水化合物的C—O 基团的伸缩振动峰,1381 cm-1附近的峰是为含油脂化合物的甲基C—H 的变形振动峰,在1643 cm-1附近的峰是氨基酸,多肽和蛋白质类物质N—H 酰胺的弯曲振动峰,2924 cm-1附近的峰是植物体内有机酸类物质的羧酸O—H 的伸缩振动峰,在3402 cm-1附近的峰代表紫花苜蓿茎中碳水化合物分子间氢键O—H 自由羟基的伸缩振动峰( 图5)。由图5看出,除3402 cm-1处峰值在高浓度出现上升外,各处峰均无明显变化,表明在Cu处理浓度不断升高的情况下,紫花苜蓿茎中这几类有机物:碳水化合物、有机酸、氨基酸、多肽和蛋白质等成分变化不明显。因此在一定浓度范围(0—100 mol/L)的Cu胁迫下,紫花苜蓿茎的生理生化过程受影响程度较小,表现出紫花苜蓿作为Cu 耐性植物的特性。
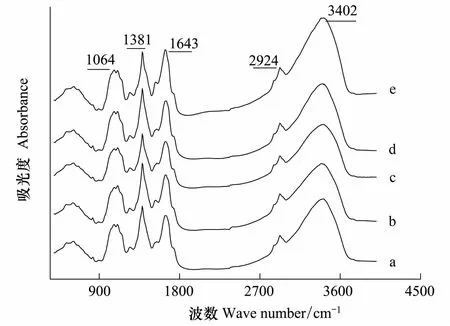
图4 不同铜处理下紫花苜蓿茎的傅里叶红外光谱图(400—4000 cm-1)Fig.4 Absorption FTIR spectra in the 400 to 4000 cm-1region in the stems of M. sativa L. a: Control; b: 1 mol/L ; c: 5 mol/L; d: 20 mol/L; e: 100 mol/L
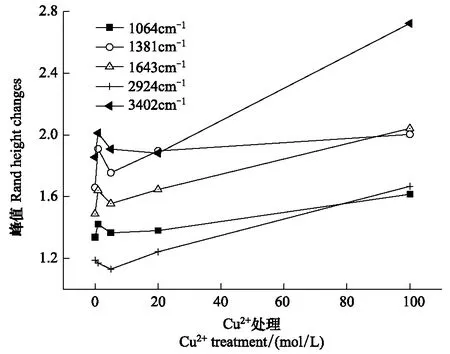
图5 不同铜处理下紫花苜蓿茎的特征峰(1064 cm-1,1381cm-1,1643 cm-1,2924 cm-1 and 3402 cm-1)变化谱图Fig.5 The band height changes of 1064 cm-1,1381cm-1,1643 cm-1,2924 cm-1and 3402 cm-1 in the stems of M. sativa L.
2.4 紫花苜蓿叶的 FTIR 分析
图6为不同铜浓度处理条件下紫花苜蓿叶的红外光谱图,图7为不同铜浓度下紫花苜蓿叶的特征峰变化图。
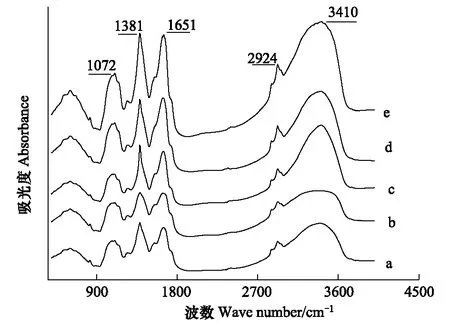
图6 不同铜处理下紫花苜蓿叶的傅里叶红外光谱图(400—4000 cm-1)Fig.6 Absorption FTIR spectra in the 400 to 4000 cm-1region in the leaves of M. sativa L. a: Control; b: 1 mol/L; c: 5 mol/L; d: 20 mol/L; e: 100 mol/L

图7 不同铜处理下紫花苜蓿叶的特征峰(1072 cm-1,1381cm-1,1651 cm-1,2924 cm-1 and 3410 cm-1)变化谱图Fig. 7 The band height changes of 1072 cm-1,1381cm-1,1651 cm-1,2924 cm-1 and 3410 cm-1in the leaves of M. sativa L.
1072 cm-1附近的峰是醇、酯基、醚基或酚类的C—O 基团的伸缩振动峰;1381 cm-1附近的峰是为含油脂化合物的甲基C—H 的变形振动峰,在1651 cm-1附近的峰是氨基酸,多肽和蛋白质类物质N—H 酰胺的弯曲振动峰,2924 cm-1附近的峰是植物体内有机酸类物质的羧酸O—H 的伸缩振动峰,在3410 cm-1附近的峰代表紫花苜蓿叶中碳水化合物分子间氢键O—H 自由羟基的伸缩振动峰。由图7看出,所有峰值在低浓度(<5 mol/L)Cu 处理下变化不明显,说明紫花苜蓿叶的生理生化过程受影响程度较小,表现出对Cu的耐性较强。高浓度(>5 mol/L)Cu 处理下所有峰值先升后降。可能与可溶性糖及可溶性蛋白质等物质的含量的先升后降有关。可能是植物体对不良环境在一定适应性基础上的抵抗性反应。但是植物耐受重金属胁迫是有一定限度,超过这个限度,可溶性糖和蛋白质等物质的含量反而下降[7,15]。
3 结论
(1) Cu 胁迫抑制了紫花苜蓿的生长,但不同处理条件下生物量的差异不显著,表明紫花苜蓿对铜胁迫有较强的耐受性。
(2)从红外光谱可以看出,经过重金属铜胁迫的紫花苜蓿,吸收峰所对应的波数相对固定,但各吸收强度有所变化,说明重金属铜胁迫并不会改变紫花苜蓿基本的化学成分组成,但对化学成分的含量有所影响。
(3)紫花苜蓿根组织在2924 cm-1处峰高随着Cu浓度的增加先下降后上升,反映在低铜处理条件下紫花苜蓿分泌的有机酸不断螯合Cu,造成羧酸O-H的减少,但随着Cu 含量的升高,其羧酸螯合力变弱,有机酸含量渐渐升高。
( 4) 紫花苜蓿茎组织在2924,1643,1381,1064 cm-1等处峰高无明显变化,表明其茎中的生理生化过程受影响的程度较小,体现了紫花苜蓿作为Cu 耐性植物的特性; 叶组织在重金属Cu 胁迫下,所有峰值在低浓度(<5 mol/L)Cu 处理下变化不明显,高处理浓度时,随着浓度的升高可溶性糖及可溶性蛋白质等物质的含量都呈现先升后降的趋势。
致谢:东南大学王大勇教授对写作给予帮助,特此致谢。
[1] Madejónb P, Ramírez-Benítezc J E, Corralesa I, Barceló J, Poschenrieder C. Copper-induced oxidative damage and enhanced antioxidant defenses in the root apex of maize cultivars differing in Cu tolerance. Environmental and Experimental Botany, 2009, 67(2): 415- 420.
[2] Janas K M, Zielińska-Tomaszewska J, Rybaczek D, Maszewski J, Posmyk M M, Amarowicz R, Kosińska A. The impact of copper ions on growth, lipid peroxidation, and phenolic compound accumulation and localization in lentil (LensculinarisMedic.) seedlings. Journal of Plant Physiology, 2010, 167(4): 270- 276.
[3] Zhang T P, Pan W B. Progress in the research of rhizosphere and phytoremediation of contaminated soils. Ecology and Environment, 2003, 12(1): 76- 80.
[4] Bert V, Macnair M R, de Laguerie P, Saonmitou-Laprade P, Petit D. Zinc tolerance and accumulation in metallicolous and nonmetallicolous populations ofArabidopsishalleri(Brassicaceae). New Phytologist, 2000, 146(2): 225- 233.
[5] Clemens S. Molecular mechanisms of plant metal tolerance and homeostasis. Planta, 2001, 212(4): 475- 486.
[6] Baker A J M. Metal tolerance. New Phytologist, 1987, 106(1): 93- 111.
[7] Liang W B, Xue S G, Shen J H, Wang P, Wang J. Manganese stress on morphological structures of leaf and ultrastructures of chloroplast of a manganese hyperaccumulator,Phytolaccaamericana. Acta Ecologica Sinica, 2011, 31(13): 3677- 3683.
[8] Bosch A, Serra D, Prieto C, Schmitt J, Naumann D, Yantorno O. Characterization of Bordetella pertussis growing as biofilm by chemical analysis and FT-IR spectroscopy. Applied Microbiology and Biotechnology, 2006, 71(5): 736- 747.
[9] Ren L M, Cheng Z F, Liu P, Li Z G. Studies on the physiological response ofPhytolaccaamericanato manganese toxicity by FTIR spectroscopy. Spectroscopy and Spectral Analysis, 2008, 28(3): 582- 585.
[10] Xue S G, Zhu F, Ye S, Wang J, Wu X E. Physiological response of mirabilis jalapa Linn. to lead stress by FTIR spectroscopy. Acta Ecologica Sinica, 2011, 31(20): 6143- 6148.
[11] Li D X, Wen Y. Discussion on the application of hyperaccumulators in the remediation of heavy metal contaminated soil. Sci-Tech Information Development & Economy, 2011, 21(1): 177- 180.
[12] Yang J R, Huang Y. Mechanism of heavy metal tolerance of plants. Chinese Journal of Ecology, 1994, 13(6): 20- 26.
[13] Zhang Y Y, Liu P, Xu G D, Zhou N. Effects of Cu stress on growth and physiological characteristics of tobacco seedlings. Guizhou Agricultural Sciences, 2009, 37(3): 32- 35.
[14] Zhang X B, Liu P, Li D T, Xu G T, Jiang M J. FTIR spectroscopic characterization of chromium-induced changes in root cell wall of plants. Spectroscopy and Spectral Analysis, 2008, 28(5): 1067- 1070.
[15] Gu Y H, Liu P, Cai Q M, Chen J, Xie H K. Effects of Cd stress on FTIR spectra and physiological traits of Hypnum fertile Sendtn. Spectroscopy and Spectral Analysis, 2009, 29(3): 620- 623.
[16] Gong N, Li R H, Meng Z F, Yang G M. Physiological response ofBrassicachinensisL. seeds in germination to cadmium toxicity by FTIR-ATR spectroscopy. Journal of Argo-Environment Science, 2010, 29(1): 9- 14.
[17] Xue S G, Huang Y H, Wang J, Tian S X, Lei J, He Z X. Physiological response ofPolygonumlapathifoliumto manganese stress by FTIR spectroscopy. Journal of Central South University: Science and Technology, 2011, 42(6): 1528- 1532.
[18] Lu W Z, Yuan H F, Xu G T, Qiang D M. Modern near infrared spectroscopy analytical technology. Beijing: China Petrochemical Press, 2000: 19- 26.
参考文献:
[3] 张太平, 潘伟斌. 根际环境与土壤污染的植物修复研究进展. 生态环境,2003, 12(1): 76- 80.
[7] 梁文斌, 薛生国, 沈吉红, 王萍, 王钧. 锰胁迫对垂序商陆叶片形态结构及叶绿体超微结构的影响. 生态学报, 2011, 31(13): 3677- 3683.
[9] 任立民, 成则丰, 刘鹏, 李志刚. 美洲商陆对锰毒生理响应的FTIR 研究. 光谱学与光谱分析, 2008, 28(3): 582- 585.
[10] 薛生国, 朱锋, 叶晟, 王钧, 吴雪娥. 紫茉莉对铅胁迫生理响应的FTIR研究. 生态学报, 2011, 31(20): 6143- 6148.
[11] 李东旭, 文雅. 超积累植物在重金属污染土壤修复中的应用. 科技情报开发与经济, 2011, 21(1): 177- 180.
[12] 杨居荣, 黄翌. 植物对重金属的耐性机理. 生态学杂志, 1994, 13(6): 20- 26.
[13] 张艳英, 刘鹏, 徐根娣, 周楠. 铜胁迫对烟草幼苗生长和生理特征的影响. 贵州农业科学, 2009, 37(3): 32- 35.
[14] 张晓斌, 刘鹏, 李丹婷, 徐根娣, 蒋敏姣. 铬诱导植物根细胞壁化学成分变化的FTIR表征. 光谱学与光谱分析, 2008, 28(5): 1067- 1070.
[15] 顾艳红, 刘鹏, 蔡琪敏, 陈洁, 谢鸿锴. FTIR 结合生理特性研究镉胁迫对果灰藓的影响. 光谱学与光谱分析, 2009, 29(3): 620- 623.
[16] 龚宁, 李荣华, 孟昭福, 杨公明. Cd 对小白菜萌发生理影响的FTIR- ATR 研究. 农业环境科学学报, 2010, 29(1): 9- 14.
[17] 薛生国, 黄艳红, 王钧, 田守祥, 雷杰, 何哲祥. 采用FTIR 法研究酸模叶蓼对锰胁迫生理响应的影响. 中南大学学报: 自然科学版, 2011, 42(6): 1528- 1532.
[18] 陆婉珍, 袁洪福, 徐广通, 强冬梅. 现代近红外光谱分析技术. 北京: 中国石化出版社, 2000: 19- 26.
Physiological response ofMedicagosativaL. to copper stress by FTIR spectroscopy
FU Chuan1, YU Shunhui1, HUANG Yimin1, DENG Hongping2,*
1KeyLaboratoryofWaterEnvironmentEvolutionandPollutionControlintheThreeGorgesReservoirRegion,Chongqing404100,China2KeyLaboratoryofEco-environmentsintheThreeGorgesReservoirRegion,SchoolofLifeScience,SouthwestUniversity,Chongqing400715,China
Although copper (Cu) is required for plant growth and development, excessive levels of this element can be toxic to plants. Soil pollution and degradation take place when Cu is released into the environment through activities such as mining, discharge of “three wastes” (i.e., waste water, waste gas, and waste residue), and application of cupric fungicides.Medicagosativa, a perennial flowering plant native to Iran, has been cultivated as an important forage crop in many countries around the world. This species is reported to be a copper-hyperaccumulator, and studies suggest that it may be useful for phytoremediation.
To elucidate the mechanism of copper tolerance inM.sativa, changes in levels of chemical constituents ofM.sativatreated with different concentrations of Cu solution were investigated using Fourier transform infrared spectroscopy (FTIR), an accurate, simple, efficient technique with high resolution.
After germination in a seed tray,M.sativaseedlings of uniform size and appearance were selected and transplanted into a hydroponics system. After pre-cultivation with one-quarter strength Hoagland′s solution for one week, the seedlings were treated with different concentrations of Cu2+, i.e., 0, 1, 5, 20, and 100 mol/L. After 45 days of treatment with Cu2+solution, roots, stems, and leaves were separated and dried to measure biomass and to detect changes in chemical constituent levels.
Although root, stem, and leaf biomass ofM.sativadecreased slightly as concentrations of Cu2+were increased, these changes were not found to be significant. After an initial decline, absorbance in roots of the dominant infrared band near 2924 cm-1exhibited an increasing trend. This result indicates that at low Cu2+concentrations (<5 mol/L), organic acids secreted byM.sativawere able to chelate Cu2+, leading to a decrease in carboxylic acid O—H; at high Cu2+concentrations (>5 mol/L), chelating activity decreased, which was followed by an increase in organic acids. Absorbance changes at 1381 cm-1mirrored those at 2924 cm-1as Cu2+concentration was increased, indicating that fat levels inc reased after an initial decrease. The observed pattern of changes in fat concentration may have been due to increases in cell wall cation-exchange capacity that enhanced Cu resistance. In stems, absorbances of the dominant infrared bands near 2924, 1643, 1381, and 1064 cm-1, which corresponded to organic acids, proteins and amino acids, fats, and carbohydrates, respectively, did not exhibit any obvious changes. In leaves, there were no obvious changes in absorbances of any dominant bands at low Cu2+concentrations; at high Cu2+concentrations, however, these absorbances fell after an initial rise. The observed trend may have been due to changes in levels of soluble sugar and soluble protein.
To summarize, roots ofM.sativaare able to adjust organic acid content and to enhance cell wall cation-exchange capacity by accumulating Cu2+and impeding transportation of Cu2+from roots to shoots. As a result, shoots were effectively protected from Cu damage.
MedicagosativaL.; copper stress; chemical composition; FTIR
三峡库区水环境演变与污染防治重庆高校市级重点实验室开放基金项目(WEPKL2012MS- 01)
2013- 05- 08;
2013- 10- 23
10.5846/stxb201305080982
*通讯作者Corresponding author.E-mail: denghp@swu.edu.cn
付川,余顺慧,黄怡民,邓洪平.紫花苜蓿对铜胁迫生理响应的傅里叶变换红外光谱法研究.生态学报,2014,34(5):1149- 1155.
Fu C, Yu S H, Huang Y M, Deng H P.Physiological response ofMedicagosativaL. to copper stress by FTIR spectroscopy.Acta Ecologica Sinica,2014,34(5):1149- 1155.
