砷诱导蚕豆气孔保卫细胞死亡的毒性效应
2014-08-11薛美昭仪慧兰
薛美昭, 仪慧兰
(山西大学生命科学学院, 太原 030006)
砷诱导蚕豆气孔保卫细胞死亡的毒性效应
薛美昭, 仪慧兰*
(山西大学生命科学学院, 太原 030006)
采用蚕豆(ViciafabaL.)叶面气孔保卫细胞,研究砷对细胞的毒性效应。结果表明,0.3—10 mg/L的NaAsO2能降低保卫细胞活性,使部分细胞死亡,死亡率随砷浓度升高而增高。死细胞中呈现核固缩、核崩解等典型程序性死亡特征,且泛caspase抑制剂Z-Asp-CH2-DCB能阻止NaAsO2诱发的细胞死亡。过氧化氢清除剂过氧化氢酶与NaAsO2共同作用时,细胞死亡率显著低于砷单独处理组,保卫细胞内Ca2+水平降低,具程序性死亡特征的细胞数减少;Ca2+特异性螯合剂EGTA亦能降低NaAsO2诱发的细胞死亡。研究结果表明,NaAsO2能诱发蚕豆保卫细胞程序性死亡,该过程由胁迫引发的ROS升高引起,ROS可能通过激活质膜Ca2+通道,使胞外Ca2+内流,造成胞内Ca2+浓度升高,进而诱导细胞程序性死亡。
蚕豆保卫细胞;NaAsO2;程序性细胞死亡;ROS;Ca2+
砷(As)是一种广泛存在于自然界中的类金属元素,通常以极低浓度存在于人类生存环境中,不会对生物造成危害。近年来,随着砷化物在工、农、医药业中的大量使用,含砷矿石的开采和冶炼,含砷废水、废渣的不合理排放,以及地下水的不合理开采,导致很多地区大气、土壤和水体砷污染[1]。

植物叶表面的气孔保卫细胞是研究细胞信号转导的模式系统,对环境变化反应灵敏而准确[9- 10]。前人采用蚕豆(ViciafabaL.)叶面气孔保卫细胞研究氰化物、铝、二氧化硫的细胞毒性效应,发现了它们对细胞的致死效应及信号途径,说明保卫细胞对环境化学物的毒性具有灵敏的反应[11- 13]。因此,本文以蚕豆气孔保卫细胞为实验模型,根据砷在植物体内多以三价砷存在的事实[14],研究NaAsO2对蚕豆气孔保卫细胞的致死作用,为进一步揭示砷的毒性作用机制提供依据。
1 材料与方法
1.1 材料准备
蚕豆(ViciafabaL.)种子清洗后用自来水浸泡48 h,25 ℃湿纱布包裹催芽2—3 d,然后播种于较肥沃的营养土中。培养条件:光暗周期为14 h/10 h,温度18—25 ℃,光照强度240 μmol·m-2·s-1,相对湿度40%—80%。幼苗长至4周时用于实验。
取顶端第2节完全展开的叶片,选非叶脉部位用镊子撕取其下表皮,切成长约1 cm,宽约0.5 cm的表皮条,置于含2-(N-morpholino)ethanesulfonic acid(MES)的缓冲液中。MES缓冲液含50 mmol/L KCL,10 mmol/L MES,用三羟甲基氨基甲烷(Tris)调节pH值至7.0。
1.2 药物处理
用MES缓冲液配制含NaAsO2浓度为0.1、0.3、1、3和10 mg/L的溶液作为砷处理液。缓解组采用一定浓度拮抗剂分别与NaAsO2同时作用。MES缓冲液作对照。每个处理用3个不同蚕豆植株上的叶片,将表皮条置于含不同药物的处理液中,于23 ℃光照3 h。
所选拮抗剂包括:0.5 μmol/L的泛caspase 抑制剂(Z-Asp-2,6-dichlorobenzoyloxymet-hylketon,Z-Asp-CH2-DCB),200 U/mL的CAT和1 mmol/L的Ca2+特异性螯合剂乙二醇双四乙酸(ethylene glycol tetraacetic acid,EGTA)。实验中,用NaAsO2处理蚕豆表皮后,检测保卫细胞内ROS和Ca2+水平,与对照组比较,以分析砷胁迫诱发的细胞死亡过程中胞内ROS和Ca2+的变化;将NaAsO2和CAT共同作用于蚕豆表皮后,检测保卫细胞内Ca2+水平的改变,分析ROS水平降低时胞内Ca2+的变化规律[12- 13],判断砷胁迫期间ROS对Ca2+的调节作用。
1.3 细胞活性检测
参照Yi等实验方法[13],药物处理结束后,表皮条用0.1 mg/L的二乙酸荧光素(fluorescein diacetate,FDA)暗染10 min,荧光显微镜下观察、拍照。统计无绿色荧光的保卫细胞(死细胞)数与观察的保卫细胞总数,计算保卫细胞死亡率。每个处理重复3次,每次至少观察2000个保卫细胞。
1.4 细胞核形态观察
药物处理后,表皮条用卡诺氏液固定2 h,Feulgen法染色[15],普通光学显微镜观察。
1.5 胞内ROS和 Ca2+水平检测
参照González等实验方法[16],药物处理后表皮条分别于10 μmol/L的活性氧荧光指示剂2′,7′-二氯荧光黄双乙酸酯(2′,7′-dichlorofluorescein diacetate,DCFH-DA)或10 μmol/L的Ca2+荧光指示剂fluo- 3 acetomethoxyester(Fluo- 3 AM)中暗孵育60—90 min后,荧光显微镜(激发波长488 nm)下观察并拍照。使用图像分析软件Image-Pro Plus 6.0测量每组3个表皮条中约300个细胞的荧光值,计算其平均值。将对照组荧光值计为1,各处理组的相对荧光值为处理组荧光值与对照组的比值。
1.6 数据分析
计算每组3个重复实验的平均值和标准误,采用SPSS17. 0对实验结果进行F检验后,采用Duncan方法进行多重比较,分析不同处理组和对照组之间的差异显著性(*P<0.05,差异显著;**P<0.01,差异极显著;不同字母间差异显著,P<0.05)。
2 结果
2.1 砷诱发蚕豆保卫细胞死亡
表皮条经FDA染色后,对照组保卫细胞发亮绿色荧光,表明细胞具有良好的活性;NaAsO2处理组保卫细胞荧光亮度降低,说明胞内非特异性酯酶活性降低,不能很好地将FDA水解为极性荧光素分子,其中部分细胞无绿色荧光,记为死细胞。随着NaAsO2浓度的增高,死细胞比率增高。浓度为0.3 mg/L的NaAsO2能显著诱导蚕豆气孔保卫细胞死亡,NaAsO2浓度为1—10 mg/L时,细胞死亡率极显著增高(图1),其中10 mg/L处理组死亡率最高,达到32.2%,比对照组增加了3.4倍。

图1 砷对蚕豆保卫细胞活性的影响Fig.1 Effect of arsenic on guard cell viability in detached epidermis of V. faba leaves
2.2 砷诱发保卫细胞程序性死亡
用Schiff试剂染色后,对照组保卫细胞核质均匀,砷处理组保卫细胞出现核固缩、核崩解等典型的程序性细胞死亡(Programmed cell death, PCD)特征(图2),由此推测砷胁迫诱发的蚕豆保卫细胞死亡过程中可能存在细胞程序性死亡。
Caspase是细胞程序性死亡的关键酶,本研究用0.5 μmol/L的泛caspase抑制剂Z-Asp-CH2-DCB分别与3 mg/L和10 mg/L的NaAsO2共同作用时,细胞死亡率显著低于砷单独处理组(图3),即caspase抑制剂抑制了NaAsO2诱发的细胞死亡。该结果说明,蚕豆保卫细胞中的类caspase蛋白酶参与并执行了NaAsO2诱发的细胞死亡过程,砷胁迫诱发的蚕豆保卫细胞死亡过程中存在程序性细胞死亡。

图2 砷诱发蚕豆气孔保卫细胞核形态异常(×200) Fig.2 Abnormal nucleus in V. faba guard cells exposed to arsenica: 对照; b-d: NaAsO2处理组; b: 核崩解;c: 核固缩; d: 核消失

图3 泛caspase抑制剂对砷致蚕豆保卫细胞死亡的缓解作用Fig.3 Antagonistic effect of caspase inhibitor on As-induced guard cell death in V. faba
2.3 胞内ROS和Ca2+水平升高与砷诱发的细胞死亡有关
在砷处理液中加入抗氧化剂CAT或Ca2+特异性螯合剂EGTA后,细胞死亡率显著降低。200 U/mL的CAT或1 mmol/L的EGTA与NaAsO2同时作用时,细胞死亡率显著低于砷单独处理组(图4),说明降低砷胁迫组胞内ROS 和Ca2+水平可有效阻止砷诱发的细胞死亡,砷胁迫诱发的细胞死亡可能与胁迫引发的胞内ROS和Ca2+升高有关。
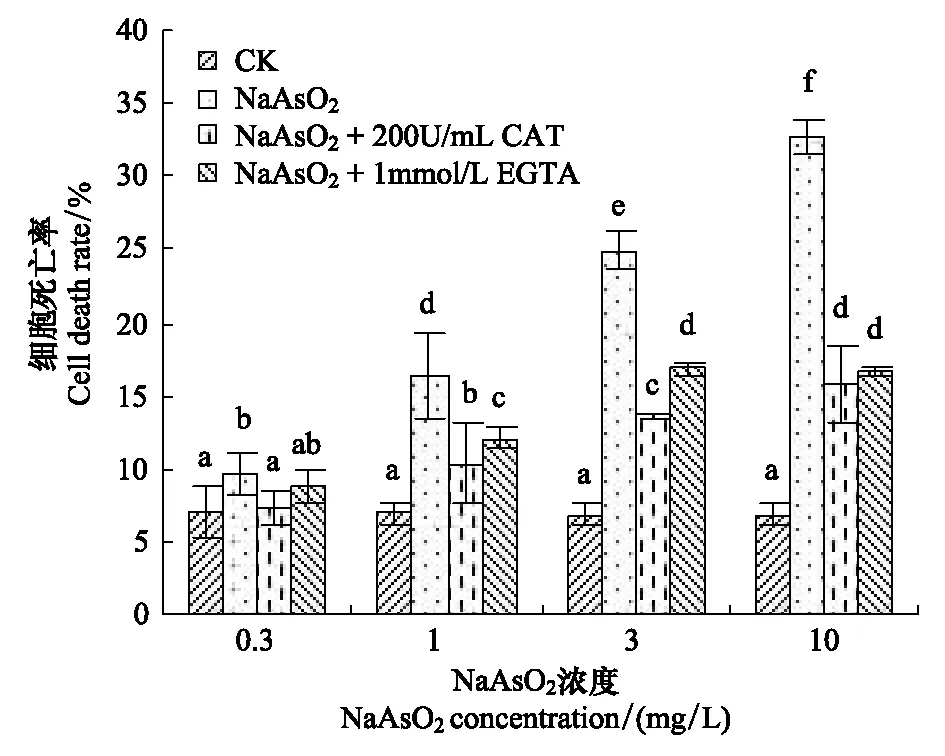
图4 CAT和EGTA对砷致蚕豆保卫细胞死亡的缓解作用Fig.4 Antagonistic effects of CAT and EGTA on As-induced guard cell death in V. faba
为了证实砷胁迫中保卫细胞内ROS 和Ca2+水平的变化,采用特异性荧光探针标记后检测了保卫细胞内ROS和Ca2+水平。经ROS探针DCFH-DA标记后,NaAsO2处理组保卫细胞ROS相对荧光值明显高于对照组;用Ca2+探针Fluo-3AM标记后,NaAsO2组保卫细胞内Ca2+相对荧光值较对照组明显升高(图5)。结果表明,NaAsO2处理组保卫细胞内ROS和Ca2+水平显著升高。
上述结果表明,砷处理组细胞死亡与胞内ROS和Ca2+水平升高同时发生,加入抗氧化剂降低胞内ROS或用Ca2+特异性螯合剂减少胞外后Ca2+内流后,保卫细胞死亡率显著下降,即胁迫组胞内ROS和Ca2+水平增高参与介导了保卫细胞的死亡。
加入200 U/mL的CAT后,砷处理组细胞死亡率降低(图4),具有程序性死亡特征的细胞数减少(图6),砷诱发的胞内Ca2+升高被抑制(图5),表明在砷诱发蚕豆保卫细胞死亡过程中,ROS对胞内Ca2+水平具有正调控作用,ROS位于Ca2+的上游发挥作用。加入Ca2+特异性螯合剂EGTA 降低细胞外Ca2+浓度,阻止胞外Ca2+内流后,可阻止砷处理诱发的细胞死亡(图4),说明在砷诱导细胞死亡的过程中,胞外Ca2+内流对胞内Ca2+水平升高和继发细胞死亡发挥了重要作用。
3 讨论
在砷的毒理学研究中以动物为材料的居多,砷对植物细胞的毒性效应研究较少,相关毒理学机制的研究更是少见。本文以蚕豆气孔保卫细胞为实验模型,提供了植物细胞中砷的毒性作用证据。用亚砷酸钠处理后蚕豆气孔保卫细胞活性降低并出现典型的程序性死亡特征,且泛caspase蛋白酶抑制剂Z-Asp-CH2-DCB能阻止砷诱发的细胞死亡,表明砷诱发的蚕豆保卫细胞死亡过程存在程序性细胞死亡。通过检测抗氧化剂CAT和钙离子特异性螯合剂EGTA对砷毒性作用的抑制效应,证实砷胁迫组胞内ROS和Ca2+水平的提高是砷诱发植物细胞程序性死亡的诱因,该结果与砷诱发的多种动物细胞的凋亡途径类似[17- 18],表明植物细胞与动物细胞中可能存在着相似的机制。

图5 砷对蚕豆保卫细胞内ROS和Ca2+水平的影响Fig.5 Changes of ROS and Ca2+ fluorescence in V. faba guard cells exposed to arsenic
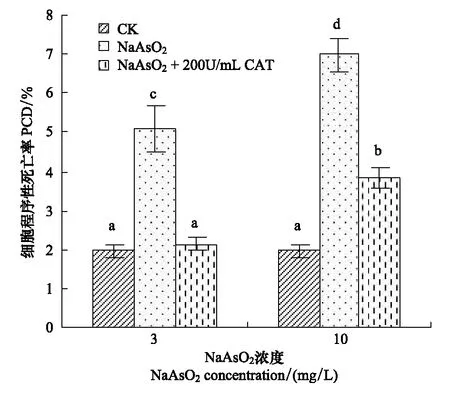
图6 CAT对砷致蚕豆保卫细胞程序性死亡的抑制效应Fig.6 Inhibition of CAT on PCD in V. faba guard cells exposed to arsenic
植物细胞可通过ROS介导的钙信号途径而致死,过氧化氢能激活质膜上的钙离子通道,使胞外Ca2+内流,胞内Ca2+水平升高[19],胞内Ca2+浓度升高可激活Ca2+依赖性核酸内切酶,使细胞核DNA在核小体连接处被切割,从而引发细胞程序性死亡。本研究发现,砷处理组ROS水平对胞内Ca2+水平具正向调节作用,减少胞外Ca2+内流后砷处理组死亡率下降,由此推测,砷胁迫产生的ROS可能通过激活质膜Ca2+通道,使Ca2+内流导致胞内Ca2+水平升高,从而介导了细胞死亡。研究发现,砷胁迫能引起酵母细胞核崩解,蚕豆和洋葱根尖细胞氧化损伤、微核率升高,这些结果的产生与砷胁迫组ROS升高有关[8,20];ROS可直接攻击DNA、蛋白质等生物大分子,使DNA 分子断裂、修复酶活性降低,DNA损伤无法及时修复。DNA损伤能激活细胞死亡程序,引发细胞死亡[21- 22],因此,砷胁迫组蚕豆保卫细胞内ROS升高可能通过类似途径诱发细胞死亡。
研究表明,砷胁迫可致酵母细胞内ROS和Ca2+水平升高,线粒体膜完整性破坏,细胞色素c释放,类caspase蛋白酶激活,引发程序性细胞死亡[20]。因此,砷胁迫组蚕豆保卫细胞内ROS和Ca2+水平升高也可能通过线粒体途径完成细胞死亡过程,通过破坏线粒体膜完整性释放细胞色素c、凋亡诱导因子,并于胞质中形成凋亡复合体,激活类caspase蛋白酶,进而特异性切割下游底物,引发细胞凋亡。
气孔调节着植物和外界环境间气体与水分的交换,砷胁迫导致气孔保卫细胞活性降低或死亡会干扰气孔正常的调节功能,影响植物的光合作用和呼吸代谢,从而干扰植株生理生化过程。但本研究观察到砷胁迫诱发的植物细胞程序性死亡,可能在植株对环境胁迫和刺激的应答过程中具有积极的意义,具体效应机制有待进一步深入研究。
[1] Garelick H, Jones H, Dybowska A, Valsami-Jones E. Arsenic pollution sources. Reviews of Environmental Contamination and Toxicology, 2008, 197: 17- 60.
[2] Singh N, Ma L Q, Srivastava M, Rathinasabapathi B. Metabolic adaptations to arsenic- induced oxidative stress inPterisvittataL andPterisensiformisL. Plant Science, 2006, 170: 274- 282.
[3] Li W X, Chen T B, Huang Z C, Lei M, Liao X Y. Effect of arsenic on chloroplast ultrastructure and calcium distribution in arsenic hyperaccumulatorPterisvittataL. Chemosphere, 2006, 62(5): 803- 809.
[4] Stoeva N, Berova M, Zlatev Z. Effect of arsenic on some physiological parameters in bean plants. Plantarum Biologia, 2005, 49(2): 293- 296.
[5] Titah H S, Abdullah S R S, Idris M, Anuar N, Basri H, Mukhlisin M. Arsenic range finding phytotoxicity test againstLudwigiaoctovalvisas first step in phytoremediation. Research Journal of Environmental Toxicology, 2012, 6(4): 151- 159.
[6] Malik J A, Goel S, Kaur N, Sharma S, Singh I, Nayyar H. Selenium antagonises the toxic effects of arsenic on mungbean (PhaseolusaureusRoxb.) plants by restricting its uptake and enhancing the antioxidative and detoxification mechanisms. Environmental and Experimental Botany, 2012, 77: 242- 248.
[7] Sharma I. Arsenic induced oxidative stress in plants. Biologia, 2012, 67(3): 447- 453.
[8] Wu L H, Yi H L, Yi M. Assessment of arsenic toxicity usingAllium/Viciaroot tip micronucleus assays. Journal of Hazardous Materials, 2010, 176(1/3): 952- 956.
[9] Hetherington A M. Guard cell signaling. Cell, 2001, 107(6): 711- 714.
[10] Schroeder J I, Allen G J, Hugouvieux V, Kwak J M, Waner D. Guard cell signal transduction. Annual Review of Plant Physiology and Plant Molecular Biology, 2001, 52: 627- 658.
[11] Samuilov V D, Kiselevshy D B, Sinitsyn S V, Shestak A A, Lagunova E M, Nesov A V. H2O2intensifies CN--induced apoptosis in pea leaves. Biochemistry, 2006, 71(4): 384- 394.
[12] Liu X, Yi H L. Aluminum induces apoptosis inViciafabaguard cells. Journal of Agro-Environment Science, 2010, 29(9): 1659- 1664.
[13] Yi H L, Yin J J, Liu X, Jing X Q, Fan S H, Zhang H F. Sulfur dioxide induced programmed cell death inViciaguard cells. Ecotoxicology and Environmental Safety, 2012, 78: 281- 286.
[14] Zhu Y G, Rosen B P. Perspectives for genetic engineering for the phytoremediation of arsenic-contaminated environments: from imagination to reality? Current Opinion in Biotechnology, 2009, 20(2): 220- 224.
[15] Yang H M. Experiment of Cell Biology. 2nd ed. Beijing: Higher Education Press, 1997: 75- 76.
[16] González A, de los Cabrera M, Henríquez M J, Contreras R A, Morales B, Moenne A. Cross talk among calcium, hydrogen peroxide, and nitric oxide and activation of gene expression involving calmodulins and calcium-dependent protein kinases inUlvacompressaexposed to copper excess. Plant Physiology, 2012, 158(3): 1451- 1462.
[17] Han Y H, Moon H J, You B R, Kim S Z, Kim S H, Park W H. Effects of arsenic trioxide on cell death, reactive oxygen species and glutathione levels in different cell types. International Journal of Molecular Medicine, 2010, 25(1): 121- 128.
[18] Das J, Ghosh J, Manna P, Sil P C. Protective role of taurine against arsenic-induced mitochondria-dependent hepatic apoptosis via the inhibition of PKCδ-JNK pathway. PLos One, 2010, 5(9): e12602.
[19] Pei Z M, Murata Y, Benning G, Thomine S, Allen G J, Grill E, Schroeder J I. Calcium channels activated by hydrogen peroxide mediate abscisic acid signalling in guard cells. Nature, 2000, 406(6797): 731- 734.
[20] Wu L H. Mechanism of Sodium Arsenite-Induced Cell Death[D]. Shanxi: Shanxi University, 2011.
[21] Pan J W, Zhu M Y, Chen H. Aluminum-induced cell death in root-tip cells of barley. Environmental and Experimental Botany, 2001, 46(1): 71- 79.
[22] Fleury C, Mignotte B, Vayssière J L. Mitochondrial reactive oxygen species in cell death signaling. Biochimie, 2002, 84(2/3): 131- 141.
参考文献:
[12] 刘鑫, 仪慧兰. 铝诱导蚕豆气孔保卫细胞凋亡研究. 农业环境科学学报, 2010, 29(9): 1659- 1664.
[15] 杨汉民. 细胞生物学实验 (第二版). 北京: 高等教育出版社, 1997: 75- 76.
[20] 吴丽华. 亚砷酸钠诱导细胞死亡的分子机制研究 [D]. 山西: 山西大学, 2011.
Arsenic induces guard cell death in leaf epidermis ofViciafaba
XUE Meizhao, YI Huilan*
SchoolofLifeScience,ShanxiUniversity,Taiyuan030006,China
Arsenic is a highly toxic metalloid for all forms of life including plants. Arsenic enters in plants through phosphate transporters as a phosphate analogue or through aquaglycoporins. Uptake of arsenic in plant tissues can affect plant metabolism, causing various physiological disorders, structural abnormalities and even plant death. Oxidative stress is considered to be a key mechanism of arsenic toxicity.
In this study, the effect of sodium arsenite (NaAsO2) on guard cell viability was investigated in detached epidermis ofV.fabaleaves. Epidermal strips were obtained from 4-week-old plants by peeling off the lower epidermis ofV.fabaleaves and incubated in 2-(N-morpholino) ethanesulfonic acid (MES) buffer containing some chemicals (NaAsO2with or without some antagonists) for 3 h in white light at 23 ℃ as the treatments. After treatment, the epidermal strips were stained with fluorescein diacetate (FDA) to show cell viability, or with 2′,7′-dichlorofluorescein diacetate (DCFH-DA) and fluo-3 acetomethoxyester (Fluo-3AM) respectively to indicate intracellular reactive oxygen species (ROS) and calcium ion (Ca2+) levels.
The results of our experiments showed that NaAsO2treatment significantly decreased cell viability and induced cell death in the concentration range of 0.3 to 10 mg/L. Arsenic provokes synchronous increases in cell death rate and intracellular levels of ROS and Ca2+inV.fabaguard cells. The typical nuclear morphological changes including nuclear fragmentation and nuclear condensation were observed in As-treated guard cells, while Z-Asp-2,6-dichlorobenzoyloxymethylketone (Z-Asp-CH2-DCB), a specific inhibitor of mammalian caspases, significantly blocked As-induced cell death. The occurrence of characteristic features of programmed cell death (PCD) and the inhibitory effect of caspase inhibitor Z-Asp-CH2-DCB on As-induced cell death suggest the activation of a PCD pathway evoked by arsenic exposure. Application of antioxidant catalase significantly inhibited As-induced cell death, PCD-to-total-cells ratio and intracellular Ca2+increase provoked by arsenic. A specific Ca2+chelator ethylene glycol tetraacetic acid also significantly decreased the cell death caused by arsenic. These results clearly demonstrated that arsenic induced cell death associated with obvious increases in intracellular ROS and Ca2+levels, in which ROS positively regulated intracellular Ca2+level.ROS generation and intracellular Ca2+level increase in As-treated stomatal guard cells were involved in the process of As-induced cell death. The results of the present study indicate that arsenite induced guard cell death via a PCD pathway through ROS mediating Ca2+elevation.
V.fabaguard cells; NaAsO2; programmed cell death; ROS; Ca2+
国家自然科学基金项目(30870454, 30470318); 教育部高等学校博士学科点基金项目(20070108007, 20121401110007); 山西省回国留学人员科研资助项目(2012013)
2012- 10- 17;
2013- 04- 18
10.5846/stxb201210171445
*通讯作者Corresponding author.E-mail: yihl@sxu.edu.cn
薛美昭, 仪慧兰.砷诱导蚕豆气孔保卫细胞死亡的毒性效应.生态学报,2014,34(5):1134- 1139.
Xue M Z, Yi H L.Arsenic induces guard cell death in leaf epidermis ofViciafaba.ActaEcologicaSinica,2014,34(5):1134- 1139.
