塔里木胡杨林可培养胡杨内生细菌多样性与群落结构的时空演变格局
2014-08-10吾尔麦提汗麦麦提明卡依尔玉素甫热孜亚艾肯布阿依夏姆阿木提努丽曼姑司马义买孜拉木肉扎洪麦合甫再木阿布都热合曼马相汝艾尔肯热合曼
吾尔麦提汗·麦麦提明,卡依尔·玉素甫,热孜亚·艾肯,布阿依夏姆·阿木提,努丽曼姑·司马义,买孜拉木·肉扎洪,麦合甫再木·阿布都热合曼,马相汝,艾尔肯·热合曼
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
塔里木胡杨林可培养胡杨内生细菌多样性与群落结构的时空演变格局
吾尔麦提汗·麦麦提明,卡依尔·玉素甫,热孜亚·艾肯,布阿依夏姆·阿木提,努丽曼姑·司马义,买孜拉木·肉扎洪,麦合甫再木·阿布都热合曼,马相汝,艾尔肯·热合曼*
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
阐明塔河,Kiyik河,Ugan河这3条河胡杨内生细菌多样性及群落结构时空演变格局。2011年5月上旬与9月下旬从Kiyik,Ugan古河道和塔河主河道的6个采样位点采集24棵树的胡杨茎秆内存液样,用4种培养基分离纯化了588株胡杨内生细菌。16S rDNA序列分析表明,588株细菌分别属于6大类群:γ-变形菌纲(50.17%),厚壁菌门(34.58%),放线菌门(10.17%),α-变形菌纲(4.24%),拟杆菌门(0.50%),β-变形菌纲(0.34%),47个属,114种。其中有211株菌的16S rDNA相似率<98.0%,它们分别属于19个属的41个物种,是胡杨林本源的潜在新菌种。假单胞菌属(29.76%)和芽孢杆菌属(19.05%)为优势属。与Pseudomonasxinjiangensis相聚类的潜在新种(74株,12.585%)是本源优势菌种。辛普森多样性指数显示,Kiyik河多样性指数为0.931,塔河为0.935;Ugan河最高,为0.969。香农-威纳均匀度指数表明, Ugan河的分布最均匀,均匀度指数为0.8570;塔河次之,为0.8314;Kiyik河最低,为0.7937。时空变化对比分析表明:整体上塔里木胡杨林内生菌群落结构的原生态状态保持较好,较少地遭受到外来优势菌群的侵染。其中,Kiyik古河道的内生菌群落结构保持原生态最好,很少受外来菌群的清洗与取代;Ugan河次之,内生菌群落结构发生了一定程度的变迁;塔河主河道细菌群落结构发生了较大程度的改变,被人类活动带来的外来常见优势菌群生态冲刷的趋势明显。
塔河;Kiyik河;Ugan河;胡杨;可培养内生细菌;16S rDNA;细菌多样性;时空演变分析
植物内生菌是栖居在陆地和水生植物相关组织内,生活史的一部分或其整个生活史在健康植物组织内部腐生、寄生和共生,而对植物不造成实质性危害的一组微生物[1- 3]。研究发现植物内生菌广泛存在,地球上300 000 种植物中都有内生菌的存在[4]。在目前研究过的所有植物中均发现有内生菌,它们可存在于植物的根、茎、叶、花、果实等各个部位[5- 7]。
胡杨(PopuluseuphraticaOliv) 分类学上属于杨柳科杨属,落叶乔木,生长在中纬度的干旱荒漠地区,具有抗寒、抗热、抗干旱、抗风沙、耐盐碱等优良性状,是新疆荒漠中分布最广的落叶树种,也是特有的荒漠森林树种[8]。塔里木河流域分布着全世界最大的一片天然胡杨林,其面积近30万hm2[9],它约占全国胡杨林总面积的90%和全世界胡杨林总面积的55% 以上[10- 11],是极其珍贵的自然资源。
对于胡杨有关的微生物多样性的研究,国内文献中袁秀英等[12]人对内蒙古的胡杨根际真菌和内生真菌;孜来古丽,王宁,玛丽艳木,祖母拉提,玛丽怕等人对塔河,沙雅县,Kiyik河和Ugan河等地区的胡杨林土壤微生物多样性和内生真菌多样性状况进行过报道[13- 21]。但是在国内外文献中,除了本实验室的卡依尔·玉素甫等人[22]2011年对Ugan河胡杨可培养内生细菌进行初步多样性分析(从胡杨内存液中共分离了62株可培养胡杨内生细菌,分别属于细菌四大类群,18个属,32 个种)以外,针对塔里木胡杨林的胡杨内生细菌资源尚未见系统地进行分离和用现代细菌分类学方法进行研究的报道。因此,对塔里木河中下游的胡杨内生细菌进行分离鉴定,系统发育分析,不仅可以搞清塔里木胡杨林的胡杨内生细菌的群落结构,分离拯救一批不可多得的珍稀菌种和本源土著菌种,还可以为将来的科学研究和在工农业生产应用提供菌种资源和数据。
1 材料和方法
1.1 材料
1.1.1 研究区自然概况
塔里木盆地特有暖温带极端干旱的大陆性气候,光热资源丰富,降水稀少,年均降水量为17.4—42mm,而年蒸发量却高达1890.1—3229.3mm,该地的胡杨林主要分布海拔高度约为700—1500m塔里木河及其废弃古河道两岸泛洪区的狭长带区。在现在的塔河中游(沙雅县至尉犁县)主河道的南面,塔克拉玛干沙漠的北部边缘荒漠区,遗留着历史上由于塔河改道而干枯的6条较大的废弃古河道遗迹,其中分布在最南部废弃年代最久远的2条河道上只剩下胡杨的残桩断枝,已没有活体胡杨的分布以外,其余的4条废弃河道沿岸,不同程度的分布着依靠地下水维系生命的衰败状态的胡杨林。其中Kiyik(断流废弃344a)河道和Ugan废弃古河道(断流废弃126a)沿岸胡杨分布密度较高,利用地下水无性繁殖的萌生林木的生长状况略好于其它废弃古河道。这两条河与当今塔河河道距离较远,断流年代比较久远,脱离了塔河水系。因此,分布在塔河、Kiyik河和Ugan河流域的胡杨林之间早已失去利用洪水散播种子的自然条件,丧失通过互换种子来维系相互之间的基因流畅通及借此传播内生菌的机制,形成了在时间和空间上相对隔离封闭的3个生态体系。
1.1.2 样品的采集
本研究分别于2011年5月上旬和2011年9月下旬从尉犁县现行塔河主河道南面的Ugan河两岸生长多年的胡杨林(N 41° 00′397″ E 85° 04′241″,N 41° 00′032″ E 85° 02′501″),尉犁县现行塔河主河道南面的Kiyik古河道胡杨林(N40°42′8″ E 85°23′22″,N40°43′22″ E 85°19′18″)和现行塔河主河道(N40°58′21″ E85°29′26″,N41°10′04″ E84°13′52″)各选取两个位点(2样点之间的直线空间距离保持在10 km以上),每个样点选取4棵胡杨(每一个样点内2棵取样树之间的直线空间距离保持在500 m以上),共24颗胡杨树作为采样目标(图1),按卡依尔·玉素甫等人[22]的方法用无菌的年轮钻在胡杨树干离地高度1.60 m处钻孔,以灭菌的离心管收集树干内存液,置于4 ℃即刻返回实验室进行涂布与分离菌株。

图1 塔里木胡杨林采样点示意图Fig.1 Six sampling sites at the three rivers in southern Xinjiang, China
1.1.3 主要试剂和仪器
Taq DNA聚合酶购自天根生物技术有限责任公司;引物由北京鼎国生物技术有限责任公司合成; PCR仪为ALD.244型,购自BIORAD公司;凝胶成像分析仪ALPHAIMAGERTM2200及成像软件AlphaEase 4.1.0,购自AlphaInnotech公司;恒温振荡摇床和恒温培养箱购自江苏省金坛市医疗仪器厂。
1.1.4 培养基
本实验中采用溶菌肉汤培养基 LB(胰蛋白胨 10 g,酵母侵粉 5 g,氯化钠 10 g),胰蛋白胨大豆琼脂培养基 TSA(胰蛋白胨 15 g,大豆蛋白胨7.5 g,氯化钠 30 g),牛肉膏蛋白胨培养基 NA(牛肉膏 30 g,蛋白胨 5 g,氯化钠 5 g),KingA(蛋白胨20 g,氯化镁1.4 g,硫酸钾10 g,氯化钠3 g,丙三醇10 g)等4种培养基。
1.2 菌株的分离培养
把每一个采样位点采来的4棵胡杨树茎秆液等量混合,稀 释 至 10-1—10-6倍,取 100 μL 涂布到上述的不同的固体培养基上,在 37 ℃ 培养 3—7 d。根据细胞与菌落形态、颜色、大小分别挑取表型差异的细菌,并在上述的培养基上划线纯化,纯化后的内生细菌用含 30% 甘油的 LB 培养基于-70 ℃保存备用。
1.3 DNA 提取及 16S rDNA 的扩增
DNA提取参照刘刚[23]等的方法进行。16S rDNA扩增采用细菌通用引物[24]27F(5′-AGAGTTTGATCCTGGCTCAG- 3′)和1492R(5′-GGTTACCTTGTTACGACTT- 3′)进行。PCR反应体系(50 μL):DNA模板约0.8 μL,10×PCR缓冲液5.0 μL,10 mmol/L的P1和P2各0.8 μL,dNTP(10 mmol/L) 4 μL,TaqDNA聚合酶(2.5 U/laL) 0.6 μL,加灭菌双蒸水至50.0 μL。PCR反应条件: 94 ℃ 5 min; 94 ℃ 30s,55 ℃ 30 s,72 ℃ 1 min 30 s,30个循环; 72 ℃10 min。反应结束后,取2—3 μL PCR产物在1.0%琼脂糖凝胶上电泳检测。PCR产物送到上海生物工程有限公司进行16SrDNA完整长度测序。
1.4 系统发育分析
测序结果Ezbiocloud(EzTaxon-e server)和BLAST(http://www.ncbi.nlm.nib.gov/blast/blast.cgi) 上进行分析。用CLUSTALX进行多序列比对[25],系统进化矩阵根据Kimura模型[26]估算,用MEGA5.0(Molecular Evolutionary Genetics Analysis)软件采用邻接法[27](Neighbor.Joining)聚类分析,并构建出系统进化树。
1.5 细菌多样性指数的分析
采用 Simpson 多样性指数(D) 、Shannon-Wiener指数(H) 和 Shannon-Wiener 均匀度指数(E) 计算多样性[28]。
Simpson 多样性指数:
Shannon-Wiener 指数:
Shannon-Wiener 均匀度指数
E=H/log2S
式中,S为菌种数;Pi为第i种的多度比例,可以用Pi=Ni/N求出;Ni是第i种的菌株数,N是所有菌株数总和。
1.6 胡杨内生细菌分布状况分析
采用维恩图(http://bioinfogp.cnb.csic.es/tools/venny/index.html)的在线作图工具对胡杨内生细菌群落结构在3条河中的分布状况分进行了分析。
2 结果和分析
2.1 菌株的分离纯化与测序分析
分别用NA,TSA,LB与King A等4种培养基进行稀释涂布法分离,选择表型不同的菌株进行划线法培养纯化。从样品中分离并成功对其16S rDNA全序列测序的胡杨内生细菌共588株,其中Ugan古河道270株,Kiyik古河道151株,塔河主河道167株。它们分别属于6大类群,47个属,114个物种(表1)。其中γ-变形菌纲的细菌占总分离菌的50.17%, 厚壁菌门占34.58%,放线菌门占10.17%、α-变形菌纲占4.24%,拟杆菌门占0.50%,β -变形菌纲占0.34%;γ-变形菌纲和厚壁菌门的细菌是胡杨茎秆液中的优势类群,假单胞菌属(29.76%)和芽孢杆菌属(19.05%)为优势属。
2.2 胡杨内生菌的系统发育分析
2.2.1 Ugan河胡杨内生细菌多样性及系统发育分析
从Ugan河胡杨林的两个采样位点共获得270株细菌(表1),通过16SrRNA基因序列测序,Ezbiocloud(EzTaxon-e server)和BLAST比对序列相似性,确定菌株的系统发育地位,并构建系统发育树分析进化关系(图2)。结果表明,它们主要分布于厚壁菌门(Firmicutes, 45.93%),γ-变形菌纲(GammaProteobacteria, 37.40%),放线菌门(Acinetobacter, 13.70%),α-变形菌纲(AlphaProteobacteria, 2.22%),β变形菌纲(Beata-proteobacteria, 0.37%)和拟杆菌门(Bacteroidetes, 0.37%)等6个大领域,由34个属81个种组成。芽孢杆菌属(Bacillus)和假单胞菌属(Pseudomonas)作为优势属分别占29.26%和19.25%。分离频率最高的是芽孢杆菌属(Bacillus),分离到79株该属的细菌,分别属于18个种。分离频率次之的是假单胞菌(Pseudomonas),分离到52株该属的细菌,分别属于12个种。除了出现频率较高的上述的细菌以外,还分离到了32个属的细菌:Brenneria(1个种),Kocuria(4个种),Planococcus(3个种),Planomicrobium(5个种),Virgibacillus(1个种),Lysinibacillus(1个种),Rhizobium(1个种),Halomonas(4个种),Nesterenkonia(3个种),Enterobacter(1个种),Microbacterium(1个种),Psychrobacter(2个种),Ralstonia(1个种),Pantoea(1个种),Acinetobacter(2个种),Brevibacterium(1个种),Microvirga(1个种),Gracilibacillus(1个种),Kineococcus(1个种),Staphylococcus(5个种),Cellulosimicrobium(1个种),Janibacter(1个种),Roseomonas(2个种),Luteimonas(1个种),Pontibacter(1个种),Exiguobacterium(1个种),Oceanobacillus(1个种),Macrococcus(1个种),Photobacterium(1个种),Providencia(1个种),Micrococcus(2个种)。

表1 3个生态区胡杨林中分离的代表菌株列表
表中分离来源一列K代表Kiyik河,U代表Ugan河,T代表塔河主河道
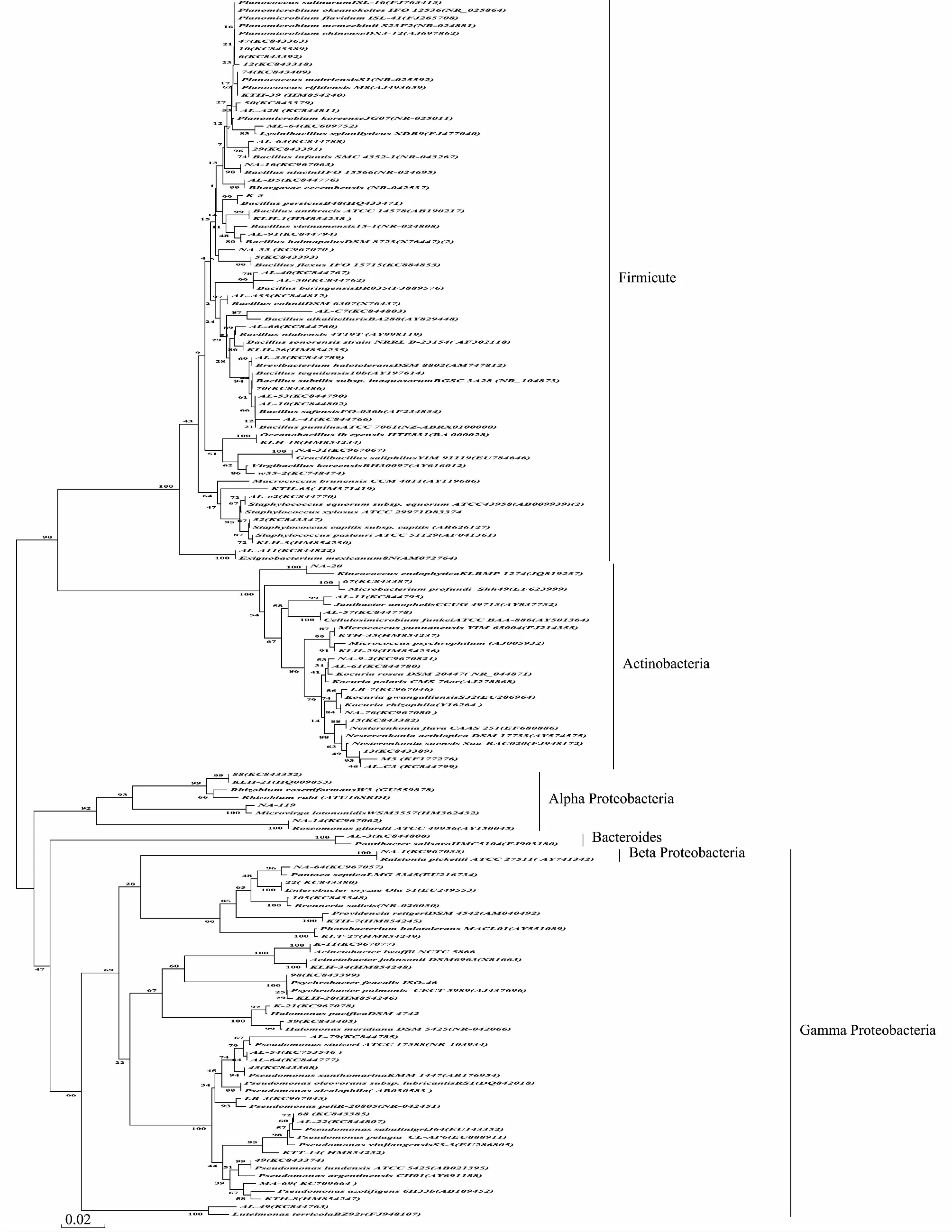
图2 Ugan河胡杨内生细菌16rDNA系统发育分析Fig.2 Phylogenetic tree of 16S rDNA sequences of endophytic bacteria isolated from populus euphratica in Ugan RiverThe tree was constructed by the neighbor-joining method.the bootstrap values were obtained after a bootstrap test with 1000 replications;The numbers in parentheses are accession numbers of sequences;Scale bar indicates 2% sequence divergence
从Ugan河采集的样品中分离的细菌最多,为270株,属于细菌六大类群。其中厚壁菌门所占的比例最高,占45.93%。γ-变形菌纲所占的比例为第2,占37.40%。而在胡杨总内存液中,γ-变形菌纲作为优势类群占总分离菌株的50.17%;厚壁菌门为第2,占34.58%。Ugan河样品和胡杨总内生细菌的细菌类群相比,所占的优势类群比例上有所差异。例如Ugan河样品中,γ-变形菌纲所占的比例从胡杨总内存液中的50.17%减少到37.4%,列为第2;而厚壁菌门所占的比例从胡杨总内存液中的34.58%增加到45.93%,列为第1。其他4个类群所占的比例基本上跟胡杨总内存液中的比例保持一致,依次为放线菌门,α-变形菌纲,拟杆菌门和β-变形菌纲。
2.2.2 Kiyik河胡杨内生细菌多样性及系统发育分析
用可培养方法从Kiyik河胡杨林的两个采样位点共获得151株细菌(表1),通过16S rRNA基因序列测序,Ezbiocloud(EzTaxon-e server)和BLAST上比对序列相似性,确定菌株的系统发育地位,并构建系统发育树分析进化关系(图3)。结果表明,151株细菌分别属于γ-变形菌纲(Gamma-Proteobacteria, 57.61%),厚壁菌门(Firmicutes, 27.15%),放线菌门(Actinobacteria, 7.94%), α-变形菌纲 (Alpha-Proteobacteria, 6.62%),β-变形菌纲 (Beta-proteobacteria, 1.32%)和拟杆菌门(Bacteroidetes, 0.66%)等细菌域6大系统发育类群,25个属,49个物种。其中假单胞菌属(Pseudomonas)作为优势属,占总分离菌株的38.40%,次之是芽孢杆菌属(Bacillus)占15.23%。假单胞菌属(Pseudomonas)的分离频率最高,分离到58株该属的细菌,分别属于8个不同种。次之是芽孢杆菌属(Bacillus),分离到23株该属的细菌,分别属于8个种。除了以上的出现频率较高的细菌以外,还分离到了23个属的细菌:Halomonas(5种),Planococcus(5种),Acinetobacter(2种),Streptomyces(3种),Nesterenkonia(2种),Microbacterium(2种),Ignatzschineria(1种),Azomonas(1种),Stenotrophomonas(1种),Ralstonia(1种),Macrococcus(1种),Saccharibacillus(1种),Planomicrobium(1种),Corynebacterium(1种),Kocuria(1种),Nocardioides(1种),Rosomonas(1种),Rhizobium(1种),Pontibacter(1种),Fictibacillus(1种),Exiguobacterium(1种),Brenneria(1种),Pantoea(1种)。
从Kiyik河采集的样品中分离的细菌较少,为151株,属于细菌六大类群。六大类群在Kiyik河样品中所占的比例基本上跟胡杨总内存液保持一致,依次为γ-变形菌纲,厚壁菌门,放线菌门,α-变形菌纲,拟杆菌门和β-变形菌纲。而Kiyik河和Ugan河样品的细菌类群相比,在Kiyik河样品中γ-变形菌纲所占的比例有所增加,占57.61%。厚壁菌门所占的比例有所减少,仅占27.15%。除此之外,放线菌所占的比例有减少,α-变形菌纲所占的比例有增加的趋势。
2.2.3 塔河胡杨内生细菌多样性及系统发育分析
用可培养方法从塔河胡杨林的两个采样位点共获得167株细菌(表1),通过16S rRNA基因序列测序,Ezbiocloud(EzTaxon-e server)和BLAST上比对序列相似性,确定菌株的系统发育地位,并构建系统发育树分析进化关系(图4)。结果表明,167株菌分别属于γ-变形菌纲(Gamma-Proteobacteria, 64.70%),厚壁菌门(Firmicutes, 23.30%),放线菌门(Actinobacteria, 6.60%),α-变形菌纲 (Alpha-Proteobacteria, 5.30%) 等细菌域4大系统发育类群,19个属39个物种。其中假单胞菌属作为优势属,占细菌总数的38.90%,共分离到65株属于该属的细菌,分别属于8个种。除此之外还分离了Aeromonas(3种),Acinetobacter(1种),Brenneria(1种),Escherichia(1种),Halomonas(1种),Rahnella(1种)和Vibrio(1种)等属于γ-变形菌纲的8个不同属的细菌。厚壁菌门(Firmicutes)细菌类群中含有39株细菌,分别属于Bacillus(5种),Aerococcus(1种),Exiguobacterium(1种),Marinilactibacillus(1种),Planococcus(3种)和Planomicrobium(4种)等6个属。放线菌门细菌类群中含有11株细菌,分别属于Kocuria(2种),Nesterenkonia(1种)和Sanguibacter(1种)等3个属。α-变形菌纲 (Alpha-Proteobacteria) 细菌类群中含有9株细菌,分别属于Roseomonas(1种),Rhizobium属(1种)。
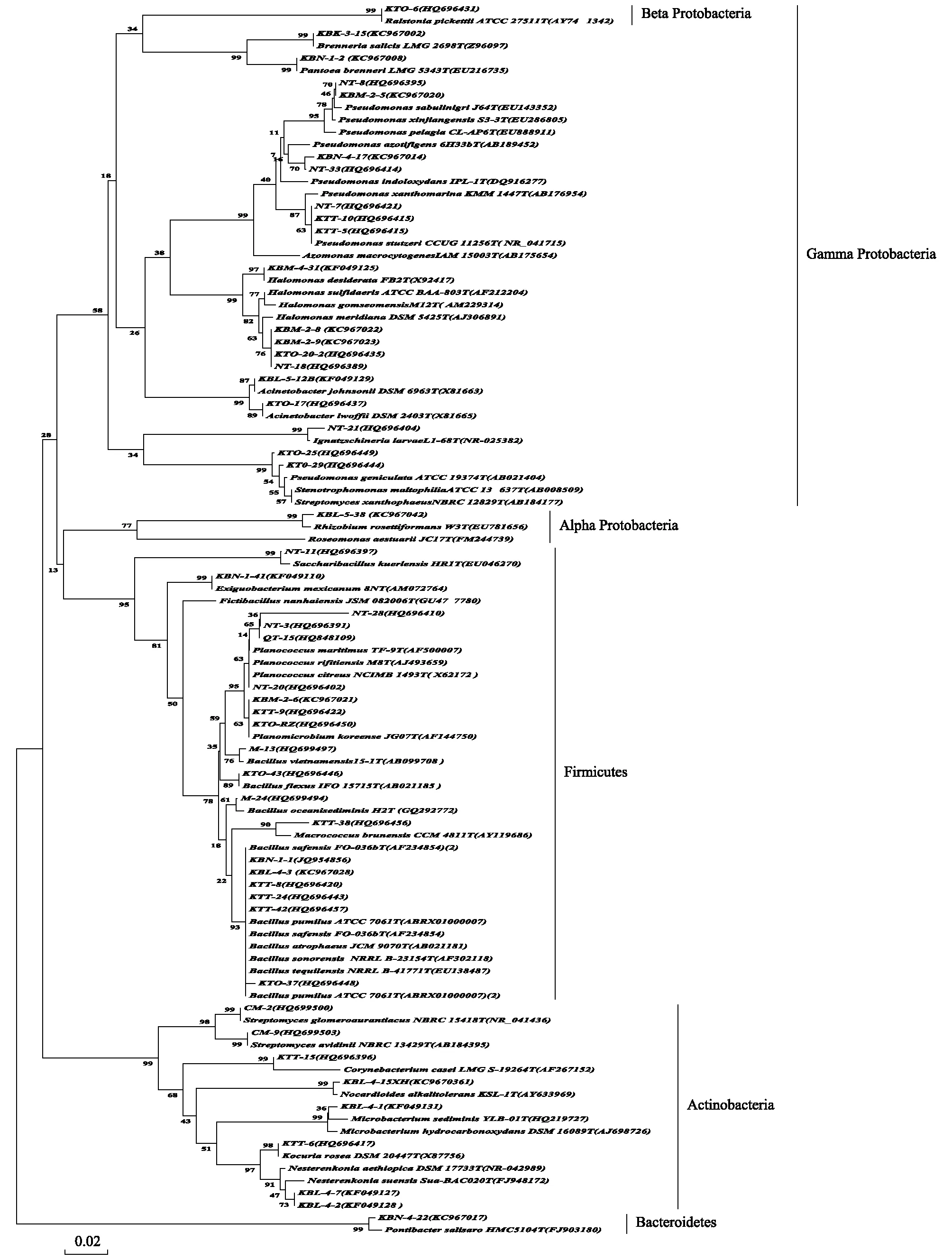
图3 Kiyik河胡杨内生细菌16rDNA系统发育分析Fig.3 Phylogenetic tree of 16S rDNA sequences of endophytic bacteria isolated from populus euphratica in Kiyik River The tree was constructed by the neighbor-joining method.the bootstrap values were obtained after a bootstrap test with 1000 replications;The numbers in parentheses are accession numbers of sequences;Scale bar indicates 2% sequence divergence
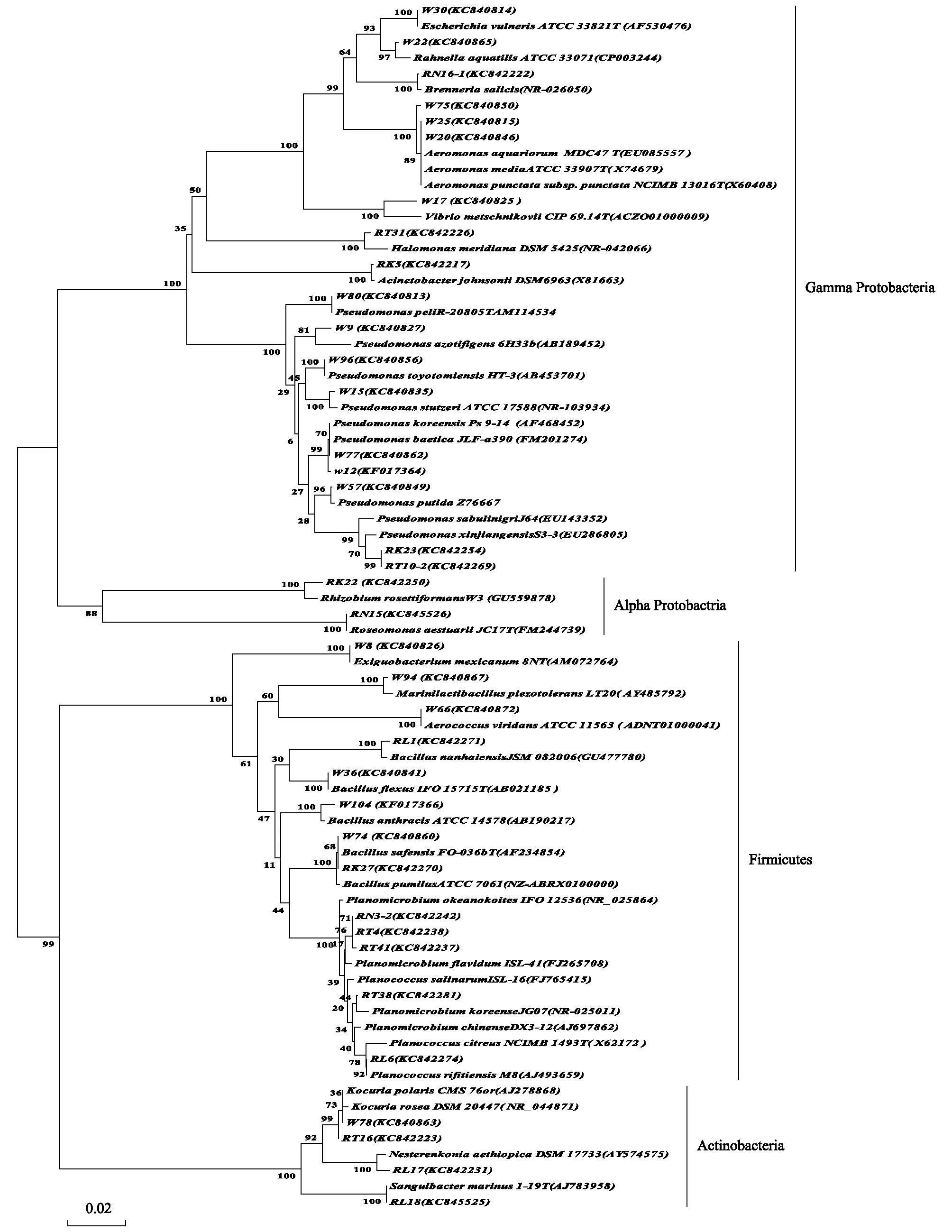
图4 塔里木河胡杨内生细菌16rDNA系统发育分析Fig.4 Phylogenetic tree of 16S rDNA sequences of endophytic bacteria isolated from populus euphratica in Tarim RiverThe tree was constructed by the neighbor-joining method.the bootstrap values were obtained after a bootstrap test with 1,000 replications;The numbers in parentheses are accession numbers of sequences;Scale bar indicates 2% sequence divergence
从塔河采集的样品中分离的细菌较多,为167株,属于细菌四大类群。塔河和Ugan河,Kiyik河样品的胡杨内生细菌相比,在细菌类群上有一定的差异,例如Ugan河,Kiyik河样品中分离的拟杆菌门和β-变形菌纲的细菌在塔河样品中没有被分离到。并且γ-变形菌纲所占的比例有继续增加的趋势,例如γ-变形菌纲在Ugan河占37.40%,在Kiyik河占57.61%,在塔河样品中占64.70%。而厚壁菌门所占的比例有减少的趋势,例如厚壁菌门在Ugan河占45.93%,在Kiyik河占27.15%,在塔河样品中占23.30%。除此之外,放线菌门所占的比例也有相应的减少趋势,放线菌门在Ugan河样品中占13.70%,在Kiyik河占7.94%,在塔河样品中占6.60%。α-变形菌纲所占的比例跟Ugan河样品相比有增加,跟Kiyik河样品相比有减少趋势。
2.3 胡杨本源内生新菌种分布状况分析
Ugan河、Kiyik河和塔河主河道胡杨林胡杨内存液中总共分离的588株细菌中,有211株菌(16S rRNA基因序列长度1300—11500 bp)与其已知的最近亲缘关系菌株的16S rRNA基因序列相似性小于98.0%(表2),占总分离菌株的35.884%。这211株菌隶属于19个属,41个种(表2),是41个潜在的新菌种,也是胡杨林中的特有本源土著菌种。这一数据充分展示了胡杨内生菌群落结构的独特性,它们整体上较少的遭受外来常见优势菌种的入侵、清洗与取代,保持了较高程度的地域隔离性、纯洁性与原始性。这41种潜在新菌中,只有与Halomonasmeridiana,Nesterenkoniaaethiopica,Pseudomonasazotifigens,Pseudomonassabulinigri,Pseudomonasxinjiangensis,Rhizobiumrosettiformans这6个菌种相聚类的6个潜在新菌种从所有3条河道的样品中检出,他们是胡杨林中普遍存在的本源物种。其中与Pseudomonasxinjiangensis这个菌种相聚类的潜在新菌种中共有74个分离株,占总分离菌株的12.585%(74/588),是胡杨内生菌中的本源优势菌种。还有与Acinetobacterlwoffii,Halomonassulfidaeris,Macrococcusbrunensis,Nesterenkoniasuensis,Pseudomonaspelagia,Pseudomonasstutzeri相聚类的6个潜在新菌种只出现在Kiyik河与Ugan河这2条河道的样品中,而没有出现在塔河样品。这一结果揭示塔河胡杨内生菌群落结构发生了较大的变化,而Ugan河与Kiyik河胡杨内生菌群落结构较多的保持了原始状态。而其余的29个潜在新菌种分别分布于3个河道中一条河道中,它们是胡杨内生菌中稀有的本源弱势菌种,比较容易受环境因素的干扰,被外来优势菌群清洗取代。各河道胡杨林区内生菌新菌种的检出率表现出了较大的差异,Ugan河为21种,Kiyik河为20种,而塔河最少只有8种。这表明塔河主河道流域受人类生活和生产活动的影响,大量的外来常见优势菌群入侵扩散,使原有本土弱势菌群大量消失,胡杨林原有的本源内生菌种群落结构产生了较大的改变。
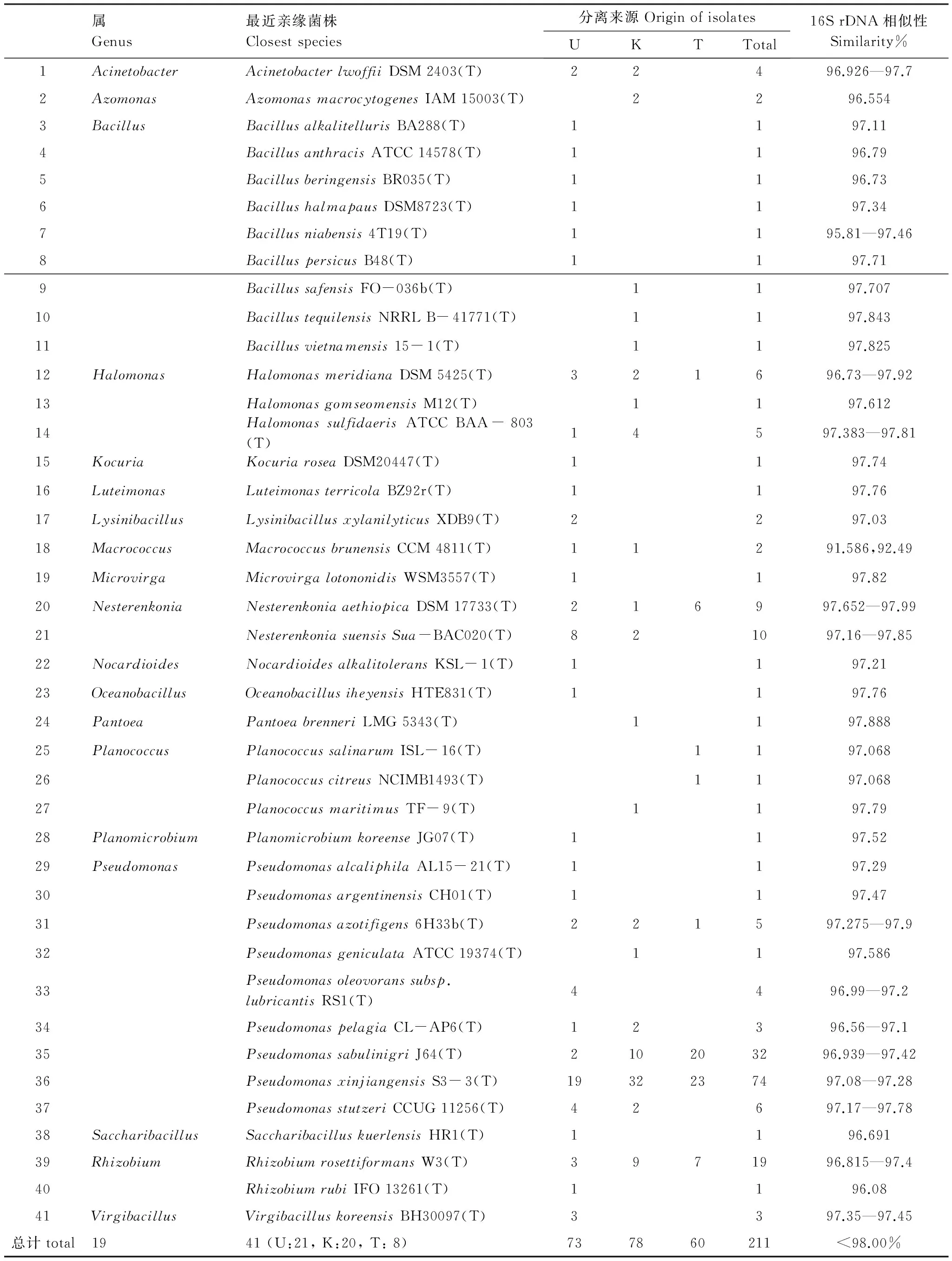
表2 潜在新种与模式菌株的16 rDNA序列相似性
表中分离来源一列K代表Kiyik河,U代表Ugan河,T代表塔河主河道
2.4 胡杨内生细菌多样性指数与3条河细菌群落的分布状况分析
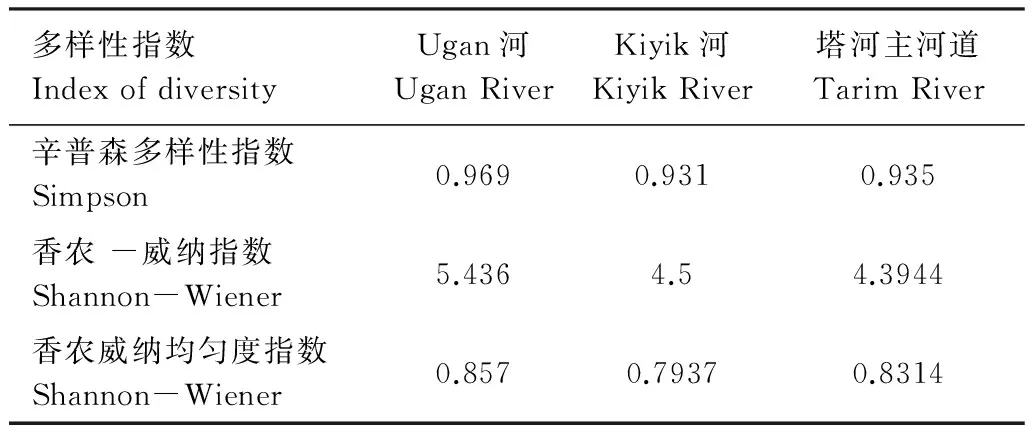
2.4.1 从3条河胡杨林中分离的胡杨内生细菌多样性指数结果见表3。从表中可知:Ugan河胡杨内生细菌辛普森(Simpson)多样性指数,香农-威纳(Shannon-Wiener)多样性指数高于Kiyik河和塔河胡杨内生细菌的多样性指数。Kiyik河和塔河比较,塔河胡杨内生细菌辛普森(Simpson)多样性指数高于Kiyik河胡杨内生细菌,而Kiyik河胡杨内生细菌香农-威纳(Shannon-Wiener)多样性指数高于塔河胡杨内生细菌。比较香农-威纳(Shannon-Wiener)均匀指数,Ugan河胡杨内生细菌均匀度最高,塔河胡杨内生细菌的均匀度为次之,Kiyik河杨内生细菌的均匀度最低。
表3 3个生态区胡杨内生细菌多样性指数与均匀度指数
Table 3 Diversity index and uniformity index of the endophytic bacteria from three ecosystems
多样性指数IndexofdiversityUgan河UganRiverKiyik河KiyikRiver塔河主河道TarimRiver辛普森多样性指数Simpson0.9690.9310.935香农-威纳指数Shannon-Wiener5.4364.54.3944香农威纳均匀度指数Shannon-Wiener0.8570.79370.8314
2.4.2 胡杨林内生细菌群落的菌种分布状况见图5。 由图5可知塔里木胡杨林内生细菌群落共形成114个物种水品的分类学单元。其中Ugan河分布81种,Kiyik河49种,塔河主河道39种。由于各河道的地理位置、空间距离和采样点的环境条件的不同,3个内生菌亚群落结构上出现了较大的差异。属于Acinetobacterjohnsonii,Bacillusflexus,Bacilluspumilus,Bacillussafensis,Brenneriasalicis,Halomonasmeridiana,Kocuriarosea,Nesterenkoniaaethiopica,Planococcusrifietoensis,Planococcussalinarum,Planomicrobiumkoreense,Pseudomonasazotifigens,Pseudomonassabulinigri,Pseudomonasxinjiangensis,Pseudomonasstutzeri,Rosemonasaestuarii,Rhizobiumrosettiformans等以上17种的细菌在3条河胡杨林采集的样品中都得到了分离培养,仅占菌种数总数的14.91%。而其余97个物种则分别分布于其中一条河道或2条河道。Ugan河分布的81种中除了3者共有的17种外,与Kiyik河共有的有12种,与塔河共有的有7种,Ugan河独有的有45种之多。Kiyik河分布的49个菌种中除了3者共有的17种外,与Ugan河共有的有12种,与塔河共有的有2种,Kiyik河独有的有18种。塔河分布的有39种除了3者共有的17种外,与Ugan河共有的仅有7种,与Kiyik河共有的仅有2种,塔河独有的有13种。3个亚群落独有的菌种数有76株之多,占总菌种数的66.67%,总体上呈现离散状态。上述数据表明胡杨内生菌的地域分布性较强,不同的胡杨林生态区有不同的菌种分布。3个亚群落中共有的17个菌种是胡杨内生菌种中适应性最强的菌种,可能在胡杨体内新陈代谢过程中具有重要的功能,与胡杨树共生共荣,不弃不离。
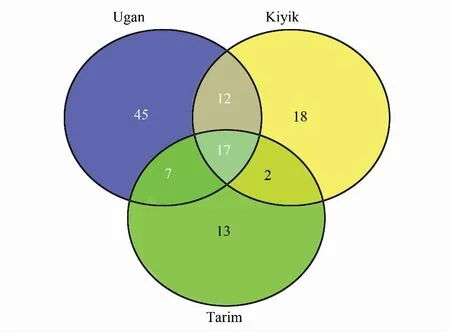
图5 胡杨内生菌群落分布状况示意Fig.5 Venn diagram of representing the number of species isolated from each sample and the overlap of species among the samples图中Ugan代表Ugan河,Kiyik代表Kiyik河, Tarim代表塔河主河道
2.5 菌种与潜在新菌种检出率分析
本源潜在新菌种是一个细菌群落中特有的物种,因为它不存在于其它任何不同的细菌群落中。因而,本源潜在新菌种数量的多少可以直观的反映一个微生物群落是否处于原生态状态。潜在新菌种数量多表明外来优势常见菌种尚未对它们进行取代和替换,反之则表明潜在新菌种被外来优势常见菌种清除、数量减少,细菌群落结构发生了改变。同理,随着外来优势常见菌种的持续入侵,群落中原有弱势菌种不断被取代清除,导致菌种数减少。所以一个细菌群落是否被外源菌群入侵,也可以通过该群落的菌种数量作为指标进行衡量和判定。
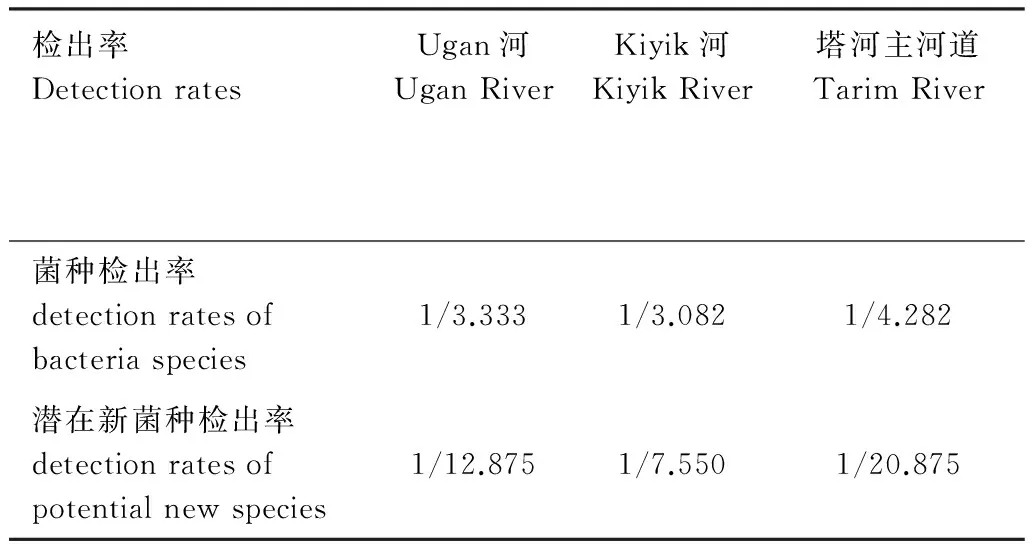
本研究从Ugan河采样点分离到了最多(270株)的表型各异的胡杨内生菌株,它们录属于6大系统发育类群,34个属81个物种。平均每3.333(270/81)个分离菌株产生1个物种水平的分类学单元(表4)。 Ugan河样品中分离到21种(表2)潜在新菌种,平均每12.857(270/21)个分离株能够检出1个潜在的新物种分类单元(表4)。在种的水平上表现出了较大的相容性。
从Kiyik河采样点分离到了较少(151株)的表型各异的胡杨内生菌株,它们录属于6大系统发育类群,25个属49个物种。平均每3.082(151/49)个分离菌株产生1个物种水平的分类学单元(表4);在潜在新菌种的检出率上也表现出同一趋势,样品中分离到20种(表2)潜在新菌种,平均每7.55(151/20,表4)个分离株就能够检出1个潜在的新物种分类单元(表4);在种的水平上表现出了最大的相容性。
从塔里木河采样点分离到了较多(167株)的表型各异的胡杨内生菌株,但是仅录属于4大系统发育类群,19个属,39个物种。平均每4.282(167/39)个分离菌株才能产生1个物种水平的分类学单元(表4)。样品中仅分离到8种(表2)潜在新菌种,平均每20.875(167/8)个分离株才能够检出1个潜在的新物种分类单元(表4);在种的水平上表现出了较大的局限性。
表4 3个生态区胡杨内生细菌菌种与潜在新菌种检出率
Table 4 The detection rates of bacteria species number and the indigenous potential new species number in three ecosystems
检出率DetectionratesUgan河UganRiverKiyik河KiyikRiver塔河主河道TarimRiver菌种检出率detectionratesofbacteriaspecies1/3.3331/3.0821/4.282潜在新菌种检出率detectionratesofpotentialnewspecies1/12.8751/7.5501/20.875
表4数据揭示,Kiyik河胡杨内生菌群落中,菌种检出率与潜在新菌种检出率均最高,细菌群落结构相对保持了最高程度的原始状态。由同类物种的外来突变体品系在胡杨体内定植类型较少,形成改变原有平衡状态的外来优势种群比较有限。在塔河主河道胡杨内生菌群落中,菌种检出率与潜在新菌种检出率均最低,菌种数量上趋于减少,细菌群落结构相对发生了较大的改变。外来优势种群的入侵、定植和扩散对原有的本源稀有弱势菌种形成较大的选择压力,稀有弱势群体已经被边缘化、取代和清洗出局。Ugan河胡杨内生菌群落的菌种检出率与潜在新菌种检出率均据第二位,细菌群落结构虽然发生了一定程度的改变,但也在相当的程度上保持了原始状态。
3 讨论
(1)塔里木胡杨林是全世界最大的一片天然胡杨林,其分布面积约为30万hm2[9]。塔河中游主林区内人烟稀少,受人类生产与生活活动影响较小,基本上保持着原生态状态。本研究所获数据表明,胡杨内生细菌多样性高,整体上在门和纲、属和物种的水平上都展现了其内在的丰富度。系统发育比较均匀,群落结构保持相对稳定。在588株分菌株中就有211株菌的16S rDNA序列与已报道的菌种序列相似性小于98.0%,它们是塔里木胡杨林内生细菌的特有本源菌群,数量大,比例高。潜在新菌种类型数量多,分布域广泛(19个属的41个种)等结果揭示:整个群落结构保持了较高的纯洁性,较少地受到了外来优势菌群的入侵与取代,原始状态保持完好,与胡杨林这一大生态环境保持了较高的一致性。
(2) 塔里木河主河道是目前最繁茂的胡杨林区,也是当今人类生产与生活活动的聚集区。已断流废弃126a的Ugan河[29]与断流废弃344a的Kiyik古河道位于塔河中游南部的荒漠区(图1),它们与当今塔河河道距离较远,已脱离了塔河水系。其河岸两侧断续地分布着相当繁茂的胡杨林,形成了在时间和空间上相对隔离封闭的3个生态体系。3条河分离菌种亚群落结构的分析数据(图5)揭示:3个亚群落共有的菌种数远低于各亚群落独有的菌种数,个性远大于共性,菌种的地域分布性较强,不同的胡杨林生态区有不同的菌种分布。菌种与潜在新菌检出率(表2,表4)数据表明:Kiyik河菌种与潜在新菌检出率最高,这与它的断流年代、无人类活动遗迹、较远的地理隔离距离与小生态环境等特征相适应,保持了最原始的群落结构体系。Ugan河的菌种与新菌种检出率较高,与Kiyik河保持了较多的共性,与塔河共性较低。这与其断流废弃年代,与人类生活区的空间距离相一致。塔河亚群落的菌种与潜在新菌种检出率最低,是外来常见优势微生物的入侵、取代和生态冲刷所致,在时间与空间上与当代人类活动的增加密切相关。
(3)本源潜在新菌种检出率是指本源的潜在新菌种数在所属群落的分离菌株数中所占的比率。它比较易于理解、直观,灵敏,变化幅度比较大,易于对群落结构是否被入侵及其改变程度进行对比研判。但是它只适用于本源新菌种较多的群落的分析,而不能用于对本源新菌种少或缺乏的群落的分析。菌种检出率是指一个群落中的所有菌种数在所属群落的分离菌株数中所占的比率。它比较抽象,不直观,灵敏度与变化幅度都较小。但是他可以用于研判任何1个群落被入侵更改的程度。尤其适应对本源新菌种少或为零的群落的分析。这两个指数越大就证明群落结构的原始状态保持的越好,反之就表明群落结构遭到了外来优势物种的更改。
(4) 3个群落共有的17个菌种(图5,表1,表2)是所有胡杨内生菌中最适应于胡杨内环境的菌种,它们可能在胡杨的生理生化、物质代谢与免疫等方面起着举足轻重的作用,它们是胡杨病虫害生防菌株的有力候选菌株。植物内生细菌作为潜在的生防资源,已成为近年来生防菌剂研制开发的热点。国内外许多学者已在该领域取得了较多的进展,并已应用于生产实践。多年来胡杨一直受到褐色斑点病,黑色斑点病,叶锈病,黑星病,栅锈菌病,树干腐烂病,春尺蠖等病原菌和害虫的危害,这些病害极大地加剧了胡杨林的衰败与生态体系的破碎化的进程[30- 36]。从胡杨中分离适应性强的可培养内生细菌,检测出一批具有生物防治作用的内生菌资源,将在提高胡杨树的抗病,抗虫能力和促进胡杨林复壮等方面具有潜在的实践意义。
(5)假单胞菌属由于简单的营养需求,易适应等特征在自然界中普遍存在[37]。该属被认为是根际微生物群体很重要的成分,他们有能力在根表面增殖,防止植物病原菌的繁殖和促进植物生长[38,39]。现已证实假单胞菌能产生有效铁载体、抗生素、胞外水解酶和HCN等抑菌代谢产物和诱导植物组织产生抗生,有效地保护植物根系免受病原微生物侵害[37,40- 42]。本研究中分离的与Pseudomonasxinjiangensis相聚类的潜在新菌种具有酯酶(C4),类脂酯酶(C8),酸性磷酸酶,碱性磷酸酶活性。并且能产生醋竹桃霉素,二甲胺四环素等抗生素。因此可以推测,与Pseudomonasxinjiangensis这个菌种相聚类的潜在新菌种作为胡杨内生菌中的本源优势菌种,在防治胡杨病害和加速胡杨对一些有机物的利用等方面起着一定的作用。
4 结论
(1)塔里木河胡杨林胡杨内生细菌具有很高的细菌多样性,在分离检测的588株细菌的范围内,共发现6大类群的细菌。其中γ-变形菌纲的细菌占总分离菌的50.17%, 厚壁菌门占34.58%,放线菌门占10.17%,α-变形菌纲占4.24%,拟杆菌门占0.50%,β-变形菌纲占0.34%;共47个属,114种;γ-变形菌纲和厚壁菌门的细菌是胡杨茎秆液中的优势类群,假单胞菌属(29.76%)和芽孢杆菌属(19.05%)为优势属。
(2)总分离菌株中就有211株菌的16S rDNA与已报道的菌种序列相似性小于98.0%,它们是塔里木胡杨林内生细菌的特有本源菌群,数量大,比例高。潜在新菌种类型数量多,分布域广泛,分布在19个属的41个物种。其中与Pseudomonasxinjiangensis这个菌种相聚类的潜在新菌种(74株,12.585%)是胡杨内生菌的本源优势菌种。
(3) 辛普森多样性指数表明Kiyik河胡杨可培养内生菌的多样性指数为0.931,塔河多样性指数为0.935;Ugan河多样性指数最高,为0.969。香农—威纳均匀度指数表明,Ugan河的可培养胡杨内生细菌的均匀度指数为0.8570;塔河次之,为0.8314;Kiyik河最低,为0.7937。
(4) 塔河主河道的胡杨内生菌群落结构,在伴随人流而入侵的外来优势菌种的作用下,已经发生了较大改变。Kiyik河的内生菌群落结构保持最为完善,很少受到外界的影响。Ugan胡杨内生细菌群落结构发生了较小程度的改变,原生态保持状况优于塔河,弱于Kiyik河。
[1] Kim T U, Cho S H, Han J H, Shin Y M, Lee H B and Kim S B.Diversity and Physiological Properties of Root EndophyticActinobacteriain Native Herbaceous Plants of Korea.The Journal of Microbiology, 2012, 50(1): 50- 57.
[2] Duan J L, Li X J, Gao J M,Wang D S, Yan Y, Xue Q H.Isolation and identification of endophytic bacteria from root tissues of Salvia miltiorrhiza Bge.and determination of their bioactivities.Annals of Microbiology, 2013, 63(4): 1501- 1512.
[3] Strobel G, Daisy B, Castillo U, Harper G.Natural products from endophytic microorganisms.Journal of Natural Products, 2004, 67(2): 257- 268.
[4] Robert P.R, Kieran G, Ashley F, David J.R, David N.D.Bacterial endophytes: recent developments and applications.FEMS Microbiology Letters, 2008, 278(1): 1- 9.
[5] Mónica R, Esperanza M R.Bacterial Endophytes and Their Interactions with Hosts.The American Phytopathological Society, 2006, 19(8): 827- 837.
[6] Compant S, Clement C, Sessitsch A.Plant growth-promoting bacteria in the rhizo-and endosphere of plants: their role, colonization, mechanisms involved and prospects for utilization.Soil Biology and Biochemistry, 2010, 42(5): 669- 678.
[7] Reinhold H B, Hurek T.Living inside plants: bacterial endophytes.Current Opinion in Plant Biology, 2011, 14(4): 435- 443.
[8] Cheng X L, Liu S Q.An elementary comment on diversifolious poplar protection in talimu diversifolious poplar protection zone.Central South Forest Inventory and Planning, 2004, 23(1): 33- 35.
[9] Wang S J.The status, conservation and recovery of global resources ofPopuluseuphradica.World Forestry Research, 1996, 9(6): 37- 44.
[10] Chen Y N, Wang Q, Ruan X, Li W H, Chen Y P.Physiological response ofPopuluseuphraticato artificial water-recharge of the lower reaches of Tarim River.Acta Botanica Sinica, 2004, 46(12): 1393- 1401.
[11] Chen Y N, Li W H, Chen Y P, Xu C C, Zhang L H.Water conveyance in dried-up riverway and ecological restoration in the lower reaches of Tarim River, China.Acta Ecologica Sinica, 2007, 27(2): 538- 545.
[12] Yuan X Y, Shi L, Hu D G L, Liu H, Lü H L.A diversity study of rhizosphere and Endophytic fungi fromPopulusEuphraticaoliver.Journal of Northwest Forestry University, 2007, 22(6): 85- 88.
[13] Han Y J, Zhang Q L.Study on soil population of different depth PopuluseuphraticaOliv.Rhizosphere soil [J].Journal of Arid Land Resources and Environment, 2008, 22(11): 185- 190.
[14] Wang N, Sheng G, Deng A H, Wang L, Ji J, Rahman E.Isolation and morphology study of pathogenic microflora in naturalPopuluseuphraticaOliverstand of Tarim River valley.Biotechnology, 2007, 17(4): 61- 63.
[15] Mijit Z, Ma X R, Abdurehim A, Rahman E.Cultivable bacteria diversity in a small area of naturalPopulusEuphraticaforest of Tarim River valley, China.Biotechnology, 2009, 19(5): 19- 22.
[16] Hamdun M, Pulat S, Yusuf K, Osman G, Turdahun M, Cheng G, Abdurehim Z, Rahman E, Abdukerim M.Culturable Bacterial Diversity in the Soil ofPopuluseuphraticaForest in Shayar County.Xinjiang Agricultural science, 2011, 48(5): 832- 840.
[17] Abdurehim Z.Phylogenetic Diversity of Endophytic Yeasts from thePopuluseuphraticaat the Ancient Rivers of Tarim Basin and Taxonomic Identification of Two Novel Species[D].Urumqi: Xinjiang University, 2012.
[18] Cheng G.Diversity of Endophytic Microbial Community of thePopuluseuphraticain Lopnur Countys[D].Urumqi: Xinjiang University, 2012.
[19] He X, Xiao T, Kuang H J, Lan X J, Tudahong M, Osman G, Fang C X, Rahman E.Sphingobacteriumshayensesp.nov., isolated from forest soil.International Journal of Systematic and Evolutionary Microbiology, 2010, 60(10): 2377- 2381.
[20] Xiao T, He X, Cheng G, Kuang H J, Ma X R, Yusup K, Hamdun M, Abaidulla G, Fang C X, Rahman E.Sphingobacteriumhotanensesp.nov., isolated from soil of aPopuluseuphraticaforest, and emended descriptions ofSphingobacteriumdaejeonenseandSphingobacteriumshayense.International Journal of Systematic and Evolutionary Microbiology, 2013, 63(3): 815- 820.
[21] Turdahon M, Osman G, Hamdun M, Yusuf K, Abdurehim Z, Abaydulla G, Abdukerim M, Fang C X, Rahman E.RhizobiumTarimensesp.nov., isolated from soil in the ancient Khiyik River.International Journal of Systematic and Evolutionary Microbiology, 2013, 63(7): 2424- 2429.
[22] Yusuf K, Pulat S, Turdahun M, Hamdun M, Osman G, Abdurehim Z, Rahman E.Phylogenetic diversity of culturable endophytic bacteria isolated from thePopuluseuphraticaat the disused ancient Ugan River.Acta Microbiologica Sinica, 2011, 51(2): 178- 188.
[23] Liu G, Zhai C Y.A current and speedy extraction method for bacterial chromosomal DNA from a trifle of broth.Medical Journal of West China, 2004, 16(2): 111- 113.
[24] Huo Y Y, Xu X W, Wang C S, Yang J Y, Wu M.Bacterial diversity of the sediment from Cangnan Large Fishing Bay.Acta Ecologica Sinica, 2008, 28(10): 5166- 5172.
[25] Thompson J D, Gibson T J, Plewni F, Jeanmougin F, Higgins D G.The Clustal X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools.Nucleic Acids Research, 1997, 25(24): 4876- 4882.
[26] Kimura M.A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences.Journal of Molecular Evolution, 1980, 16(2): 111- 120.
[27] Saitou N, Nei M.The neighbor-joining method: A new method for reconstructing phylogenetic trees.Molecular Biology and Evolution,1987, 4(4): 406- 425.
[28] Tom C J H, Kerry A W, James A H, Bruce F M.Using ecological diversity measures with bacterial communities.FEMS Microbiology Ecology, 2003, 43(1): 1- 11.
[29] Li M.Groundwater Exploitation and Ecological Environment Protection in Weigan River Basin, Xinjiang, RR.China[D].Beijing: China University of Geosciences, 2005.
[30] Xiao T.Isolation and Identification of Leaf Brown Spot Caused Pathogens fromPopulusEuphracticaForest of Tarim River and Identification of a Novel Species[D].Urumqi: Xinjiang University, 2010.
[31] Xiao T, Kuang H J, He X, Lan X J, Rahman E, Abaidulla G.Research on poplar leaf rust.Biotechnology, 2009, 19(5): 94- 96.
[32] Li Q, Gu S C, Wang Y L, Li Z J, Li Z L, Li J Q.Morphology of uredospores and infecting structure of Melampsora pruinosae inPopuluseuphraticaandP.pruinosa.Acta Phytopathologica Sinica, 2013, 43(3): 267- 273.
[33] Mo Y D.A Primary study on poplar scab ofPopuluseuphratica.Shanxi Forest Science and Technology, 2002, (2): 54- 55.
[34] Cao Z M, Du L, Wang Q H, Yu Z D.Genetic diversity of poplar rust fungus Melampsora larici-populina in China.Mycosystema, 2012, 31(4): 510- 522.
[35] Ayup M, Yimit H, Wang Z M, Ebeidul D.P.euphraticaecosystem fragility and protecting strategy on TarimP.euphraticanature reserve in Xinjiang.Journal of Water Resources &Water Engineering, 2007, 18(3): 30- 35.
[36] Zhang T, Sun J H.Aerial spray of Bt WP against Apocheima cinerarius in the natural forests ofpopuluseuphratica.Forest Pest and Disease, 2006, 25(3):38- 40.
[37] Mercado B J, Bakker P A H M.Interactions between plants and beneficialPseudomonasspp.: exploiting bacterial traits for crop protection.Antonie van Leeuwenhoek, 2007, 92(4): 367- 389.
[38] Fett W F.Inhibition of Salmonella enterica by plant-associatedpseudomonadsin vitro and on sprouting alfalfa seed.Journal of Food Protection, 2006, 69(4): 719- 728.
[39] Seveno N A, Morgan JAW, Wellington E M H.Growth ofPseudomonasaureofaciensPGS12 and the dynamics of HHL and phenazine production in liquid culture, on nutrient agar, and on plant roots.Microbial Ecology, 2001, 41(4): 314- 324.
[40] Haas D, Défago G.Biological control of soil-borne pathogens byfluorescentpseudomonads.Nature Reviews Microbiology, 2005, 3(4): 307- 319.
[41] Haas D, Keel C.Regulation of antibiotic production in root-colonizingPseudomonasspp. and relevance forbiological control of plant disease.Annual Review of Phytopathology, 2003, 41:117- 153.
[42] Bischoff K M, Wicklow D T, Jordan D B, De Rezende S T, Liu S Q, Hughes S R, Rich J O.Extracellular hemicellulolytic enzymes from the maize endophyte Acremonium zeae.Current Microbiology, 2009, 58(5): 499- 503.
参考文献:
[8] 程小玲,刘淑清.浅议塔里木胡杨保护区胡杨林的保护.中南林业调查规划, 2004, 23(1): 33- 35.
[9] 王世绩.全球胡杨林的现状及保护和恢复对策.世界林业研究, 1996, 9(6): 37- 44.
[11] 陈亚宁, 李卫红, 陈亚鹏, 徐长春, 张丽华.新疆塔里木河下游断流河道输水与生态恢复.生态学报, 2007, 27(2): 538- 545.
[12] 袁秀英, 石林, 胡达古拉, 刘慧, 吕洪丽.胡杨根际真菌与内生真菌多样性研究.西北林学院学报, 2007, 22(6): 85- 88.
[13] 韩艳洁, 张秋良.胡杨根际土壤微生物区系研究.干旱区资源与环境.2008, 22(11): 185- 190.
[16] 马丽艳木·阿木东,谢仁娜依·甫拉提, 卡依尔·玉素甫, 艾尼江·尔斯曼, 玛丽帕·吐达洪, 程刚, 祖母拉提·阿布都热依木, 艾尔肯·热合曼, 木合塔·阿布都克里木.沙雅县胡杨林土壤可培养细菌的多样性分析.新疆农业科学.2011, 48(5): 832- 840.
[17] 祖母拉提· 阿布都热依木.塔河废弃古河道胡杨内生酵母菌的多样性分析及两个新种的分类学鉴定[D].乌鲁木齐: 新疆大学, 2012.
[18] 程刚.新疆尉犁县胡杨内生微生物群落多样性的研究[D].乌鲁木齐: 新疆大学, 2012.
[22] 卡依尔·玉素甫, 谢仁娜依·甫拉提, 玛丽帕·吐达洪, 马丽艳木·阿木东, 艾尼江·尔斯曼, 祖母拉提· 阿布都热依木, 艾尔肯·热合曼.Ugan古河道胡杨可培养内生细菌的多样性.微生物学报, 2011, 51(2): 178- 188.
[23] 刘刚, 翟朝阳.一种通用的从少量培养液中快速提取细菌染色体DNA的方法.西部医学, 2004, 16(2): 111- 113.
[24] 霍颖异, 许学伟, 王春生, 杨俊毅, 吴敏.浙苍南近海沉积物细菌物种多样性.生态学报, 2008, 28(10): 5166- 5172.
[29] 黎明.新疆渭干河流域地下水开采—生态环境保护研究[D].北京:中国地质大学, 2005.
[30] 肖婷.塔河胡杨林树叶褐色斑点病原菌的分离鉴定及一株新种的分类学鉴定[D].乌鲁木齐: 新疆大学, 2010
[31] 肖婷, 邝海菊, 荷香, 蓝晓君, 艾尔肯·热合曼, 古丽斯玛依·艾拜都拉.杨树叶锈病研究.生物技术, 2009, 19(5): 94- 96.
[32] 李倩, 谷思辰, 王玉丽, 李志军, 李占林, 李建强.胡杨和灰叶胡杨锈菌夏孢子形态和侵染结构观察.植物病理学报, 2013, 43(3): 267- 273.
[33] 莫延德.胡杨幼苗黑星病初步研究.陕西林业科技, 2002, (2): 54- 55.
[34] 曹支敏, 杜林, 王秦虎, 余仲东.中国落叶松-杨栅锈菌遗传多样性研究.菌物学报, 2012, 31(4): 510- 522.
[35] 木巴热克·阿尤普, 海米提·依米提, 王智明, 迪丽拜尔.塔里木胡杨自然保护区胡杨生态系统脆弱性及其治理措施研究.水资源与水工程学报, 2007, 18(3): 30- 35.
[36] 张涛, 孙建华.飞机喷洒Bt粉剂防治天然胡杨林春尺蠖技术.中国森林病虫, 2006, 25(3): 38- 40.
Temporal and spatial patterns of diversity and community structure of culturable endophytic bacteria isolated fromPopuluseuphraticawithin the rivers of the Tarim basin
Hormathan Mamtimin, Khayir Yusuf, Raziya Erkin, Buayshem Hamood, Nurimagbul Ismayil, Manziram Rozahon,Mahfuzem Abdurahman, Xangru MA, Erkin Rahman*
CollegeofLifeScienceandTechnology,XinjiangUniversity,Urumqi830046,China
The aim of this study was to clarify the temporal and spatial patterns of the bacterial diversity and community structure of endophytes isolated fromPopuluseuphraticabeside the Tarim, Kiyik (disused) and Ugan (disused) Rivers. The storage liquid in the stem ofPopuluseuphraticastands was gathered as the source for isolation of endophytic bacteria. For each river, eight stands of riparian forest were targeted and the storage liquid from 24 tree stems was sampled in early May and late September 2011. A total of 588 bacterial strains were isolated using four different types of culture media (LB, TSA, NA and King A). Phylogenetic analysis based on 16S rRNA gene sequences showed that the 588 isolates belonged toGammaproteobacteria(50.17%),Firmicutes(34.58%),Actinobacteria(10.17%),Alphaproteobacteria(4.24%),Bacteroidete(0.50%) andBetaproteobacteria(0.34%), encompassing 47 genera and 114 species. Of those isolates, the 16S rRNA gene sequences of 211 were <98% similar to 41 species within 19 genera that could be represented as potentially novel indigenous species.γ-proteobacteriaandFirmicuteswere the dominant groups inPopuluseuphraticastem liquid.PseudomonasandBacilluswere the most widely distributed and predominant genera, accounting for 29.76% and 19.05% of isolates, respectively. The most widely distributed and predominant novel indigenous species had < 98% 16S rRNA gene sequence similarity toPseudomonasxinjiangensis, representing 12.585% of all isolates. The Simpson′s diversity index of endophytic bacteria fromPopuluseuphraticawas highest for the disused Ugan River (0.969), then lower for the Tarim River (0.935) and the ancient disused Kivik River (0.931). These data showed that the cultivable endophytic bacteria ofPopuluseuphraticawere highly diverse, and similar among the three riparian forest ecosystems. The Shannon-Wiener uniformity index of endophytic bacteria fromPopuluseuphraticafrom the Ugan River was 0.8570, compared with 0.8314 and 0.7937 for the Tarim and Kiyik Rivers, respectively. The analysis of spatial and temporal variations in the endophytic bacterial community structure ofPopuluseuphraticafor the three ecosystems revealed that in general, the community structure of endophytic bacteria from each ecosystem was relatively intact, with some small impact from foreign common dominant bacteria. The bacterial community of the Kiyik River was the least impacted, with the highest abundance of bacterial species and potentially novel indigenous species (1/3.082 and 1/7.55, respectively), and a minor impact of replacement and cleaning and associated non-indigenous bacterial species. The Ugan River was next highest for abundance of bacterial species and potentially novel indigenous species (1/3.333, 1/12.857) and these values indicate that the bacterial community structure has changed to a certain extent. In contrast, the bacterial community isolated from the Tarim River had been intensively substituted, with the abundance of bacterial species and potentially novel indigenous species greatly decreased to 1/4.282 and 1/20.875, respectively. It is clear that non-indigenous microbes have had a large ecological impact on this bacterial community. Our combined results demonstrate that the endophytic bacterial community structure was influenced by human activity near these three rivers. Human activity stopped for the Kivik and Ugan Rivers after those rivers dried out. The period of time without human activity for the ancient Kiyik and Ugan Rivers has had a positive impact on the community structure of the bacterial population.
Tarim River; Kiyik River; Ugan River; Populus euphratica; endophytic bacteria; 16S rDNA; diversity; spatial and temporal variation
国家自然科学基金项目(31060002); 国家自然科学基金项目(U1203101); 新疆维吾尔自治区科技支疆项目(201091236)
2014- 01- 24;
2014- 08- 06
10.5846/stxb201401240174
*通讯作者Corresponding author.E-mail: erkin1106@163.com
吾尔麦提汗·麦麦提明,卡依尔·玉素甫,热孜亚·艾肯,布阿依夏姆·阿木提,努丽曼姑·司马义,买孜拉木·肉扎洪,麦合甫再木·阿布都热合曼,马相汝,艾尔肯·热合曼.塔里木胡杨林可培养胡杨内生细菌多样性与群落结构的时空演变格局.生态学报,2014,34(22):6622- 6639.
Hormathan Mamtimin, Khayir Yusuf, Raziya Erkin, Buayshem Hamood, Nurimagbul Ismayil, Manziram Rozahon,Mahfuzem Abdurahman, Xangru MA, Erkin Rahman.Temporal and spatial patterns of diversity and community structure of culturable endophytic bacteria isolated fromPopuluseuphraticawithin the rivers of the Tarim basin.Acta Ecologica Sinica,2014,34(22):6622- 6639.
