重金属胁迫对醉马草生长及生理生化指标的影响
2014-08-10张兴旭赵晓静李春杰
王 萍,张兴旭,赵晓静,李春杰
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
重金属胁迫对醉马草生长及生理生化指标的影响
王 萍,张兴旭,赵晓静,李春杰
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
本研究通过比较不同浓度的Mn、Zn和Fe胁迫下醉马草(Achnatheruminebrians)的形态及生理生化指标,探讨醉马草对Mn、Zn和Fe的耐受性。结果表明,随着Mn、Zn和Fe胁迫浓度的增大,醉马草地上生物量积累、株高和分蘖数均显著降低(P<0.05),而脯氨酸(Pro)含量和丙二醛(MDA)含量显著升高(P<0.05)。Mn胁迫下,醉马草幼苗体内的过氧化物酶(POD)活性随着处理浓度的增加而显著(P<0.05)增加;过氧化氢酶(CAT)和超氧化物歧化酶(SOD)在Mn处理0.01~2.5 mmol·L-1浓度范围内呈显著(P<0.05)上升的趋势,在Mn处理2.5~7.5 mmol·L-1浓度范围内呈显著(P<0.05)下降的趋势。Zn胁迫下,POD活性在Zn处理7.0 mmol·L-1时达到最大,SOD活性在Zn处理14.0 mmol·L-1时达到最大,均与其他处理差异显著(P<0.05);CAT活性随着Zn处理浓度的增大而显著(P<0.05)升高。Fe胁迫下,POD活性随着处理浓度的增加而显著(P<0.05)增加;CAT和SOD活性均在Fe处理6.0 mmol·L-1时达到最大,并与其他处理差异显著(P<0.05)。综上所述,重金属胁迫对醉马草幼苗生长有一定的抑制作用,同时对其生理生化指标也产生影响。
抗氧化物活性酶;脯氨酸;Mn;Zn;Fe
醉马草(Achnatheruminebrians)是我国北方天然草原主要的烈性毒草之一,广泛分布于甘肃、新疆、内蒙古、青海等省(区)[1]。由于醉马草根系发达、枝叶茂盛,有着极强的生命力、繁殖力、耐旱耐寒力,可以用作荒漠、沙化土地等非放牧地区的防风固沙和水土保持植物,在干旱半干旱的恶劣环境条件下,醉马草在草地群落中具有明显的生长优势[1-2]。近年来,国内外学者在关于生物和非生物因素胁迫对醉马草生长及其生理生化影响的研究中发现,醉马草抗虫[3]、抗旱[4-5]、抗寒[6]、耐盐碱[7]等,对重金属镉(Cd)毒害也有一定的耐受性[8-9]。
Mn、Zn和Fe是植物生长所必需的微量元素,适量的微量元素可促进植株生长并增加产量[10],但过量的Mn、Zn、Fe元素会对植物产生毒害[11]。随着我国工业的发展,Mn、Zn、Fe等重金属离子以各种渠道进入土壤,其对环境的污染已日益成为全球问题[12-14]。土壤中重金属浓度过大会导致土壤质量退化、作物减产、农产品质量变差。此外,不同于其他有机污染物,重金属不能通过生物过程来降解[15],从而对人类和生态系统均构成潜在威胁。目前,在治理重金属离子污染中,因植物修复技术有很多优点,如成本较低、不破坏土壤和河流生态环境、不引起二次污染等,逐渐受到人们的普遍推崇。
本研究对Mn、Zn和Fe 3种元素胁迫条件下的醉马草生长及生理生化指标进行测定,旨在探讨醉马草对这3种重金属胁迫的耐受性,以期为利用醉马草进行生物修复奠定基础。
1 材料与方法
1.1 试验材料
醉马草种子于2010年采自甘肃天祝打柴沟(102°52′ E,37°12′ N)并播种于兰州大学榆中校区,2012年10月收获的种子5 ℃保存于农业部牧草与草坪草种子质量监督检验中心(兰州)种子储藏室,备用。
3种金属分别以MnCl2·4H2O、ZnSO4·7H2O和Fe·citrate·3H2O分析纯试剂的形式添加。
1.2 试验方法
1.2.1 Mn、Zn、Fe胁迫处理 挑选籽粒饱满,表面健康的醉马草种子于2012年11月播种于装有300 g混合培养基质的(蛭石∶珍珠岩=3∶1)聚乙烯花盆(口径15 cm,底径10 cm,深12 cm)中,在温室条件下[光周期12 h光照,温度(20±1) ℃,光照强度120 μmol·m-2·s-1]进行培养。
待醉马草幼苗生长到第4周开始处理,处理液元素种类和处理水平如表1所示。Mn和Zn元素浓度梯度的设置参考苏加义和赵红梅[16]的方法,Fe元素浓度梯度的设置参考高大文等[17]的方法。以浇灌完全营养液作为对照,其他各浓度梯度作为处理,每个浓度梯度(共计5个浓度梯度)3次重复。每周浇灌处理液和蒸馏水各一次,每次浇灌量为300 mL。试验各处理梯度采取完全随机区组摆放,胁迫处理5周后开始植株形态学和生理生化指标的测定。
1.2.2 株高、分蘖数和单株地上生物量的测定 采用常规方法,于Mn、Zn和Fe 3种重金属元素胁迫醉马草幼苗5周后分别测定株高、分蘖数和地上生物量。
1.2.3 幼苗脯氨酸(Pro)含量的测定 脯氨酸含量测定采用酸性茚三酮比色法:称取样品加入3%的磺基水杨酸5 mL,在沸水浴中提取20 min,冷却后过滤,加入2 mL冰醋酸和2 mL酸性茚三酮试剂,在沸水浴中加热30 min,待冷却后,加入5 mL甲苯,静置片刻取上层液在520 nm下测定吸光值[18]。

表1 盆栽试验处理元素种类和处理水平
1.2.4 丙二醛(MDA)含量的测定 丙二醛含量测定采用硫代巴比妥酸(TBA)法:取新鲜植物叶片,加5%TCA 5 mL,研磨后所得匀浆离心10 min。取上清液2 mL,加0. 67% TBA 2 mL,混合后在100 ℃水浴上煮沸30 min,再离心一次。取上清液分别在450、532和600 nm处测定吸光度值,并按如下公式计算MDA的含量(C,μmol·L-1)[18]:
C=6.45(A532-A600)-0.56A450.
1.2.5 抗氧化酶活力的测定 称取样品加入pH为7.8的磷酸缓冲液研磨成匀浆,离心15 min,上清液即为粗酶提取液。分别采用愈创木酚法、氮蓝四唑(NBT)法和紫外吸收法分别测定过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性[18]。
1.2.6 数据处理 所有数据均用Microsoft Excel录入,并作图。采用SPSS 16.0 for windows统计分析软件进行差异显著性分析,用Duncan法进行多重比较。
2 结果与分析
2.1 Mn、Zn和Fe胁迫对醉马草株高的影响
与对照相比,随着3种金属元素胁迫浓度的增大,醉马草的株高均有明显下降的趋势(表2)。0、5.0和7.5 mmol·L-1Mn处理的醉马草植株的株高均显著(P<0.05)低于Mn对照,分别降低了约30%、33%和49%,而Mn处理2.5与对照之间则无显著差异(P>0.05);7.0、14.0和21.0 mmol·L-1Zn处理下醉马草植株的株高均显著(P<0.05)低于Zn对照,分别降低了约35%、47%和72%,Zn处理0与Zn对照之间无显著差异(P>0.05),但与其他各Zn处理之间差异显著(P<0.05);6.0、12.0和18.0 mmol·L-1Fe处理下醉马草植株的株高均显著低于Fe对照,分别降低了30%、47%和56%。
2.2 Mn、Zn和Fe胁迫对醉马草分蘖的影响
与对照相比,醉马草植株的分蘖数随着Mn、Zn和Fe浓度的升高均有明显下降的趋势(表2)。2.5、5.0和7.5 mmol·L-1Mn处理下醉马草植株的分蘖数均显著(P<0.05)低于Mn对照,分别比对照降低了约40%、46%和46%;Mn 处理0与Mn对照之间无显著差异(P>0.05),但与其他各Mn处理间差异显著(P<0.05);0、7.0、14.0和21.0 mmol·L-1Zn处理下醉马草植株的分蘖数均显著(P<0.05)低于Zn对照,分别降低了约40%、40%、60%和80%,Zn处理0与7.0 mmol·L-1之间无显著差异,但与其他各Zn处理间差异显著(P<0.05)。6.0、12.0和18.0 mmol·L-1Fe处理下醉马草植株的分蘖数均显著低于Fe对照,分别降低了66%、80%和94%。
2.3 Mn、Zn和Fe胁迫对醉马草地上生物量的影响
与对照相比,随着Mn、Zn和Fe胁迫浓度的增加醉马草地上生物量均呈明显的下降趋势(表2)。0、2.5、5.0和7.5 mmol·L-1处理下醉马草地上部生物量均显著(P<0.05)低于Mn对照,分别比对照降低了约50%、60%、60%和70%;0、7.0、14.0和21.0 mmol·L-1Zn处理下醉马草植株的地上部生物量均显著低于Zn对照,分别比对照降低了约50%、60%、70%和90%,14.0 mmol·L-1与0、7.0、21.0 mmol·L-1间差异不显著(P>0.05);0、6.0、12.0和18.0 mmol·L-1处理下醉马草植株的地上生物量均显著(P<0.05)低于Fe对照,分别比对照降低了约40%、60%、80%和80%。
2.4 Mn、Zn和Fe胁迫对醉马草Pro含量的影响
随着3种重金属胁迫浓度的增大,醉马草幼苗Pro含量与对照相比均呈上升趋势(表3)。在Mn胁迫下,0~7.5mmol·L-1处理下Pro含量均显著(P<0.05)高于对照,为对照的1.7~5.1倍,Mn处理5.0和7.5 mmol·L-1之间无显著差异(P>0.05),但两者均与其他各Mn处理间差异显著(P<0.05)。0、7.0、14.0和21.0 mmol·L-1Zn处理下Pro含量均显著高于Zn对照(P<0.05),分别约为对照的2.2、3.2、3.7和7.1倍,Zn处理7.0与14.0 mmol·L-1较高,均与其他各Zn处理间差异显著(P<0.05)。Fe处理下,12.0和18.0 mmol·L-1Fe胁迫下Pro含量显著高于Fe对照,分别约为对照的2.8和2.5倍,Fe处理6.0 mmol·L-1的Pro含量稍高于Fe对照,但两者差异不显著,12.0和18.0 mmol·L-1Fe处理较高,均与其他各Fe处理间差异显著。

表2 Mn、Zn和Fe胁迫对醉马草株高、分蘖及地上部生物量的影响
注:同列不同字母表示差异显著(P<0.05)。下同。
Note:Different lower case letters within the same column mean significant difference at 0.05 level. The same below.

表3 Mn、Zn和Fe胁迫对醉马草脯氨酸和丙二醛的影响
2.5 Mn、Zn和Fe胁迫对醉马草MDA含量的影响
随着3种重金属胁迫浓度的增大,醉马草幼苗MDA含量总体有缓慢上升趋势(表3)。Mn处理7.5 mmol·L-1下,MDA含量显著(P<0.05)高于Mn对照,约为Mn对照的1.5倍,Mn处理0~5.0 mmol·L-1下的醉马草MDA含量均高于Mn对照,但差异不显著(P>0.05)。Zn处理7.0~21.0 mmol·L-1下醉马草MDA含量均显著高于Zn对照,分别约为对照的1.4、1.5和1.8倍,Zn处理14.0与0、7.0、21.0 mmol·L-1间无显著差异(P>0.05)。Fe处理6.0~18.0 mmol·L-1下醉马草MDA含量显著高于Fe对照(P<0.05),分别约为对照的1.4、1.5和1.8倍。
2.6 Mn、Zn和Fe胁迫对醉马草POD活性的影响
醉马草幼苗POD活性的变化在3种重金属胁迫条件下呈现出不同的变化趋势(表4)。Mn胁迫下, POD活性随着胁迫浓度的升高而增大,2.5~7.5 mmol·L-1处理下醉马草幼苗POD活性均显著高于(P<0.05)对照,分别比对照增加了约53%、59%和77%;Zn 胁迫下,对照、0和7.0 mmol·L-1处理下呈现上升趋势,而在7.0~21.0 mmol·L-1浓度范围内呈现下降趋势,POD活性在7.0 mmol·L-1处理下达到最大,与其他各处理之间差异显著(P<0.05),比对照增加了约60%。Fe胁迫下,POD活性随着处理浓度的增大而增大,在6.0~18.0 mmol·L-1处理下POD活性显著高于对照,分别比对照增加了约59%、67%和77%;18.0 mmol·L-1处理下POD活性最大,但与6.0和12.0 mmol·L-1处理下差异不显著(P>0.05)。
在缺Mn、Fe条件下,POD活性均高于Mn、Fe对照,但差异不显著(P>0.05);在缺Zn条件下,POD活性显著(P<0.05)高于Zn对照。
2.7 Mn、Zn和Fe胁迫对醉马草CAT活性的影响
醉马草幼苗CAT活性的变化在3种重金属胁迫条件下呈现出不同的变化趋势(表4)。Mn胁迫下,在对照和0、2.5 mmol·L-1处理下逐渐升高,并在2.5 mmol·L-1处理下醉马草幼苗CAT活性达到最大,且与其他各处理之间差异显著(P<0.05),与对照相比增加了约24%,Mn处理浓度继续升高至7.5 mmol·L-1,CAT活性逐渐降低,与对照相比,虽降低了7%,但没有显著差异(P>0.05)。Zn 胁迫下,除了在0处理下的醉马草幼苗CAT活性显著低于对照外,随着Zn处理浓度的升高,CAT活性也随之升高,21.0 mmol·L-1处理下醉马草幼苗CAT活性达到最大,并显著高于对照,与对照相比增加了约36%。Fe胁迫下,6.0 mmol·L-1处理下醉马草幼苗CAT活性达到最大,与其他各处理之间差异显著(P<0.05),与对照相比增加了约24%,在12.0~18.0 mmol·L-1浓度范围内,CAT活性逐渐降低,且18.0 mmol·L-1处理下的CAT活性与对照相比降低了约12%。
在缺Mn、Fe条件下,CAT活性均低于Mn、Fe对照,但无显著差异(P>0.05);在缺Zn条件下,CAT活性显著(P<0.05)低于Zn对照(表4)。
2.8 Mn、Zn和Fe胁迫对醉马草SOD活性的影响
随着3种重金属胁迫浓度的增大,醉马草幼苗SOD活性呈现先上升后下降的趋势(表4)。Mn胁迫下,对照和0、2.5 mmol·L-1处理下,醉马草幼苗SOD活性呈现上升趋势,在2.5 mmol·L-1处理下达到最大,与其他各处理间存在显著差异(P<0.05),与对照相比增加了113%,之后随处理浓度增加逐渐下降,7.5 mmol·L-1处理下与对照相比下降了约33%,但差异不显著(P>0.05)。Zn胁迫下,对照和0、7.0、14.0 mmol·L-1处理下,醉马草幼苗SOD活性呈现上升趋势,在14.0 mmol·L-1处理下达到最大,显著高于除7.0 mmol·L-1外的其他处理,与对照相比增加了约21%;在处理21.0 mmol·L-1下,SOD活性开始降低,与对照相比,降低了64%,且差异显著。Fe胁迫下,对照和0、6.0 mmol·L-1处理下,SOD活性呈上升趋势,在6.0 mmol·L-1处理下达到最大,与对照相比增加了约97%,并与对照和0、18.0 mmol·L-1处理间差异显著,之后随在Fe处理浓度增加SOD活性开始降低。
在缺Mn、Fe条件下,SOD活性均高于各Mn、Fe对照,且无显著差异(P>0.05);在缺Zn条件下,CAT活性低于Zn对照,但无显著差异(P>0.05)。
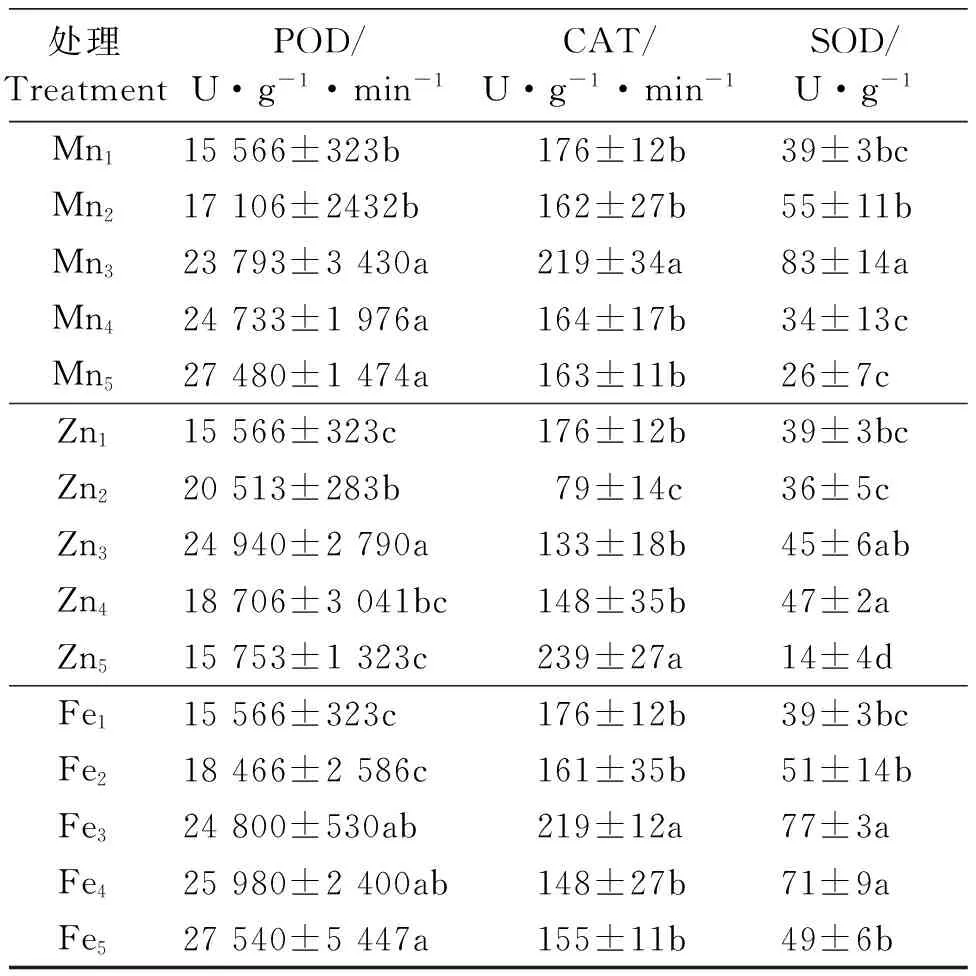
表4 Mn、Zn和Fe胁迫对醉马草POD、CAT、SOD酶活性的影响
3 讨论与结论
3.1 Mn、Zn和Fe对醉马草幼苗株高、分蘖数和地上生物量的影响
随着干旱胁迫的加重,醉马草分蘖增加数和地上生物量均显著降低[5],在重度NaCl胁迫条件下,醉马草分蘖数增长量、株高随浓度升高而显著降低,而在轻度胁迫下,醉马草的分蘖数增加并未受到影响,株高增长量则高于对照[7];低浓度的Cd可以促进醉马草植株的分蘖、株高和生物量,而高浓度(≥100 mmol·L-1)的Cd胁迫显著降低醉马草植株的分蘖、株高和生物量[8-9]。与以上结果相似,本研究发现, 随着Mn、Zn和Fe浓度的升高,醉马草植株的株高、分蘖和地上部生物量均呈显著降低的趋势,这可能是因为植物在遭受重金属胁迫时,光合效率显著降低[19],进而生长也受到影响。
Mn、Zn、Fe都是植物生长发育所必需的微量元素,适量的微量元素可促进植株生长,增加产量[20],缺少时也会影响植物生长,如本研究中缺少Mn、Zn和Fe元素的醉马草,其株高、分蘖、生物量与对照相比也呈降低趋势。
3.2 Mn、Zn和Fe对醉马草幼苗的Pro和MDA含量的影响
本研究中,高浓度的Mn、Zn和Fe胁迫导致了醉马草体内脯氨酸含量的增加,这可能降低Mn、Zn、Fe高浓度胁迫对醉马草幼苗的伤害程度,李飞[5]、Zhang等[8]对醉马草的研究和其他学者对早熟禾(Poaannua)[21]的研究也得到了类似结果。重金属在植物生长过程中,可以直接诱导植物一系列生理生化反应的变化从而引起其新陈代谢的紊乱[22-23]。一些学者认为,Pro累积并不是植物受重金属损伤的症状[24],而是保护植物免受重金属毒害[25-26]。似乎是植物受到各种压力时脂质过氧化和脯氨酸积累之间存在一种关系[27]。如果这样的关系存在,脯氨酸积累可能在抑制重金属的脂质过氧化作用中扮演一个重要的角色。可见,在高浓度的重金属胁迫下,不同植物经常发生脯氨酸积累,但是目前关于脯氨酸与机体代谢过程中有关的应激反应,还没有达成统一的观点[28-30]。
3.3 Mn、Zn和Fe对醉马草幼苗的POD、CAT和SOD活性影响
ROS的清除剂主要有SOD、POD和CAT[31-32]。在高等植物体内,Mn、Zn、Fe主要作为某些酶的专一性组分或者某些酶的激活剂参与代谢的各种生化过程,以维持生物膜稳定性[33]。Zhang等[8-9]研究发现,POD、CAT和SOD活性随着Cd胁迫浓度的增大呈逐渐上升的趋势,而本研究发现,随着Mn、Zn和Fe胁迫浓度的增大,POD、CAT和SOD活性均有一定的上升趋势。POD能够催化某些酚类和H2O2的分解,有助于缓解H2O2对细胞膜造成的伤害,在金属离子胁迫后,植物POD酶活性增强[34]。本研究也发现,Mn、Zn和Fe在一定的胁迫浓度内,POD酶活性和金属离子胁迫浓度基本呈正相关,有一定的规律性。CAT酶大量分布于动植物细胞内,可以分解H2O2,属于活性氧清除剂,可以分解机体代谢过程中产生的活性氧如H2O2、超氧阴离子等,这些物质可对机体尤其是质膜产生毒害作用,测定这种酶的活力可以评价机体受活性氧毒害的程度。在本研究中,随着Mn、Zn和Fe胁迫浓度的增大,CAT酶活性有所上升,这是因为抗氧化酶系的活性受到Mn、Zn和Fe胁迫而应激增强[35]。在高浓度重金属胁迫下,醉马草的酶活性被激活的现象有可能是醉马草在受外界不良因素干扰达到一定程度的所表现出来的一种应激反应,进而表明其对相应重金属胁迫的抗性增强。至于醉马草酶活性增加后下降的原因,可能是由于增加的活性氧超过了正常歧化能力,多种细胞内的功能酶及膜系统遭到破坏,生理代谢发生紊乱,酶活性受到抑制下降。
本研究发现,Mn、Zn和Fe对醉马草幼苗的形态指标和生理生化指标有一定的影响,说明醉马草对这3种重金属有一定的抗逆性。有关醉马草对重金属胁迫的抗性及其分子机理有待进一步研究。
[1] 史志诚.中国草地重要有毒植物[M].北京:中国农业出版社,1997:166-176.
[2] 李学森,任继生,冯克明,雷特生,阿依丁,张学洲,穆合塔尔,双湖尔.醉马草生态控制的研究[J].草业学报,1996,5(2):14-17.
[3] 张兴旭,陈娜,李春杰,南志标.禾谷缢管蚜与内生真菌互作对醉马草幼苗的生理影响[J].草地学报,2008,16(3):240-244.
[4] 李春杰.醉马草-内生真菌共生体生物学与生态学特性的研究[D].兰州:兰州大学,2005.
[5] 李飞.内生真菌对醉马草抗旱性影响的研究[D].兰州:兰州大学,2007.
[6] 陈娜.醉马草遗传多样性及内生真菌对其抗寒性的影响[D].兰州:兰州大学,2008.
[7] 缑小媛.内生真菌对醉马草耐盐性影响的研究[D].兰州:兰州大学,2007.
[8] Zhang X X,Li C J,Nan Z B.Effects of cadmium stress on growth and anti-oxidative systems inAchnatheruminebrianssymbiotic withNeotyphodiumgansuense[J].Journal of Hazardous Materials,2010,175:703-709.
[9] Zhang X X,Fan X M,Li C J,Nan Z B.Effects of cadmium stress on seed germination,seedling growth and antioxidative enzymes inAchnatheruminebriansplants infected with aNeotyphodiumendophyte[J].Plant Growth Regulation,2010,60:91-97.
[10] 昝亚玲,王朝辉,毛晖.施用硒、锌、铁对玉米和大豆产量与营养品质的影响[J].植物营养与肥料学报,2010,16(1):252-256.
[11] 罗亚平,刘杰,蔡湘文,何春梅.铜对水稻种子萌发和生长的影响[J].广西农业科学,2005,36(4):316-318.
[12] Chen F,Wu F B,Dong J,Vincze E,Zhang G,Wang F,Huang Y,Wei K.Cadmium translocation and accumulation in developing barley grains[J].Planta,2007,227:223-232.
[13] Pilon-Smits E.Phytoremediation[M].Annual Review of Plant Biology,2005,56:15-39.
[14] Wu F B,Dong J,Qian Q Q,Zhang G P.Subcellular distribution and chemical form of Cd and Cd-Zn interaction in different barley genotypes[J].Chemosphere,2005,60:1437-1446.
[15] Muhammad D,Chen F,Zhao J.Comparison of EDTA and citric acidenhanced phytoextraction of heavy metals in artificially metal contaminated soil by Typha Angustifolia[J].International Journal of Phytoremediation,2009,11:558-574.
[16] 苏加义,赵红梅.微量元素对黑麦草产量和品质的影响[J].草业科学,2008,25(10):66-69.
[17] 高大文,文湘华,周晓燕,钱易.微量元素对白腐真菌的生长影响和抑制酵母菌效果的研究[J].环境科学,2006,27(8):1624-1616.
[18] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2000:134-278.
[19] Krupa Z,Baszyński T.Some aspects of heavy metals toxicity towards photosynthetic apparatus-direct and indirect effects on light and dark reactions[J].Acta Physiologiae Plantarum,1995,17:177-190.
[20] Zan Y L,Wang Z H,Mao H,Graham L.Effect of Se,Zn and Fe application on yield and nutritional quality of maize and soybean[J].Plant Nutrition and Fertilizer Science,2010,16(1):252-256.
[21] Wang Z L,Huang B R.Physiology recovery of kentucky bluegrass from simultaneous drought and heat stress[J].Grop Science,2004,44:1729-1736.
[22] Woolhouse H W.Toxicity and tolerance in the responses of plants to metals[J].Encyclopedia of Plant Physiology,1983,12C:245-300.
[23] Van Assche F,Clijsters H.Effects of metals on enzyme activity in plants[J].Plant,Cell and Environment,1990,13:195-206.
[24] Lutts S,Kinet J M,Bouharmont J.Effects of various salts and of mannitol on ion and proline accumulation in relation to osmotic adjustment in rice (OryzasativaL.) callus cultures[J].Journal of Plant Physiology,1996,149:186-195.
[25] Mehta S K,Gaur J P.Heavy metal-induced proline accumulation and its role in ameliorating metal toxicity inChlorellavulgaris[J].New Phytologist,1999,143:253-259.
[26] Siripornadulsil S,Train S,Verma D P S,Sayre R T.Molecular mechanisms of proline-mediated tolerance to toxic heavy metals in transgenic microalgae[J].Plant Cell,2002,14:2837-2847.
[27] Molinari H B C,Marur C J,Daros E,Marilia K F,Jane F R P,Filho J C B,Pereira L F P,Vieira L G E.Evaluation of the stress-inducible production of proline in transgenic sugarcane (Saccharumspp.):Osmotic adjustment chlorophyll fluorescence and oxidative stress[J].Physiologia Plantarum,2007,130:218-229.
[28] Schat H,Sharma S S,Vooijs R.Heavy metal-induced accumulation of free proline in a metal-tolerant and a nontolerant ecotype ofSilenevulgaris[J].Plant Physiology,1997,101:477-482.
[29] Shah K,Dubey R S.Effect of cadmium on proline accumulation and ribonuclease activity in rice seedlings:Role of proline as a possible enzyme protectant[J].Biologia Plantarum,1998,40:121-130.
[30] Zengin F K,Munzuroglu O.Effect of some heavy metals on content of chlorophyll,proline and some antioxidant chemicals in bean seedling[J].Acta Biologica Cracoviensia Series Botanica,2005,47:157-164.
[31] Bowler C M,Montagu V,Inze D.Superoxide dismutase and stress tolerance[J].Annual Review of Plant Physiology,1992,43:83-116.
[32] Abernethy G A,McManus M T.Biochemical response to an imposed waster deficit in mature leaf tissue ofFestucaarundinacea[J].Environmental and Experimental Botany,1998,40:17-28.
[33] Gao J J,Li T,Yu X C.Gene expression and activities of SOD in cucumber seedlings were related with concentrations of Mn2+,Cu2+,or Zn2+under low temperature stress[J].Scientia Agricultura Sinica,2009,8(6):678-684.
[34] 林慧龙,任继周,傅华.草地农业生态系统中的能值分析方法评价[J].草业学报,2005,14(4):1-7.
[35] 胡一鸿.铜锌铬对水稻幼苗抗氧化酶的影响[J].安徽农业科学,2010,38(5):2283-2284.
(责任编辑 武艳培)
Effects of three metal ions on growth and physio-biochemical response ofAchnatheruminebrians
WANG Ping, ZHANG Xing-xu, ZHAO Xiao-jing, LI Chun-jie
(Key Laboratory of Grassland Agro-ecosystems, College of Pastoral Agriculture Science and Technology , Lanzhou University, Lanzhou 730020, China)
The effects of manganese (Mn), zinc (Zn) and iron (Fe) on growth parameters of drunken horse grass (Achnatheruminebrians) over an 8-week period were determined with controlled-environment experiment. Varions were also determined for anti-oxidative enzymes including catalase (CAT), superoxide dismutase (SOD) and peroxidase (POD), proline and malonialdehyde (MDA). The results showed that the plant height, tiller number and aboveground biomass ofA.inebriansdecreased with the increasing concentration of Mn, Zn and Fe, which had significant differences (P<0.05) among treatments. However, MDA and the proline content significantly (P<0.05) increased with the increasing concentration of heavy metals. Under the stress of Mn, POD activities ofA.inebriansincreased with the increasing concentration of Mn. CAT and SOD activities significantly (P<0.05) increased under the concentrations of 0.01~2.5 mmol·L-1treatments and dropped dramatically under the concentrations of 2.5~7.5 mmol·L-1treatments. Under the stress of Zn, POD activities had a peak value at 7.0 mmol·L-1, while SOD activities maintained higher level at 14.0 mmol·L-1treatment which had significant (P<0.05) difference with other concentrations treatments. Under the stress of Fe, POD activities significantly (P<0.05) increased with the increasing concentrations of Fe and SOD and CAT activities had a peak value at 6.0 mmol·L-1which had significant (P<0.05) difference. These results suggested that theA.inebrianshad strong tolerance to three heavy metal stresses, as reflected by morphological parameters and reduced ROS injury.
Antioxidantenzyme; proline; Mn; Zn;Fe
LI Chun-jie E-mail:chunjie@lzu.edu.cn
10.11829j.issn.1001-0629.2013-0337
2013-06-27 接受日期:2013-08-27
国家重点基础研究发展计划(973项目)课题(2014CB138702);国家自然科学基金项目(31372366、30771531);长江学者和创新团队发展计划(IRT13019);中央高校基本科研业务费(Lzujbky-2014-75)
王萍(1990-),女,宁夏吴忠人,在读硕士生,研究方向为禾草-内生真菌共生体。E-mail:pwang2008@lzu.cn
李春杰(1968-),男,甘肃镇原人,教授,博导,博士,研究方向为禾草内生真菌共生体及草类植物病理学。 E-mail:chunjie@lzu.edu.cn
S543+.901;Q945.78
A
1001-0629(2014)06-1080-07*1
