甘肃陇西野生草地早熟禾植株的再生体系
2014-08-10马晖玲
俞 玲,马晖玲
(1.甘肃农业大学草业学院,甘肃 兰州 730070; 2.草业生态系统教育部重点实验室,甘肃 兰州 730070;3.中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
植物生产层
甘肃陇西野生草地早熟禾植株的再生体系
俞 玲1,2,3,马晖玲1,2,3
(1.甘肃农业大学草业学院,甘肃 兰州 730070; 2.草业生态系统教育部重点实验室,甘肃 兰州 730070;3.中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
以甘肃陇西野生草地早熟禾(Poapratensis)成熟种子为外植体,研究不同激素及其浓度组合对愈伤组织诱导及分化的影响。结果表明,不同浓度2,4-D处理下,愈伤组织的诱导率差异明显。MS+1.0 mg·L-12,4-D是陇西野生草地早熟禾愈伤组织诱导的最佳培养条件,诱导率为41.40%;单独使用2,4-D,愈伤组织的诱导率和质量要优于2,4-D和6-BA配合使用的情况。2 mg·L-16-BA适合甘肃陇西野生草地早熟禾愈伤组织的分化,在MS+2 mg·L-16-BA基础上添加0.5 mg·L-1NAA和0.2 mg·L-12,4-D,绿苗率显著提高(P<0.05),分别为22.88%和19.72%。生根培养基同分化培养基,生根率为100%。
野生草地早熟禾;甘肃陇西;愈伤组织诱导;分化;植株再生
草地早熟禾(Poapratensis)是禾本科早熟禾属主要的冷季型草坪草,喜冷凉气候,在种群竞争中具强侵占力,是高寒草甸退化草地恢复与重建的先锋草种[1]。它不仅是优良的牧草,并且由于其质地纤细、色泽诱人、抗寒能力强、耐修剪等特点,广泛应用于城市绿化、运动场建设和生态环境改善等方面,是宝贵的草坪资源。
甘肃地处三大高原和西秦岭山地的交汇处[2],境内地形、气候复杂,有丰富的早熟禾属植物资源,甘肃特有种就有6种[3]。甘肃的早熟禾属资源主要分布在甘南、阿尔金山、祁连山等寒冷高海拔地带,其中以甘南地区数量最多[4]。陇西地处黄河最大支流渭水上游,即甘肃省东南部渭水流域,定西市中部,自然地域开阔,渭水流经全境,为温带大陆性季风气候,四季分明,日照充足,气候温和。年平均降水量445.8 mm,蒸发量1 440 mm。年平均气温7.7 ℃,年平均无霜期146 d。其南山为温寒半湿润区,野生草种质资源较丰富。充分利用本土优良野生早熟禾种质资源,发掘和培育本土早熟禾新品种,其研究意义深远,应用价值极高。
组织培养技术是生物技术育种的主要组成部分和基础[5],建立野生草地早熟禾高效再生体系,可为早熟禾抗逆新品种的育成提供优良的亲本材料及其育种途径,具有重要的研究价值。迄今为止,关于草地早熟禾再生体系建立的研究已有很多报道:McDonnell和Conger[6]首次用成熟种子诱导出胚性愈伤组织,然而植株再生率很低,仅有6%;Nielsen和Knudsen[7]建立了胚性细胞悬浮再生体系,获得了再生植株;Jeffrey和Margarent[8]建立了Baron再生体系,并且获得6株转基因植株。与此相关的研究在国内起步较晚,朱根发和余毓君[9]利用草地早熟禾幼穗诱导出愈伤组织,并且认为,幼穗是愈伤组织诱导的最佳外植体;马忠华等[10]初步建立了草地早熟禾的基因转化体系;余建明等[11]报道,可以通过外源激素的调控使愈伤组织长期保持再生植株的能力;马晖玲等[12]对草地早熟禾午夜2号进行了体外植株再生的研究,其愈伤组织经过增殖分别在相应的分化培养基上诱导出芽、根,进而再生出完整植株,建立了高频再生体系。虽然草地早熟禾再生体系已经发展成熟,但其野生材料的研究报道甚少。同时,体细胞胚的形成率较低,且随着愈伤组织继代保存时间的增长,其再生能力减弱甚至丧失,这制约着草地早熟禾资源的应用和育种进程。
本试验以甘肃陇西野生草地早熟禾的成熟种子为材料,研究了不同激素配比对其愈伤组织诱导及分化的影响,建立了野生草地早熟禾再生体系,为进一步开展甘肃野生草地早熟禾材料和商用品种体细胞杂交奠定了研究基础。
1 材料和方法
1.1 材料和培养基
野生草地早熟禾种子采自甘肃陇西。
愈伤组织诱导培养基:MS+7 g·L-1琼脂+30 g·L-1蔗糖,pH为5.8,添加不同浓度的2,4-D和6-BA(表1和2)。
分化培养基:MS+7 g·L-1琼脂+30 g·L-1蔗糖,pH为5.8,添加的激素类型和组合处理详见表3。
1.2 试验方法
1.2.1 外植体处理 将野生草地早熟禾成熟种子,浸泡过夜,在超净工作台内灭菌,75%酒精灭菌30 s,用无菌水冲洗2~3次,10% NaClO灭菌25 min,无菌水冲洗3~4次,最后用无菌滤纸吸干水分,待用。
1.2.2 愈伤组织的诱导 将已灭菌的种子接种于添加不同激素种类和浓度的MS培养基上。每皿接种50粒种子,每个处理10个重复。愈伤组织的诱导条件为(25±1) ℃,暗培养。在此期间观察并记录愈伤组织的生长状态,统计愈伤组织的诱导率。
出愈率=(愈伤组织数/接种外植体总数)×100%。
1.2.3 愈伤组织的继代培养 50 d后,将愈伤组织转移到继代培养基上培养,继代培养基激素浓度同诱导培养基。
1.2.4 愈伤组织的分化 选择颜色、质地较好的愈伤组织在分化培养基上进行分化培养。每个激素组合设定5个重复。观察并统计分化的愈伤组织数。培养条件:光强度2 000 lx,光照16 h,暗照8 h,(25±1)℃。20 d后统计绿色芽点数。
体细胞胚形成率(绿芽率)=(形成绿芽的愈伤数/愈伤总数)×100%;
绿苗率=(形成绿色植株的愈伤数/愈伤总数)×100%。
1.2.5 移栽成苗 打开三角瓶口,将已生根的再生苗植株炼苗3 d后,移栽到花盆中。基质为无菌营养土和蛭石,3∶1混匀。
1.3 数据分析
利用Excel进行数据整理,SPSS 19.0进行方差分析。
2 结果与分析
2.1 激素配比对陇西野生草地早熟禾愈伤组织诱导的影响
将成熟种子接种到愈伤组织诱导培养基上培养,15 d后初始愈伤组织形成,呈乳白色、质地坚硬,50 d后,愈伤组织呈淡黄色,颗粒状明显(图1-Ⅰ)。继代培养后,愈伤组织体积增大,呈现出不同的状态(图1-Ⅱ~图1-Ⅳ)。
2.1.1 2,4-D浓度对草地早熟禾愈伤组织诱导率的影响 在诱导培养基中加入不同浓度的2,4-D(表1),50 d 后统计出愈率,本试验设置11个2,4-D浓度梯度,每0.5 mg·L-1为一个梯度。当2,4-D浓度为0时,种子只发芽而无愈伤组织的产生,添加2,4-D有愈伤组织的产生,可见,2,4-D对愈伤组织的诱导起着关键作用;当2,4-D浓度为1.0 mg·L-1时,愈伤组织的诱导率为41.40%,均显著高于其他浓度下的诱导率,并且愈伤组织呈淡黄色,颗粒状,质地致密,增殖速度快;当2,4-D浓度为0.5 mg·L-1时,愈伤组织的诱导率为30.00%,且愈伤组织乳白色,透明状,水渍化;当2,4-D浓度为4.0~5.0 mg·L-1时,愈伤组织的诱导率很低,只有10%左右,愈伤表面有大量的毛状根出现,经继代培养后愈伤组织多褐化,后期很难再生。总体而言,愈伤组织的诱导率随着2,4-D浓度的增加呈先上升后下降的趋势。培养基中添加1.0 mg·L-12,4-D时,陇西野生草地早熟禾出愈率最高。
2.1.2 6-BA浓度对草地早熟禾愈伤组织诱导率的影响 在MS培养基中添加1.0 mg·L-1的2,4-D和不同浓度的6-BA时,愈伤组织的诱导率存在明显差异(表2)。结果表明,当6-BA浓度为0时,愈伤组织的诱导率显著高于其他浓度的诱导率(P<0.05)。随着6-BA浓度的增加,愈伤组织的诱导率反而降低。因此,在陇西野生草地早熟禾愈伤组织的诱导培养中不宜添加6-BA。
2.2 不同激素处理对陇西野生草地早熟禾愈伤组织分化的影响
将继代培养1次的愈伤组织转移至分化培养基中。经过观察,生长状态较好的愈伤组织5~7 d后开始出现绿色芽点(图1-Ⅴ),即体细胞胚,20 d 后有绿色芽点的愈伤组织体积明显增大,有的已分化成绿色小苗(图1-Ⅵ)。

表1 2,4-D浓度对陇西野生草地早熟禾愈伤组织诱导的影响
注:同列不同小写字母表示在 α=0.05水平上差异显著。下表同。
Note:Different lower case letters within the same column mean significant difference at 0.05 level. The same below.

表2 6-BA浓度对愈伤组织诱导的影响
在培养基中加入不同的激素及其浓度组合,绿苗率存在明显差异(表3)。单独加入6-BA能够促进愈伤组织的分化,并且随着6-BA浓度的升高,绿苗率提高,由5.83%提高到9.17%。在2 mg·L-16-BA诱导下,绿苗率大于1 mg·L-16-BA的处理下的绿苗率,但差异不显著(P>0.05)。
分别在0.1和0.2 mg·L-1的2,4-D基础上,添加2 mg·L-16-BA,其绿苗率高于添加1 mg·L-16-BA处理下的绿苗率,前者绿苗率为19.43%~19.72%,而后者为12.86%~14.19%。在0.5 mg·L-1NAA的基础上,随着6-BA浓度的增加,绿苗率提高,但差异不显著(P>0.05)。
在6-BA的基础上添加NAA和2,4-D较之单独使用6-BA,其绿苗率明显提高,2,4-D和6-BA配合使用时绿苗率为单独使用6-BA时的2.12~2.43倍,NAA和6-BA配合使用时绿苗率为单独使用6-BA时的2.43~2.50倍。当培养基中添加0.5 mg·L-1NAA+2 mg·L-16-BA时,绿苗率高达22.88%;添加0.2 mg·L-12,4-D+2 mg·L-16-BA时,绿苗率为19.72%,二者没有显著差异。
2.3 再生苗的生根移栽
待绿色芽点生长至2 cm左右时,转至生根培养基中,生根培养基同分化培养基,25 d左右生根率达到100%,再生出完整的植株(图1-Ⅶ),此时打开三角瓶口,炼苗3 d,洗去根表面的愈伤组织及培养基,移栽至花盆中(图1-Ⅷ),放置在室外培养。
3 讨论
3.1 成熟种子可作为诱导愈伤组织的适宜外植体
大量研究表明,草地早熟禾的很多组织和器官(种子、幼穗、叶片、匍匐茎等)均能产生愈伤组织[13-16]。其中,幼穗作为外植体,再生率最高,被认为是理想的外植体材料[9,14],但是,受生长季节和发育阶段的影响,幼穗无法提供大量外植体,具有一定的局限性。而以草地早熟禾成熟种子诱导愈伤组织作为遗传转化受体,有取材方便、不受生长季节限制等优点,是目前通常采用的方法。本研究显示,以成熟种子为外植体在植株再生方面有着良好的表现。
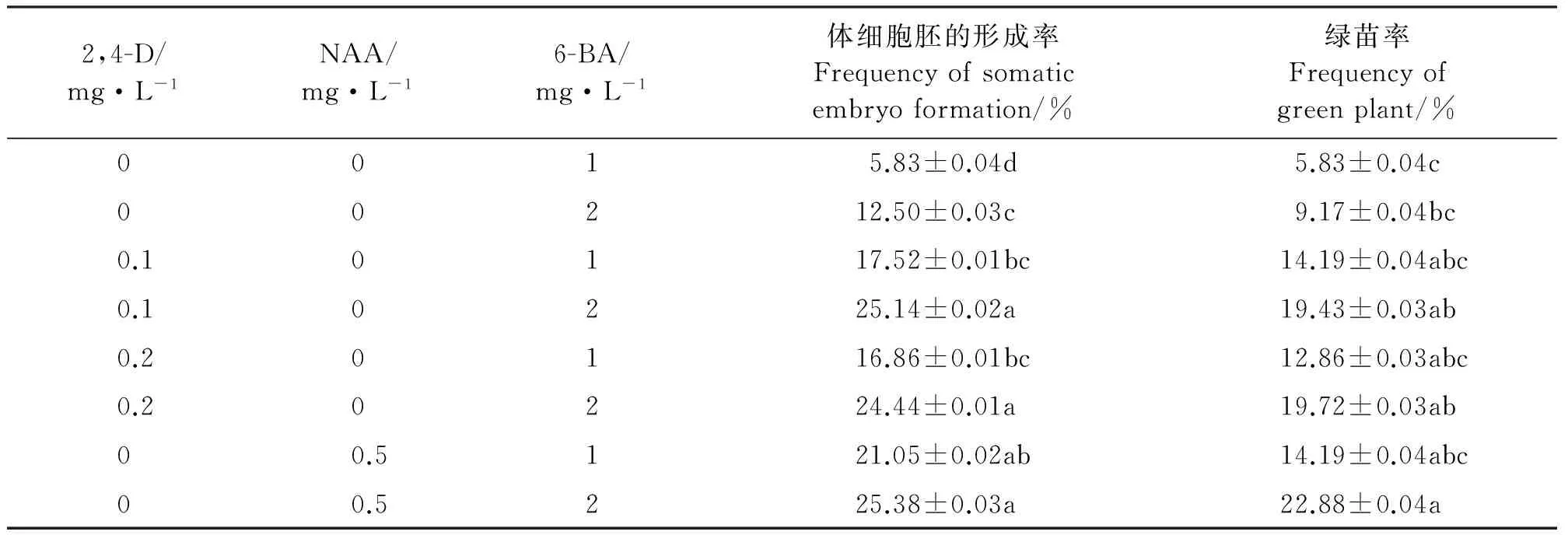
表3 不同激素配比对愈伤组织分化的影响

图1 甘肃陇西野生草地早熟禾植株再生的各发育阶段
注:Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ和Ⅷ分别为从成熟种子诱导出愈伤组织、继代培养的愈伤组织、愈伤组织水渍化、愈伤组织褐化、愈伤组织形成体细胞胚、分化出幼苗、再生出植株、移栽后的植株。
Note: Ⅰ,Ⅱ,Ⅲ,Ⅳ,Ⅴ,Ⅵ,Ⅶ and Ⅷ show Callus induced from seeds, Callus subculture, Water-soaked callus, Brown callus, Somatic embryo formation, Plantlet differentiation, Plants regeneration, and Regenerated plants in pot, respectively.
3.2 外源激素对陇西野生草地早熟禾愈伤组织诱导的影响
影响植物组织培养成功的因素是多方面的,而植物激素是愈伤组织诱导和分化的关键性因素[17-19]。2,4-D作为一种常用激素,能够诱导禾本科植物体细胞转变为胚性细胞,调整和平衡体内生长素的水平,启动细胞的分裂和胚的早期发育[20]。本试验中,2,4-D浓度为1.0 mg·L-1时,愈伤组织的诱导率为41.40%,达到最高,随2,4-D浓度的继续增加,愈伤组织的诱导率反而下降,并且愈伤组织表面出现毛状根,影响愈伤组织的增殖生长和再生。而马忠华等[10]研究表明,随着2,4-D浓度的增加,草地早熟禾品种nuble愈伤组织的诱导率提高,当2,4-D浓度为7 mg·L-1时,愈伤组织的诱导率高达91.1%。丁路明等[21]认为,2,4-D和6-BA配合使用时,肯塔基草地早熟禾愈伤组织的诱导率要高于单独使用2,4-D时的诱导率。但在本研究中,在2,4-D的基础上,6-BA的加入并没有促进陇西野生草地早熟禾愈伤组织的形成,反而显著降低了愈伤组织的诱导率,这可能与其基因型有关。不同的品种或材料,其细胞内内源激素水平不同,致使其再生出植株的能力有所不同[22]。植株的再生往往有赖于本身内源激素水平和外源激素的平衡和协调,在相同的外源激素刺激下,其形态的建成主要取决于植物体本身内源激素的形成和作用浓度[23]。
3.3 外源激素对陇西野生草地早熟禾愈伤组织分化的影响
在愈伤组织的继代培养过程中,保持愈伤组织的胚性是建立其高频再生体系的前提。本研究表明,颗粒状愈伤组织具有较好的胚性,在后续的分化培养中表现良好。
单独使用6-BA时愈伤组织能够分化成幼苗,2 mg·L-16-BA处理下,陇西野生草地早熟禾绿苗率为9.17%。若在2 mg·L-1的6-BA的基础上添加0.2 mg·L-12,4-D和0.5 mg·L-1NAA,可以提高体细胞胚的形成率,分别为19.72%和22.88%。在其他草地早熟禾品种中也得到了相似的结论[24]。
4 结论
单独使用2,4-D,陇西野生草地早熟禾成熟的种子能够诱导出愈伤组织,且愈伤组织的诱导率显著高于2,4-D和6-BA配合使用时愈伤组织的诱导率;单独使用6-BA能够促进陇西野生草地早熟禾愈伤组织的分化,并且2 mg·L-16-BA有利于陇西野生草地早熟禾愈伤组织的分化,但是绿苗率低于6-BA与2,4-D以及6-BA与NAA配合使用时的绿苗率。
[1] 郭本兆.青海经济植物志[M].西宁:青海人民出版社,1987:762-773.
[2] 黄大燊.甘肃植被[M].兰州:甘肃科学技术出版社,1997:1-15.
[3] 耿以礼.中国主要植物图说(禾本科)[M].北京:科学出版社,1959:111-113.
[4] 马范,石隐孝,向得福.甘肃草地资源[M].兰州:甘肃科技出版社,1999:663-665.
[5] 刘进平,吴发红,王丹,刘杨晶,朱涛.柱花草愈伤组织培养与植株再生[J].草业学报,2007,16(3):136-138.
[6] McDonnell R E,Conger B V.Callus induction and plantlet formation from mature embryo explants of Kentucky bluegrass [J].Crop Science,1984,24(3):573-578.
[7] Nielsen K A,Knudsen E.Regeneration of green Plants from embryogenic suspension culture of kentucky bluegrass (PoapratensisL.)[J].Journal of Plant Physiology,1993,141(5):589-595.
[8] Jeffrey D G,Margarent S D.High-frequency plant regeneration from seed-derived callus cultures of Kentucky bluegrass (PoapratensisL.)[J].Plant Cell Reports,1995,14(11):721-724.
[9] 朱根发,余毓君.草地早熟禾的组织培养条件和分化能力研究[J].华中农业大学学报,1994,13(2):199-203.
[10] 马忠华,张云芳,徐传祥,陈文峻,尹红华,蒯本科.早熟禾的组织培养和基因枪介导的基因转化体系的初步建立[J].复旦学报,1999,38(5):540-544.
[11] 余建明,张宝龙,陈志一,倪万潮.草地早熟禾成熟胚离体培养植株再生技术研究[J].草地学报,2005,13(1):58-62.
[12] 马晖玲,赵小强,周万海,吴翔.草地早熟禾午夜2号植株再生研究[J].草地学报,2009,17(2):193-196.
[13] Boyd L A,Dale P J.Callus production and plant regeneration from mature embryos ofPoapratensisL.[J].Plant Breeding,1986,97(3):246-254.
[14] Van der Valk P,Zeal M A C M,Creemers-Molenaar J.Somatic embryogenesis and plant regeneration in inflorescence and seed derived callus culture ofPoapratensisL.(Kentucky bluegrass)[J].Plant Cell Report,1989,7(8):644-647.
[15] Ke SH Q,Lee C W.Plant Regeneration in Kentucky bluegrass (PoapratensisL.) via coleoptile tissue culture[J].Plant Cell Reports,1996,15(12):882-887.
[16] Pieper M A,Smith M A L.A whole plant microculture selection system for Kentucky bluegrass[J].Crop Science,1988,28(1):611-614.
[17] 葛台明.余毓君.小麦花药培养的基因型和培养基效应研究[J].华中农业大学学报,1996,15(5):400-413.
[18] 叶兴国,王连铮.大豆花药愈伤组织的分化及内源激素的分析[J].作物学报,1997,23(5):555-561.
[19] 罗琼,胡延玉,周开达.内源激素对水稻成熟胚培养力的影响[J].中国水稻科学,1998,12(4):238-240.
[20] 孙在红,刘荣堂,梁慧敏,夏阳,吴德军,李萍.植物激素在草坪草组织培养及植株再生中的应用与进展[J].草原与草坪,2004(2):13-16.
[21] 丁路明,龙瑞军,王长庭.肯塔基草地早熟禾愈伤组织的诱导及再生体系的建立[J].中国草地,2005,27(3):31-36.
[22] 谢从华,柳俊.植物细胞工程[M].北京:高等教育出版社,2004.
[23] 奚元龄,颜吕敬.植物细胞培养手册[M].北京:农业出版社,1992.
[24] 雷炳琪,代亮,柳玉霞,刘洁,徐筱,徐倩,徐吉臣.不同草地早熟禾品种愈伤组织再生体系研究[J].分子植物育种,2012,10(6):751-755.
(责任编辑 武艳培)
Plant regeneration system of wild Kentucky bluegrass in Longxi, Gansu Province
YU Ling1,2,3, MA Hui-ling1,2,3
(1.College of Pratacultural, Gansu Agricultural University, Lanzhou 730070, China;2.Key laboratory of Grassland Ecosystem, Ministry of Education, Lanzhou 730070, China;3.Sino-U.S. Centers for Grazingland Ecosystem Sustainability, Lanzhou 730070, China)
The present research studied the influence of different hormones and their concentrations on callus induction and differentiation of mature seeds from wild Kentucky bluegrass in Longxi, Gansu. Callus induction rate had significant difference (P<0.05) with different regeneration medium and with different concentrations of 2,4-D. MS medium supplemented with 1.0 mg·L-12,4-D was optimum for callus induction which had a callus induction rate of 41.40%. When 2, 4-D used alone, callus induction had higher frequency and better quality compared with the combination of 2,4-D and 6-BA. MS medium supplemented with 2 mg·L-16-BA was optimum for callus differentiation. The green plant frequency increased significantly (P<0.05) after adding 0.5 mg·L-1NAA and 0.2 mg·L-12,4-D to MS medium with 2 mg·L-16-BA which was 22.88% and 19.72%, respectively. The optimum medium for rooting differentiation was the same as the medium for callus differentiation which has 100% rooting frequency.
wild kentucky bluegrass; longxi Gansu; callus induction; differentiation; plant regeneration
MA Hui-ling E-mail: mahl@gsau.edu.cn
10.11829j.issn.1001-0629.2013-0321
2013-06-21 接受日期:2013-09-08
国家自然科学基金——草地早熟禾种间体细胞杂交的研究(31160482)
俞玲 (1987-),女,甘肃景泰人,在读硕士生,研究方向为草种质资源及其育种。E-mail: 503379294@qq.com
马晖玲(1966-),女(回族),甘肃兰州人,教授,博士,研究方向为草种质资源及其育种。E-mail: mahl@gsau.edu.cn
S812;S543+.9;Q945.39
A
1001-0629(2014)06-1063-07*1
