清热消积方对荷瘤鼠肿瘤组织HIF-1α 蛋白表达的影响*
2014-08-10潘银平陈培丰
潘银平,闫 珍,潘 磊,陈培丰△
(1.浙江中医药大学第一临床医学院,浙江杭州310053;2.杭州市第二人民医院,浙江杭州310015;3.浙江中医药大学附属第一医院,浙江杭州310006)
恶性肿瘤最显著的表型是肿瘤细胞的失控性生长及异常血管增生。传统的手术、放疗及化疗主要是针对恶性肿瘤细胞的杀伤和控制,但要达到临床治愈较困难。通过抑制肿瘤血管形成治愈肿瘤已成为可能[1]。目前抑制肿瘤血管生成已为探讨中医药治疗恶性肿瘤的作用机制提供了一个新思路[2],深入开展相关研究对丰富中医药抗肿瘤理论,提高临床疗效,促进中医药现代化是一项有益的探索。清热消积方是浙江省中医院肿瘤科在长期的临床实践中逐渐积累的抗癌有效方剂,具有一定的临床疗效[3]。本实验采用荷瘤Lewis 肺癌小鼠建立移植瘤模型观察清热消积方对肿瘤组织中缺氧诱导转录因子-1α(HIF-1α)蛋白表达的影响,探讨该复方抑制肿瘤血管生成的作用机制。
1 材料与方法
1.1 实验动物及瘤株
近交系C57BL/6J 纯系小鼠,上海斯莱克动物有限责任公司提供,许可证号:SCXK(沪)2013-0003。在浙江中医药大学实验动物中心SPF 级动物房适应性饲养7 d。Lewis 肺癌细胞株,购自中国科学院上海细胞生物学研究所。
1.2 实验用药
清热消积方中蛇六谷、白花蛇舌草、半枝莲、绞股蓝、猫爪草、猫人参等采购自浙江省中医院中药房。设定中药中剂量组作为临床常用剂量,给药剂量参照人鼠给药剂量换算公式[4]方法计算:dB=dA×RB/RA×(WA/WB)1/3。式中:dB、dA 是AB 2 种动物的每kg 体质量剂量(mg/kg);RB、RA 是动物体型系数,小鼠为59,人为100;WA、WB 是动物的体质量(kg)值。将该复方水煎、浓缩,制成高、低、中3 个剂量组(生药量分别为1.12 g/mL,0.56 g/mL、0.28 g/mL)。环磷酰胺注射液(cyclophosphamide,0.2 g/支),江苏恒瑞医药股份有限公司产品,国药准字:H32020857;批号:12021725。
1.3 主要试剂与仪器
兔免疫组化试剂盒(美国Invitrogen 公司);BCA蛋白定量试剂盒(普利莱基因技术有限公司);RIPA裂解液(普利莱基因技术有限公司);GL-400SD 超声波细胞破碎仪(南京顺流仪器有限公司);ELX8000 全自动酶标仪(Bio-Tek,美国);多功能真彩色细胞图象分析管理系统(美国Media Cybernetics 公司Image-Pro Plus);ECL 化学发光试剂盒(普利莱基因技术有限公司)。
1.4 方法
1.4.1 荷瘤小鼠造模、分组与用药
在无菌条件下取接种Lewis 肺癌10 d 的C57BL/6J 荷瘤小鼠,脱颈椎处死,无菌条件下取皮下生长良好、呈鱼肉状的瘤组织,去除坏死部分,剪碎,按瘤重与生理盐水1∶3 制成匀浆,200 目细胞筛过滤,得瘤细胞混悬液。1 500 r/min 离心5 min,加生理盐水调至肿瘤细胞数约为1×107/mL。无菌条件下,75%酒精消毒小鼠右腋下皮肤,用1 mL 无菌注射器取细胞悬液0.2 mL(约含2×106个活细胞),无菌条件下接种于小鼠右腋窝皮下,拔出针头,用无菌棉球轻压针眼处片刻,防止细胞悬液流出。接种瘤细胞后,送回动物饲养室继续饲养。
接种24 h 后,用随机化数字表法将荷瘤小鼠分为5 组,分别为:荷瘤空白对照组(NS 组);阳性对照组(CTX 组);清热消积方高、中、低剂量组;每组12 只小鼠。灌胃:第二天分组后称体质量,即开始给药,每日1 次,连续14 d。荷瘤空白对照组,清热消积方高、中、低3 个剂量组按0.2 mL/10g 量分别胃饲生理盐水、中药水煎液。阳性对照组腹腔注射环磷酰胺,参照人鼠给药剂量换算后按30 mg/kg(0.3 mg/10 g)作为一次用药剂量,每周给药2 次,实验期间共给药4 次。
1.4.2 检测项目及方法
荷瘤小鼠瘤组织HIF-1α 蛋白表达:免疫组织化学法和免疫印迹法。
1.4.3 统计分析
采用SPSS 17.0 统计软件分析,计量资料均以(x±s)描述,2 组间比较采用配对t 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 建立移植瘤模型
C57BL/6J 小鼠接种Lewis 肺癌细胞悬液7d 后在右腋皮下可触摸到米粒大小结节,连续观察12d,实验小鼠接种部位皮下肿块无自然消退现象,成瘤率100%,符合实验要求。
2.2 对荷瘤小鼠肿瘤组织HIF-1α 蛋白表达的影响
经免疫组化法测定,清热消积方高、中、低剂量组、CTX 组均能下调荷瘤小鼠肿瘤组织HIF-1α 蛋白的表达。
数据经统计学分析,清热消积方高、中、低剂量组、CTX 组肿瘤组织平均光密度(MOD)值与NS 组比较均有差异(P<0.05);清热消积方高、中、低剂量组之间的肿瘤组织MOD 值比较均无差异(P>0.05);清热消积方高、中、低剂量组与CTX 组肿瘤组织MOD 值两两比较均无差异(P>0.05)(表1)。

表1 各组荷瘤小鼠肿瘤组织HIF-1α 蛋白的表达(MOD)(x±s)
数据经统计学分析,清热消积方高、低剂量组、CTX 组肿瘤组织阳性细胞所占值(A%)与NS 组比较均有差异(P<0.05);清热消积方各剂量组间的瘤组织阳性细胞所占值(A%)均无差异(P>0.05)(表2)。
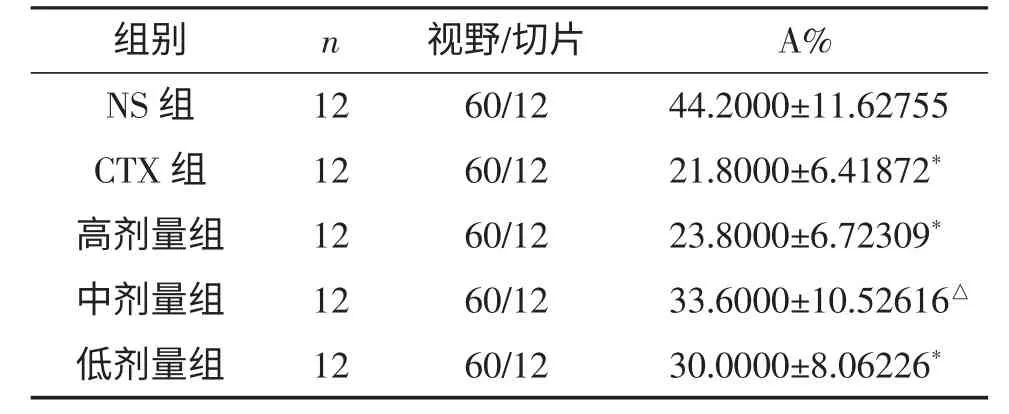
表2 各组荷瘤小鼠肿瘤组织HIF-1α 蛋白的表达(A%)(x±s)
经免疫印迹法测定,如下图所示,β-actin 片段大小趋于一致,清晰且无杂带。各组蛋白均有较强的actin 条带出现,表明各组样品的蛋白总浓度相近,且各组actin 条带的亮度相似。而实验组中,空白对照组HIF-1α 条带较各治疗组明显增强,治疗组中,CTX 组和中药高、中剂量组条带亮度趋于一致,中药低剂量组条带亮度较CTX 组增强,见图1。

图1 各组荷病小鼠肿瘤组织HIF-1 d 蛋白的表达
3 讨论
缺氧是实体肿瘤的重要特征之一[5]。恶性肿瘤通过血管新生和增加糖酵解来不断适应缺氧的微环境,继而使肿瘤在缺氧条件下也可不断生长、浸润。HIF-1α 是广泛存在的一种缺氧诱导因子,在正常氧分压条件下它位于胞浆中,正常的细胞中不表达,在缺氧的条件下则可以进入到核内发挥作用。所确定的受HIF-1α 调控的缺氧反应基因涉及参与肿瘤细胞的能量代谢、增殖、凋亡、转移、耐药及血管扩张、血管新生等多个方面[6-7]。由此可见,HIF-1α在肿瘤的恶性进展过程中起着关键性作用。有研究发现,HIF-1α 在肺癌中有过度表达,发挥着促进肿瘤血管生成、促进肿瘤细胞侵袭转移和影响细胞凋亡等作用[8-10]。HIF-1α 在肿瘤中的重要作用是可调节VEGF 的转录,上调VEGF 的表达,诱导新生血管形成,导致恶性肿瘤的生长、侵袭及转移[11-12]。HIF-1α 高表达的恶性肿瘤大多分化差、进展快、血管生成密度高、易发生转移及复发、预后差。
清热消积方是浙江省中医院肿瘤科常用的抗癌复方,其中蛇六谷,性寒味辛,具有消肿散结、解毒止痛的功效;白花蛇舌草,性寒味苦,具有清热解毒、利湿消肿的功效;半枝莲,性寒味辛、苦,具有清热解毒、化瘀利尿的功效;绞股蓝,性微寒味甘,具有清热解毒、止咳消痰、益气健脾的功效;猫爪草,性微温味甘、辛,具有化痰散结、解毒消肿的功效;猫人参,性凉味苦、涩,具有清热解毒、消肿抗癌的功效。诸药合用,体现了清热解毒、化痰消积的治则,共除热毒痰积,邪去而己自安。
我们前期研究发现[13],清热消积方对S180 癌细胞生长有抑制作用,抑瘤率达30.72%~40.75%,且与对照组的瘤重比较有统计学意义(P<0.05)。还证实清热消积方对VEGF、bFGF 等重要的肿瘤血管生成因子有降低其表达的作用。还能对Lewis 肺癌的CD44V6 表达具有调节作用[14]。并可抑制SPC-A-1人肺癌细胞和HUVEC 脐静脉内皮细胞的增殖、迁移、趋化和成管能力,从而抑制肿瘤细胞的侵袭、转移和血管生成[15]。
本实验在前期实验的基础上,采用免疫组织化学法和免疫印迹法观察对荷瘤鼠肿瘤组织中HIF-1α 蛋白表达的影响。结果提示:清热消积方的不同剂量组均能下调HIF-1α 蛋白的表达,并与对照组比较具有统计学意义(P<0.05)。表明清热消积方下调肿瘤组织的HIF-1α 蛋白的表达可能是其抗肿瘤血管生成等作用机制之一。
[1] 李涛,孙才兴. 肿瘤血管形成的分子调控机制[J]. 中国肿瘤,2014,23(1):44-48.
[2] 徐艳秋,史锁芳. 培土解毒方联合化疗治疗非小细胞肺癌30 例临床观察[J]. 云南中医学院学报,2014,37(3):64-66.
[3] 陈培丰,孙维成. 清热消积方治疗胃癌的临床疗效观察[J]. 辽宁中医杂志,2003,6(1):27-28.
[4] 孙敬方. 动物实验方法学[M]. 北京:人民卫生出版社,2001:357.
[5] 秦姣,龙汉安. 缺氧诱导因子-1α 与肿瘤关系的研究进展[J]. 西部医学,2010,22(7):1323-1325.
[6] 李姗姗,姚登福,董志珍. 肝缺氧诱导因子-1α 与肝癌发生、发展及治疗研究新进展[J]. 世界华人消化杂志,2010,18(4):361-367.
[7] 赵航,刘东屏. HIF-1α 与实体性肿瘤发生及临床关系的研究进展[J]. 现代肿瘤医学,2013,21(9):2134-2137.
[8] 连一新,施敏骅. 缺氧诱导因子-1α 和环氧化物酶-2 在肺癌组织中的表达及其与血管生成的关系[J]. 南京医科大学学报,2012,32(5):690-692.
[9] 刘衡,戴天阳. HIF-1 与肺癌关系研究新进展[J]. 医学综述,2012,18(23):3957-3959.
[10] 徐怀阳,钟竑,陆善伟,等. HIF-1α 与非小细胞肺癌增殖、血管生成及预后的关系[J]. 临床肺科杂志,2014,19(1):73-76.
[11] 冉凤明,魏万里,胡红艳,等. STAT3、p-STAT3、HIF-1α、VEGF 蛋白表达与肺癌侵袭和转移的相关性研究[J]. 实用医学杂志,2011,27(14):2570-2572.
[12] 李国元,赵久达,王成,等. HIF-1α 和VEGF 在胃癌中的表达及临床意义[J]. 中国癌症杂志,2010,20(8):602-606.
[13] 陈培丰,刘鲁明. 清热消积方抑瘤效应及诱导肿瘤细胞凋亡作用的研究[J]. 中国中医药科技,2000,7(3):145-146.
[14] 陈培丰,倪桂宝. 清热消积方对细胞跨膜信号转递与肿瘤转移的影响[J]. 浙江中医药大学学报,2006,30(2):195-198.
[15] 陈培丰,潘磊,金莹祺. 清热消积方对人肺腺癌细胞诱导的人脐静脉内皮细胞迁移、趋化和成管能力的影响[J].中国中西医结合杂志,2013,33(4):497-501.
