穿山龙总皂苷对哮喘小鼠气道重塑及MMP-9、TIMP-1 表达的影响*
2014-08-10胡晶晶杨珺超江立斌
胡晶晶,杨珺超,汪 潞,江立斌△
(1.浙江中医药大学第一临床医学院,浙江杭州310053;2.浙江中医药大学附属第一医院、浙江省中医院,浙江杭州310006)
哮喘是一种异质性疾病,通常以慢性气道炎症为特征。其定义包括呼吸道症状如随时间而强度变化的喘息、气短、胸闷与咳嗽,伴随不同程度的呼气气流受限,是一种与免疫、遗传、感染、环境等众多因素相关的疾病。目前研究发现气道重构与重症哮喘所导致的肺功能下降密切相关,近年来其被认为是引起不可逆性气道阻塞和难治性哮喘的病理基础和重要原因之一[1],但是哮喘引起气道重构的发病机制至今尚未阐明。在正常生理情况下,基质金属蛋白酶-9(MMP-9)及其组织抑制物-1(TIMP-1)保持平衡状态,MMP-9/TIMP-1 失衡则会导致细胞外基质代谢异常,参与气道重塑过程[2]。本实验通过建立小鼠哮喘模型,探讨穿山龙总皂苷对哮喘气道重构的作用及对MMP-9、基质金属蛋白酶抑制剂-1(TIMP-1)表达的影响。
1 材料与方法
1.1 实验动物与分组
清洁级雌性BALB/c 小鼠60 只,6~8 周龄,体质量(18±2)g。随机分成6 组,每组10 只:A 组(正常对照组),B 组(哮喘模型组),C 组[阳性对照组(醋酸泼尼松组)],D 组(穿山龙总皂苷低剂量组),E组(穿山龙总皂苷中剂量组),F 组(穿山龙总皂苷高剂量组)。
1.2 动物模型的建立
采用卵白蛋白(OVA)注射雾化吸入致敏激发法复制哮喘小鼠模型。取0.05 mg OVA+10%硫酸铝钾混悬液0.1 mL 于实验第0 天和第12 天腹腔注射以致敏小鼠,第18-23 天连续每天予5% OVA 生理盐水溶液超声雾化激发,30 min/次,1 次/d,第26 天起,予5% OVA 生理盐水溶液超声雾化激发,30 min/次,3 次/周,末次雾化为第55 天。雾化在30*40*40crn 大小的透明塑料盒中分组进行。正常对照组用等量生理盐水替代OVA 混悬液进行腹腔注射和雾化吸入。
1.3 药物干预
各组分别于实验第18 天起灌胃给药,阳性对照组给醋酸泼尼松混悬液10 mg/kg,治疗组按穿山龙总皂苷高、中、低剂量组每天灌胃分别给予穿山龙总皂苷20 mg/kg、40 mg/kg、80 mg/kg。穿山龙总皂苷以含0.01%吐温80 为溶媒的生理盐水做溶剂,当日配制。正常对照组、模型对照组给予相同体积的含上述溶媒的生理盐水。各组均于实验第18 天起雾化吸入后给药,每天1 次,连续给药至第55 天。
1.4 标本收集
每只小鼠最后1 次雾化激发后24 h 内颈椎脱臼处死,开胸,用含1%肝素的无菌生理盐水100 mL快速冲洗肺血管床后,取肺组织存于-80 ℃冰箱。
1.5 HE 染色
取适量肺组织用生理盐水冲洗干净后利用10%中性福尔马林溶液固定,常规脱水,石腊包埋。制成切片后行HE 染色,中性树脂封片,光学显微镜观察气道粘膜组织形态,测定气道平滑肌面积和气道内壁面积,观察炎症细胞浸润程度等。
1.6 蛋白免疫印迹法(Western blot)检测MMP-9、TIMP-1 蛋白的表达
以蛋白裂解液提取部分肺组织总蛋白质,以BCA 法测定蛋白质浓度。取30 μg 蛋白样品经12%的十二烷基磺酸钠-聚丙酰胺凝胶电泳分离后,半干电转至PVDF 膜上。1%牛血清白蛋白(BSA)4 ℃封闭过夜。0.05%的Tween-20 磷酸盐缓冲液(PBST)洗膜后与1∶400 的Ⅰ抗(羊抗鼠α-SMA、MMP-9和TIMP-1 多克隆抗体)反应2h。然后与1∶3 000 的辣根过氧化酶标记的Ⅱ抗(兔抗羊IgG)孵育1h。β-Actin Ⅰ抗(羊抗鼠β-Actin 多克隆抗体)浓度为1∶500,辣根过氧化酶标记的Ⅱ抗(兔抗羊IgG)浓度为1∶5 000。DAB 显色。目的蛋白呈棕红条带,晾干后拍照,以凝胶成像系统扫描比较。
1.7 统计学分析
采用SPSS12.0 统计软件处理。实验数据用(x±s)表示,各指标间比较用单因素方差分析,随后采用q 检验进行两两比较。2 组数据相关分析采用spearman 等级相关分析。计数资料分析采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 穿山龙总皂苷对哮喘小鼠支气管肺组织病理学的影响
空白组小鼠气道上皮结构正常,气道周围未见淋巴细胞及其他炎症细胞的浸润。见图1A。模型组小鼠气管上皮变性,气道壁明显增厚,黏膜下及管壁周围有大量炎性细胞浸润,气道平滑肌增厚,见图1B。阳性对照组可见气道壁及上皮结构等方面较哮喘组均改善,炎症细胞浸润明显减少,但未完全消失。穿山龙总皂苷低、中、高剂量组小鼠支气管平滑肌的增厚、肺泡壁水肿及气道炎性细胞浸润均有所改善,见图1C、D、E,其中高剂量组改善最为明显。
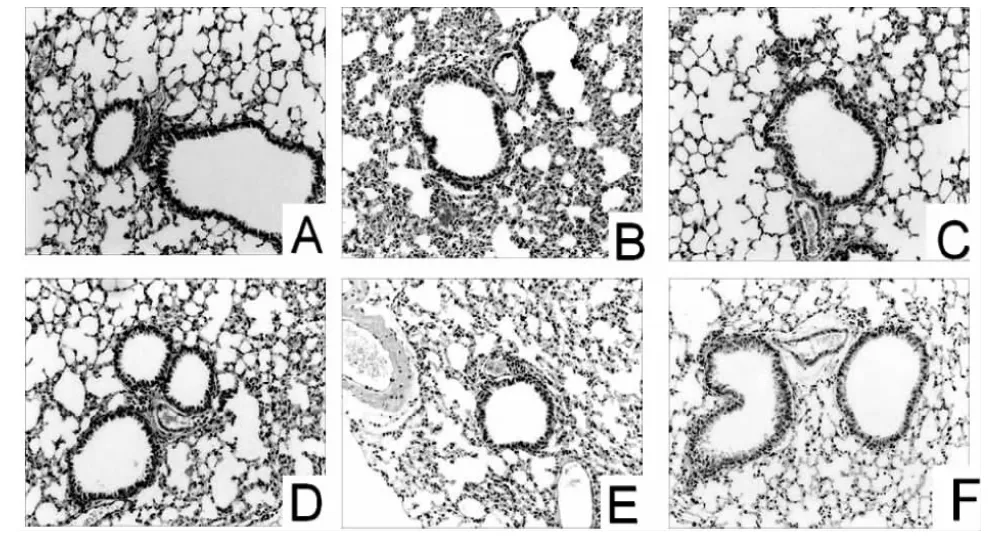
图1 各组肺组织病理(HE 染色,×100)
2.2 应用Western blot 法测定穿山龙总皂苷对气道重构相关蛋白MMP-9 及TIMP-1 的表达
与空白对照组比较,小鼠哮喘模型组MMP-9表达明显升高(P<0.05),TIMP-1 表达明显降低(P<0.05);与模型组比较,各治疗组MMP-9 表达明显降低(P<0.05),TIMP-1 表达明显升高(P<0.05);但MMP-9 在各穿山龙总皂苷组表达强于阳性对照组,TIMP-1 在各穿山龙总皂苷组表达弱于阳性对照组;穿山龙总皂苷各剂量组MMP-9 表达随剂量增加而降低,TIMP-1 表达随剂量增加而增加。(图2a、b)。
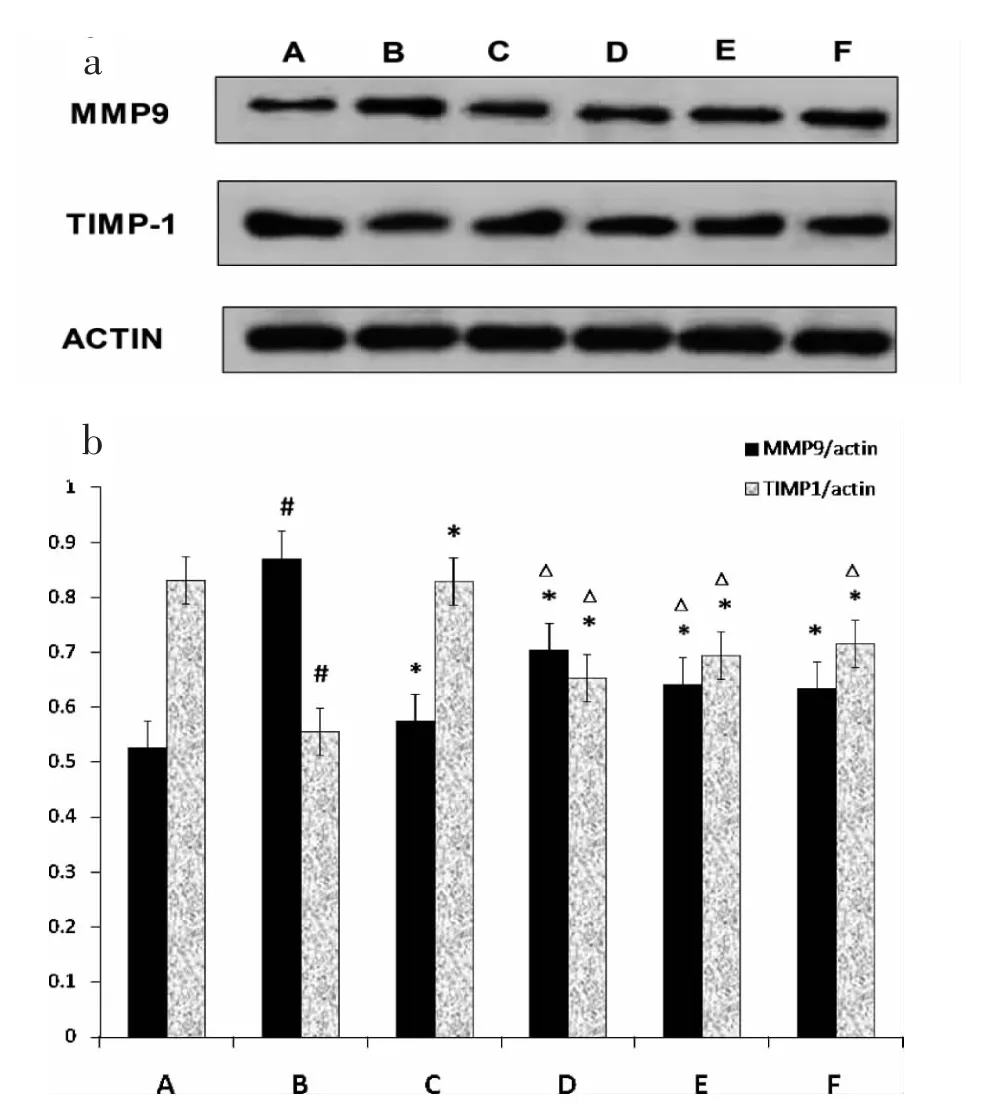
图2 穿山龙总皂苷对MMP-9 及TIMP-1 蛋白表达的影响
3 讨论
哮喘发病机制尚不完全清楚,目前认为,变态反应、气道炎症、气道重构等方面共同参与哮喘的发病过程[3]。气道慢性炎症被认为是哮喘的基本的病理改变和哮喘反复发作的主要病理生理机制[4]。但近来诸多实验显示单纯抗炎治疗对哮喘的治疗却不甚理想[5]。气道长期持续性的炎症反复发作,反复修复,会导致组织增生而发生重塑[6]。因此只有控制或者逆转了气道重构,哮喘才可能得到真正意义上的控制。
目前研究表明:细胞外基质(ECM) 在气道壁降解与沉积失衡、气管平滑肌(airwaysmoothmusele,ASM)增生肥大、基底膜增厚及管壁玻璃样变是支气管哮喘气道重塑的重要原因之一。ECM 降解中起关键作用的是基质金属蛋白酶(MMPs),是ECM 代谢的主要限速酶,具有限制ECM 降解的作用,从而使ECM 沉积增加[7],而基质金属蛋白酶抑制物(TIMPs)是MMPs 的特异性抑制剂,它可抑制MMPs 的活性而使ECM 降解增加,沉积减少。MMP-9 及其抑制剂TIMP-1 与哮喘气道重塑关系最大[7-8]。研究证实MMP-9/TIMP-1 失衡可能是急性或慢性哮喘的特征。在对哮喘患者的研究中发现,由于炎症的反复刺激,MMP-9 表达失衡,表现为EMC 降解和合成紊乱,进而导致气道异常修复和损伤,最终发展成气道重构[9-10]。
中药穿山龙为薯蓣科植物穿龙薯蓣(Dioscorea nipponica Makino)的干燥根茎。多用于治疗风寒湿痹、慢性气管炎、消化不良、劳损扭伤等。现代药理研究表明,穿山龙具有调节免疫、改善心血管功能、镇咳、祛痰、平喘等多种药理作用,可用于治疗类风湿性关节炎、冠心病心绞痛、慢性气管炎、慢性布鲁菌病、脂肪瘤等疾病[11-12]。据抗炎反应试验,穿山龙在试管中的浓度大体相当于血中有效浓度时,有抑制过敏介质释放的作用及调节免疫的作用[13~14]。在许多中医药复方中均选用了穿山龙作为主要药物治疗支气管哮喘;穿山龙注射液也被用于穴位注射治疗重症支气管哮喘,有资料表明效果明显[15]。但穿山龙总皂苷治疗支气管哮喘的实验研究报道较少。而穿山龙总皂苷对哮喘气道壁重塑的影响及其可能机制未见报道。
传统的中医认为哮喘病因病机主要以"痰饮"为主,治疗中采用化痰等方法能取得很好的疗效。本文研究结果显示,对于哮喘小鼠,穿山龙可改善气道壁及气道上皮结构,减少黏膜下及管壁周围炎性细胞浸润,在进一步机制研究中我们发现,阳性对照组及低、中、高剂量组MMP-9 和TIMP-1 表达水平均较哮喘模型组改善,并且穿山龙与阳性对照组有类似的减轻气道重塑的作用机制,此外,我们还发现MMP-9 表达强度可能随穿山龙总皂苷剂量的增加而减弱,TIMP-1 表达强度可能随穿山龙总皂苷剂量的增加而增加。说明穿山龙总皂苷可能是通过抑制肺组织内MMP-9、增加TIMP-1 的表达而减轻气道重塑,这与醋酸泼尼松减轻气道重塑的机制类似。
[1] Halwani R,Al-Muhsen S,Hamid Q. Airway remodeling in asthma [J]. Curr Opin Pharmacol,2010,10(3):236-245.
[2] Moore CS,Crocker SJ. An alternate perspective on the roles of TIMPs and MMPs in pathology[J]. Am J Pathol 2012,180(1):12-16.
[3] 中华医学会呼吸病学分会哮喘学组. 支气管哮喘防治指南[J]. 中华结核和呼吸杂志,2008,31(3):177-185.
[4] Usmani OS. Small airways dysfunction in asthma:evaluation and management to improve asthma control[J]. Allergy Asthma Immunol Res,2014,6(5):376-388.
[5] 李淼,尚云晓,魏兵. 布地奈德吸入对哮喘气道重塑大鼠气道平滑肌细胞MMP-9 及TIMP-1 表达的影响 [J]. 中国组织化学与细胞化学杂志,2012,21(2):142-145.
[6] 张维溪,戴欢,贺孝良,等. 糖皮质激素调控哮喘大鼠气道重塑中TGF-β_1/Smad 信号通路的研究[J]. 中国药理学通报,2009(9):1142-1146.
[7] Wu SM,Li CE,Cai RP,et al . Airway remodeling assessed by high-resolution computed tomography in patients with asthma:relationship to biological markers in induced sputum[J]. Article in Chinese,2012,35(12):892-896.
[8] Ohbayashi H,Shimokata K. Matrix metalloproteinase-9 and airway remodeling in asthma [J]. Curr Drug Targets Inflamm Allergy,2005,4(2):177-181.
[9] Rogers NK,Clements D,Dongre A,et al. Extra-cellular matrix proteins induce matrix metalloproteinase-1(MMP-1)activity and increase airway smooth muscle contraction in asthma[J]. PLoS One,2014,9(2):1-12.
[10] 王成阳,刘向国,彭青和,等. MMPs 系统和细胞因子在慢性阻塞性肺疾病模型大鼠中的作用[J]. 免疫学杂志,2013,(12):1024-1028.
[11] 姚丽,刘树民,王加志,等. 穿山龙中薯蓣皂苷元的提取分离及测定方法研究概况[J]. 中华中医药学刊,2008,26(1):164-165.
[12] 丁小林,李卿. 中药穿山龙的研究进展[J]. 重庆中草药研究,2003,48(2):55-57.
[13] 唐丽香. 福建穿山龙抗炎镇痛作用的实验研究[J]. 海峡药学,2000(3):34.
[14] 南景一,王忠,杨玉娟,等. 穿山龙对小鼠免疫功能的影响[J]. 中草药,1998,19(3):22.
[15] 雷励. 穿山龙注射液穴位注射治疗重症支气管哮喘临床观察[J]. 中国中医急症,2005,14(5):219-220.
