ApoE4对大鼠在体海马L-LTP的影响及其分子机制的分析
2014-08-10祁金顺
乔 枫,祁金顺
(山西医科大学 基础医学院生理学系,细胞生理学教育部重点实验室,太原 030001)
ApoE4对大鼠在体海马L-LTP的影响及其分子机制的分析
乔 枫,祁金顺
(山西医科大学 基础医学院生理学系,细胞生理学教育部重点实验室,太原 030001)
探讨载脂蛋白E4(apolipoprotein E,apoE4)的神经毒性作用。将12只健康雄性SD大鼠随机分成对照组和实验组两组(n=6)。采用电生理手段,利用海马给药装置和刺激/记录绑定电极记录大鼠在体海马CA1区场兴奋性突触后电位(fEPSP)和高频刺激(HFSs)诱导的晚期长时程增强(L-LTP),观察急性注射apoE4后对大鼠海马CA1区L-LTP的诱导及维持的影响。并且通过Western Blotting检测cAMP应答元件结合蛋白(CREB)的表达及其磷酸化水平,探讨apoE4影响L-LTP的分子机制。结果表明,HFSs前注射0.2 μg apoE4并没有改变突触传递,对双脉冲易化(PPF)没有影响。但显著抑制L-LTP的诱导和维持,降低CREB的磷酸化水平。说明apoE4可以损伤海马L-LTP。这种神经毒性不是突触前神经递质释放所介导,而是通过降低突触后CREB活性实现的。
载脂蛋白E4;阿尔茨海默病;晚期长时程增强;cAMP应答元件结合蛋白
阿尔茨海默病(Alzheimer’s disease, AD)是一种发生在中枢神经系统中的慢性、原发性、不可逆性的神经退行性疾病,主要表现为进行性认知功能障碍、学习和记忆能力丧失,晚期出现严重痴呆[1]。大量流行病学调查结果显示有四种基因与其发生有关, 包括:淀粉样前体蛋白(amyloid precursor protein, APP)、早老素-1(presenilin-1, PS-1)、早老素-2(presenilin-2, PS-2)和载脂蛋白E4(apolipoprotein-E4, APOE4)。其中,APOE4是迟发家族AD的主要危险因子。APOE4基因纯合子(apoE4+/+)携带者的AD发病率为未携带该基因者的8倍[2]!该基因过表达后的产物apoE4也被证明具有较强的神经毒性。目前已有资料表明,apoE4可与多种致病因素协同作用并且加速AD的发生[3]。长时程增强(long-term potentiation,LTP)是学习和记忆机制的细胞模型之一。鉴于海马是AD发病过程中最早和最易受累的脑区之一,海马LTP已被广泛用于AD发病机制研究。LTP分为早期 LTP (early-phase LTP,E-LTP)和晚期LTP (late-phase LTP,L-LTP)。前者与膜上已有受体蛋白的磷酸化有关,后者则包括了新的蛋白质的合成。虽然apoE4和AD之间的关系已经被证实[4], 一些相关的电生理实验就apoE4对E-LTP的作用做了一定的研究[5],但是apoE4对海马L-LTP的影响及其分子机制,目前仍然不清楚。本实验对apoE4的电生理机制及其分子机制进行了探究。
1 材料和方法
1.1 药品与动物实验分组
apoE4(购自sigma公司)经生理盐水稀释成0.1 μg/μL。CREB工作浓度(体积比)1∶7000,p-CREB工作浓度(体积比)1∶250,购自Abcam公司。二抗(工作浓度1∶100 000)购自中杉金桥公司。
健康雄性SD大鼠12只,体重为250~350 g,由山西医科大学动物中心提供。实验分为对照组 (n=6)和实验组(n=6)。对照组给与2 μL生理盐水。注药组给与2 μL apoE4(质量浓度为0.1 μg/μL)。
1.2 手术及电极定位
所有动物均用25%乌拉坦腹腔麻醉(1.5 g/kg)。在三维脑立体定位仪上将大鼠固定后,暴露颅骨,以前囟点、矢状缝为基准,用骨钻于刺激/记录电极和注药位点钻孔。刺激电极位点P:-4.2 mm,R:3.8 mm;记录电极位点P:-3.8 mm,R:2.9 mm;注药管位于P:-2.8 mm,R:2.0 mm。在立体定位仪和微推进装置引导下,将刺激电极、记录电极及不锈钢给药导管垂直插入大鼠海马部位。刺激电极尖端位于Schaffer collateral/commissural pathway;记录电极尖端位于CA1区放射层;给药管尖端位于CA1区放射层,深度比记录电极浅0.1 mm。
1.3 给药及电生理记录
用电刺激诱发海马CA1区场兴奋性突触后电位(field excitatory postsynaptic potential,fEPSP)。测试刺激的频率为0.033 Hz,刺激强度以引起兴奋性突触后电位(fEPSP)最大幅度的50 %强度为准。记录30 min基础fEPSP以确保基础性突触传递的稳定性,用微量注射泵 (KD Scientific, Inc, KDS310, plus, USA)和5 μL微量注射器经导管以0.1 μL/min的速度将药物或生理盐水2 μL注入海马。给药后,继续记录30min的基础fEPSP,以观察药物对基础性突触传递的影响。再给予双脉冲刺激3 次,以诱发突触传递的易化现象,即双脉冲易化(paired-pulse facilitation, PPF),用以分析药物是否影响突触前神经递质的释放。诱发PPF的双脉冲刺激间隔是50 ms。之后,给予高频刺激(HFSs)。HFSs共有三组,组间隔5min,每组共3个串刺激,串间隔30 s,每串刺激包含20个脉冲,频率200 Hz,波宽50 μs。HFSs后,连续记录3 h fEPSP以观察L-LTP的持续性变化。
所有数据经多道生物信号处理系统(RM6240B/C)进行信号采集、 放大和储存。离线分析时,以其基础 fEPSP的幅度值作为100%,计算HFSs前后各时间点fEPSP幅度改变的百分比。HFSs后以fEPSP幅度值增加超过30%为L-LTP的成功诱导。最后以fEPSP幅度变化百分比作为纵坐标,时间为横坐标,绘制L-LTP随时间变化情况。
1.4 Western免疫印迹
电生理记录后,取大鼠海马,提取蛋白,用BCA法检测蛋白浓度。各孔加上样蛋白25 μg,进行SDS-PAGE电泳。之后,将蛋白转到PVDF膜上,5%的BSA封闭,4℃一抗孵育过夜,TBST洗膜3×10 min。4℃二抗孵育2 h,洗膜。用ECL发光液显色,由FluorChem Scanner采集,Alpha View SA software分析。以对照组的灰度值作为100%,计算注药组CREB的总蛋白量及其磷酸化水平改变的百分比。
1.5 统计学处理
所有的数据以x±s表示。运用SPSS 14.0统计软件进行两样本均数比较的t检验,以P<0.05表示有统计学意义。
2 结果
2.1 急性注射apoE4抑制 L-LTP的诱导及维持
对照组中,在基础的fEPSP幅度保持稳定的基础上,给予HFSs能够有效诱导L-LTP的出现,如图1-a所示。HFSs后1,60,120 ,180 min的平均fEPSP幅度分别是(211±7.2)%,(170.4±4.5)%,(164.2±2.9)%,(161.2 ±3.3)%。如图1-b所示。与对照组相比,HFSs前30 min注射0.2μg apoE4并没有改变突触传递。给予HFSs后,在相同的时间点,apoE4显著抑制L-LTP的诱导和维持,平均fEPSP幅度分别是(178.3±5.8)%,(149.7±5)%,(144.3±5.0)%,(142.2±5)%(P<0.01)。
2.2 注射apoE4对双脉冲易化(PPF)无影响
为了阐明突触前神经递质的释放是否参与了apoE4对海马CA1区L-LTP的抑制。在注射生理盐水或apoE4(0.2 μg)后,观察了各组双脉冲易化(见图2)。PPF比值分别为(164.8±3.4)%和(163.2±3)%(P>0.05)。未受影响的PPF表明apoE4的L-LTP诱导的抑制作用可能不是通过突触前神经递质的释放介导的,而是作用在突触后的信号通路。
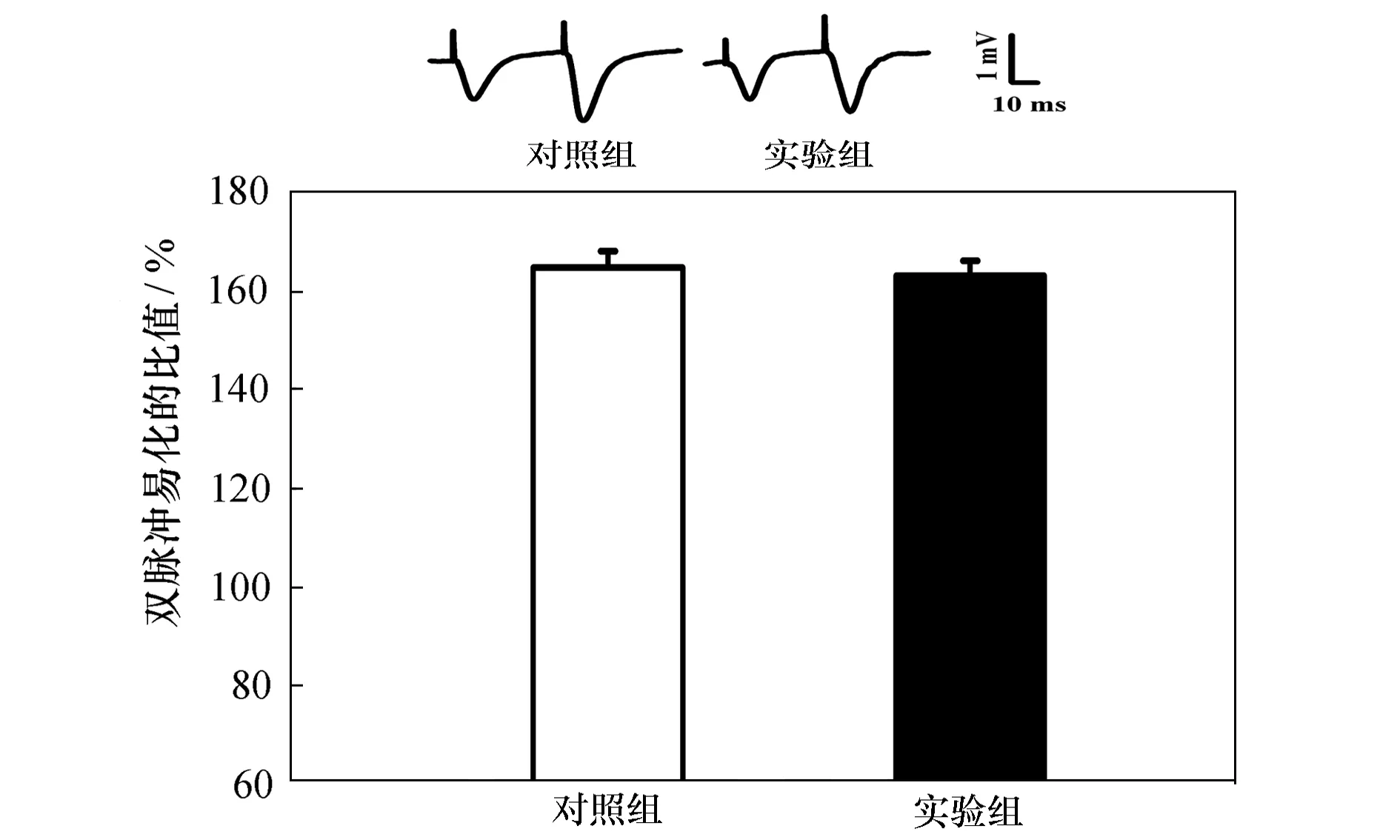
图2 apoE4不影响PPF
2.3急性注射apoE4抑制了CREB的磷酸化水平,对其总蛋白含量没有影响
Western免疫印迹结果显示,实验组中p-CREB的表达水平下降,是对照组的(64.80±12.58)%(P<0.05),有统计学意义。而CREB的总蛋白量是对照组的(95.24±11.45)%(P>0.05),没有统计学意义(见图3)。

图3 apoE4抑制了CaMKII和CREB的磷酸化,对其总蛋白含量没有影响
3 讨论
apoE4是迟发家族AD的主要危险因子。而apoE4对LTP的作用存在着很大的争议。有研究表明用apoE4转基因鼠的离体脑片可以抑制LTP的诱导[3, 6],但是有些实验室却发现apoE4可以促进LTP的诱导与维持[4]。由于这些实验多为离体实验,不能很好的反映体内正常生理环境。本实验采用在体LTP记录的方法,在记录海马 CA1区fEPSP的基础上,将apoE4直接注射到海马CA1区,观察了局部给予apoE4对海马突触传递的直接效应。我们发现,急性注射apoE4不影响基础性fEPSP,但L-LTP的诱导与维持明显低于对照组,且差异具有统计学意义。与此同时,PPF未受影响。这表明,apoE4的神经毒性作用主要是对L-LTP诱导和维持有抑制作用。此作用不是通过突触前神经递质的释放介导的,而是作用在突触后的信号通路。
L-LTP形成机制的研究主要集中在N-甲基-D-天门冬氨酸(N-methyl-D-aspartate,NMDA)受体依赖的细胞内级联反应上[7]。强直刺激作用下,突触后膜发生去极化,膜上的NMDA 受体通道上的Mg2+离开,解除对其的阻塞,使得NMDA受体与兴奋性神经递质谷氨酸结合并开放,进而出现Ca2+内流、 胞内Ca2+浓度升高[8],从而使CaMKⅡ、cAMP依赖性蛋白激酶(PKA)等活性增加[9-10],引起下游一系列生化反应,最终使CREB磷酸化。活化的CREB促进转录翻译,产生新的蛋白质[11-12]。apoE4可以与apoE受体2(apoE receptor2,apoER2)结合。apoER2会通过NPxY 模、Dab1以及SFKs作用于NMDA受体[13-15]。进而对LTP产生作用。本实验发现apoE4对CaMKII及CREB的总蛋白量没有影响,但对其磷酸化水平有抑制作用。说明apoE4对L-LTP的毒性作用很有可能是通过抑制了CREB和磷酸化来抑制了L-LTP的诱导与维持。
4 结论
动物实验研究了apoE4的神经毒性作用及其靶点,结果表明apoE4可以损伤海马L-LTP。这种作用不是突触前神经递质释放所介导,而是通过降低突触后CREB活性实现的。因此,实验为apoE4的神经毒性作用和机制提供了重要线索,从而为预防和治疗AD提供新的实验证据。
[1]Citron M, Oltersdorf T, Haass C, et al. Mutation of the beta-amyloid precursor protein in familial Alzheimer's disease increases beta-protein production [J]. Nature, 1992, 360, 672-674.
[2]Suzuki N, Cheung TT, Cai XD, et al. An increased percentage of long amyloid beta protein secreted by familial amyloid beta protein precursor (beta APP717) mutants[J]. Science, 1994, 264, 1336-1340.
[3]Qin Y, Qi JS, Qiao JT. Apolipoprotein E4 suppresses delayed-rectifier potassium channels in membrane patches excised from hippocampal neurons[J]. Synapse, 2006, 59, 82-91.
[4]Korwek KM, Trotter JH, Ladu MJ, et al. ApoE isoform-dependent changes in hippocampal synaptic function[J]. Mol Neurodegener, 2009, 4, 21.
[5]Chen Y, Durakoglugil MS, Xian X, et al. ApoE4 reduces glutamate receptor function and synaptic plasticity by selectively impairing ApoE receptor recycling[J]. Proc Natl Acad Sci U S A 107, 2010, 12011-12016.
[6]Trommer BL, Shah C, Yun SH,et al.ApoE isoform affects LTP in human targeted replacement mice[J]. Neuroreport, 2004, 15, 2655-2658.
[7]Bortolotto ZA, Collingridge GL. Characterisation of LTP induced by the activation of glutamate metabotropic receptors in area CA1 of the hippocampus[J]. Neuropharmacology, 1993, 32, 1-9.
[8]Derkach V, Barria A, Soderling TR. Ca2+/calmodulin-kinase II enhances channel conductance of alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionate type glutamate receptors[J]. Proc Natl Acad Sci U S A, 1999, 96, 3269-3274.
[9]Fink CC, Meyer T. Molecular mechanisms of CaMKII activation in neuronal plasticity[J]. Curr Opin Neurobiol, 2002, 12, 293-299.
[10]Impey S, Obrietan K, Wong ST, et al. Cross talk between ERK and PKA is required for Ca2+stimulation of CREB-dependent transcription and ERK nuclear translocation[J]. Neuron, 1998, 21, 869-883.
[11]Wu GY, Deisseroth K, Tsien RW. Activity-dependent CREB phosphorylation: convergence of a fast, sensitive calmodulin kinase pathway and a slow, less sensitive mitogen-activated protein kinase pathway[J]. Proc Natl Acad Sci U S A, 2001, 98, 2808-2813.
[12]Takeda H, Kitaoka Y, Hayashi Y, Calcium/calmodulin-dependent protein kinase II regulates the phosphorylation of CREB in NMDA-induced retinal neurotoxicity[J]. Brain Res, 2007, 1184, 306-315.
[13]Koch S, Strasser V, Hauser C, et al. A secreted soluble form of ApoE receptor 2 acts as a dominant-negative receptor and inhibits Reelin signaling[J]. EMBO J, 2002, 21, 5996-6004.
[14]Howell BW, Gertler FB, Cooper J A. Mouse disabled (mDab1): a Src binding protein implicated in neuronal development[J]. EMBO J, 1997, 16, 121-132.
[15]Beffert U, Weeber EJ, Durudas A, et al. Modulation of synaptic plasticity and memory by Reelin involves differential splicing of the lipoprotein receptor Apoer2[J]. Neuron, 2005, 47, 567-579.
(编辑:张爱绒)
EffectsofApolipoproteinE4onHippocampalLate-phaseLong-TermPotertiationofRatsinvivoandAnalysisofMolecularMechanism
QIAOFeng,QIJinshun
(DepartmentofPhysiology,KeyLaboratoryofCellularPhysiology,MinistryofEducation,ShanxiMedicalUniversity,Taiyuan030001,China)
To investigate the neurotoxicity of apolipoprotein E4 (apoE4) and the underlying mechanisms, we recorded in vivo late-phase long-term potentiation (L-LTP) of field excitatory postsynaptic potentials (fEPSPs) in hippocampal CA1 region of rats. Twelve male SD rats were used and the L-LTP was induced by three groups of high frequency stimulations (HFSs). ApoE4 solution (0.1μg/μL, 2 μL,n=6) was injected into the CA1 region of hippocampus 30 min before HFS. Control rats (n=6)
only saline (2 μL,n=6). The paired pulse facilitation (PPF) was also recorded. The expression and phosphorylation levels of cAMP response element-binding protein (CREB) were measured by Western Blotting. The results show that apoE4 did not change the base line synaptic transmission and the PPF, but significantly impair the induction and the maintenance of L-LTP. In addition, the apoE4 decreasd the phosphorylation levels of the CREB in the hippocampus. These results strongly suggest that the neurotoxicity of ApoE4 on the synaptic plasticity was mainly involved in the suppression of L-LTP. And the attenuation of L-LTP was not mediated by presynaptic neurotransmitter release, but by the postsynaptic signaling. The decrease of the CREB phosphorylation in the hippocampus seemed to be related to the neurotoxicity.
apolipoprotein E4 (apoE4); Alzheimer’s disease (AD); late-phase long-term potentiation (L-LTP); cAMP response element-binding protein (CREB)
2013-11-19
国家自然科学基金资助项目(31271201);山西省自然科学基金资助项目(2009011054-2)
乔枫(1987-),女,山西大同人,硕士生,主要从事神经生理学研究,(E-mail)qiaofeng-fq@163.com,13753189173
祁金顺,男,教授,(E-mail)jinshunqi2006@yahoo.com
1007-9432(2014)02-0244-04
R743
:A
