硫砷铜矿和辉锑矿在焙烧/熔炼温度下的氧化-挥发反应
2014-08-10摘译
梁 愿 摘译
(中国恩菲工程技术有限公司, 北京 100038)
国外工程技术
硫砷铜矿和辉锑矿在焙烧/熔炼温度下的氧化-挥发反应
梁 愿 摘译
(中国恩菲工程技术有限公司, 北京 100038)
熔炼/吹炼法生产铜时,铜精矿中的微量有害元素砷和锑会发生蒸发副反应。众所周知,当这些杂质元素以可观数量存在于铜精矿中时,环境被砷和锑污染的危险性显著增加,使最终的铜质量恶化。本文讨论了一项在500~1 100 ℃温度范围内从Cu3AsS4中挥发As和从Sb2S3中挥发Sb的研究结果。采用Cu3AsS4,纯Sb2S3及预制的Cu3AsS4-Sb2S3混合矿样,在N2和空气可控气氛下进行研究。结果表明在氧化气氛下,Cu3AsS4中的As完全挥发,留下铜复合物CuO渣,辉锑矿部分以SbO2形式蒸发,蒸发程度主要依赖于温度。在800 ℃和1 000 ℃时,辉锑矿的挥发程度分别达到45%和75%。混合硫砷铜矿- 辉锑矿样品氧化- 挥发时,在硫砷铜矿存在下,锑的挥发加强,加强的程度同样依赖于温度。在1 000 ℃,约99%的Sb2S3在5 min内迅速挥发。
火法冶金; 氧化反应; 挥发; 砷; 锑
0 引言
目前,大部分的铜是采用熔炼/吹炼技术从硫化铜精矿中生产出来的。在这种技术中,精矿中的杂质砷和锑在熔炼/吹炼的不同阶段发生蒸发副反应,是有害的微量元素。当这些杂质以可观的数量存在于精矿中时,周围环境被砷和锑污染的风险性显著增加,最终的铜产品质量恶化。
对微量元素As、Sb及其他杂质的处理是智利铜冶炼行业所面临的关键问题之一,原因是铜精矿中的这些元素含量越来越高,在熔炼前可以采用预处理如焙烧来处理含杂质多的铜精矿,消除有害元素。关于这个问题曾有报道说,铜- 金混合精矿在缺氧环境(O2<2%)进行焙烧,原料中大部分As蒸发,但大约一半的Sb残留在煅烧物中。为了正确理解在焙烧或熔炼过程中蒸发对微量元素的消除作用,对智利铜精矿中主要砷矿物- 硫砷铜矿和辉锑矿进行蒸发/挥发的基础研究很有必要。本文将讨论一项关于在500~1 100 ℃范围内从Cu3AsS4中挥发As和从Sb2S2中挥发Sb的研究结果。
一篇研究Cu3AsS4高温行为的文献表明Cu3AsS4在氮气气氛下分解,他们证明Cu3AsS4在N2中分解是通过中间介质Cu12As4S13发生的。但是,As在煅烧和熔炼温度下的氧化气氛中从Cu3AsS4中蒸发/挥发的过程却鲜为人知。关于这点,Wihajlovic等人在水平管炉400~800 ℃范围内进行了一项Cu3AsS4含量较多的Cu-As矿的氧化焙烧试验。这些研究表明在800 ℃,30 min后获得最大脱S量,在750 ℃,30 min后81%的As被除去。
2002年,Zivkovic等人用热重分析法研究了Sb2S3在空气中200~800 ℃范围内的氧化反应动力学,得出氧化过程如下:

(1)

(2)
用大泽之助法计算,反应1和反应2的活化能分别为90 kJ/mol和97 kJ/mol。
1 试验
试验采用El印第奥矿业(巴力克公司,智利)提供的硫砷铜矿晶体样品,样品经粉碎,磨矿,通过粒度筛分进行分类。样品的化学分析(-75+53 um)表明含18.9%的As,45.3%的Cu和31.6%的S。化学分析和矿物学分析如表1所示,表明硫砷铜矿样品较纯,主要的杂质是脉石。另外,试验所用的辉锑矿来自Aldrich化学试剂公司,Sb2S3含量为95.43%。试验采用这两种样品以及质量比为1∶1的Cu3AsS4和Sb2S3混合样品。另外Indura S.A.(因杜拉公司)提供了纯N2,O2和空气用于研究。
试验在常规的热重分析仪上进行,热重分析仪由竖管炉,电子天平,温度控制单元,数据采集和气体分布系统组成,试验样品重50~200 mg。在一个典型试验中,竖管炉反应器在缓慢的N2气流速下加热到设定的温度,当温度稳定后,装在5 mL瓷坩埚中的样品用竖直石英管悬挂起来,记录样品失重量。在试验过程中,氧气局部压力和氮气的流速保持不变,大部分试验在等温条件下进行直到观察不到样品的质量变化。
表1 硫砷铜矿矿物组成表 %
2 结果
2.1 硫砷铜矿的氧化/挥发
硫砷铜矿在空气中500~900 ℃范围内的氧化蒸发结果如图1所示,图中失重分数是反应时间的函数,从中可以观察到As的挥发速率是非常迅速的,即使是在500 ℃低温下,也可以观察到在研究的温度范围中,失重分数的最大值~0.45,对试验曲线最大值对应的样品进行XRD分析表明Cu2O是未挥发的复合物。按反应3进行的硫砷铜矿氧化反应的理论失重分数为0.45,因此,曲线的最大值对应的是As、S完全从体系中挥发形成的Cu2O。在较长时间内观察到,增重是由于Cu2O变为CuO,作为硫砷铜矿在氧化剂环境下氧化/挥发现象的最终稳定残留物,图2所示的衍射图表也证明了这一观点,图中主要的衍射线为CuO,因此,硫砷铜矿进行了以下反应:

(3)

(4)
图1 硫砷铜矿在空气中的氧化挥发
图2 硫砷铜矿在空气中氧化的样品的衍射线图谱
2.2 辉锑矿的氧化/挥发
辉锑矿在空气中氧化的试验结果如图3所示,在图3中观察到,在最低温700 ℃,失重分数很低并稳定在大约0.14处。相同的现象也在较高温度下观察到,随温度升高失重分数稳定在较高的数值。例如在800 ℃,稳定值大约在0.45,而在1 000 ℃是0.75。对应着Sb2S3氧化成Sb2O3的理论失重分数是0.14,这表明在温度低于700 ℃时,辉锑矿氧化成Sb2O3,在这样的温度下,挥发明显放慢。但是在较高温度下,Sb2O3挥发较快,伴随着Sb2O3氧化成不挥发性氧化物SbO2。通过图3失重分数曲线平台对应的样品的XRD分析,证实了SbO2的形成。XRD分析结果如图4所示,从图中只能看到SbO2的衍射线,因此,接下来的辉锑矿在流动空气中氧化/挥发的反应方程式如下:

(5)

(6)

(7)
图3 辉锑矿在空气中氧化和挥发随温度的变化
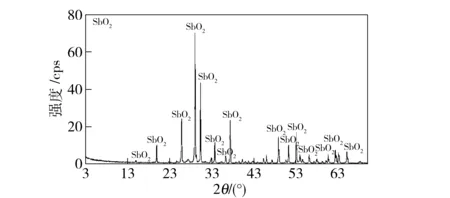
图4 Sb2S3挥发的平台区域样品的衍射图谱
2.3 硫砷铜矿- 辉锑矿混合样品的挥发
硫砷铜矿加辉锑矿(质量比为1∶1)的混合样品在空气中的氧化/挥发结果如图5所示。有趣的是,在空气中砷、锑完全从样品中挥发,假设不挥发性的CuO为最后残留物,失重分数应该为0.7。在图5中观察到,在1 000℃ 和1 100 ℃,试验得到的失重分数为0.7。由于纯辉锑矿的氧化/挥发应该无残留,此结果表明辉锑矿在硫砷铜矿存在下完全挥发。表2表明了辉锑矿在混合矿中与纯辉锑矿挥发增强程度的计算值。
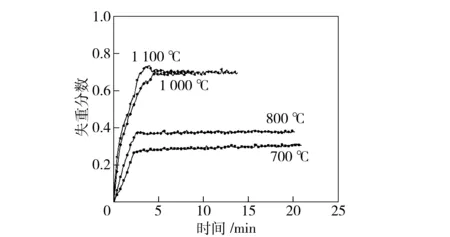
图5 硫砷铜矿和辉锑矿混合样品(质量比为1∶1)在空气中的氧化和挥发
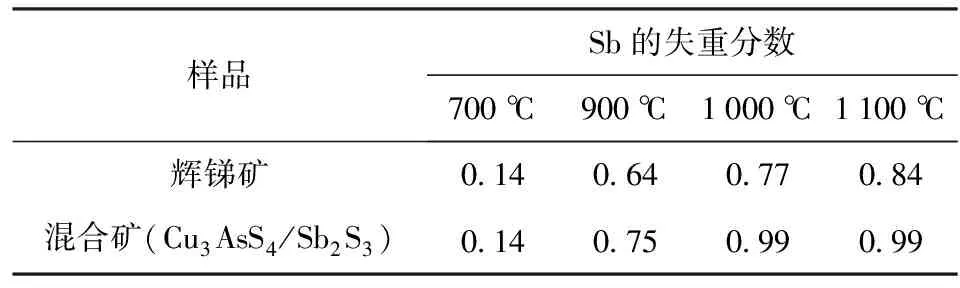
表2 锑从辉锑矿和混合硫砷铜矿- 辉锑矿样品中挥发(反应10 min时)
与纯硫砷铜矿和纯辉锑矿样品的氧化/挥发过程相比,辉锑矿在混合样品中的氧化/挥发通过一系列不同的反应发生。在图6和图7中,呈现了800 ℃氧化0.2和1.6 min的样品的XRD分析结果。在这些数据中,在两种反应时间里都观察到CuSbS2和Cu10.2Sb4S12.8的衍射线,如图6,7所示,衍射线的相对强度随时间变化,该结果表明硫砷铜矿和辉锑矿的氧化挥发过程是通过复杂异核化合物和固溶体形式发生的。因此,由失重分数数据,考虑锑以SbO形式完全挥发,可以写出以下的总反应来表示砷和锑从混合矿样中的挥发反应。

(8)

(9)
因此,在温度低于1 000 ℃,反应8占优势,高于1 000 ℃,反应9占优势。

图6 硫砷铜矿- 辉锑矿混合样品在1 000 ℃反应0.2 min的衍射曲线

图7 硫砷铜矿- 辉锑矿混合样品在1 000 ℃反应1.6 min的衍射曲线
3 结论
硫砷铜矿、辉锑矿和两者的混合矿的氧化/挥发试验可以得到以下结论。
在氧化性气氛下,硫砷铜矿经历了As的完全氧化和挥发,留下CuO作为最终残留的铜复合物。
在氧化性气氛下,辉锑矿最先氧化成Sb2O3,之后继续挥发氧化为SbO2。Sb2O3的氧化速率和挥发速率很大程度上依赖于温度。在较高温度下,挥发速率大于氧化速率。
在混合硫砷铜矿- 辉锑矿样品的氧化- 挥发过程中,硫砷铜矿的存在增强了锑的挥发,增强的程度同样依赖于温度。在1 000 ℃,纯辉锑矿中Sb2S3的挥发分数为0.77,而混合矿中Sb2S3挥发分数为0.99。
略)
苏平校对
Oxidation-volatilizationofenargiteandstibniteatroasting/smeltingtemperatures
Translated selectively by LIANG Yuan
In the production of copper by smelting/converting technology, arsenic and antimony are detrimental minor elements in the concentrates that undergo vaporization side reactions. It is well known, that when these impurities are present in appreciable amounts in the concentrates, the risk of ambient contamination with arsenic and antimony increases dramatically and the quality of the final copper deteriorates. In the present work, the results of an investigation on the volatilization of arsenic from enargite (Cu3AsS4) and antimony from stibnite (Sb2S3) at the temperature range of 500 to 1 100 ℃ is discussed. The study was conducted in controlled atmospheres of nitrogen and air using pure minerals samples of enargite, pure Sb2S3and prepared enargite - Sb2S3mixed samples. The results indicated that in oxidizing atmosphere enargite undergoes complete volatilization of arsenic leaving a residue of CuO as the final copper compound. Stibnite vaporizes partially with the formation of cervantite (SbO2) and the extent of volatilization is greatly dependant on the temperature. At temperature of 800 and 1 000 ℃, the vaporization of stibnite reached about 45 and 75 percent, respectively. On the other hand, in the case of oxidation-volatilization of the mixed enargite stibnite samples, the volatilization of antimony was enhanced by the presence of enargite. The degree of enhancement depended also on the temperature. At 1 000 ℃, about 99 percent of Sb2S3was volatilized very rapidly in less than 5 min.
hydrometallurgy; oxidation reaction; volatilization; arsenic; antimony
梁愿(1987—),女,河北石家庄人,硕士,主要从事有色冶金设计工作。
TF811
B

