漆酶催化香草醛接枝壳聚糖及其在抗菌纸中的应用
2014-08-09余成华裴继诚张方东顿秋霞
余成华 裴继诚 张方东 顿秋霞 王 兵
(天津科技大学天津市制浆造纸重点实验室,天津,300457)
流通领域用纸、食品及药品包装用纸、餐巾纸及生活用纸在制造、储藏或使用过程中可能会沾染上细菌,因而使得以上纸种在某些范围内的使用受到局限或影响[1]。在食品行业中,油脂酸败是含油脂食品品质变坏、影响食品保质期的一个重要因素。但一般抗氧化剂的耐热性均较差,经过加热,特别是在高温油炸的条件下,很容易分解或挥发[2]。因此生产一种既具有抑菌作用又具有抗氧化作用的食品包装纸成为一种新的诉求。
壳聚糖 (Chitosan,CTS)是甲壳素 (Chitin)的脱乙酰基产物,其学名是β-(1,4)-2-氨基-2-脱氧-D-葡聚糖。它是一种插线型聚合物,分子链中含有大量具有反应活性的氨基和羟基[3]。壳聚糖能有效地抑制细菌和真菌的生长和繁殖,与一般抑制剂相比,具有抑菌活性高、广谱、杀灭率高等优点。目前已有研究证明,壳聚糖及其衍生物在细胞水平和动物整体水平上具有一定的抗氧化作用[4]。其溶解性和抗氧化性较差,特别是对中、高分子质量壳聚糖,限制了其在许多领域的应用[5]。因此,对壳聚糖进行改性成为有关壳聚糖研究的重要课题。
目前对壳聚糖的改性方式主要是化学改性,包括酰基化、烷基化、羟基化、酯化、醚化、羧基化、季铵化[6]、接枝共聚[7]、Schiff碱反应、交联等[8]。常用醛、酰氯、酸酐、环氧化物等活性高、危害性大的试剂,对环境污染较大,同时化学法还存在着反应步骤多、得率低、专一性差等缺点[9-10]。与化学催化相比,生物催化具有催化效率高、专一性强、反应条件温和、对环境友好等优点[11-12]。壳聚糖的酶法接枝所用的催化剂主要有酪氨酸酶 (Tyrosinase,TYR)[13]、过氧化物酶[14]等。与其他氧化酶相比漆酶以氧分子作为电子受体,不仅具有高效率的催化效果,而且其催化的最终产物是水,在反应过程中对环境影响更小。
漆酶 (Laccase)是一种结合多个铜离子的蛋白质,属于铜蓝氧化酶。在氧气存在下,漆酶可以使酚型结构单元失去一个电子形成酚氧游离基,进而形成醌型结构[15],醌可以与壳聚糖上的氨基基团发生化学键连接,目前对该反应历程尚不清楚,但普遍认为醌与氨基通过席夫碱或迈克尔加成反应机理发生共价作用[16]。
香兰素 (Vanillin,VA)又名香草醛,天然存在于许多植物和有机物质中,具有香子兰特有的甜美香气,广泛用于食品、化妆品、个人卫生用品、去污剂、香水、农用化学品、防晒产品等。近几年还发现香草醛具有很好的抗氧化活性和抗肿瘤活性,能够防止食物变质[17]。研究表明香草醛在细菌、哺乳动物细胞以及动物整体实验中具有清除过氧化物和自由基的抗氧化作用。
本实验选取香草醛作为接枝物,通过漆酶催化氧化作用,将香草醛接枝于壳聚糖上,提高VA-壳聚糖的抗氧化性能和抑菌性能;并采用浆内添加法和表面涂布法制备抗菌纸,考察VA-壳聚糖对抗菌纸抗菌性能以及物理性能的影响。
1 实验
1.1 试剂与仪器
漆酶,商品号NOVOZYME 51003,酶活1070 U/mL,由诺维信公司提供。酶活用以丁香醛连氮 (Syringldazine)的氧化率为基准的漆酶单位LAMU表示,1个漆酶单位 (LAMU)是指在给定的分析条件下(pH值7.5、30℃)每分钟转化1 μmol丁香醛连氮所需酶量。香草醛 (VA);壳聚糖,脱乙酰度≥95%,黏度 100 ~200 mPa·s;2,2-联氮-二 (3-乙基-苯并噻唑-6-磺酸)二铵盐 (ABTS),均购于Sigma-Aldrich公司;其他试剂购于天津市化学试剂一厂;漂白硫酸盐针叶木浆,智利银星牌商品浆。
VECTOR 22傅里叶变换红外光谱仪 (FT-IR),德国布鲁克仪器公司;ZD-2型自动电位滴定仪,上海仪电科学仪器股份有限公司;UV-2550紫外可见分光光度计,日本岛津公司;RK-2A-KWT型快速纸页成形器,奥地利PTI公司。
1.2 实验方法
1.2.1 漆酶催化氧化VA-壳聚糖的接枝反应
将壳聚糖粉末分散于100 mL缓冲溶液 (100 mmol/L磷酸盐缓冲液,pH值6.5)中,并在40℃下不断摇晃,然后依次加入6 mL溶有香草醛 (10 mmol/L)的甲醇溶液和漆酶 (214 U),在整个反应过程中通氧,反应4 h。反应后,分别用甲醇、乙醇和水对VA-壳聚糖进行彻底漂洗,真空干燥后储存于4℃下备用分析。对照组的样品在没有加香草醛的条件下,以相同的方式进行处理[16]。
1.2.2 接枝率的测定
采用线性电位滴定法[18]测定VA-壳聚糖中的自由氨基含量。根据反应前后自由氨基含量的变化即可测得接枝率,即:
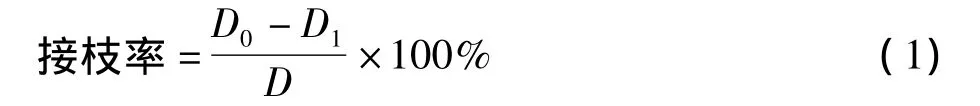
式中,D1为VA-壳聚糖的脱乙酰度 (即自由氨基含量);D0为壳聚糖对照样 (缓冲溶液处理样)的脱乙酰度 (即自由氨基含量);D为壳聚糖原样(未处理样)的脱乙酰度 (即自由氨基含量)。
1.2.3 红外光谱 (FT-IR)分析
将壳聚糖原样及VA-壳聚糖进行FT-IR分析,扫描范围:4000~500 cm-1,分辨率4 cm-1,扫描 16次,环境气体为空气。
1.2.4 ABTS·+自由基的清除
将壳聚糖原样以及VA-壳聚糖溶于0.1 mol/L醋酸中,浓度分别为0.2、0.5、0.8、1.0、2.0、2.5 mg/mL;将7 mmol/L ABTS和2.45 mmol/L过硫酸钾溶液等体积混合,并在室温下无光储存12 h,得到ABTS·+自由基溶液。在使用之前,ABTS·+溶液用pH值7.4磷酸盐缓冲液稀释,在734 nm下达到0.700±0.025的吸光度[16]。在装有2 mL 的 ABTS·+溶液的试管中,加入不同浓度的壳聚糖溶液2 mL,摇匀,25℃下避光静置10 min,在734 nm处测量吸光度,并用式 (2)计算ABTS·+自由基的清除率 (%)。
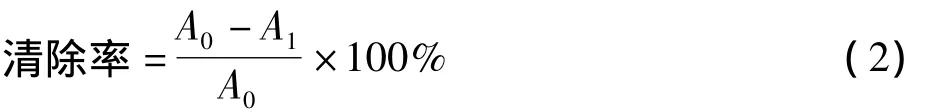
式中,A0为ABTS·+初始浓度的吸光度;A1为添加壳聚糖溶液后清除ABTS·+后浓度的吸光度。
1.2.5 还原能力的测定
对文献[19]的方法稍做改进来测定还原能力。取2 mL不同浓度的样品,加入0.2 mol/L磷酸缓冲液(pH值6.6)和质量分数1%铁氰化钾溶液各2.5 mL,混匀,50℃水浴20 min后迅速冷却,加入2.5 mL质量分数10%的三氯乙酸溶液,混匀后在2000 r/min下离心10 min,取上清液2 mL,加入2.5 mL去离子水和0.5 mL质量分数0.1%的三氯化铁溶液,静置10 min后在700 nm处测定吸光度。
1.2.6 抑菌性能检测
采用牛津杯法检测壳聚糖及VA-壳聚糖的抑菌能力。首先取菌浓为105~106CFU/mL的指示菌培养物0.1 mL滴加到牛肉膏蛋白胨培养基平板 (直径为90 mm)上,采用涂布棒将平板均匀涂满,自然干燥30 min,然后将已消毒的牛津杯均匀放置在平板上,每个平板放4个,向其中加入采用0.1 mol/L盐酸溶解的VA-壳聚糖0.2 mL(待测样品浓度分别为1 mg/mL、2 mg/mL、5 mg/mL、10 mg/mL),将培养皿置于培养箱中37℃下培养24 h,测定抑菌圈直径。
1.2.7 抗菌纸的制备
(1)浆内添加法
分别向纸浆中加入壳聚糖原样及VA-壳聚糖粉末,用量分别为0.2%、0.5%、0.8%、1.0%(相对于绝干浆量),同时加入0.08%(相对绝干浆量)阳离子聚丙烯酰胺 (CPAM)作为助留剂,与浆料混合均匀后,采用快速纸页成形器抄造定量为60 g/m2的纸张。
(2)表面涂布法
称取一定量的淀粉置于三口烧瓶中,以1%(相对淀粉绝干量)的比例加入过硫酸铵,然后加入一定量的蒸馏水后在恒温水浴锅中90℃的温度下进行糊化1 h,得到柔软、透明、均一的淀粉涂布液。将壳聚糖原样及 VA-壳聚糖粉末分别按照 0.2%、0.5%、0.8%、1.0%(相对绝干浆量)加入到淀粉中,搅匀后,用5#涂布棒将其涂布于所抄空白纸的表面,自然干燥。
1.2.8 纸张抑菌性能检测
采用改良奎因法检测纸张的抑菌效果。将指示菌配成105~106CFU/mL的菌悬液,备用。将纸样裁成大小为25 mm×25 mm的纸片放入直径为90 mm的无菌培养皿内,均匀滴加0.5 mL菌液置于37℃培养箱内干燥1 h,干燥后的纸张平贴于营养琼脂平板表面,再用半固体营养琼脂均匀覆盖纸样表面,置37℃培养箱内培养24 h。采用活菌计数法测定其活菌数,并用式 (3)计算抑菌率K。

式中,A为从空白样回收的平均菌数;B为从抗菌纸回收的平均菌数。
2 结果与讨论
2.1 接枝率测定
接枝率是指壳聚糖进行接枝反应生成壳聚糖衍生物时,氨基被接枝的比例。接枝率反映原料向产品的转化程度。采用线性电位滴定法分别对壳聚糖原样、壳聚糖对照样以及VA-壳聚糖进行滴定,实验结果见图1。根据图1,按照文献 [18]方法计算在本实验条件下,壳聚糖原样的总氨基含量约为8.8%,壳聚糖对照样 (缓冲溶液处理样)氨基含量为7.2%,VA-壳聚糖的氨基含量为6.3%,本实验条件下测得其接枝率约为10.2%。
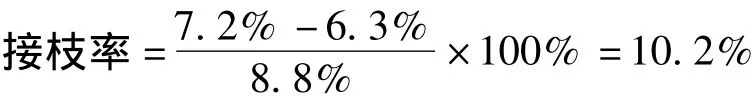
2.2 FT-IR分析
壳聚糖原样和VA-壳聚糖的FT-IR图如图2所示。从图2中可知,壳聚糖原样在3440 cm-1处附近有吸收带是—OH和—NH的伸缩振动,2875 cm-1处为C—H伸缩振动吸收峰,1596 cm-1处为氨基N—H变形振动峰;1421 cm-1处为—NH3+弯曲振动[20],1384 cm-1和1324 cm-1处为氨基葡萄糖单元上—NH的弯曲振动[21],1261 cm-1处为 C—O和 C—C伸缩振动,1155 cm-1处为C—O—C的反对称伸缩振动,1080 cm-1处是包含C—O结构的伸缩振动;VA-壳聚糖在 3400 cm-1、1421 cm-1、1384 cm-1和 1324 cm-1处吸收减弱,1596 cm-1处吸收消失,这些吸收峰的变化表明壳聚糖上氨基的减少,与漆酶催化香草醛的产物和壳聚糖氨基基团之间发生共价反应相符[5],并且在1637 cm-1处出现CN伸缩振动峰,归因于壳聚糖上氨基基团和酚羟基基团之间形成席夫碱键[22]。这些在光谱中的变化表明通过漆酶催化氧化香草醛的产物与壳聚糖上的氨基基团之间受到席夫碱型的共价修饰。
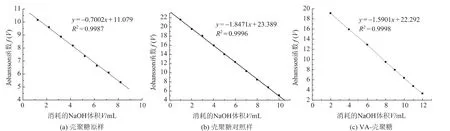
图1 壳聚糖接枝前后氨基含量的测定

图2 壳聚糖原样和VA-壳聚糖FT-IR图
2.3 ABTS·+自由基的清除
ABTS自由基清除法[23]目前也已被广泛应用于生物样品的总抗氧化能力的测定。在此反应体系中,ABTS经氧化后生成相对稳定的蓝绿色ABTS·+水溶性自由基,且在734 nm处具有典型的特征吸收峰。抗氧化剂与ABTS·+自由基反应后使其溶液褪色,特征吸光值降低。溶液吸光值越低则表明所检测物质的总抗氧化能力越强。在本实验中,对ABTS·+溶液进行紫外可见分光光度计 (UV-Vis)扫描,结果如图3所示。壳聚糖原样对ABTS·+溶液的清除作用较低,原因可能是因为氢分子内和分子间的连接抑制了自由基的清除,而VA-壳聚糖对ABTS·+溶液的清除作用有了明显的提高,在浓度为2.5 mg/mL时VA-壳聚糖对ABTS·+溶液的清除作用达到了75.7%,相比未改性提高了59.5%。其对ABTS·+自由基清除率的IC50(半数抑制浓度)为1.62 mg/mL。由此证明,漆酶催化VA-壳聚糖接枝的产物,可使其抗氧化活性得到明显增强。
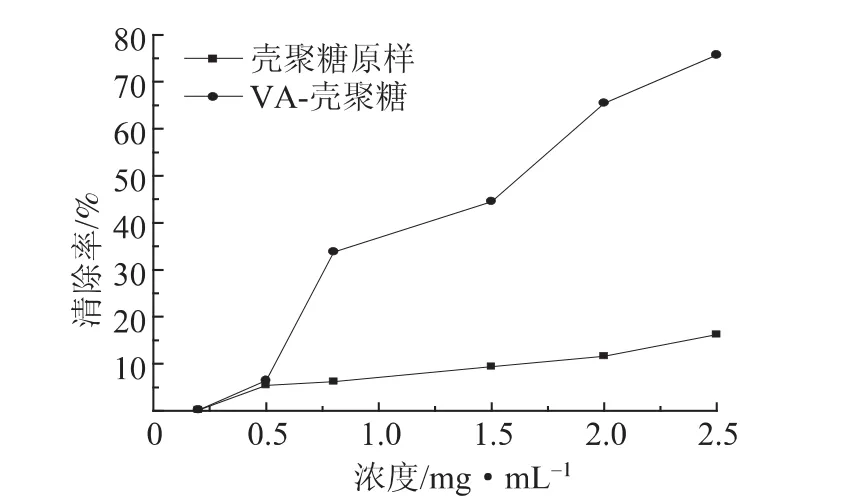
图3 不同浓度壳聚糖原样和VA-壳聚糖对ABTS·+自由基清除的影响
2.4 还原能力测定
还原能力是表示抗氧化物质提供电子能力的重要指标,研究表明抗氧化活性和还原能力之间存在着密切的关系,在一般情况下,还原特性与还原酮的存在有关,通过提供一个氢原子以打破自由基链而表现出抗氧化性能[24]。壳聚糖原样及VA-壳聚糖的还原能力如图4所示。从图4可知,随着浓度的增加,壳聚糖原样的吸光度值增加不显著,其表现出的还原力几乎可以忽略不计。而改性后的VA-壳聚糖随着浓度的增加,吸光度值随之增加,还原能力逐渐增强。VA-壳聚糖在浓度为5 mg/mL时在700 nm处的吸光度为0.502,较壳聚糖原样提高0.321。
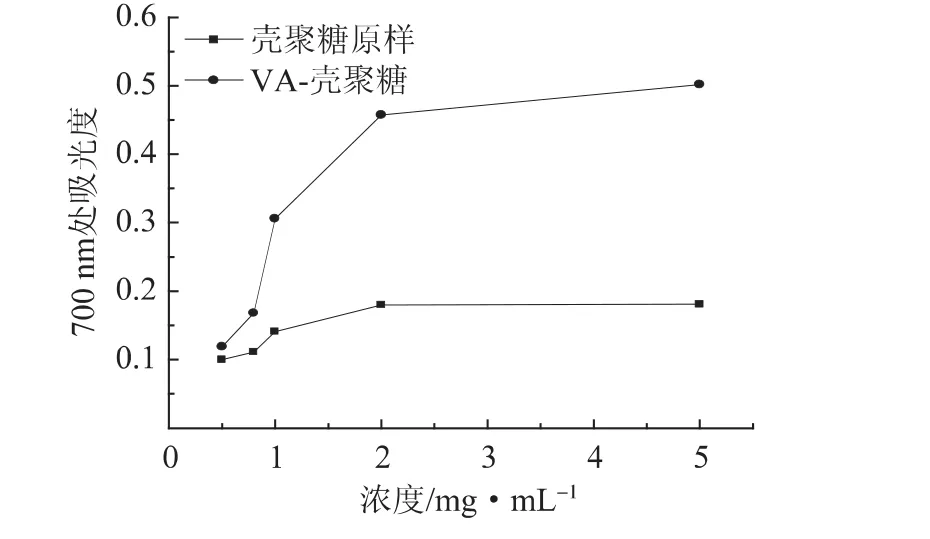
图4 不同浓度壳聚糖原样和VA-壳聚糖的还原能力
2.5 壳聚糖抑菌性能检测
表1列出了壳聚糖原样和VA-壳聚糖对大肠杆菌、沙门氏菌、枯草芽孢杆菌及金黄色葡萄球菌的抑菌活性。从表1可知,在浓度为1 mg/mL时,VA-壳聚糖较壳聚糖原样对大肠杆菌和沙门氏菌的抑菌圈分别提高了1.5 mm和1.3 mm;在浓度为5 mg/mL时,VA-壳聚糖较壳聚糖原样对枯草芽孢杆菌和金黄色葡萄球菌的抑菌圈分别提高了3.8 mm和4.0 mm。
这通常是因为壳聚糖中带有正电荷的氨基基团,易与呈负电性的菌体相吸附,一方面是由于壳聚糖可以透过微生物细胞壁进入到菌体内部,与细菌生存所必需的微量元素、金属元素或蛋白质等结合,破坏其代谢平衡,从而抑制微生物的生长和繁殖[25];也可能同时与DNA形成稳定的混合物,干扰DNA的复制与转录[26-28]。另一方面是由外部对菌体细胞发生作用,使菌体细胞聚沉,高分子链密集于细菌菌体表面,使其变性或在细胞表面形成一层高分子膜,影响细菌对营养物质的吸收,阻止代谢废物的排泄,导致菌体的新陈代谢紊乱,进而导致菌体死亡[29]。通过Schiff键的接枝引入酚类物质,一方面由于携带有Schiff碱等疏水性基团的抗菌剂因与细菌膜有更好的亲和性,从而可提高抗菌活性;另一方面由于进行亚结构修饰,通过增加抑菌活性中心的数量,提高抑菌活性[30],使得VA-壳聚糖与细菌膜有更好的亲和性,从而提高VA-壳聚糖对细菌的抑菌性能。
由表1可知,壳聚糖原样及VA-壳聚糖的抑菌性能不随着浓度的增大而增大。这可能是由于低浓度的壳聚糖聚阳离子更容易接近细菌并与之结合,从而发生凝聚,而高浓度会出现类似于混凝过程中的“再稳”现象;另一种解释基于壳聚糖可能会引起细胞壁通透性改变的抑菌机理假设,认为高浓度壳聚糖在细胞壁表面形成的致密包裹层可导致细胞质泄漏量降低[31]。
2.6 纸张抑菌性能检测
2.6.1 浆内添加法
图5为浆内添加法制得的抗菌纸对大肠杆菌、沙门氏菌、枯草芽孢杆菌及金黄色葡萄球菌的抑菌率。从图5可以看出,VA-壳聚糖抗菌纸对4种细菌的抑菌率较壳聚糖原样都有所提高。实验结果显示,在VA-壳聚糖用量较小时就具有良好的抑菌性能,但抑菌率不随着VA-壳聚糖用量的增加而增加,这可能是由于当用量增大时壳聚糖颗粒容易相互絮聚而影响了其抑菌性能[31]。
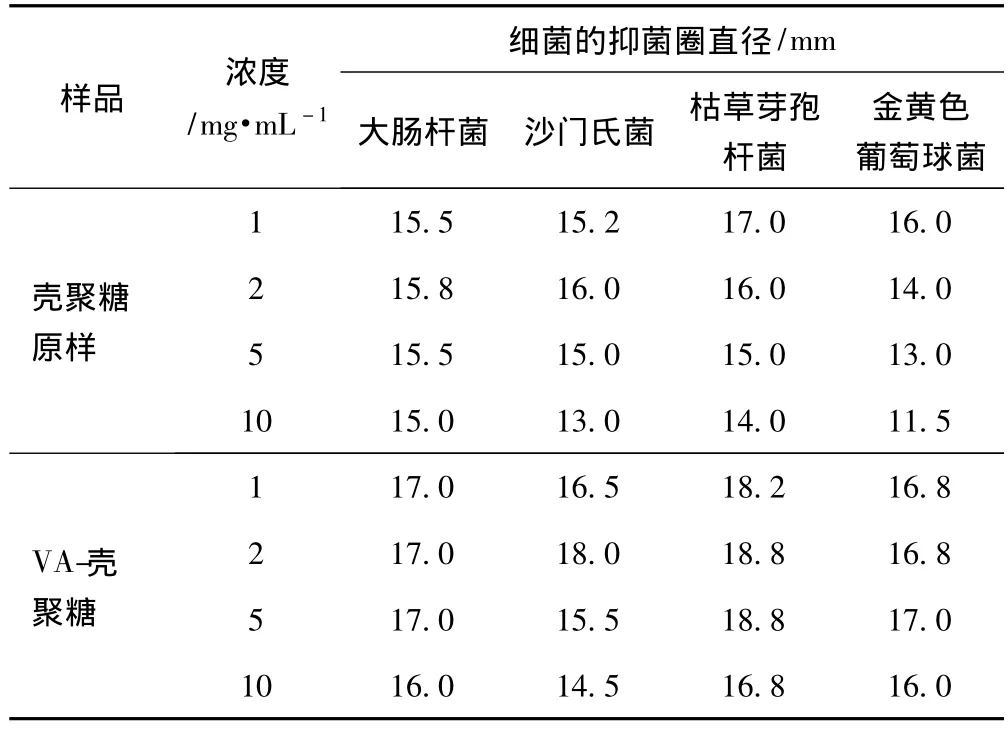
表1 壳聚糖原样和VA-壳聚糖抑菌性能检测
2.6.2 表面涂布法
图6为表面涂布法制得的抗菌纸对大肠杆菌、沙门氏菌、枯草芽孢杆菌及金黄色葡萄球菌的抑菌率。从图6可以看出,VA-壳聚糖制得的抗菌纸对4种细菌的抑菌率较壳聚糖原样都有所提高,表明该抗菌纸对这几种微生物的抵抗性良好。
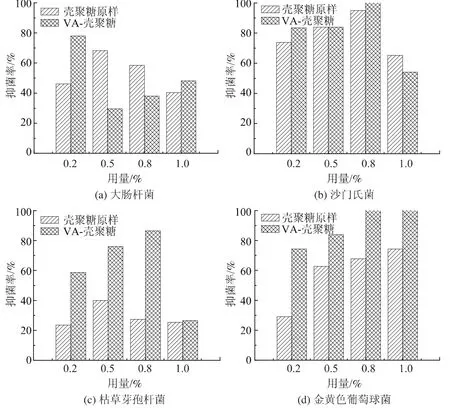
图5 浆内添加法抗菌纸抑菌率
2.7 抗菌纸物理性能比较
表2、表3分别为不同处理方式对抗菌纸抗张指数、耐破指数、撕裂指数的影响。从表2、表3可知,抗菌纸的抗张指数、耐破指数与原纸相比略有提高,撕裂指数有所降低。其原因可能是因为处理后的纸张,壳聚糖原样及VA-壳聚糖与纤维上的羟基形成氢键,使抗菌剂牢固地吸附在纤维表面;同时,由于壳聚糖的聚阳离子性,能够与带负电的纤维发生吸附作用,表现为在纤维表面上牢固地附着在纤维表面,从而有利于纤维间结合力的提高[1]。
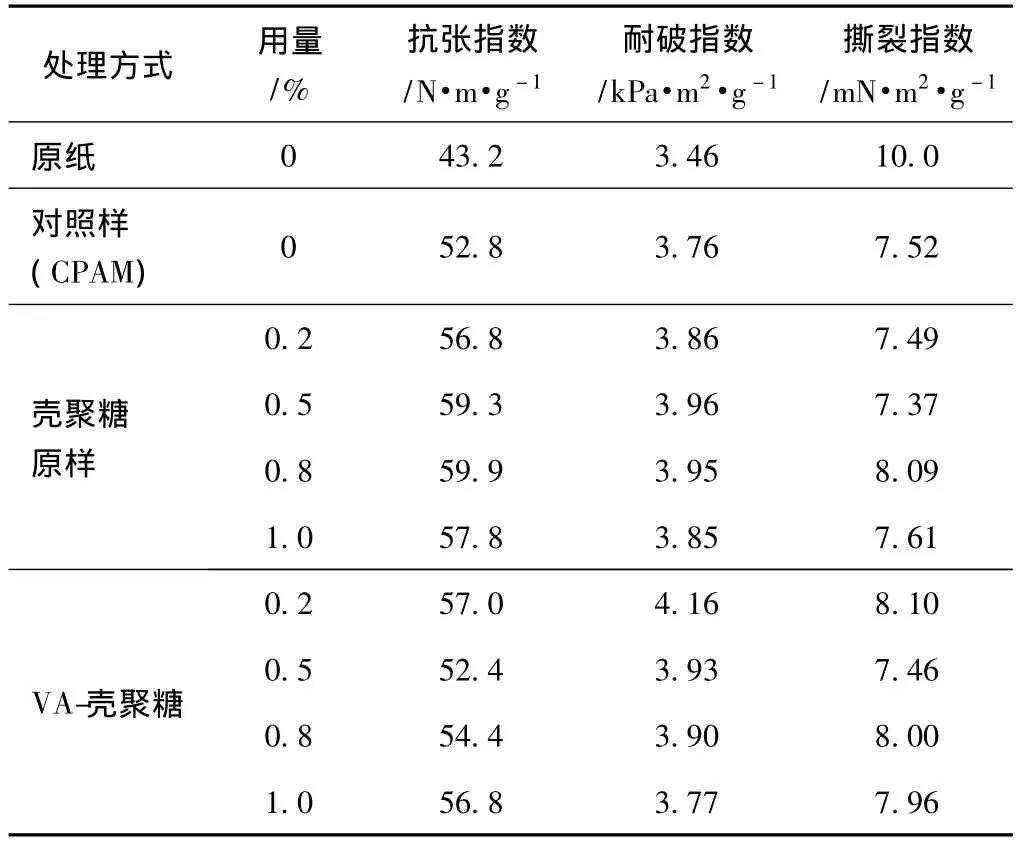
表2 浆内添加法抗菌纸物理性能

图6 表面涂布法抗菌纸抑菌率

表3 表面涂布法抗菌纸物理性能
3 结论
本实验利用漆酶催化香草醛 (VA)与壳聚糖接枝反应,以提高壳聚糖的抗氧化性能和抗菌性能;并采用浆内添加法和表面涂布法制备抗菌纸。
3.1 实验中的酶促反应是在温和的条件下与固体壳聚糖颗粒进行反应,测得 VA-壳聚糖的接枝率约为10.2%。
3.2 红外光谱 (FT-IR)分析表明,在漆酶催化作用下香草醛与壳聚糖上的氨基参加反应形成席夫碱(CN)结构。
3.3 VA-壳聚糖对 2,2-联氮-二 (3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(ABTS·+自由基)半数抑制浓度(IC50)值为1.62 mg/mL,还原能力检测得出浓度为5 mg/mL时在700 nm处的吸光度较壳聚糖原样提高0.321,表明VA-壳聚糖的抗氧化性能得到提高;同时VA-壳聚糖对大肠杆菌、沙门氏菌、枯草芽孢杆菌和金黄色葡萄球菌的抑菌性有所改善。
3.4 纸张经浆内添加和表面涂布VA-壳聚糖后,制备的抗菌纸对大肠杆菌、沙门氏菌、枯草芽孢杆菌和金黄色葡萄球菌的抑菌性能均有所提高。
3.5 与原纸相比,抗菌纸的抗张指数、耐破指数略有提高,但撕裂指数有所降低。
[1] Guo H P,Zhang M Y.The study of antibacterial paper[C]//The Thirteenth Annual Meeting of Chinese Paper Association,2008.郭惠萍,张美云.具有抗菌功能抗菌纸的研究[C]//中国造纸学会第十三届学术年会,2008.
[2] Liu Z M,Jiang S Y,Huang C J,et al.Antioxidative Effect s of Food Antioxidative Paper on the Oil Fried Food[J].Journal of Guangxi Institute of Technology,1998,9(4):85.刘昭明,蒋世云,黄翠姬,等.食品抗氧化纸对油炸食品抗氧化效果的研究[J].广西工学院学报,1998,9(4):85.
[3] Jiang T D.Chitosan[M].Beijing:Chemical Industry Press,2001.蒋挺大.壳聚糖[M].北京:化学工业出版社,2001.
[4] Varma A J,Deshpande S V,Kennedy J F.Metal complexation by chitosan and its derivatives:A review[J].Carbohydrate Polymers,2004,55(1):77.
[5] Abdulhadi A,Isabelle C,Bernadette P,et al.Functionalization of chitosan by laccase-catalyzed oxidation of ferulic acid and ethyl ferulate under heterogeneous reaction conditions[J].Carbohydrate Polymers,2012,87(1):537.
[6] ZHANG Mei-yun,GUO Hui-ping.Preparation of Quaternary Ammonium Salt of Chitosan and Its Application in Antibacterial Paper[J].China Pulp & Paper,2008,27(2):14.张美云,郭惠萍.季铵盐壳聚糖的制备及其在抗菌纸中的应用[J].中国造纸,2008,27(2):14.
[7] YANG Qiang,LIU Zhong.Preparation and Application of Graft Copolymer of Chitosan with Polyacrylamide CAM[J].China Pulp& Paper,2003,22(12):15.杨 强,刘 忠.壳聚糖丙烯酰胺接技共聚物的合成及应用[J].中国造纸,2003,22(12):15.
[8] Ma N,Wang Q,Sun S L,et al.Progress in Chemical Modification of Chitin and Chitosan[J].Progress in Chemistry,2004,16(4):643.马 宁,汪 琴,孙胜玲,等.甲壳素和壳聚糖化学改性研究进展[J].化学进展,2004,16(4):643.
[9] Zhou Q F,Hu H J.High polymer chemistry[M].Beijing:Chemical Industry Press,2001.周其凤,胡汉杰.高分子化学[M].北京:化学工业出版社,2001.
[10] Chen T,Kumar G,Harris M T,et al.Enzymatic grafting of hexyloxyphenol onto chitosan to alter surface and rheological properties[J].Biotechnol Bioeng.,2000,70(5):564.
[11] Georg M G,Artur C P.New substrates for reliable enzymes:enzymatic modification of polymers[J].Chemical Biotechnogy,2003,14:577.
[12] Kobayashi S,Uyama H,Kimura S.Enzymatic polymerization[J].Chem Rev.,2001,101(12):3793.
[13] Kumar G,Smith P J,Payne G F.Enzymatic grafting of a natural product onto chitosan to confer water solubility under basic conditions[J].Biotechnol.Bioeng.,1999,63(2),154.
[14] Vachoud L,Chen T,Payne G F,et al.Enzyme Microb[J].Tech.,2001,29:380.
[15] Witayakran S,Ragauskas A J.Modification of high-lignin softwood kraft pulp with laccase and amino acid[J].Enzyme and Microbial Technology,2009,44(3):176.
[16] Mojca B,Gorgieva,Selestina,et al.Laccase-mediated functionalization of chitosan by caffeic and gallic acids for modulating antioxidant and antimicrobial properties[J]. Carbohydrate Polymers,2012,87(4):2388.
[17] Zheng H,An J,Xu Q Z.The anti-radiation effect of vanillin derivatives P7[J].Journal of Toxicology,2005,19(3):247.郑 红,安 静,徐勤枝.香兰素衍生物P7抗辐射的作用[J].毒理学杂志,2005,19(3):247.
[18] Ke H Z,Chen Q C.Linear potentiometric titration of Chitosan[J].Chemistry,1990,10(1):44.柯火仲,陈庆绸.线性法电位滴定壳聚糖[J].化学通报,1990,10(1):44.
[19] Oyaizu M.Studies on product of browning reaction prepared from glucose amine[J].Japanese Journal of Nutrition,1986,44:307.
[20] Muzzarelli R A A,Tanfani F,Emanuelli M,et al.N-(carboxymethylidene)-chitosans and N-(carboxymethyl)-chitosans:Novel chelating polyampholytes obtained from chitosan glyoxylate[J].Carbohydrate Research,1982,107(2):199.
[21] Sousa F,Guebitz G M,Kokol V.Antimicrobial and antioxidant properties of chitosan enzymatically functionalized with flavonoids[J].Process Biochemistry,2009,44(7):749.
[22] Sampaio S,Taddei P,Monti P,et al.Enzymatic grafting of chitosan onto Bombyx mori silk broin:Kinetic and IR vibrational studies[J].Journal of Biotechnology,2005,116(1):21.
[23] Miller N J,Sampson J,Candeias L P,et al.Antioxidant activities of carotenes and xanthophylls[J].FEBS Letters,1996,384(3):240.
[24] Duh P D.Antioxidant activity of burdock(Arctium lappa Linné):Its scavenging effect on free-radical and active oxygen[J].Journal of the American Oil Chemists’Society,1998,75(4):455.
[25] ZHAO Y Q,Bu J F,Hai H,et al.Studies on the bacteriostasis of CTS-compounds[J].Progress in Biotechnology,2005,25(5):67.
[26] Coma V,Deschamps A,Gros A M.Bioactive packaging materials from edible chitosan polymer antimicrobial activity assessment on dairy related contaminants[J].Journal of Food Science,2003,68(9):2788.
[27] Issams T,Adelem G,Adele P,et al.Chitosan polymer as bioactive coating and film against aspergillus niger contamination[J].Journal of Food Science,2005,70(2):100.
[28] Coma V,Deschamps A,Gros M.Bioactive packaging materials from edible chitosan polymer antimicrobial activity assessment on dairy related contaminants[J].Journal of Food Science,2003,68(9):2788.
[29] Wan R X,Gu H Q.The research on antibacterial properties of chitosan and its derivatives[J].Chinese Journal of Dialysis and Artificial Organs,2010,21(2):36.
[30] Hang Y P,Li K Y,Yang H W,et al.Research on antibacterial mechanism of chitosan and its chemical modification[J].Chemical World,2012,53(4):248.韩永萍,李可意,杨宏伟,等.壳聚糖的抗菌机理及其化学改性研究[J].化学世界,2012,53(4):248.
[31] Sudharshan N R,Hoover D G,Knorr D.Antibacterial action of chitosan[J].Food Biotechnol,1992,6(3):257. CPP
