丹参酮ⅡA对ApoE基因敲除小鼠肝脏脂质沉积的影响及机制
2014-08-09王俊岩朱美林马佳会邵楚茜贾连群
王俊岩,朱美林,冷 雪,马佳会,杨 祎,邵楚茜,贾连群
(辽宁中医药大学省部共建教育部重点实验室, 辽宁 沈阳 110032)
动脉粥样硬化(atherosclerosis,AS)是导致心脑血管疾病的主要病理基础。载脂蛋白E (apolipoprotein E, aopE)主要存在于极低密度脂蛋白(very low density lipoprotein, VLDL)、乳糜微粒(chylomicrons,CM)和部分高密度脂蛋白 (high density lipoprotein receptor, HDL)中,参与甘油三酯(triglyceride,TG)和胆固醇的转运,通过低密度脂蛋白受体(low density lipoprotein receptor, LDL-R)途径和非LDL-R途径发挥降低血浆中TG、总胆固醇(total cholesterol, TC)水平的作用。AopE基因缺失小鼠,由于apoE依赖的LDL-R途径和非LDL-R途径受阻,导致TG、TC、LDL和 VLDL 水平升高进而诱发AS发生[1-2]。
丹参酮ⅡA为唇形科植物丹参(Salvia miltiorrhiza Bge)的干燥根及根茎的主要脂溶性成分之一。现代药理学研究表明丹参酮ⅡA能抑制内源性胆固醇的合成,降低氧化低密度脂蛋白(LDL)的生成,能有效抑制AS形成[3]。本研究通过观察丹参酮ⅡA对ApoE基因敲除(ApoE-/-)小鼠肝脏脂质沉积的影响及可能机制,为该类药物在临床上通过降脂防治AS相关疾病提供实验依据。
1 材料
1.1 实验动物 20只ApoE-/-小鼠,6~8周龄,雌雄各半,体重18~20 g。同龄具有相同遗传背景的C57BL/6J小鼠10只。购于北京大学实验动物中心,合格证号为[SCXK(京)2011-0012],饲养于辽宁中医药大学实验动物中心,SPF级,自由饮水与摄食。
1.2 试剂与仪器 Trizol、RT-PCR试剂盒、琼脂糖购自大连TaKaRa公司;HE染色液购自北京鼎国生物技术公司;兔抗小鼠LDL-R、LCAT单克隆抗体购自Abcam公司;TG、TC、HDL-C、LDL-C测定试剂盒购自四川迈新生物技术有限公司。丹参酮ⅡA购自中国药品生物制品检定所。荧光显微镜,德国Leica;PCR仪,美国伯乐;全自动生化分析仪,日本东芝。
2 方法
2.1 分组、造模及给药 20只ApoE-/-小鼠全程给予西方高脂膳食饲料(含脂肪21%,胆固醇0.15%),饲喂8周后随机分为模型组、丹参酮ⅡA组,每组10只。另外同龄具有相同遗传背景的C57BL/6/J小鼠10只作为空白对照。各组按如下方式处理:①空白对照组:予普通颗粒小鼠饲料,同时给予等量蒸馏水灌胃。②模型组:予西方高脂膳食饲料,同时给予等量蒸馏水灌胃。③丹参酮ⅡA组:予西方高脂膳食饲料,每日灌服丹参酮ⅡA 30 mg / kg。灌胃给药,每日1次,按照上述方法连续喂养8周取材。实验期间模型组ApoE-/-小鼠死亡2只,最终获取有效实验数据的动物为28只。
2.2 检测指标及方法
2.2.1 血脂检测 全自动生化分析仪检测血清中TG、TC、HDL-C、LDL-C含量。
2.2.2 肝脏病理组织形态学观察 肝脏组织4%多聚甲醛溶液中固定24 h,按苏木素-伊红(HE)染色常规方法进行70%~100%梯度酒精脱水、二甲苯透明、石蜡包埋、切片(切片厚度为5 μm)、贴片、烤片后,用二甲苯脱蜡、70%~100%梯度酒精复水、苏木精染色、70%盐酸酒精分色、伊红复染后,再用70%~100%梯度酒精脱水、二甲苯透明,中性树胶封片石蜡包埋,光学显微镜下观察肝脏组织形态。
2.2.3 油红O染色观察主动脉脂质沉积 肝脏样本制备冰冻切片(6 μm),切片干燥后入50%乙醇水洗,油红O染色8 min,50%乙醇分化,自来水终止分化,苏木素复染,自来水反蓝,甘油明胶封片。光学显微镜下观察肝组织脂质沉积情况。
2.2.4 反转录-聚合酶链反应(RT-PCR) 定量分析肝脏LDL-R、LCAT mRNA水平 引物由大连TaKaRa生物技术公司合成,选用β-actin作为内参照(见表1)。100mg组织液氮研磨后加入1 mL Trizol裂解,转移至1.5 mL离心管中,加入0.2 mL氯仿,离心,吸取上层水相,加等量的异丙醇沉淀RNA,离心,缓慢加人75%乙醇洗涤,离心,空气风干后加入DEPC水溶解。紫外分光光度计测定260 nm及280 nm OD值,计算RNA的浓度和纯度同时电泳检测。取0.5 μg RNA用于RT-PCR,按照RT-PCR试剂盒说明操作,循环参数为94 ℃预变性2 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min进行30个循环,72 ℃延伸10 min 后4 ℃保存。各组取10 μL PCR扩增产物进行琼脂糖凝胶电泳,在Gelpro32凝胶成像系统上进行分析,以各组目的基因条带与β-actin条带密度比值表示相应基因mRNA的相对表达水平,实验重复3次。
表1引物序列表

引物上游引物下游引物长度LDL-R5′-TCCATCTTCTTCCCTATTGC-3′5′-GCCCAGCTTTGCTCTTAT-3′358bpLCAT5′-GTCTTCCTCATTGGGCATAG-3′5′-AAAGTCTTGGACGGTGTAGTT-3′312bpβ-actin5′-TCCTCCCTGGAGAAGAGCTA-3′5′-TCAGGAGGAGCAATGATCTTG-3′302bp
2.2.5 Western bloting 法检测肝脏LDL-R、LCAT蛋白表达 加入蛋白裂解液提取总蛋白, Bradford蛋白质测定试剂盒进行蛋白定量。60μg蛋白/泳道上样,经SDS-PAGE电泳后,电转膜至PVDF膜,加入1∶100兔抗小鼠 LDL-R、LCAT, 4℃封闭过夜,TBST洗涤3次,每次5 min,加入HRP标记的羊抗兔二抗(1∶2000)。按试剂盒说明书混合发光液A和B,与膜作用5 min后进行X光片曝光。X光片显影和定影后观察结果。

3 结果
3.1 各组实验小鼠血脂变化比较(见表2) 与空白对照组相比,模型组小鼠血清中TG、TC、LDL-C水平显著升高(P<0.01),HDL-C水平显著降低(P<0.01)。与模型组相比,丹参酮ⅡA组小鼠血清中TG、TC、LDL-C水平显著降低(P<0.01),HDL-C水平显著升高(P<0.01)。


组别TGTCLDL-CHDL-C 空白对照组1.01±0.032.21±0.120.18±0.030.95±0.08 模型组3.63±0.12∗∗21.36±2.35∗∗2.60±0.25∗∗0.36±0.01∗∗ 丹参酮ⅡA组2.03±0.30△13.35±0.58△△1.45±0.25△△0.71±0.01△△
注:与空白对照组比较:*P<0.05,**P<0.01;与模型组比较:△P<0.05,△△P<0.01。
3.2 各组实验小鼠肝脏病理组织形态学改变(见图1) 空白对照组小鼠肝脏组织结构正常,肝细胞大小均匀,肝细胞索排列规整,肝细胞形态结构清晰,核膜完整,核圆、大、居中,核仁清晰可见。模型组小鼠肝细胞排列层次紊乱,肝细胞肿胀,细胞核变大界限不清,核仁消失,肝血窦变小、有充血,中央静脉和肝细胞结构变形现象明显,细胞浆内可见大量大小不等的圆形脂肪空泡和中性粒性炎性细胞浸润。丹参酮ⅡA组肝细胞排列层次较规则,形态结构较清晰,肝细胞水肿减轻,中性粒性炎性细胞浸润减少。油红O染色结果显示模型组小鼠肝脏细胞中脂滴明显增多,而丹参酮ⅡA组小鼠肝脏细胞中脂滴明显减少。

注:A、D:空白对照组;B、E:模型组;C、F:丹参酮ⅡA组;A、B、C:(HE染色×200);D、E、F:(油红O染色×400)。图1 各组小鼠肝脏组织形态学改变及油红O染色结果
3.3 各组实验小鼠肝脏LDL-R、LCAT mRNA表达(见图2,3) 与空白对照组相比,模型组小鼠肝脏LDL-R、LCAT mRNA水平显著降低(P<0.01)。与模型组相比,丹参酮ⅡA组小鼠肝脏LDL-R、LCAT mRNA水平显著升高(P<0.01)。

注:1.空白对照组;2.模型组;3.丹参酮ⅡA组。 图2 各组小鼠肝脏LDL-R、LCAT mRNA表达
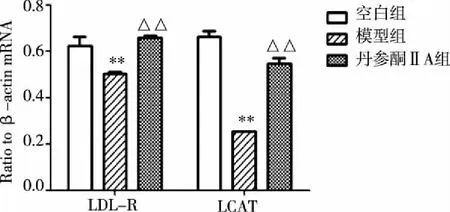
注:1.空白对照组;2.模型组;3.丹参酮ⅡA组。 图3 丹参酮ⅡA对小鼠肝脏LDL-R、LCAT mRNA表达的影响
3.4 各组实验小鼠肝脏LDL-R、LCAT蛋白表达(见图4,5) Western bloting结果显示,与空白对照组相比,模型组小鼠肝脏LDL-R、LCAT蛋白水平显著降低(P<0.01)。与模型组相比,丹参酮ⅡA组小鼠肝脏LDL-R、LCAT蛋白水平显著升高(P<0.01)。

注:1.空白对照组;2.模型组;3.丹参酮ⅡA组。 图4 各组小鼠肝脏LDL-R、LCAT蛋白表达
4 讨论
中医认为AS发生常与身体虚弱加之血脉瘀阻、痰浊等有关,治疗时当以益气健脾、活血祛瘀为要。丹参又名赤参,紫丹参,红根等。为双子叶植物唇形科,干燥根及根茎。具有活血调经,祛瘀止痛,养血安神等作用。临床中常应用于治疗胸痹、真心痛、瘀血等证。丹参酮ⅡA为丹参中主要脂溶性成分。本实验拟探讨丹参酮ⅡA对ApoE-/-小鼠血脂、肝脏脂质沉积的影响及其可能的机制。
本实验选用的ApoE-/-小鼠由美国洛克菲勒大学生化遗传与代谢实验室和北卡罗莱那大学病理遗传实验室应用胚胎干细胞基因敲除(gene knockout)技术于1992年培育成功该种小鼠在饲喂普通饲料时即可产生血脂代谢异常而形成动脉粥样斑块,在饲喂高脂(高脂肪、高胆固醇)饲料时,血脂明显异常,斑块形成明显,病变程度较重。该种小鼠动脉斑块特点与人类动脉斑块极其相似,是研究各类药物对肝脏脂类代谢沉积影响的理想模型[4]。
本研究结果发现,与空白对照组相比,模型组小鼠血清TC、TG、LDL-C水平显著升高;HDL- C水平显著降低,肝脏油红O染色显示有大量脂滴沉积。以上结果表明本研究的动物造模比较成功。对脂类代谢相关基因研究表明,与正常组比较,模型组小鼠肝脏LDL-R、LCAT 基因表达显著下调,提示ApoE-/-AS模型小鼠存在脂类代谢相关基因表达紊乱。
血脂代谢异常造成肝内脂质沉积是造成动脉粥样硬化的主要危险因素之一,脂类沉积和细胞内胆固醇聚集在AS形成过程中始终为主要因素。肝脏的LDL-R在机体脂蛋白代谢过程中发挥至关重要的作用,血浆中胆固醇主要存在于LDL中,而65%~70%的LDL是依赖肝细胞LDL-R清除。肝脏LDL-R还影响LDL生成的速率[5-6]。LCAT催化HDL-C的胆固醇3位羟基接受卵磷脂2位酰基后酯化而生成胆固醇酯,体内绝大部分胆固醇经过这一步骤后才能被转运到肝脏进一步分解代谢[7]。LCAT催化胆固醇酯化后引起广泛的生理效应,主要包括新生HDL向成熟大颗粒 HDL亚类转变、清除LDL和VLDL颗粒中过剩CE、促进细胞膜上的胆固醇转移至HDL等。LCAT结构异常或表达减少导致胆固醇逆向转运受阻,具有拮抗AS作用的HDL-C水平下降,外周组织以及LDL和VLDL中过剩的游离胆固醇水平升高,AS易感性增加[7-8]。
本研究发现,与模型组相比较,丹参酮ⅡA组小鼠血清TC、TG、LDL- C 水平显著下降,HDL-C水平显著升高,肝脏油红O染色显示肝脏内脂滴数量明显减少,表明肝脏内脂质沉积明显减少,提示丹参酮ⅡA具有降低血脂减少肝脏内脂质沉积的作用。同时,与模型组比较,丹参酮ⅡA组小鼠肝脏LDL-R、LCAT 基因表达显著上调,肝脏细胞对游离胆固醇摄取能力主要取决于膜表面LDL-R数量及其活性。结果表明丹参酮ⅡA增强了LDL-R基因的表达,进而使细胞膜LDL-R数目增多,LDL-R活性升高,清除和转移血中胆固醇等脂类能力增强。LCAT表达增多,促进了胆固醇逆向转运以及其在肝脏的清除,从而一定程度上抑制AS发生发展[9]。综上所述,丹参酮ⅡA具有减少ApoE-/-小鼠肝脏内胆固醇等脂类沉积的作用,其机制可能与调控LDL-R和LCAT基因表达相关。
[参考文献]
[1] 戴学栋,尹苗,潘杰,等.ApoE/LDLR 双基因缺失幼龄小鼠主动脉中动脉粥样硬化相关基因的表达[J].生理学报, 2008,60 (1):43-50.
[2]俞杉,彭佑林,邱江梅,等. 冠心病患者血脂、载脂蛋白AI和B100的变化[J] .遵义医学院学报, 1999,22(1):54-55.
[3]张萌涛,钱亦华,唐安琪.丹参酮ⅡA药理作用的研究进展[J].医学综述, 2010,16(17):2661-2664.
[4]康爱君,田枫,张阔,等.载脂蛋白E基因缺陷(C57BLP6J-ApoE)小鼠血脂及病理组织学观察[J]. 中国比较医学杂志, 2006,16(2):85-88.
[5]韩峰,谢梅林,朱路佳,等.百草降脂灵对动脉粥样硬化兔OX-LDL和LDL-R mRNA表达的影响[J]. 中国新药与临床杂志, 2002,21(7):289-393.
[6]王浩,张泽生,张颖,等.高胆固醇膳食对大鼠和仓鼠肝脏HMG- CoA- R、LDL- R蛋白和基因表达的影响[J].食品研究与开发, 2010,31(10):192-195.
[7]BrousseauM E, Kauffman R D, Herderick E E, et al. LCAT modulates atherogenic plasma lipoproteins and the extent of atherosclerosis only in the presence of normalLDL receptor in transgenic rabbits[J].Arterioscler Thromb Vasc Biol, 2000, 20(2):450-458.
[8]Elina Ikonen. Cellular cholesterol trafficking and compartmentalization[J]. Nat Rev Mol Cell Biol, 2008,9(2):125-138.
[9]潘健源,徐岩.卵磷胆固醇脂酰基转移酶与动脉粥样硬化关系的研究进展[J].安徽医药, 2011,32(5):689-691.
