环境因子及藻体密度对条斑紫菜生长与氮磷去除效率的影响
2014-08-08吴海龙张建恒韦章良何培民
邵 飞, 费 岚, 吴海龙, 张建恒, 胡 明, 韦章良, 何培民,2,*
(1. 上海海洋大学水产与生命学院,上海 201306;2. 上海海洋大学海洋科学研究院,上海 201306)
环境因子及藻体密度对条斑紫菜生长与氮磷去除效率的影响
邵 飞1, 费 岚1, 吴海龙1, 张建恒1, 胡 明1, 韦章良1, 何培民1,2,*
(1. 上海海洋大学水产与生命学院,上海 201306;2. 上海海洋大学海洋科学研究院,上海 201306)

条斑紫菜;生态修复潜力;特定生长率;氮磷吸收率
随着现代工农业的高速发展,海水经济动物养殖产业规模不断扩大,导致近海海域已不同程度地受到污染而趋于富营养化[1- 2]。而大型海藻在生长过程中可去除N、P,同化成自身需要的营养成分,是控制海洋富营养化的有效手段[3]。
紫菜是我国近海大型经济海藻重要养殖种类,也是世界上最有价值的人工养殖海藻,干重价格约为18000美元/t,每年的市场价值超过13亿美元[4]。条斑紫菜的形态学特征,使其成为一个高效的生物修复和改善海洋环境的理想品种,其藻体组织很薄,只有一层细胞,藻体厚度仅35—50 μm,由于表面积和体积比很大,并且每个细胞都参与各种营养盐的吸收,因此,条斑紫菜的生长速率大,比其他大型海藻高63%—170%,营养盐去除效率高[5- 8]。且紫菜营养价值很高,蛋白质含量高达40%,富含矿物质(如铁)、维生素(B族和C)等,并含有人体主要来源的牛磺酸,可控制人体血液中的胆固醇[9- 10]。因此,条斑紫菜不但具有很好的经济效益和社会效益,还具有良好的环境效益,是实现生物修复改善海洋环境的理想品种。
目前,国内对江蓠属、石莼属和海带属的生态修复潜力的研究较成熟并且很多[11- 13],相比之下,有关紫菜属(特别是条斑紫菜)生态修复潜力的系统研究较少[6,14]。因此,本文特以条斑紫菜为材料,系统探究实验室条件下光照强度、温度、光周期、盐度和干出等生态因子和藻体密度对条斑紫菜生长和氮磷去除的影响,为今后条斑紫菜大规模栽培的生态修复潜力研究及海洋富营养化治理奠定理论基础。
1 材料与方法
1.1 实验材料
实验用条斑紫菜(Porphyrayezoensis)小苗来自上海海洋大学藻类学实验室,由条斑紫菜丝状体在适宜的条件下释放出的壳孢子,经附着,萌发,生长成小苗。丝状体由2008年5月采自江苏省南通大丰条斑紫菜养殖区成熟藻体。
1.2 藻体预培养
条斑紫菜小苗进行大量培养,培养容器为1L特制充气瓶,培养液为自然海水加富VSE[15],pH值8.0,光照强度30—40 μmol m-2s-1,温度(15±2) ℃,盐度(25±0.2),光照周期12L∶12D(light∶dark),实验用条斑紫菜叶片长度为3—5 cm。
1.3 藻体密度和光照强度实验设计

1.4 温度和光周期实验设计
通过藻体密度和光照强度实验得出的最佳藻体密度和光照强度组合用于温度和光周期实验。实验温度设置5、10、15、20、25 ℃共5个梯度,光周期(light∶dark)设置为8L∶16D、12L∶12D、16L∶8D共3个梯度,共15个组合,每组设置3个平行,其余条件同预培养。实验步骤和方法同1.3。
1.5 盐度和干出实验设计
通过藻体密度和光照强度、温度和光周期实验得出的最佳藻体密度、光照强度、温度、光周期用于盐度和光周期实验。实验盐度设置15、20、25、30、35共5个梯度,干出实验设置为在光照培养箱中:①每天干出1 h,②每天干出2 h,③每天干出4h,④不干出,共20个组合,每组3个重复,实验步骤和方法同1.3。
1.6 条斑紫菜特定生长率测定方法
实验开始与结束时,小心取出条斑紫菜,用吸水纸吸去藻体表面多余水份,于10-4g电子天平上称量鲜重,按公式计算条斑紫菜的特定生长率SGR[16](%):
SGR(%/d)=(lnS2-lnS1)/(T2-T1)×100%
式中,S1为条斑紫菜初始鲜重(g),S2为实验进行至第T2天时的条斑紫菜鲜重(g),T1为实验开始时间。
1.7 氮磷浓度测定方法
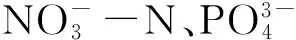
1.8 叶绿素荧光参数测定
用浮游植物调制荧光仪PHYTO-PAM和带数据获得软件(PhytoWin)的计算机连体测定[18]。
1.9 数据处理
实验数据用Spss18.0进行方差分析(ANOVA)及Duncan多重比较进行处理,以P<0.05作为差异显著水平,所得数据均以平均值±标准差表示。
2 结果及分析
2.1 藻体密度和光照强度对紫菜生长及去除氮磷的影响
2.1.1 对紫菜生长的影响
图1为不同藻体密度条斑紫菜在不同光照强度的特定生长率,可见藻体密度与光照强度对条斑紫菜生长均有重要影响。实验结果显示条斑紫菜生长率为12.6%—38.1%之间,相同藻体密度条件下,藻体平均特定生长率随光照强度提高而逐渐增大,而相同光照强度下,藻体密度与藻体日生长率成反比。其中,当藻体密度为0.1 g/L、光照强度120 μmol m-2s-1时,藻体平均日生长率最大为38.1%,当藻体密度1.60 g/L、光照强度30 μmol m-2s-1,藻体平均日生长率最小为12.6%。且藻体密度与光照强度交互作用对条斑紫菜生长具有极显著影响(P<0.01)。
条斑紫菜不同藻体密度在不同光照强度条件下的周增重量(图1),可见相同藻体密度条件下,藻体周增重量随光照强度提高而增大,相同光照强度条件下,藻体周增重量与藻体密度之间成正比关系。其中,藻体密度为1.60 g/L、光照强度120 μmol m-2s-1时,藻体平均周增重量最大为0.68 g,增重率为171.4%;藻体密度0.1 g/L、光照强度为30 μmol m-2s-1时,藻体周增重量最小为0.089 g,但增重率最大为357.6%。
2.1.2 对条斑紫菜去除氮磷的影响

图1 不同藻体密度和光照强度对条斑紫菜生长和氮磷去除效率的影响Fig.1 Effect of light intensity and algae density on growth and nutrient uptake of Porphyra yezoensis
2.2 温度和光周期交互作用对紫菜生长及去除氮磷的影响
2.2.1 对条斑紫菜生长的影响
温度和光周期对条斑紫菜生长的影响(图2),结果表明,实验室条件下,条斑紫菜生长的最适宜温度15 ℃、光周期16L∶8D,此时藻体的特定生长率最大,为36.9%。温度25 ℃、光周期16L∶8D紫菜的特定生长率最小,为7.5%。条斑紫菜对高温耐受性比低温差。
2.2.2 对条斑紫菜去除氮磷的影响

图2 不同温度和光周期对条斑紫菜生长和氮磷去除效率的影响Fig.2 Effect of temperature and photoperiod on growth and nutrient uptake of Porphyra yezoensis
2.3 盐度和干出对紫菜生长及去除氮磷的影响
2.3.1 对条斑紫菜紫菜生长的影响
盐度和干出时间影响对条斑紫菜特定生长率(图2)。结果表明,盐度、干出以及两者的交互作用对条斑紫菜均有极显著影响(P<0.01)。实验盐度(10—35)和干出(0—4 h)条件下,条斑紫菜均能生长。同一盐度下,干出时间越长紫菜的特定生长率越小。盐度25、不干出条件下,条斑紫菜的特定生长率最大,为37.9%。盐度10、每天干出4 h,藻体特定生长率最小,仅为5.2%。

图3 不同盐度和干出时间对条斑紫菜生长和氮磷去除效率的影响Fig.3 Effect of salinity and desiccation time on growth and nutrient uptake of Porphyra yezoensis
2.3.2 对条斑紫菜去除氮磷的影响
不同干出时间处理影响条斑紫菜藻体经过复水后的最大光化学效率(Fv/Fm)(图3)。经过干出处理的条斑紫菜复水10min测定叶绿素荧光参数,干出组的最大光化学效率(Fv/Fm)相对于未干出组均显著下降(P<0.05),且干出时间越长(Fv/Fm)的值越小。干出组复水24 h后最大光化学效率(Fv/Fm)均恢复到比为未干出组大。可见,干出可以提高紫菜的活力。
3 讨论
大型海藻的特定生长率越大,也就意味着其去除营养物质的速率越大,生态修复潜能也越大[14]。Carmona等[6]曾研究表明条斑紫菜(P.yezoensis)第1周生长率最大为18%(SGR),1周后藻体成熟,组织慢慢解体,4周内平均SGR为10.1%。而本实验中,藻体两周平均生长率为38.1%(SGR),其最大生长率和平均生长率均高于前者,可能与选用藻体有关,前者使用藻体长度为10 cm的成熟藻体,试验周期为4周,而本实验使用的藻体为3—5 cm左右的小苗,实验周期为2周,且已有相关研究表明成熟组织藻体生长率和氮磷去除效率远低于小苗[19]。Pereira等[20]报道紫菜(P.dioica)在光照强度250 μmol m-2s-1藻体密度为0.1 g/L时,3周平均生长率为33.6%(SGR);Kim等[21]研究紫菜(P.linearis)在2周平均生长率为16%(SGR)。本实验也显示条斑紫菜的生长率比其它可用于海洋生态修复的大型海藻要高很多,如Zhou等[22]等报道的胶州湾鱼类养殖区栽培龙须菜(G.lemaneiformis)30 d内的生长率只有11.03%(SGR),Troell等[23]研究证明在距鲑鱼网箱10 m处养殖的江蓠(G.chilensis)只为7%(SGR)等。

藻体组织氮磷的含量是大型海藻生态修复潜力的另一重要标准[24]。藻体组织氮磷的含量高低可反映该藻体在人工采收后运回到陆地的直接去除氮磷能力。目前,国内外学者对大型海藻石莼属和江蓠属的生态修复潜力的研究较为透彻,证明石莼属和江蓠属具有良好的生态修复潜力,并且已经成功的应用于中、大规模混合养殖系统[11- 13]。其中,石莼属多数呈扁平状或圆管型,具有很高的生长率,藻体组织氮一般含量为3.06%—5.07%[11,25],则收获100 t海藻氮的直接去除量为3.06 t—5.07 t;江蓠属形态呈圆管型,生长率普遍为10%左右,藻体组织氮含量4.18%—4.59%[26],收获100 t海藻氮的直接去除为4.18—4.59 t。曾测得条斑紫菜组织氮含量4.85%—7.65%[9],表明每收获100吨条斑紫菜氮的直接去除量高达4.85—7.65 t。可见,条斑紫菜组织氮含量及直接去除率远高于其它大型海藻。Neori[24]曾总结出圆管型海藻(如江蓠)吸收氮磷能力要低于扁平状大型海藻(如石莼和海带),而扁平状大型海藻(如石莼)吸收氮磷能力又低于单层细胞藻体(如紫菜)。可见,紫菜的去除氮磷能力均高于其它海藻。
根据本实验所得理论上的氮磷去除效率可以推测其应用于海洋经济动物养殖海区氮磷去除效果。相关研究表明,根据现有养殖饲料的组分、鱼类的消化能力和饲料的转化效率,每年养殖1t海鱼平均向海洋中排放9.5 kg的P和78 kg的N[27],即养殖的海鱼每天向海洋中排放N和P分别为214 g和26 g。本文藻体密度0.8 g/L-1、光照强度90 μmol m-2s-1时,条斑紫菜N、P日均去除量分别为1.70 mg/d、0.22 mg/d,假设在体积为1 m3,表面积为1 m2的养殖网箱中,那么1 m3的体积的网箱需要800 g紫菜,每天去除1.7 g的N和0.22 g的P。可知,养殖1t海鱼每天向海水中排放的氮磷理论上需要126 m2面积的紫菜,所需紫菜101 kg来净化去除。
环境因子对条斑紫菜生长、氮磷去除率均有重要影响。本实验中可得出条斑紫菜的适宜生长范围为10—15 ℃,在此温度范围内藻体生长率和氮磷去除效率处于较高水平。其中15 ℃为最适温度,这与条斑紫菜海区生长温度相吻合。从江苏省南部海区条斑紫菜实际养殖情况来看[28],每年10月底条斑紫菜壳孢子采苗下海到肉眼见苗约需12—20 d,这段时间海区温度为23—18 ℃,11月上旬水温降至15 ℃左右,小苗进入快速生长期,在此阶段藻体生长速率快,产量高。1—2月份,低温期水温下降到3—5 ℃,条斑紫菜生长缓慢,采收间隔长,产量相对较低。当3—4月份水温回暖,藻体进入生长的最盛期。本实验高温组20—25 ℃藻体经过2周的培养藻体边缘逐渐解体,色素丢失,缺乏光泽,此时藻体生长率和营养盐去除率处于较低水平。光周期对条斑紫菜生长和氮磷吸收的影响实质是藻体日接收光照量对条斑紫菜生长和氮磷吸收的影响,因此光周期和光照强度对紫菜生长和氮磷去除率的影响相似。条斑紫菜属广盐性种类,从河口的低盐度海区到高盐度海区都有条斑紫菜的自然分布,退潮后,干出的的紫菜经过7—8h的日晒雨淋仍能健康地生长,都说明条斑紫菜对海水的盐度有很强的适应性。本实验中条斑紫菜能够在10 这样的低盐度条件下存活,并且特定生长率能够达到8.16%;盐度为25—30时条斑紫菜特定生长率和N、P去除率均处于较高的水平;其中盐度25是条斑紫菜生长的最适宜盐度;干出时间越长,生长率和氮、磷去除效率越差,未干出组的生长率和氮磷去除效率最高。自然条件下,随着潮水的涨落,海区每天一般有两次干出,每次干出的时间在高潮区可长达7—8 h,而且小潮的时候藻体会受到高光照强度的直射,藻体内部水分被消耗殆尽,然而到涨潮叶状体仍然能够正常生活[28]。这也充分说明了耐干是条斑紫菜的一大特性。条斑紫菜干出具有非常重要的意义,一方面能够清除和抑制不耐干旱的杂藻和附着的病菌,提高藻体的活力。另一方面在干出的过程中能够淘汰病弱藻体,提高藻体抗氧化能力,使生活能力强的藻体旺盛生长[29]。但是,从本实验藻体生长情况看,未干出组的藻体都比干出组的藻体生长率大。
本实验结果显示,条斑紫菜生长速率快,氮磷去除效率高,生态修复潜力高。但选用条斑紫菜进行生态修复也面临着一些困难:(1)生活史不能满足全年的种植;(2)高温条件下藻体容易患病、同时成熟较快并解体。
[1] De Jong V N, Elliott M, Orive E. Causes, historical development, effects and future challenges of a common environmental problem: eutrophication. Hydrobiologia, 2002, 47- 476(1): 1- 19.
[2] Xu S N, He P M. Analysis of phenomena for frequent occurrences of red tides and bioremediation by seaweed cultivation. Journal of Fisheries of China, 2006, 30(4): 554- 561.
[3] Yang Y F, Fei X G. Prospects for bioremediation of cultivation of Large-Sized seaweed in eutrophic mariculture areas. Journal of Ocean University of Qingdao, 2003, 33(1): 53- 57.
[4] Nicolas A B, Juliet A B, ArthuC G, XU P, Susan H B.Porphyra: a marine crop shaped by stress. Cell, 2011, 16(1): 29- 37.
[5] Kraemer G P, Carmona P R, Chopin T, Neefus C, Tang X R, Yarish C. Evaluation of the bioremediatory potential of several species of the red algaPorphyrausing short-term measurements of nitrogen uptake as a rapid bioassay. Journal of Applied Phycology, 2004, 16(6): 489- 497.
[6] Carmona R, Kraemer G P, Yarish C. Exploring Northeast American and Asian species ofPorphyrafor use in an integrated finfish-algal aquaculture system. Aquaculture, 2006, 252(1): 54- 65.
[7] Kraemer G P, Yarish C. A preliminary comparison of the mariculture potential ofPorphyrapurpureaandPorphyraumbilicalis. Journal of Applied Phycology, 1999, 11(5): 473- 477.
[8] He P M, Xu S N, Zhang H Y,etal. Bioremediation efficiency in the removal of dissolved inorganic nutrients by the red seaweed,Porphyrayezoensis, cultivated in the open sea. Water Research, 2008, 42(4/5): 1281- 1289.
[9] MacArtain P, Gill C I, Brooks M, Campbell R, Rowland I R. Nutritional value of edible seaweeds. Nutrition Reviews 2007, 65(12Pt1): 535- 543.
[10] Smith J L. Summers G, Wong R. Nutrient and heavy metal content of edible seaweeds in New Zealand. New Zealand Journal of Crop and Horticultural Science, 2010, 38(1): 19- 28.
[11] Hernández I, Pérez-Pastor A, Vergara J J, Martínez-Aragón J F, Fernández-Engo M A, Pérez-Lloréns J L. Studies on the biofiltration capacity ofGracilariopsislongissima: from microscale to macroscale. Aquaculture, 2006, 252(1): 43- 53.
[12] Yang Y F, Fei X G, Song J M, Hu H Y, Wang G C, Chung I K. Growth ofGracilarialemaneifor misunder different cultivation conditions and its effects on nutrient removal in Chinese coastal waters. Aquaculture, 2006, 254(1): 248- 255.
[13] Chopin T, Bastarache S, Belyea E, Haya K, Sephton D, Martin J L, Eddy S, Stewart I. Development of the cultivation ofLaminariasaccharinaas the extractive inorganic component of an integrated aquaculture system and monitoring of therapeutants and phycotoxins. Journal of Phycology, 2003, 39(S1): 10- 10.
[14] Chopin T, Yarish C, Wilkes R, Belyea E, Lu S, Mathieson A. DevelopingPorphyra/salmon integrated aquaculture for bioremediation and diversification of the aquaculture industry. Journal of Applied Phycology, 1999, 11(5): 463- 472.
[15] Ott F D. Synthetic media and techniques for the xenic cultivation of marine algae and flagellate. Virginia Journal of Science, 1965, 16: 205- 218.
[16] DeBoer J A, Guigli H J, Israel T L, D′Elia C F. Nutritional studies of two red algae. I. Growth rate as a function of nitrogen source and concentration. Journal of Phycology, 1978, 14(3): 261- 266.
[17] General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China. GB17378. 4—2007. The specification for marine monitoring—Seawater analysis. Beijing: Standards Press of China.
[18] Gera A, Alcoverro T, Mascaró O, Pérez M, Romero J. Exploring the utility ofPosidoniaoceanicachlorophyll fluorescence as an indicator of water quality within the European Water Framework Directive. Environmental Monitoring and Assessment, 2012, 184(6): 3675- 3686.
[19] Harrison P J, Hurd C L. Nutrient physiology of seaweeds: application of concepts to aquaculture. Cahiers de Biologie Marine, 2001, 42(1/2): 71- 82.
[20] Pereira R, Yarish C, Sousa-Pinto I. The influence of stocking density, light and temperature on the growth, production and nutrient removal capacity ofPorphyradioica(Bangiales, Rhodophyta). Aquaculture, 2006, 252(1): 66- 78.
[21] Kim J K, Kraemer G P, Neefus C D, Chung I K, Yarish C. Effects of temperature and ammonium on growth, pigment production and nitrogen uptake by four species ofPorhyra(Bangiales, Rhodophyta) native to the New England coast. Journal of Applied Phycology, 2007, 19(5): 431- 440.
[22] Zhou Y, Yang H S, Hu H Y, Liu Y, Mao Y Z, Zhou H, Xu X L, Zhang F S. Bioremediation potential of the macroalgaGracilarialemaneiformis(Rhodophyta) integrated into fed fish culture in coastal waters of north China. Aquaculture, 2006, 252(2/4): 264- 76.
[23] Troell M, Halling C, Nilsson A, Buschmann A H, Kautsky N, Kautsky L. Integrated marine cultivation ofGracilariachilensis(Gracilariales, Rhodophyta) and salmon cages for reduced environmental impact and increased economic out put. Aquaculture, 1997, 156(1): 45- 61.
[24] Neori A, Chopin T, Troell M, Buschmann A H, Kraemer G P, Halling C, Shpigel M, Yarish C. Integrated aquaculture: Rationale, evolution and state of the art emphasizing seaweed biofiltration in modern aquaculture. Aquaculture, 2004, 231(1/4): 361- 391.
[25] Liu J W, Dong S L. Comparative studies on utilizing nitrogen capacity between two macroalgaeGracilariatenuistipitatavar.liui(Rhodophyta) andUlvapertusa(Chlorophyta). I. Nitrogen storage under nitrogen enrichment and starvation. Journal of Environmental Sciences, 2001, 13(3): 318- 322.
[26] Nagler P L, Glenn E P, Nelson S. G, Napolean S. Effects of fertilization treatment and stocking density on the growth and production of the economic seaweedGracilariaparvispora(Rhodophyta) in cage culture at Molokai, Hawaii. Aquaculture, 2003, 219: 379- 391.
[27] Ackefors H, Enell M. The release of nutrients and organic matter from aquaculture systems in Nordic countries. Journal of Applied Ichthyology, 1994, 10(4): 225- 241.
[28] Ma J H, Cai S Q. Cultivation and Processing ofPorphyrayezoensis. Beijing: Science Press, 1996: 44- 51.
[29] Loretto C P, Daniela T, Flores V, Correa J A. Tolerance to oxidative stress induced by desiccation inPorphyracolumbina(Bangiales, Rhodophyta). Journal of Experimental Botany, 2011, 62(6): 1815- 1829.
参考文献:
[2] 徐姗楠, 何培民. 我国赤潮频发现象分析与海藻栽培生物修复作用. 水产学报, 2006, 30(4): 554- 561.
[3] 杨宇峰, 费修绠. 大型海藻对富营养化海水养殖区生物修复的研究与展望. 青岛海洋大学学报: 自然科学版, 2003, 33(1): 53- 57.
[17] 国家质量监督检验检疫总局. GB17378. 4- 2007海洋监测规范- 海水分析. 北京: 中国标准出版社.
[28] 马家海, 蔡守青. 条斑紫菜的栽培与加工. 北京: 科学出版社, 1996: 44- 51.
Effect of environmental factors and algae density on the growth and nutrient uptake inPorphyrayezoensis
SHAO Fei1, FEI Lan1, WU Hailong1, ZHANG Jianheng1, HU Ming1, WEI Zhangliang1, HE Peimin1,2,*
1CollegeofFisheriesandLifeScience,ShangHaiOceanUniversity,Shanghai201306,China2InstitutesofMarineSciences,ShangHaiOceanUniversity,Shanghai201306,China

国家科技支撑计划项目(2012BACD7B03)
2013- 10- 08; 网络出版日期:2014- 03- 13
10.5846/stxb201310082414
*通讯作者Corresponding author.E-mail: pmhe@shou.edu.cn
邵飞, 费岚, 吴海龙, 张建恒, 胡明, 韦章良, 何培民.环境因子及藻体密度对条斑紫菜生长与氮磷去除效率的影响.生态学报,2014,34(21):6164- 6171.
Shao F, Fei L, Wu H L, Zhang J H, Hu M, Wei Z L, He P M.Effect of environmental factors and algae density on the growth and nutrient uptake inPorphyrayezoensis.Acta Ecologica Sinica,2014,34(21):6164- 6171.
