初始pH值对碱性和酸性水稻土微生物铁还原过程的影响
2014-08-08吴超,曲东,刘浩
吴 超,曲 东,刘 浩
(西北农林科技大学 资源环境学院, 杨凌 712100)
初始pH值对碱性和酸性水稻土微生物铁还原过程的影响
吴 超,曲 东*,刘 浩
(西北农林科技大学 资源环境学院, 杨凌 712100)
酸碱度(pH值)是水稻土铁还原过程的重要影响因素之一。通过模拟水稻土淹水厌氧培养,以Al2(SO4)3和Na2CO3溶液分别调节碱性和酸性水稻土pH值至强酸性(pH值<5.0)、酸性(pH值5.0—6.5)、中性(pH值6.5—7.5)、碱性(pH值7.5—8.5)、强碱性(pH值>8.5),以此来研究5种初始pH值对水稻土泥浆铁还原过程的影响;通过微生物群落厌氧培养研究了2种水稻土菌悬液在6种pH值条件下的铁还原能力差异。结果表明,碱性水稻土铁还原潜势(a)、最大铁还原速率(Vmax)随初始pH值的降低而下降,而达到最大铁还原速率所需的时间(TVmax)则延长。提高酸性水稻土初始pH值使铁还原Vmax增加而TVmax缩短,但土壤中无定形氧化铁均能还原,初始pH值与Vmax具有显著正相关关系。碱性和酸性水稻土的土壤菌悬液在试验pH值范围内厌氧培养,其铁还原能力在培养初期差异不显著,但培养后期的差异明显,且最终都能把培养液中氧化铁完全还原。随着初始pH值升高TVmax延长,Vmax则降低,且均显著负相关,但碱性水稻土微生物群落的Vmax在pH值6.00时最大。初始pH值和土壤类型对水稻土铁还原过程具有显著影响,且对土壤菌悬液微生物群的铁还原具有一定影响。
初始pH值;水稻土;异化铁还原;泥浆和土壤菌悬液厌氧培养
异化铁还原是指微生物将外部的Fe(Ⅲ)作为电子受体,将Fe(Ⅲ)还原成Fe(Ⅱ)的过程,该过程自然地发生在土壤、水体沉积物和地下环境,是极其重要的地球化学过程之一[1]。异化铁还原过程被证实不仅对铁循环产生重要的影响,而且还和水稻土中氮磷等养料的分布、有机物的分解转化以及重金属的迁移转化有着紧密的联系。pH值是影响异化铁还原的重要因素之一[2],不但会直接影响水稻土中Fe(Ⅲ)溶解度及各氧化还原体系间的化学反应[3],而且还会影响微生物生长和形态,及其代谢过程中的酶活性[4]。此外,土壤pH值也是全球范围内细菌多样性和群落结构的重要决定因子[5]。过往的研究多集中报道中性环境中异化铁还原过程及相关微生物的生长情况,如陈秦等[6]研究表明渤海沉积物中微生物群落在中性条件下Fe(Ⅲ)还原能力最强,pH过低或过高都会降低其Fe(Ⅲ)还原能力。近些年越来越多的研究发现,在过低或过高的pH值环境中都有铁还原微生物的存在[2,7- 12],如AcidiphiliumcryptumJF- 5能够在酸性沉积物中发挥铁还原功能[7];嗜碱性厌氧铁还原菌新种AlkaliphilusAanaerobicsp. nov.的最适pH值为9.4[12]。
然而,现有的研究多限于微生物纯培养,关于泥浆培养和混合培养体系中铁还原过程与pH值关系的报道却相当少见。仅见朱超[13]利用Al2(SO4)3调低四川水稻土pH值与浙江水稻土进行比较测定泥浆中地杆菌和厌氧粘细菌丰度差异。本研究望通过泥浆培养和混合培养体系综合比较不同初始pH对水稻土铁还原过程的影响:模拟水稻土淹水过程,利用Al2(SO4)3调低碱性水稻土pH值及Na2CO3调高酸性水稻土pH值,研究不同初始pH值对水稻土泥浆中铁还原过程的影响;利用混合培养体系研究微生物群落铁还原能力对不同初始pH值的响应。
1 材料与方法
1.1 供试土壤
供试水稻土分别采自吉林省松原市前郭尔罗斯县查干花镇(N 44°34′29″,E 124°05′22″,用JL表示),属于北方水稻土分散区,东北半湿润早熟单季稻作带;江西省宜春市靖安县香田乡黄垅村(N 28°49′43″,E 115°20′59″,用JX表示),属于南方水稻土集中分布地区,华中湿润单/双季稻作区[3,14]。在水稻收割后分别采集稻田0—20 cm的耕层土壤,拣去植物残体,自然风干,磨细,过1 mm土壤筛,存储于塑料容器中备用。供试JL、JX水稻土的基本性质分别如下:土壤pH 10.51、4.84;有机质含量6.42、13.86 g/kg;全氮0.81、2.07 g/kg;全磷0.21、0.35 g/kg;全钾17.84、40.70 g/kg;游离铁2.98、6.48 g/kg;无定形铁0.46、1.94 g/kg。
1.2 水稻土初始pH的调节
配置100 mmol/L的Al2(SO4)3、Na2CO3溶液为标准储备液,将标准储备液逐级稀释,浓度依次为95、90、85、80、75、70、65、60、55、50、45、40、35、30、25、20、15、10、5、4、3、2、1 mmol/L。分别称取5.0000 g JL若干份至12 mL血清瓶中,加入5 mL不同浓度的Al2(SO4)3溶液,涡旋2 min,静置30 min,测定pH值,平行3份。同理,添加Na2CO3溶液至JX中。绘制pH值随Al2(SO4)3与Na2CO3添加量(用Δ表示)的变化趋势,根据趋势线找出达到目的pH值所需的调节剂添加量,记为估算值。泥浆培养试验的目的pH值根据估算值前后波动进行试验测定进一步确定。
1.3 土壤菌悬液制备
分别称取12.0000 g风干过筛(<1 mm)的JL和JX各一份,置于25 mL血清瓶中,添加无菌水12 mL,充N2除O2,用橡胶盖及铝盖密封,于30 ℃恒温避光培养,淹水7 d后进行土壤菌悬液提取。制备菌悬液时,添加无菌水96 mL,无损失地转移到离心管中,于30 ℃下,在FUMA恒温培养摇床QYC- 200中以180 r/min振荡浸提1 h后,于ZONKIA KDC- 40低速离心机中以1000 r/min离心10 min,收集悬浊液为土壤菌悬液。
1.4 厌氧培养试验及分析指标测定方法
泥浆培养试验:称取风干过筛(< 1 mm)的JL 5.0000 g数份至12 mL血清瓶中,根据我国土壤酸碱度的分级标准[3],分别添加不同浓度的Al2(SO4)3溶液 5mL,将水稻土的初始pH依次调节成强酸性(pH值< 5.0,标识“-2”)、酸性(pH值5.0—6.5,标识“-1”)、中性(pH值6.5—7.5,标识“0”)、碱性(pH值7.5—8.5,标识“1”)、强碱性(pH值> 8.5,标识“2”)。设置添加无CO2水为对照。同JL处理设置,使用Na2CO3溶液提高JX初始pH值进行试验。
土壤菌悬液培养试验:于7 mL血清瓶中添加1 mL人工合成的3.551 g/L Fe(OH)3悬浊液为唯一电子受体,1 mL 0.25 mol/L葡萄糖作为唯一碳源,不同的0.1 mol/L的N或0.025 mol/L的P缓冲液各1 mL及1 mL水稻土菌悬液。缓冲体系pH值依次为6.00、7.00、8.00、9.00,且设置两个水稻土的初始pH值4.84(JX)和10.51(JL)为对照。实验pH值4.84—8.00采用磷酸盐缓冲体系,pH值9.00—10.51采用铵盐缓冲体系[15]。
培养体系中物质添加完毕之后,充N2除O2,用橡胶盖及铝盖密封,置于30 ℃恒温箱中避光培养。于培养的第0、1、3、5、7、10、13、16、20、25、30、35、40、50、60 d在同一处理中随机选取样品采样,用邻菲罗啉比色法[16- 18]测定Fe(Ⅱ)浓度,玻璃电极电位法测定pH值。
1.5 数据分析方法
Origin 8.0用于数据统计与绘图。Curve Expert 1.3用于拟合回归分析,铁还原特征用Logistic方程,表达式:
为y=a/(1+be-cx)
式中,y为不同时刻的Fe(Ⅱ)质量分数或浓度;x为反应时间;参数a表征Fe(Ⅲ)还原的最大潜势,即Fe(Ⅱ)最大累积量;c表征反应速率常数;0.25ac表征Fe(Ⅲ)最大还原速率(Vmax);lnb/c表征最大还原速率对应的时间(TVmax)[19]。
选取Vmax作为铁还原过程的特征指标,用SPSS 16.0统计软件进行初始pH值与土壤泥浆或菌悬液对铁还原过程的影响的双因素方差分析,基于欧式距离的距离相关分析,以及初始pH值与铁还原过程的Pearson相关分析。
2 结果与分析
2.1 pH值调节剂用量与水稻土pH值的关系
在试验所选取的pH值调节剂用量范围内,JL的pH值随Al2(SO4)3的添加逐渐降低;JX的pH值随Na2CO3的添加而增加(图1)。由变化趋势及试验再次确定可得,往每克JL干土中添加Al2(SO4)31.7107、3.4214、17.1068、51.3204 mg,JL的pH值可相应变成8.47(JL1)、7.63(JL1′)、6.85(JL0)、6.10(JL- 1)。每克JX干土添加Na2CO31.0599,3.1797,6.3593,9.5390 mg时,其pH值依次成5.90(JX- 1)、7.27(JX0)、8.19(JX1)、9.17(JX2)。
2.2 调节淹水初始pH值对水稻土铁还原过程的影响
降低初始pH值后,JL在培养过程中Fe(Ⅱ)含量及pH值变化如图2所示。培养周期内JL中Fe(Ⅱ)含量随时长增加,最终Fe(Ⅱ)累积量随初始pH值的降低而减少,尤其在酸性条件下,Fe(Ⅱ)含量基本不变,仅为0.47 mg/g土(图2)。初始pH值为强碱性时,JL的pH值随时间先降低20 d后稳定于9左右,其余处理中pH值在培养3—7 d内均有所增加而后降低并稳定在与初始pH值相应的酸碱度级别范围内。pH值变化情况同Ponnamperuma等[20]的研究相一致。由此可见,降低JL的初始pH值不利于其铁还原过程的发生。

图1 供试水稻土pH值与pH值调节剂添加量的关系Fig.1 Relationship between tested paddy soil pH value and addictive amount of pH value regulatorsJL: 吉林;JX:江西
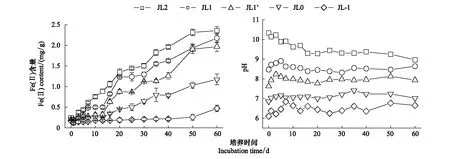
图2 降低初始pH值培养60天JL中Fe(Ⅱ)含量及pH值的变化Fig.2 Change of Fe(Ⅱ) content and pH value decreasing pH value in JL incubated for 60 d
在淹水培养周期内,JX各处理的Fe(Ⅱ)含量均先上升后稳定,差异在于稳定时间和增加速度(图3)。初始pH值为强酸性时,达到平衡所需时间和增加速度都比其余酸碱度处理落后且差异明显;随着初始pH增加,Fe(Ⅱ)含量增加速度越快且达到最大值所需时间越短,但是彼此差异不大。在培养周期内,各个处理的pH值随时间变化趋势如图3所示。培养过程中各处理的pH值均趋向于中性,这同Ponnamperuma等[20]的研究相一致。综上所述,JX的铁还原过程在提高水稻土初始pH值后更活跃。
采用Logistic方程对两个土样调节初始pH后还原Fe(Ⅲ)的情况进行拟合(表1)发现,除JL- 1处理以外,Fe(Ⅱ)累积量与培养时间的相关系数均达0.95以上,由此说明不同初始pH值条件下,水稻土泥浆中Fe(Ⅲ)还原过程随时间的变化曲线与Logistic模型的契合度较高。
由表1可知,JL逐一降低初始pH值后,铁还原潜势(a)、最大铁还原速率(Vmax)随初始pH值的降低而降低,相应达到最大铁还原速率所需的时间(TVmax)则随之延长。JL在酸性条件下a值仅占水稻土无定形氧化铁含量的56%,而其余pH值条件下a值均大于两种水稻土无定形氧化铁含量,由此可见部分游离铁含量也被还原。JL的Vmax由强碱性时的0.05 mg·g-1·d-1降至中性时的0.02 mg·g-1·d-1,约为原先的一半。依次提高JX初始pH值对其铁还原过程所造成的影响为Vmax增加及TVmax缩短,但a值均在3.24—3.36 mg/g之间,说明水稻土无定形氧化铁均已还原。碱性条件下,Vmax最大,达到(0.46±0.04) mg·g-1·d-1,其TVmax最短((3.6±0.2) d)。在有交互作用的双因素方差分析模型中,在5%的显著性水平下初始pH值(P=0.000)、水稻土类型(P=0.000)以及两者交互作用(P=0.000)对Vmax影响显著。Pearson相关性分析结果显示,初始pH值与Vmax的正相关关系显著(JLr=0.897,P=0.000;JXr=0.903,P=0.000)。JL和JX的夹角余弦相似系数是0.677,说明不同酸碱度条件下两个土样的变化规律相似。由基于欧式距离的不相似矩阵(表2)可知,Vmax在强酸性和酸性时不一致性较低,中性和碱性及强碱性时差异亦较小,但低于中性和大于及等于中性时不一致性较大,酸性时和强碱性时差异最大。因此,在试验pH值范围内,初始pH值的提高能够明显促进水稻土铁还原过程的进行。

图3 提高初始pH值培养60dJX中Fe(Ⅱ)含量及pH值的变化Fig.3 Changes of Fe(Ⅱ) content and pH value by increasing pH value in JX incubated for 60 d
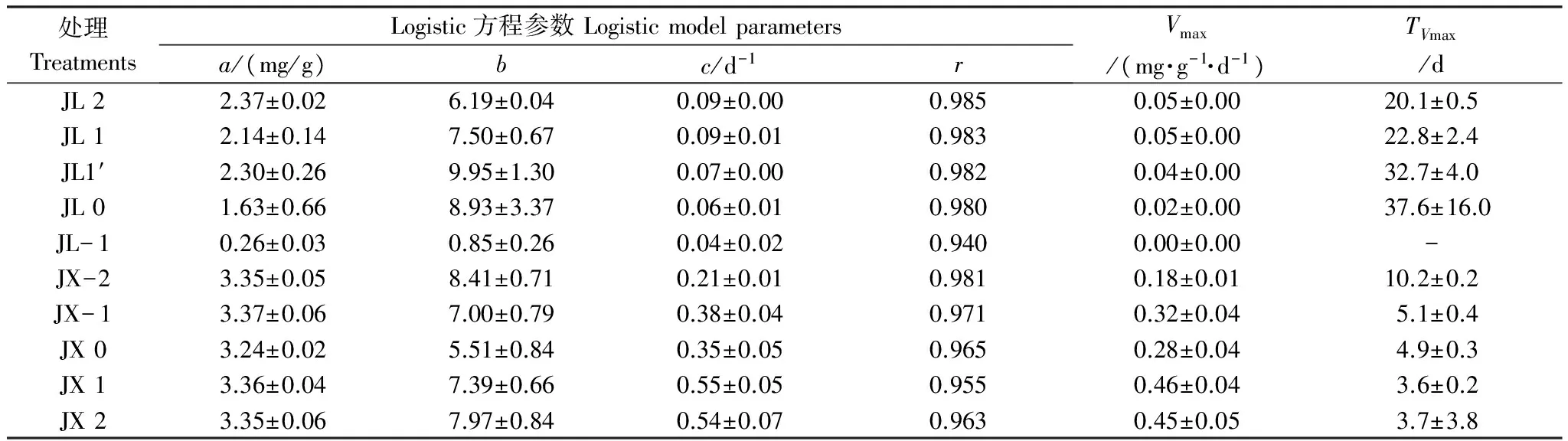
处理TreatmentsLogistic方程参数Logisticmodelparametersa/(mg/g)bc/d-1rVmax/(mg·g-1·d-1)TVmax/dJL22.37±0.026.19±0.040.09±0.000.9850.05±0.0020.1±0.5JL12.14±0.147.50±0.670.09±0.010.9830.05±0.0022.8±2.4JL1′2.30±0.269.95±1.300.07±0.000.9820.04±0.0032.7±4.0JL01.63±0.668.93±3.370.06±0.010.9800.02±0.0037.6±16.0JL-10.26±0.030.85±0.260.04±0.020.9400.00±0.00-JX-23.35±0.058.41±0.710.21±0.010.9810.18±0.0110.2±0.2JX-13.37±0.067.00±0.790.38±0.040.9710.32±0.045.1±0.4JX03.24±0.025.51±0.840.35±0.050.9650.28±0.044.9±0.3JX13.36±0.047.39±0.660.55±0.050.9550.46±0.043.6±0.2JX23.35±0.067.97±0.840.54±0.070.9630.45±0.053.7±3.8
“-”表示无拟合结果;JL: 吉林; JX: 江西

表2 不同酸碱度条件下泥浆铁还原过程Vmax的不相似矩阵
2.3 水稻土微生物群落铁还原能力对不同pH值条件的响应
两种水稻土微生物群落在不同pH值条件下Fe(Ⅱ)累积量及pH值变化情况如图4所示。在培养周期结束时,除JL微生物群落在pH值10.51条件下最终Fe(Ⅱ)浓度为(575.24±10.00) μg/mL,其余处理中的Fe(Ⅱ)浓度均在689—724 μg/mL范围内且铁还原率均达100%左右(图4JL-A,JX-A)。25 d前JL中的Fe(Ⅱ)浓度增加缓慢且各处理趋势基本一致,而后各处理增加幅度出现差异:pH值≤7.00时JL微生物群落还原铁的速度大于pH值>7.00的铁还原速度,相应达到Fe(Ⅱ)浓度最大值所需的时间则pH值≤7.00条件下短。JX微生物群落各pH值不同处理在培养前5 d增加缓慢且增加态势保持基本一致,5 d后各处理之间出现差异。初始pH值4.84和6.00时,培养5 d后Fe(Ⅱ)浓度迅猛增加,并于20 d左右达到极值;初始pH值7.00和8.00的两个处理在16 d前变化趋势保持一致,16 d后pH值7.00的Fe(Ⅱ)浓度增加幅度高于pH值8.00,两个处理于35 d达到极值;pH值9.00和10.51时16 d前增长态势相似,16 d后pH值越高增加越平缓,但同时于60 d达到极值。由此可见来源于供试土壤的两种微生物群落介导的铁还原过程随初始pH值的增加而变缓。

图4 在不同初始pH值体系中培养60天2种水稻土菌悬液铁还原能力及pH值的变化Fig.4 Changes of iron reduction ability of microbial communities and pH value in the two paddy soils during 60 d in different initial pH value systems
Fe(Ⅱ)浓度变化伴随着pH值的变化(图4),各处理pH值均先下降后稳定于4—5。JL各处理趋于稳定的时间约为25 d。JX在pH值为4.84—8.00的稳定时间约为16 d,pH值9.00和10.51时培养体系的pH值30 d前基本稳定,30 d后迅速降低,50 d后稳定。这些时间的转折点与体系中相应的Fe(Ⅱ)浓度增加趋势分歧点基本一致。
由Logistic拟合结果(表3)可知,各处理的a值在686.6—818.1 μg/mL之间,占培养体系中总无定形氧化铁量(710.2 μg/mL)的百分比即铁还原率为96.7%—115.2%,由此可见在不同初始pH值条件下,来自两个水稻土的微生物群落最终都能把体系中的铁还原,区别在于过程中最大铁还原速率及其需要的时间。随着初始pH值升高TVmax延长,在JX培养体系中尤为明显,TVmax从pH值4.84的(7.49±0.03) d延长至pH值10.51的(45.2±0.3) d,增加了近6倍。相反,Vmax则随着初始pH值的升高而降低。在有交互作用的双因素方差分析模型中,在5%的显著性水平下初始pH值(P=0.000)、水稻土微生物群落类型(P=0.000)以及两者交互作用(P=0.000)对Vmax影响极显著。JL微生物群落的Vmax在pH值6时最大,其Vmax与初始pH值呈显著性负相关(r=-0.838,P=0.000)。JX微生物群落在pH值4.84时Vmax最大,且与初始pH值显著负相关(r=-0.913,P=0.000)。JL微生物群落和JX微生物群落的夹角余弦相似系数是0.898,说明两种微生物群落的铁还原能力随初始pH值的变化情况相似。以初始pH值4.84为基础,Vmax的不一致性随pH值梯度增加而升高。pH值4.84与6.00时的Vmax差异较小,且与pH值为7.00—10.51时差异明显较大。pH值8.00和9.00的不一致性最小,pH值4.84和10.51的不一致性最大。因此,在试验初始pH值范围内,初始pH值对水稻土微生物群落铁还原能力存在明显的负面影响。JL微生物群落在初始pH值6.00时铁还原能力最佳,JX微生物群落则在pH值4.84时最佳。
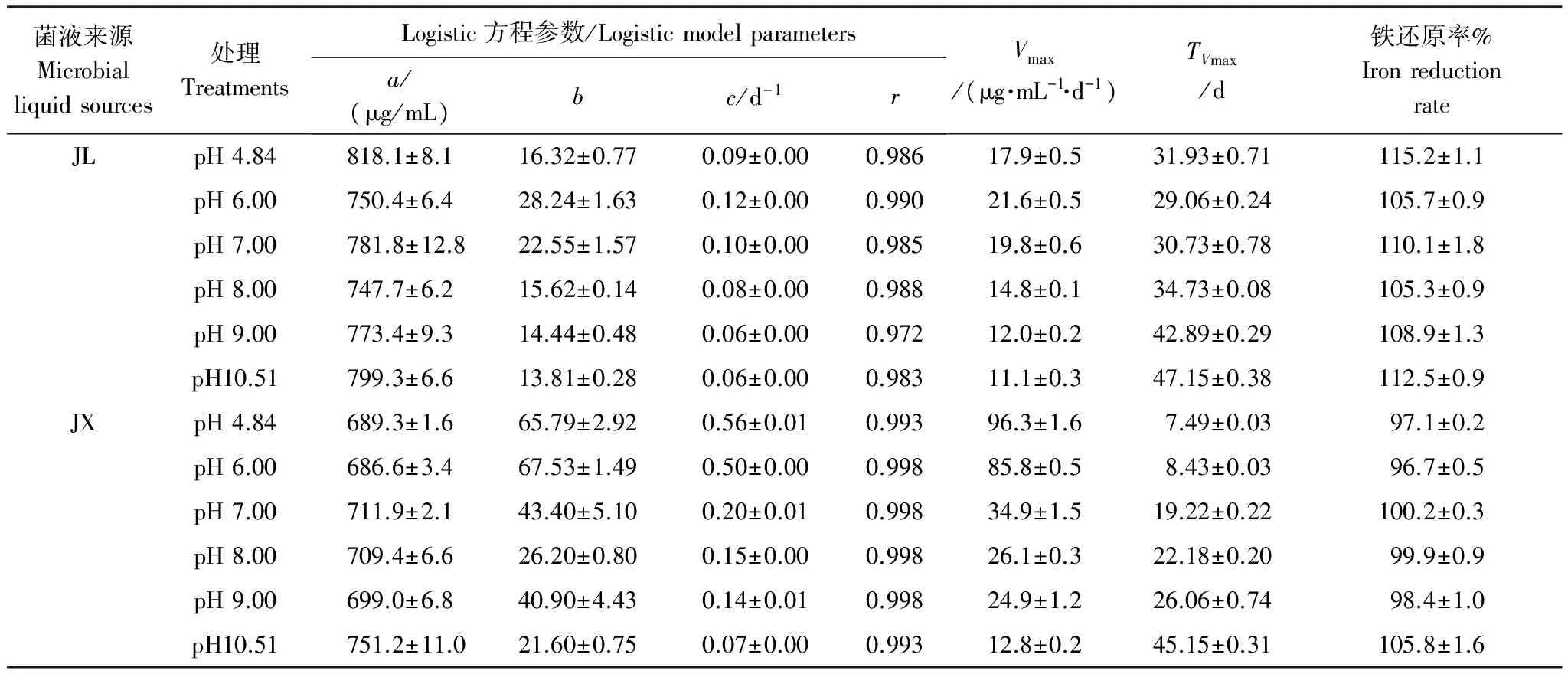
表3 不同初始pH值条件下水稻土微生物群落还原Fe(Ⅲ)过程的动力学拟合结果
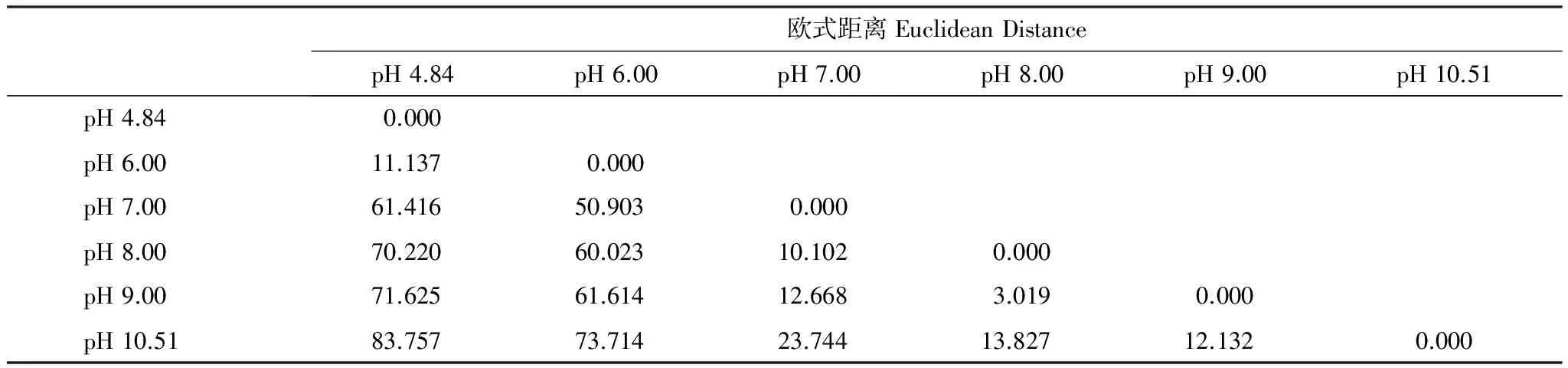
表4 不同pH值条件下微生物群落铁还原Vmax的不相似矩阵
3 讨论
3.1 泥浆培养和混合培养体系中pH值的变化
酸性水稻土渍水后pH值迅速上升,以后逐渐达到平衡;中性水稻土pH值无明显变化;微碱性水稻土pH值反而下降,后期逐渐达到平衡。有机质的嫌气分解是不容忽视的原因[3]。有机质分解产生的大量还原性物质与铁、锰氧化物强烈作用,并消耗溶液中的质子,使土壤pH值升高。而有机质分解产生的有机酸和CO2,则使土壤pH值降低。所以,泥浆淹水过程中pH值存在一定的变化。混合培养体系中各个处理的pH值均由原始pH值降至4—5左右,主要是由葡萄糖发酵产酸所造成的。
3.2 初始pH值对Fe(Ⅲ)还原的影响
本文利用泥浆培养和微生物群落培养两种方法来探讨初始pH值对水稻土微生物铁还原过程的影响,结果发现,高初始pH值能够促进水稻土铁还原过程的进行,与Bloethe等[21]利用湖泊沉积物研究结果一致;水稻土微生物群落的铁还原能力则受到高初始pH值的抑制。水稻土是一个复杂的载体,除包含微生物群落以外,还包含了土壤组成部分,如生物学、矿物学表面化学等方面的性质,这些性质同样会受到pH值的影响,因此两种方法得到的结果存在偏差也不无可能。两种方法得到的结果虽然存在一定出入,但也不乏相似之处,即酸性条件及以下和中性条件及以上差异明显,说明初始pH值对水稻土铁还原过程的影响程度以中性条件为界。原因在于中性环境中的Fe(Ⅲ)还原菌数目远大于酸性环境中的[1],这也解释了水稻土铁还原过程在低初始pH条件下受到抑制的原因。
pH值会影响Fe(Ⅲ)的存在形态,在酸性条件下可存在大量可溶性的Fe(Ⅲ)。可溶性Fe(Ⅲ)/Fe(Ⅱ)的氧化还原电位(+0.77 V)与O2/H2O的氧化还原电位相近(+0.82 V),增加了微生物利用Fe(Ⅲ)进行呼吸获能的优势,而且相对于不溶性的Fe(Ⅲ)氧化物来说,可溶性的Fe(Ⅲ)易被异化还原[22]。两种微生物群落在低初始pH值条件下铁还原能力较强的原因之一就在于此,因混合培养体系摒弃了土体复杂环境组分,氢氧化铁-初始pH值-微生物群落三者的相互作用更直接明了。JL和JX的铁还原强度的差异一定程度上也是由pH值对Fe(Ⅲ)存在形态的影响所造成的,JX属潴育水稻土,以1∶1型粘土矿物和铁、铝氧化物(水铁矿、针铁矿、三水铝矿等)为主,能够较好的微生物所利用。
异化铁还原过程是一个由微生物介导的生物化学过程,微生物在铁还原过程中扮演重要角色。微生物长期生长在某种特定环境中会逐步适应,最终获得较高的耐受力和代谢活性,当外界环境发生变化时会出现不适应性。因此JL调低初始pH值后水稻土铁还原过程受抑制及JX微生物群落的铁还原能力在初始pH值4.84时能够较好发挥原因可能就在于此。魏素珍[23]的研究显示污泥经碱处理后可以释放大量有机质,在碱性条件下可以消耗以蛋白质为主的有机物获得相对较高的产氢量,微生物群落中以Clostridium为主。泥浆与污泥存在一定的相似性,据此推测泥浆经碱处理之后存在产氢量增加的可能,H2可被一些异化Fe(Ⅲ)还原的古生菌利用[24- 25],从而促进JX铁还原过程。
水稻土的微生物群落随淹水时间不断演替生物群落随淹水时间不[26- 27],铁还原过程受初始pH值的影响一定程度上也反应了微生物群落的变化。Rousk等[28]研究表明,当环境pH值从4.0升高到8.3时,相应的细菌拷贝数也随之增加了约3倍,且细菌群落多样性也增加了一倍。细菌群落生长和pH值正相关,并且这种现象不会因土壤类型不同而变化[29]。朱超[13]的研究表明过度调低初始pH值会显著降低水稻土泥浆的总细菌拷贝数,且会持续抑制地杆菌和厌氧粘细菌的生长及其群落规模。此外,土壤中的主要细菌群落包括变形菌、拟杆菌、放线菌等的生长都与pH值正相关,且这些种群常是高pH值土壤的土著优势菌。虽然土壤中酸杆菌通常认为与pH值负相关[30- 32],但实际上酸杆菌的很多亚类同pH正相关[31]。因此,初始pH值对水稻土铁还原过程的促进作用于参与其中的铁还原微生物密切相关。确切的微生物群落及典型兼性铁还原菌(梭菌和芽孢杆菌)群落及丰度信息正在试验获取中。
微生物群落的铁还原能力并非培养一开始便出现差异,而是基本在初始pH值降至4—5之后出现差异。易维洁[33]的研究显示,Clostridiumspp.在葡萄糖富集下占到可分离菌株的45%。Clostridium作为糖分解发酵菌能在厌氧条件下对Fe2O3进行还原性溶解。因此,推断培养前期兼性铁还原菌占据主导地位,待葡萄糖发酵完毕之后,兼性铁还原菌则联合专性铁还原菌共同发挥铁还原功能。
4 结论
初始pH值和土壤类型对水稻土铁还原过程影响显著。在试验所选取的pH值范围内,初始pH值与水稻土铁还原过程呈显著正相关,与水稻土微生物群落的铁还原能力均有显著性负相关关系,但JL微生物群落在初始pH值为6.00时最佳。由此可见,初始pH的改变对铁还原过程的影响是对微生物群落和水稻土土壤组分共同影响的结果。
混合培养前期,初始pH对微生物群落铁还原能力影响不显著,待pH降至4—5之后铁还原能力出现差异。这一现象为兼性铁还原细菌在铁还原过程中占据不可忽视的地位提供了新的依据。
[1] Lovley D R. Dissimilatory Fe(Ⅲ)-and Mn(IV)-Reducing prokaryotes // Falkow S, Rosenberg E, Schleifer K, Stackebrandt E, eds. The Prokaryotes. New York: Springer-Verlag, 2000: 635- 658.
[2] Lovley D R, Holmes D E, Nevin K P. Dissimilatory Fe(Ⅲ) and Mn(IV) reduction. Advances in Microbial Physiology, 2004, 49: 219- 286.
[3] Li Q K. The Chiese paddy soils. Beijing:Science Press,1992.
[4] Shen P,Chen X D. Microbiology. Beijing:Higher Education Press,2009.
[5] Xiong J B, Liu Y Q, Lin X G, Zhang H Y, Zeng J, Hou J Z, Yang Y P, Yao T D, Knight R, Chu H Y. Geographic distance and pH drive bacterial distribution in alkaline lake sediments across Tibetan Plateau. Environmental Microbiology, 2012, 14(9): 2457- 2466.
[6] Chen Q,Zhao J J,Qu D,Zhu Chao. The capability and influencing factors of microbial iron reduction in marine sediments from Bohai Bay, China. Chinese Journal of Agro-environment Science,2011,30(6):1172- 1179.
[7] Kusel K, Dorsch T, Acker G, Stackebrandt E. Microbial reduction of Fe(Ⅲ) in acidic sediments: Isolation ofAcidiphiliumcryptumJF- 5 capable of coupling the reduction of Fe(Ⅲ) to the oxidation of glucose. Applied and Environmental Microbiology, 1999, 65(8): 3633- 3640.
[8] García-Balboa C, Pedrazza A, Blázquez M L, González F, Muoz J A, Ballester A. The role of iron bacteria on weathering and attenuation processes at acidic environments. Water, Air, and Soil Pollution, 2009, 199(1/4): 203- 217.
[9] Gorlenko V, Tsapin A, Namsaraev Z, Teal T, Tourova T, Engler D, Mielke R, Nealson K.Anaerobrancacaliforniensissp nov., an anaerobic, alkalithermophilic, fermentative bacterium isolated from a hot spring on mono lake. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(pt 3): 739- 743.
[10] Ye Q, Roh Y, Carroll S L, Blair B, Zhou J Z, Zhang C L, Fields M W. Alkaline anaerobic respiration: Isolation and characterization of a novel alkaliphilic and metal-reducing bacterium. Applied and Environmental Microbiology, 2004, 70(9): 5595- 5602.
[11] Thorpe C L, Morris K, Boothman C, Lloyd J R. Alkaline Fe(Ⅲ) reduction by a novel alkali-tolerantSerratiasp. isolated from surface sediments close to Sellafield nuclear facility, UK. FEMS Microbiology Letters, 2012, 327(2): 87- 92.
[12] Lu G. Cultivation of Alkaliphic iron-reducing bacteria in ultra-pressure metamorphic rocks collected from Chinese Contiental Scientific Drilling Program(CCSD)[D]. Beijing:China university of geosciences,2011.
[13] Zhu C. Effects of environmental factors on Geobacteraceae spp. and Anaeromyxobacter spp. communities in paddy soils [D]. Shaanxi:Northwest agriculture and forestry university,2011.
[14] Xu Q,Yang L Z,Dong Y H. Chinese paddy eocosystem. Beijing:China Agricultural Press,1998.
[15] Zhu Y Q,Li J Y. Practical analytical chemistry. Chengdu:Sichuan Renmin Press,1981:527- 545.
[16] Schnell S, Ratering S, Jansen K. Simultaneous determination of Iron(Ⅲ), Iron(II), and Manganese(II) in environmental samples by ion chromatography. Environmental Science and Technology, 1998, 32(10): 1530- 1537.
[17] Qu D,Tan Z X,Wang B L,He J Z. Effect of EDTA,fulvic acid and acetate addition on microbial iron reduction in paddy soils. Chinese Journal of Northwest Sci-tech University of Agriculture and Forestry(Natural Science Edition),2003,31(4):6- 10.
[18] Yi W J,Qu D,Wang Q. Effects of carbon source and flooding time on microbial Fe ( Ⅲ) reduction in paddy soils. Chinese Journal of Applied Ecology,2010,21(12):3133- 3140.
[19] He J Z, Qu D. Dissimilatory Fe(Ⅲ) reduction characteristics of paddy soil extract cultures treated with glucose or fatty acids. Journal of Environmental Sciences, 2008, 20(9): 1103- 1108.
[20] Ponnamperuma F N. The chemistry of submerged soils // Brady N C, ed. Advances in Agronomy. Waltham: Academic Press, 1972: 29- 96.
[21] Bloethe M, Akob D M, Kostka J E, Goeschel K, Drake H L, Kuesel K. pH gradient-induced heterogeneity of Fe(Ⅲ)-reducing microorganisms in coal mining-associated lake sediments. Applied and Environmental Microbiology, 2008, 74(4): 1019- 1029.
[22] Slobodkin A I. Thermophilic microbial metal reduction. Microbiology, 2005, 74(5): 501- 514.
[23] Wei S Z. Hydrogen production of sludge under alkaline conditions [D]. Beijing:Graduate university of Chinese academy of science,2009.
[24] Chidthaisong A, Rosenstock B, Conald R. Measurement of monosaccharides and conversion of glucose to acetate in anoxic rice field soil. Applied and Environmental Microbiology, 1999, 65(6): 2350- 2355.
[25] Dassonville F, Godon J J, Renault P, Richaume A, Cambier P. Microbial dynamics in an anaerobic soil slurry amended with glucose, and their dependence on geochemical processes. Soil Biology and Biochemistry, 2004, 36(9): 1417- 1430.
[26] Zhu C,Ratering S,Qu D,Schnell S. Effects of short-term flooding onGeobacteraceaespp. andAnaeromyxobacterspp. abundance in paddy soil. Acta Ecologica Sinica,2011,31(15):4251- 4260.
[27] Noll M, Matthies D, Frenzel P, Derakshani M, Liesack W. Succession of bacterial community structure and diversity in a paddy soil oxygen gradient. Environmental Microbiology, 2005, 7(3): 382- 395.
[28] Rousk J, Bääth E, Brookes P C, Lauber C L, Lozupone C, Caporaso J G, Knight R, Fierer N. Soil bacterial and fungal communities across a pH gradient in an arable soil. The ISME Journal, 2010, 4(10): 1340- 1351.
[29] Lauber C L, Hamady M, Knight R, Fierer N. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale. Applied and Environmental Microbiology, 2009, 75(15): 5111- 5120.
[30] Männistö M K, Tiirola M, Häggblom M M. Bacterial communities in Arctic fjelds of Finnish Lapland are stable but highly pH-dependent. FEMS Microbiology Ecology, 2007, 59(2): 452- 465.
[31] Jones R T, Robeson M S, Lauber C L, Hamady M, Knight R, Fierer N. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses. The ISME Journal, 2009, 3(4): 442- 453.
[32] Dimitriu P A, Grayston S J. Relationship between soil properties and patterns of bacterial β-diversity across reclaimed and natural boreal forest soils. Microbial Ecology, 2010, 59(3): 563- 573.
[33] Yi W J. Effects of carbon sources on iron reduction characteristic and diversity of iron reducer isolated in paddy soils [D]. Shaanxi:Northwest agriculture and forestry university,2011.
参考文献:
[3] 李庆逵. 中国水稻土. 北京: 科学出版社, 1992.
[4] 沈萍, 陈向东. 微生物学. 北京: 高等教育出版社, 2009.
[6] 陈秦, 赵佳佳, 曲东, 朱超. 渤海沉积物中微生物铁还原能力及其影响因素探讨. 农业环境科学学报, 2011, 30(6): 1172- 1179.
[12] 吕国. 中国大陆超深钻(CCSD)高压变质岩嗜碱铁还原菌培养研究 [D]. 北京: 中国地质大学, 2011.
[13] 朱超. 环境因素对水稻土中地杆菌和厌氧粘细菌群落的影响 [D]. 陕西: 西北农林科技大学, 2011.
[14] 徐琪, 杨林章, 董元华. 中国稻田生态系统. 北京: 中国农业出版社, 1998.
[15] 朱盈全, 李俊义. 实用分析化学. 成都: 四川人民出版社, 1981: 527- 545.
[17] 曲东, 谭中欣, 王保莉, 贺江舟. 外源物质对水稻土铁还原的影响. 西北农林科技大学学报: 自然科学版, 2003, 31(4): 6- 10.
[18] 易维洁, 曲东, 王庆. 碳源和淹水时间对水稻土微生物Fe(Ⅲ)还原能力的影响. 应用生态学报, 2010, 21(12): 3133- 3140.
[23] 魏素珍. 碱性条件下污泥发酵产氢研究 [D]. 北京: 中国科学院研究生院, 2009.
[26] 朱超, Ratering S, 曲东, Schnell S. 短期淹水培养对水稻土中地杆菌和厌氧粘细菌丰度的影响. 生态学报, 2011, 31(15): 4251- 4260.
[33] 易维洁. 碳源对水稻土中铁还原特征和铁还原菌多样性的影响 [D]. 陕西: 西北农林科技大学, 2011.
Effect of initial pH value on microbial Fe (Ⅲ) reduction in alkaline and acidic paddy soils
WU Chao,QU Dong*,LIU Hao
CollegeofNaturalResourcesandEnvironment,NorthwestAgricultureandForestryUniversity,Yangling,Shaanxi712100,China
The pH value is one of the most important factors affecting iron reduction in paddy soils. The objective of this study was to determine how changes in initial pH affected iron reduction in paddy soils from Jilin (JL) and Jiangxi (JX) provinces. Anaerobic incubations were conducted using (1) soil slurries and (2) mixed microbial cultures that had been isolated from each soil type. The pH value of the alkaline JL samples was reduced with Al2(SO4)3. The pH value of the acidic JX samples was increased using Na2CO3. The pH values of the soil slurries were strongly acidic (pH<5.0), acidic (pH 5.0—6.5), neutral (pH 6.5—7.5), alkaline (pH 7.5—8.5), and strongly alkaline (pH > 8.5). The mixed microbial cultures were incubated in medium with pH ranging between 4.84—10.51. The Fe(Ⅱ) concentration and pH value of the samples were measured at regular intervals. A logistic model was used to analyze the characteristics of Fe(Ⅲ) reduction. The results showed that iron reduction potential and the maximum rate of iron reduction decreased as the initial pH value decreased. The time to reach the maximum rate of iron reduction increased as the initial pH value of the JL soil slurry declined. The maximum rate of iron reduction in the JL slurry decreased by nearly 50% as the pH value decreased, declining from (0.05±0.00) mg·g-1·d-1at pH 10.51 to (0.02±0.00) mg·g-1·d-1at pH 7.00. All amorphous iron oxides were reduced in the JX paddy soils, although the maximum rate of iron reduction increased and the time to reach the maximum rate of iron reduction decreased as the initial pH increased. The maximum rate of iron reduction in the JX soil was highest ((0.46±0.04) mg·g-1·d-1) and the time to reach the maximum rate of iron reduction was shortest ((3.65±0.21) d) at pH 8.19. There was a highly significant positive correlation between the maximum rate of iron reduction and the initial pH value of both soils (JLr= 0.897,P=0.000; JXr=0.903,P=0.000). Mixed microbial cultures from both the JL and JX soil reduced all ferric iron, regardless of the initial pH value. It finally indicated that the iron reducing ability of microbial communities from both paddy soils were similar during the early stages of incubation but became different during the later stages. This observation provided support for the idea that facultative iron-reducing bacteria contribute to iron reduction in paddy soils. In the mixed cultures, the initial pH value increased. This was especially evident in the JX soil where the time to reach the maximum rate of iron reduction increased nearly six-fold, from (7.49±0.03) d at pH 4.84 to (45.2±0.3) d at pH 10.51. The maximum rate of iron reduction by the JL microbial community was negatively correlated with the initial pH value (r=-0.838,P=0.000). The maximum rate of iron reduction was highest at pH 6.00. The maximum rate of iron reduction by the JX microbial communities was highest at pH 4.84. There was a significantly negative correlation between the maximum rate of iron reduction and the initial pH value of the JX microbial community (r=-0.913,P=0.000). In conclusion, the effect of initial pH and soil type on iron reduction was significant in paddy soils. The initial pH has a certain influence on microbial communities and soil components.
initial pH; paddy soils; dissmilatory iron reduction; anaerobic incubation of slurry and microbial communities
国家自然科学基金面上资助项目(40971158,41171204)
2012- 10- 09;
2013- 03- 04
10.5846/stxb201210091394
*通讯作者Corresponding author.E-mail: dongqu@nwsuaf.edu.cn
吴超,曲东,刘浩.初始pH值对碱性和酸性水稻土微生物铁还原过程的影响.生态学报,2014,34(4):933- 942.
Wu C,Qu D,Liu H.Effect of initial pH value on microbial Fe (Ⅲ) reduction in alkaline and acidic paddy soils.Acta Ecologica Sinica,2014,34(4):933- 942.
