滩涂围垦和土地利用对土壤微生物群落的影响
2014-08-08陈学萍方长明
林 黎,崔 军,陈学萍,方长明
(复旦大学生命科学学院生态与进化生物学系, 上海 200433)
滩涂围垦和土地利用对土壤微生物群落的影响
林 黎,崔 军,陈学萍,方长明*
(复旦大学生命科学学院生态与进化生物学系, 上海 200433)
土壤微生物在生态系统营养物质循环过程,特别是碳、氮循环过程中扮演着重要的角色。上海市崇明岛位于长江入海口,因其土壤发育时间较短、土地利用历史背景清晰、土壤本底均一,不同土壤围垦年代的土壤,代表了土壤发育年代的不同时期。以空间变化代替时间变化,对崇明岛稻田和旱地6个不同围垦年代土壤的磷酸脂肪酸(PLFA)指纹图谱研究表明,湿地滩涂围垦16a后土壤微生物总PLFA、细菌PLFA、革兰氏阳性菌(G+) PLFA和革兰氏阴性菌(G-) PLFA含量显著降低。随着围垦时间的逐步增加,PLFA含量逐步上升。经过长时间的农业种植,G+PLFA在围垦120a和300a稻田和旱地土壤中没有显著性差异;而总PLFA、细菌和G-PLFA在围垦75、120a和300a的土壤中含量趋于稳定且没有显著性差异。围垦16a和40a稻田土壤中总PLFA和G+PLFA显著高于旱地土壤;围垦40a稻田土壤中细菌和G-PLFA显著高于旱地土壤。不同围垦年代土壤总PLFA、细菌PLFA与土壤总氮、粘土含量成显著的正相关关系。河口湿地围垦后微生物数量的变化与土壤营养含量存在强烈相关关系,提示土壤围垦及演替过程中微生物与土壤肥力之间的紧密关系,对探讨土壤演替过程中微生物群落的变化具有重要意义。
崇明湿地;围垦;土地利用;微生物群落;磷酸脂肪酸
微生物是土壤生态系统中的重要组成部分,在有机物分解、养分循环、氮的固定、土壤结构等方面有着举足轻重的作用。同时,土壤中微生物受到耕作方式、土壤质地、土壤层次、植被和土壤自然环境等因素的影响,土壤微生物群落结构及其多样性又在一定程度上反映了土壤生态系统的结构、功能及过程。
崇明岛位于长江入海口,占地面积1267 km2,属于亚热带季风气候区,四季分明,年平均气温约为16 ℃,年平均降水量为1144 mm。崇明岛东滩是中国长江口规模最大、发育最完善的河口型滩涂湿地,长江入海径流携带的泥沙在河口附近沉积,塑造了广阔的潮滩湿地,而崇明岛东滩则以每年100多米的推进速度向东海推进,使东滩滩涂面积不断於涨[1]。围垦区的土壤来自于滩涂淤积的泥沙,因土壤发育时间相对较短,其土壤本底较为均一。不同土壤围垦年代的土壤,代表了土壤发育的不同时期,在自然条件下,土壤发育的空间变化可以代替时间尺度上的变化[2]。崇明岛长江河口湿地滩涂围垦后自然条件的相对稳定、土壤本底条件的相对一致性、以及相对单一和清晰的土地利用背景为人们提供了一个研究人类长期的干扰活动对土壤微生物群落影响的机会。
崇明岛滩涂围垦后的土壤具备相当完善的年代发育序列,以空间代替时间,进行土壤微生物群落研究,对讨论自然环境状态下土壤发育过程有重要意义,对土壤微生物群的讨论有助于阐明土壤生态系统动态过程,对于合理开展滩涂围垦有理论指导意义。
1 材料与方法
1.1 取样
研究地点位于上海市崇明岛(东经121°09′—121°54′,北纬31°27′—31°51′)。崇明岛滩涂围垦后土壤空间尺度上的变化,代表了土壤发育年代的变化;根据崇明岛滩涂土壤围垦的时间、土地利用历史记载及当地常住居民提供的信息,本研究共选取了6个不同年代的土壤[2- 4]。实验涉及2种不同的土地利用方式:稻田和旱地,以未围垦的东滩湿地滩涂土壤为0年代土壤,涉及了5个滩涂围垦后不同年代序列的土壤,包括16,40,75,120,300a。
滩涂围垦后16a和40a的实验样点根据Gao等的文献报告选取[3]; 300a的实验样点根据崇明岛当地官方文献记录选取[4];75a和120a的实验样点根据当地5位以上常住居民提供的信息选取,因此75a和120a的土壤可能有10—20a的误差[2]。
为了使实验结果能更准确反映不同的土地发育年限对土壤微生物群落的影响,实验选择耕作方式相对稳定的实验样点,每一个样点设有3个平行样地,每个平行样地间隔距离在500—1000 m;为了尽量减少环境因素造成的实验误差,在每块样地中以S形设置6个采样点,各采样点间距约为5—8 m,用土钻钻取表层0—20 cm鲜土,并将该6个采样点采取的土壤均匀混合为1个混合样本,于保温盒加冰袋保存运回实验室冷冻保存备用。Cui 等对不同年代土壤的理化性质进行了详细测量,本实验研究涉及土壤样品的部分理化性质如表1所示[2]。
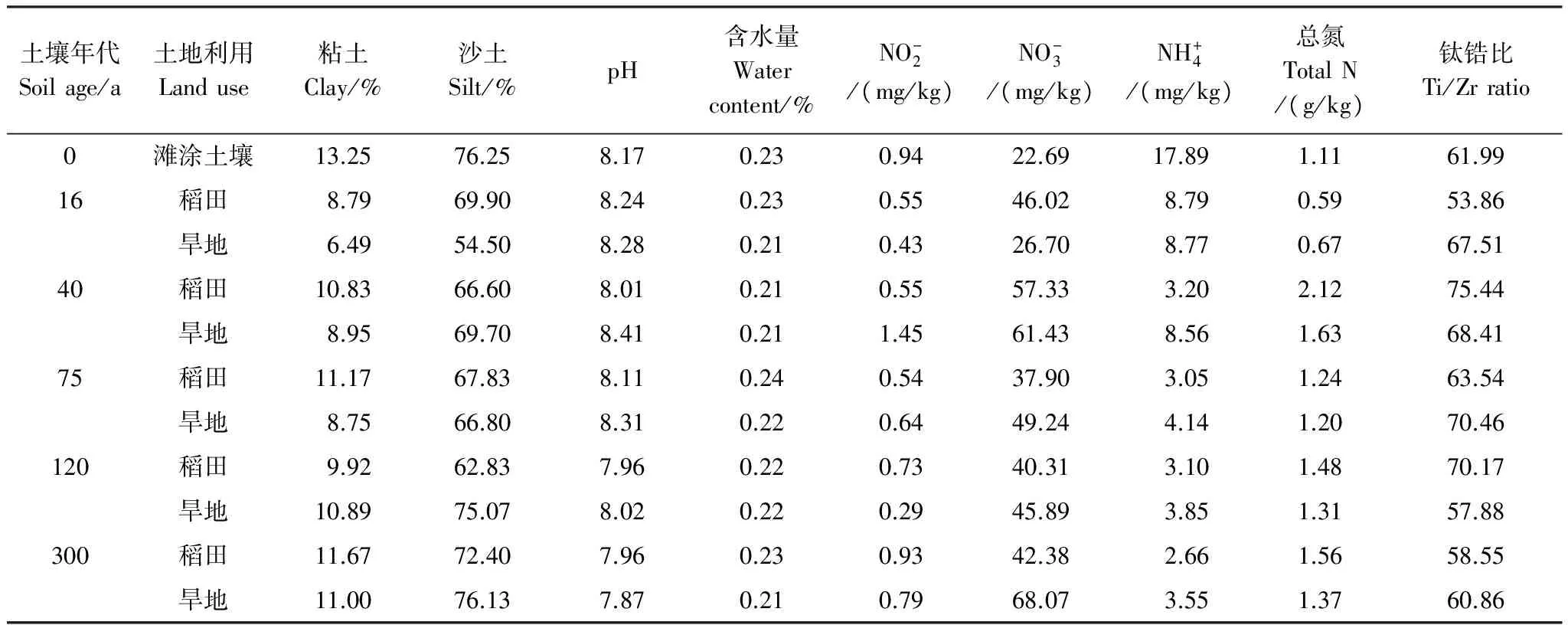
表1 不同围垦年代土壤的部分理化性质[2]
1.2 磷酸脂肪酸(PLFA)的提取和检测方法
1.2.1 PLFA的提取和检测
PLFA的提取方法改良自Zelles的传统提取方法[5- 6],PLFA的提取流程如下:称取4 g冻干土于25 mL比色管中,加3 mL 柠檬酸缓冲液和12 mL甲醇∶氯仿(2∶1)混合液,充分震荡萃取2次;加4 mL氯仿和4 mL柠檬酸缓冲液混合液,放置过夜分层后,取下层溶液,用氯仿萃取3次;旋转蒸发萃取液至少量后,将萃取液过层析柱层析;将层析柱淋出液于三角瓶中40 ℃蒸干,并加0.5 mL 二氯甲烷和1 mL甲醇钠溶液,在50 ℃下加热10 min甲酯化磷脂;加6 mL分析纯正己烷振荡萃取,上清液经无水硫酸钠过滤后,在10 mL KD浓缩器中经氮气吹干,最后用色谱纯正己烷定容至100 μL,即可上机检测。
柠檬酸缓冲液的配比为9.38 g柠檬酸和11.03 g柠檬酸钠溶于250 mL重蒸水。甲醇钠溶液配比为1 g NaOH溶于50 mL分析纯甲醇。甲酯化磷脂(FAME)标准品购自英国Supelco公司(Supelco, Supelco UK, Poole, Dorset, UK),包括共25种FAMEs。
实验中使用的仪器包括:数控恒温水浴仪(北京帅恩科技有限责任公司,型号SE812J),氮吹仪,旋转蒸发仪(上海申生科技有限公司,R系列),循环水式样真空泵,Agilent 6820气象色谱仪。色谱分析采用FID检测器检测,检测器温度280 ℃,进样口温度250 ℃,柱箱初始温度120 ℃,最高温度300 ℃,吹扫气体N2,吹扫时间0.75 min,色谱柱采用长30.0 m、直径为320.00 μm的HP- 5MS毛细管柱,数据采集频率为20 Hz。
1.2.2 PLFA作为生物标记
本研究用到的PLFA生物标记分组如表2所示。生物标记物可分为通用生物标记物和特定生物标记物两类。通用生物标记物可反映总生物量,如PLFA、酯链磷脂脂肪酸(EL-PLFA)的总量可用于了解土壤微生物总生物量[7- 8];单不饱和脂肪酸(MUFA)可用作革兰氏阴性细菌的通用生物标记[9];双不饱和脂肪酸18:2ω6,9可用作真菌的特定生物标记[6]。
本研究PLFA命名规则采取通用的ω系统。前缀a,i,和cy分别表示反式,顺式和环状支链构型。以18:2ω6,9为例,18表示主链C原子数目,冒号“:”后紧跟的数字代表不饱和度,ω后的数字代表双键所在的位置。
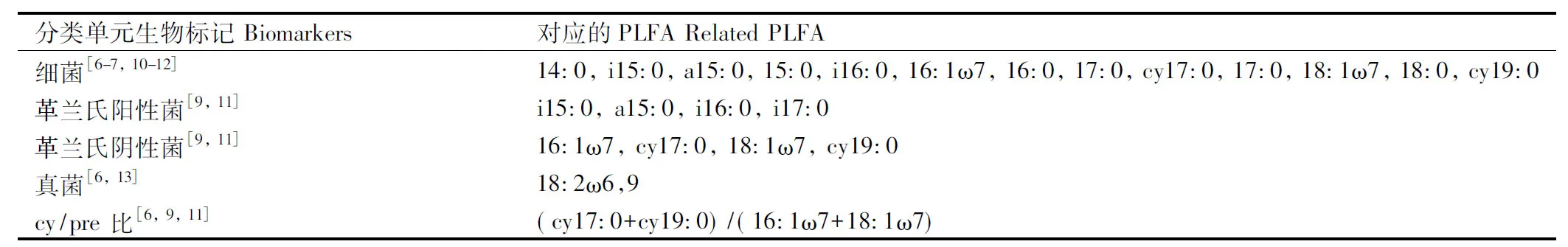
表2 PLFA分析生物标记分组
前缀a,i,和cy分别表示反式,顺式和环状支链构型
1.3 数据处理
实验采用Microsoft Excel 2007进行一般数据处理,采用SPSS 17.0软件进行统计分析。不同围垦年代土壤PLFA方差分析Post hoc采用Duncan′s test方法,PLFA与土壤基本性质相关性分析采用Spearman方法。
2 结果
2.1 PLFA作为生物标记
PLFA总量反应了土壤微生物总生物量[7]。如图1中A所示为旱地和稻田不同围垦年代土壤总PLFA的对照图。围垦16a土壤的总PLFA相对于未围垦的湿地滩涂土壤显著降低(P<0.05)。随着围垦时间的逐步增加,稻田和旱地土壤总PLFA含量逐步上升。围垦75、120a和300a的土壤总PLFA逐渐趋于稳定且没有显著差异(P>0.05)。
类似的变化趋势在细菌、革兰氏阳性(G+)和革兰氏阴性菌(G-)PLFA中也有发现。如图1所示,围垦16a的土壤中细菌、G+和G-PLFA相对于湿地滩涂土壤均显著性降低(P<0.05)。随着围垦后时间的逐步增加,PLFA含量逐步上升。G+PLFA在围垦120a和300a土壤中没有显著性差异(P>0.05);而细菌和G-PLFA在围垦75、120a和300a土壤中没有显著性差异(P>0.05)。
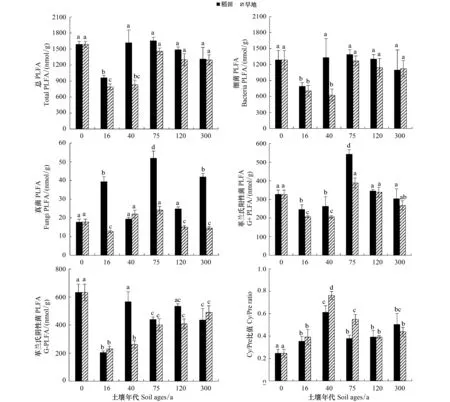
图1 稻田和旱地不同围垦年代土壤的总PLFA,细菌,真菌,革兰氏阳性菌,革兰氏阴性菌和Cy/Pre比值Fig.1 Total PLFA, bacteria, Fungi, G+, G-, and Cy/Pre ratio of paddy and upland soils corresponding to soil ages每个土壤围垦年代相同小写字母表示差异不显著(P>0.05)
在两种土地利用方式下,如图1,围垦16a和40a稻田土壤微生物总量、G+PLFA显著高于旱地土壤(P<0.05);如图1所示,围垦40a稻田土壤中细菌PLFA和G-PLFA显著高于旱地土壤(P<0.05)。而围垦75、120a和300a稻田土壤微生物PLFA与旱地土壤无明显差异(P>0.05)。
土壤微生物环状支链的磷脂酸(Cy)及其前体(Pre,一般是单不饱和磷脂酸)之间的比值Cy/Pre往往随着环境胁迫作用的影响而发生改变[6,9- 10]。如图1所示,随着围垦后时间的逐步增加,稻田和旱地土壤Cy/Pre比值均逐步升高,并在围垦40年代的土壤中达到最大值;围垦40a和75a土壤Cy/Pre比值均显著高于湿地滩涂土壤(P<0.05)。围垦120a和300a土壤Cy/Pre比值没有显著性差异(P>0.05),但总是显著高于湿地滩涂土壤(P<0.05)。
2.2 PLFA指纹图谱主成份分析
对PLFA指纹图谱做主成份分析的前提是各磷酸酯之间不相关。相关性检验表明磷脂酸12:0和13:0具有显著的相关关系(P<0.05)。因此排除了磷脂酸12:0后,对不同年代土壤的磷酸酯做主成份分析(PCA),结果如图2所示。

图2 PCA分析主成份PC1和PC2散点图Fig.2 PC1 and PC2 scatter diagram of PCA analysis
PCA分析得到两个主要成份因子PC1和PC2,分别解释了不同年代土壤PLFA指纹图谱差异的51.12%和18.57%。从图2中可以进一步看出,围垦75a后的土壤(包括75a)与75a前的土壤清晰地区别开来。围垦75a后土壤微生物生物量的恢复和Cy/Pre比值的降低,以及围垦后120a和300a土壤微生物生物量和Cy/Pre比值的相对稳定,提示土壤微生物可能需要相当长的时间适应和克服环境压力。PCA分析中,围垦75a后的土壤(包括75a)与之前的土壤明显区别开来,也从另一方面证明了这一假设。
2.3 PLFA与土壤基本性质相关性
Cui等对不同围垦年代土壤理化性质进行了全面的分析[2]。将部分土壤基本性质与各群落PLFA进行了相关性分析,结果如表3所示。不同围垦年代土壤总PLFA、细菌PLFA与总氮成极显著的正相关关系(P<0.01);同时总PLFA、细菌PLFA与粘土含量成显著的正相关关系(P<0.05)。另外,Cy/Pre比值与总氮含量显著相关(P<0.05),真菌PLFA与含水量显著相关(P<0.05)。
3 讨论
3.1 河口湿地滩涂围垦对土壤微生物各群落PLFA含量的影响
湿地滩涂土壤围垦后,显著降低了土壤微生物总PLFA、细菌PLFA、G+PLFA和G-PLFA含量(P<0.05),同时显著提高了土壤Cy/Pre比值(P<0.05)。Schutz等利用PLFA的方法,对人工地下水再生系统中水淹部分和未被水淹部分的森林土壤进行了微生物群落的研究,发现水分胁迫会诱导Cy/Pre比值的增加[14]。Cordova-Kreylos等对加里福利亚滨海盐碱湿地进行了土壤微生物群落结构的研究,发现重金属污染物和有机污染与环状磷脂酸成显著的正相关关系[15]。Dickens等采用氯仿熏蒸的方法,对沼泽和森林两种土壤进行了微生物群落结构的PLFA分析,发现熏蒸培养后的土壤,诱发生产了大量的环状磷脂酸Cyclic 19:0,而Cyclic 19:0是Cy/Pre比值分子的重要组成部分之一[16]。本研究中,围垦后稻田和旱地土壤微生物生物量均有显著性降低,提示长江河口湿地滩涂土壤围垦后,土地利用对土壤微生物产生了长期的胁迫压力。

表3 PLFA与土壤基本性质相关性分析
** 表示P<0.01水平显著相关;* 表示P<0.05水平显著相关
围垦16a和围垦40a土壤微生物总PLFA、细菌PLFA、G+PLFA和G-PLFA逐步增加,而总PLFA、细菌和G-PLFA在围垦75、120a和300a土壤中含量趋于稳定且没有显著性差异(P>0.05)。Cui等对崇明岛东滩不同围垦年代土壤的理化性质进行了详细的分析,发现围垦16a土壤有机碳相对于湿地滩涂土壤迅速降低,但是在围垦40a后土壤有机碳、氮、磷等营养元素逐渐积累并得到恢复[2]。经过长时间的农业种植,土壤营养环境逐渐改善,可能是围垦75、120a和300a土壤微生物群落PLFA含量差异减少并趋于稳定的主要原因。
不同围垦年代土壤真菌PLFA含量没有明显的变化趋势。Kasel等曾经对澳大利亚不同地区4种不同的土地利用方式进行了真菌群落结构的研究,发现真菌群落结构具有很高的可变性[17]。土壤中的真菌相对于细菌,其菌丝更容易受到环境干扰因素的影响,使其在不同土地利用方式和土壤围垦年代下含量的变化波动较大。
3.2 土地利用对土壤微生物各类群PLFA含量的影响
围垦16a和40a稻田土壤微生物总PLFA、G+PLFA显著高于旱地土壤(P<0.05),围垦40a稻田土壤细菌PLFA和G-PLFA显著高于旱地土壤(P<0.05)。而围垦75、120a和300a稻田土壤微生物总PLFA与旱地土壤无显著性差异(P>0.05)。Drenovsky等对美国跨洲际的8种不同土地利用方式土壤进行了研究,得出土地利用方式是驱动微生物群落结构变异主要因子的结论[18]。Bossio等采用了DGGE的实验方法,对肯尼亚热带林地和农业土壤微生物群落结构进行了探讨,结果也表明不同的土地利用方式是影响土壤微生物群落结构最重要的影响因素[19]。不同的土地利用方式,可能通过改变土壤盐碱度、pH值、含水量、有机物含量等,影响土壤微生物群落结构。稻田和旱地不同的灌溉方式及土壤营养元素的投入,可能导致土壤营养物质、pH值及盐碱度等存在差异,从而造成微生物含量的差异。
3.3 土壤微生物群落PLFA含量与土壤基本性质的相关性
4 结论
河口湿地滩涂围垦和土地利用,增大了土壤微生物的生存压力,显著降低了土壤微生物总PLFA、细菌PLFA、G+PLFA和G-PLFA含量。随着围垦时间的逐步增加,PLFA含量逐步上升。经过长时间的农业种植,土壤营养环境逐渐改善,G+PLFA在围垦120a和300a稻田和旱地土壤中没有显著性差异;而总PLFA、细菌和G-PLFA在围垦75、120a和300a土壤中含量趋于稳定且没有显著性差异。围垦16a和40a稻田土壤微生物总PLFA、G+PLFA显著高于旱地土壤;围垦40a稻田土壤中细菌PLFA和G-PLFA显著高于旱地土壤。不同围垦年代土壤总PLFA、细菌PLFA与土壤总氮、土壤粘土含量成显著的正相关关系,总N或总有机C等营养元素的投入和土壤结构的变化可能是造成微生物群落结构产生变化的原因之一。真菌因其更易受到轻微改变的环境因子的影响,使其在不同土地利用方式和土壤围垦年代下含量的变化波动较大。河口湿地围垦后微生物数量的变化与土壤营养含量存在强烈相关,提示土壤围垦及演替过程中微生物与土壤肥力之间的紧密关系,对探讨土壤演替过程中微生物群落的变化具有重要意义。
[1] He X Q. Modern Geomorphic Processes of Eastern Chongming Island, the Yangtze Estuary [D]. Shanghai: East China Normal University, 2004.
[2] Cui J, Liu C, Li Z L, Chen X F, Ye Z Z, Fang C M. Long-term changes in topsoil chemical properties under centuries of cultivation after reclamation of coastal wetlands in the Yangtze Estuary, China. Soil and Tillage Research, 2012, 123: 50- 60.
[3] Gao Y, Zhao B. The effect of reclamation on mud flat development in Chongming Island, Shanghai. Chinese Agricultural Science Bulletin, 2006, 22(8): 475- 479.
[4] Zhou Z, Ji J. Chongming County Annals. Shanghai: Shanghai People′s Press, 1989: 42- 42.
[5] Deng H, Li X F, Cheng W D, Zhu Y G. Resistance and resilience of Cu-polluted soil after Cu perturbation, tested by a wide range of soil microbial parameters. FEMS Microbiology Ecology, 2009, 70(2): 293- 304.
[6] Zelles L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. Biology and Fertility of Soils, 1999, 29(2): 111- 129.
[7] Frostegård A, Bååth E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil. Biology and Fertility of Soils, 1996, 22(1/2): 59- 65.
[8] Han X M, Wang R Q, Liu R, Wang M C, Zhou J, Guo W H. Effects of vegetation type on soil microbial community structure and catabolic diversity assessed by polyphasic methods in North China. Journal of Environmental Sciences, 2007, 19(10): 1228- 1234.
[9] Kieft T L, Wilch E, O′Connor K, Ringelberg D B, White D C. Survival and phospholipid fatty acid profiles of surface and subsurface bacteria in natural sediment microcosms. Applied and Environmental Microbiology, 1997, 63(4): 1531- 1542.
[10] Frostegård A, Bååth E, Tunlid A. Shifts in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty acid analysis. Soil Biology and Biochemistry, 1993, 25(6): 723- 730.
[11] Moore-Kucera J, Dick R P. PLFA profiling of microbial community structure and seasonal shifts in soils of a Douglas-fir chronosequence. Microbial Ecology, 2008, 55(3): 500- 511.
[12] Zhu Y, Li J X, Meng C, Wu T, Zhang T. Land use change in the eastern part of Chongming Island in Shanghai in recent two decades. Chinese Journal of Applied Ecology, 2007, 18(9): 2040- 2044.
[13] De Forest J L, Zak D R, Pregitzer K S, Burton A J. Atmospheric nitrate deposition, microbial community composition, and enzyme activity in northern hardwood forests. Soil Science Society of America Journal, 2004, 68(1): 132- 138.
[14] Schütz K, Nagel P, Better E, Kandeler E, Ruess L. Flooding forested groundwater recharge areas modifies microbial communities from top soil to groundwater table. FEMS Microbiology Ecology, 2009, 67(1): 171- 182.
[15] Cordova-Kreylos A L, Cao Y P, Green P G, Hwang H M, Kuivila K M, LaMontagne M G, Van De Werfhorst L C, Holden P A, Scow K M. Diversity, composition, and geographical distribution of microbial communities in california salt marsh Sediments. Applied and Environmental Microbiology, 2006, 72(5): 3357- 3366.
[16] Dickens H E, Anderson J M. Manipulation of soil microbial community structure in bog and forest soils using chloroform fumigation. Soil Biology and Biochemistry, 1999, 31(14): 2049- 2058.
[17] Kasel S, Bennett L T, Tibbits J. Land use influences soil fungal community composition across central Victoria, south-eastern Australia. Soil Biology and Biochemistry, 2008, 40(7): 1724- 1732.
[18] Drenovsky R E, Steenwerth K L, Jackson L E, Scow K M. Land use and climatic factors structure regional patterns in soil microbial communities. Global Ecology and Biogeography, 2010, 19(1): 27- 39.
[19] Bossio D A, Girvan M S, Verchot L, Bullimore J, Borelli T, Albrecht A, Scow K M, Ball A S, Pretty J N, Osborn A M. Soil microbial community response to land use change in an agricultural landscape of Western Kenya. Microbial Ecology, 2005, 49(1): 50- 62.
[20] Hamer U, Makeschin F, Stadler J, Klotz S. Soil organic matter and microbial community structure in set-aside and intensively managed arable soils in NE-Saxony, Germany. Applied Soil Ecology, 2008, 40(3): 465- 475.
[21] Yao H, He Z, Wilson M J, Campbell C D. Microbial biomass and community structure in a sequence of soils with increasing fertility and changing land use. Microbial Ecology, 2000, 40(3): 223- 237.
参考文献:
[1] 何小勤. 长江口崇明东滩现代地貌过程研究 [D]. 上海: 华东师范大学, 2004.
[3] 高宇, 赵斌. 人类围垦活动对上海崇明东滩滩涂发育的影响. 中国农学通报, 2006, 22(8): 475- 479.
[4] 周之珂.崇明县志. 上海: 上海人民出版社, 1989: 42- 42.
[12] 朱颖, 李俊祥, 孟陈, 吴彤, 张挺. 上海崇明岛东部近20年土地利用变化. 应用生态学报, 2007, 18(9): 2040- 2044.
Effects of reclamation on tidal flat and land use on soil microbial community
LIN Li, CUI Jun, CHEN Xueping, FANG Changming*
CoastalEcosystemsResearchStationofYangtzeRiverEstuary,MinistryofEducationKeyLaboratoryforBiodiversityandEcologicalEngineering,TheInstituteofBiodiversityScience,FudanUniversity,Shanghai200433,China
Soil microbes play a vital role in nutrient cycling, especially in carbon and nitrogen cycling. Microbes are influenced and regulated by many factors, such as anthropogenic disturbances, environmental conditions and soil properties. Little has been reported on soil microbial response to long term cultivation after reclamation of estuary wetland. One of possible reasons may be the heterogeneity of soil background and complicated land use history. The Chongming Island, located in the estuary of Yangtze River, was originated mainly from periodical reclamation on tidal flat. Because of an excellent homogeneous soil background and a relatively short and clear land use history on the island, the chronosequence of soils reflects mainly microbial response to soil development and cultivation. Phospholipid Fatty Acids (PLFA) are principle components of microbial cell membranes. Its pattern can be used as a fingerprint of soil microbes to provide insight information of soil bacterial and fungal communities because different microbes show different PLFA profile patterns.
This research focused on a chronosequence of 6 soil ages under two different cultivation (paddy rice and upland cropping) systems, including 0 (unclaimed wetland soil), 16, 40, 75, 120 and 300 years old soils. PLFA analysis results showed that after reclamation of coastal wetland, soil total PLFA, bacterial PLFA, Gram-positive (G+) PLFA and Gram-negative (G-) PLFA all reduced significantly in both paddy rice and upland cropping soils. Microbial PLFA abundance then increased gradually over several decades in both paddy rice and upland cropping soils. After a long-term human cultivation, no significant difference in G+PLFA was observed in 120 or 300 years old soils, either in paddy rice or upland cropping soils. No significant difference in total PLFA, bacterial PLFA or G-PLFA was observed among 75, 120 or 300 years old soils. Principle component analysis (PCA) showed that two principle components, PC1 and PC2, could explain 51.12% and 18.57% of the total PLFA variation, respectively. PCA also revealed that PLFA profiles of 75, 120 and 300 years old soil were clearly different from those of 0, 16 and 40 years old soil. Cultivations of paddy rice and upland crops have significantly affected soil microbial structure. Total PLFA and G+PLFA were significantly higher in 16 and 40 years old paddy soils than those of upland cropping soils. Bacterial and G-PLFA were significantly higher in 40 years old paddy rice soils than those of upland cropping soils. Soil total PLFA and bacterial PLFA were significantly correlated to soil total nitrogen and clay content, suggesting strong relations between soil microbes and soil nutrient status. The PLFA results indicated that human cultivations have led to environmental stress on soil microbes and this stress was gradually relieved along with long-term cultivations, because of improved soil nutrient conditions due to inputs of carbon, nitrogen and phosphorus fertilizers.
This study provided deep insights into soil microbial structures of different soil ages based on PLFA analysis under paddy and upland cultivation systems, which are two major cropping systems in China. It was helpful for us to better understand the development of soil microbial communities along with soil succession in arable soils.
Chongming Island; reclamation; land use; soil microbial structure; Phospholipid Fatty Acid
科技部气候变化专项资助项目(2010CB950600);上海市科委资助项目(09DZ1900106)
2013- 05- 27;
2013- 10- 16
10.5846/stxb201305271198
*通讯作者Corresponding author.E-mail: cmfang@fudan.edu.cn
林黎,崔军,陈学萍,方长明.滩涂围垦和土地利用对土壤微生物群落的影响.生态学报,2014,34(4):899- 906.
Lin L, Cui J, Chen X P, Fang C M.Effects of reclamation on tidal flat and land use on soil microbial community.Acta Ecologica Sinica,2014,34(4):899- 906.
