连作苹果园土壤真菌的T-RFLP分析
2014-08-08尹承苗王功帅李园园陈学森吴树敬毛志泉
尹承苗, 王功帅, 李园园, 陈学森, 吴树敬,毛志泉,*
(1. 山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,泰安 271018;2. 青岛明月蓝海生物科技有限公司, 青岛 266400)
连作苹果园土壤真菌的T-RFLP分析
尹承苗1, 王功帅1, 李园园2, 陈学森1, 吴树敬1,毛志泉1,*
(1. 山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,泰安 271018;2. 青岛明月蓝海生物科技有限公司, 青岛 266400)
为探讨连作苹果园不同土壤空间真菌群落结构,应用T-RFLP(Terminal Restriction Fragment Length Polymorphism)技术,比较了3个连作园不同取样位置(行间、原穴、株间)和不同土层(0—30 cm、30—60 cm)的土壤真菌多样性,并结合不同样品T-RFLP图谱的差异,采用多样性指数分析、聚类分析和主成分分析(PCA),分析了3个连作园土壤真菌群落结构特征。结果表明,磁窑、道朗和金城连作园的土壤真菌多样性存在差异,各采样地区的Shannon多样性指数在0.43—2.47 之间,Pielou 均匀度指数在0.17—0.85 之间,Simpson优势度指数在0.12—0.81 之间,Margalef 丰富度指数最高的是金城树穴0—30 cm土层 (R=4.55),最低的是磁窑行间30—60 cm土层 (R=0.77)。在调查的不同取样位置、不同土层中,原树穴具有最高的多样性指数、均匀度指数、丰富度指数和最低的优势度指数;0—30 cm土层的土壤真菌多样性指数、均匀度指数、丰富度指数均高于30—60 cm土层,而优势度指数的趋势正好相反;PCA和聚类分析结果显示磁窑、道朗和金城连作园的土壤真菌群落结构均有明显差异,3个连作园的土壤真菌各自构成一个独立的群落结构,这些群落能够适应各自的土壤环境并成为环境的优势群落。
连作果园;土壤真菌;T-RFLP
苹果是我国栽培面积最大的果树树种,受土地资源限制,老果园更新时面临连作障碍现象较为普遍,即病虫害严重、产量下降、品质变劣等,给果农造成巨大的经济损失。如何有效缓解或克服连作障碍已成为苹果产业可持续发展的一项重要工作[1- 2]。
苹果连作障碍由来已久,病因复杂。在多数地区,与土传真菌有关的生物因素是造成连作障碍的主要原因[3- 5]。Urashima等[6]研究发现芦荟连作障碍与真菌群落结构的变化有关。李延茂等[7]研究结果显示,杉木连作引起土壤真菌种群发生较大变化。李坤等[8]采用PCR-DGGE技术,对连作的葡萄种植园进行研究表明,葡萄连作对土壤细菌与真菌的群落组成产生了显著的影响。因此,探究苹果连作对土壤真菌群落多样性及群落结构的影响,特别是不同连作果园真菌群落结构特征,对于进一步了解和防控苹果连作障碍具有重要意义。
末端限制性片段长度多态性( Terminal Restriction Fragment Length Polymorphism,T-RFLP)技术是研究微生物多样性的一种新兴的分子生物学方法[9- 10],不依赖于培养即可进行群落分析[11]。这种技术可有效地用于微生物菌种鉴定、群落的对比和多样性分析[12]。本文将T-RFLP技术用于连作苹果园土壤真菌群落结构的研究中,基于T-RFLP图谱,运用多样性指数、聚类分析和主成分分析比较了不同连作苹果园不同取样位置、不同土层的土壤真菌多样性及其群落结构特征,以期掌握连作苹果园土壤真菌分布状况及群落结构特征变化,为防控苹果连作障碍提供一定的理论基础。
1 材料与方法
1.1 样品采集
2012年3月分别在山东省泰安市宁阳县磁窑镇大磨庄村、岱岳区道朗镇玄庄村和烟台莱州市金城镇大沙岭村选取一片20年生的老果园,去除老树后,重新栽植两年生富士/平邑甜茶苹果幼苗,新建三片连作园。不同园片按原树穴、原行间和原株间三处分别采样,采样在幼树周围半径0.5 m范围内进行,挖直径40 cm,深60 cm的土坑,分0—30 cm和30—60 cm采集土样,将土样过筛、装入封口袋,避光储存,带回室内分析,3次重复。
1.2 样品理化指标的测定
参照鲍士旦《土壤农化分析》第三版[13]的方法,对土壤氮磷钾和有机质进行测定。速效磷(P2O5)-钼锑抗比色法;速效钾(K2O)-火焰光度法;有机质的测定-重铬酸钾容量法(稀释热法);铵态氮和硝态氮 (NH-H和NO-N)-CaCl2浸提流动注射分析仪法[14]。
1.3 总DNA的提取及纯化
样品基因组总DNA的提取及纯化按照E.Z.N.A. Soil DNA Kit说明书进行操作。
图1 磁窑、道朗和金城连作园土壤样品总DNAFig.1 Total DNA of apple replanted ochard soil of Ciyao, Daolang and Jincheng1: 磁窑行间0—30 cm; 2: 磁窑树穴0—30 cm; 3: 磁窑行间30—60 cm; 4: 磁窑株间30—60 cm; 5: 磁窑树穴30—60 cm; 6: 磁窑株间0—30 cm;7: 道朗行间0—30 cm;8: 道朗树穴0—30 cm;9: 道朗株间0—30 cm;10: 道朗行间30—60 cm;11: 道朗树穴30—60 cm; 12: 道朗株间 30—60 cm;13: 金城行间0—30 cm;14: 金城树穴0—30 cm;15: 金城株间0—30 cm;16: 金城行间30—60 cm;17: 金城树穴30—60 cm;18: 金城株间30—60 cm
1.4 T-RFLP分析
1.4.1 ITS-PCR扩增
用于ITS 片段扩增的引物采用带FAM荧光标记的真菌通用引物ITS1-F-FAM和ITS4,由上海生工生物工程技术服务有限公司合成。
ITS1-F-FAM(5′→3′): CTTGGTCATTTAGAG GAAGTAA;
ITS4(5′→3′): TCCTCCGCTTATTGATAGC
ITS 扩增反应体系为:12.5 μL 2×Taq Master Mix,1 μL DNA 模板,ITS1-F 和ITS4(10 μmol/L)各1.5 μL,加ddH2O 至25 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性60 s,51 ℃退火60 s,72 ℃延伸60 s,共34个循环;最后72 ℃延伸10min。取5 μL ITS-PCR 扩增产物经2%琼脂糖凝胶电泳检测,按照PCR产物纯化试剂盒说明书进行PCR产物纯化,-20 ℃保存备用。
1.4.2 酶切
用限制性内切酶Hha I对上述PCR纯化产物进行酶切。酶切反应体系为30 μL: 含10 μL ITS-PCR 纯化产物、2 μL Hha I (10 U/μL)、2 μL 10×Buffer、加ddH2O 至30 μL。置于37 ℃水浴中温育4 h, 酶切完毕后65 ℃水浴20 min 终止反应。将酶切产物送至上海生工生物技术有限公司进行测序。
1.5 数据分析
1.5.1 真菌群落多样性分析和相似度分析
用 Peak Scanner软件分析各样品的T-RFLP图谱,去掉引物峰及杂峰,其中T-RF小于50 bp为引物峰,相对峰面积(每个限制性片段的峰面积除以累计峰面积)小于0.5%为杂峰[15- 16]。单个T-RF(Terminal Restriction Fragment) 的相对峰面积(Ap) 按照公式Ap=ni/N×100计算,式中ni代表每个可分辨的T-RF 的峰面积,N代表所有T-RF 峰面积的总和[17]。以图谱中每一个可统计的T-RF,视为一个OTU(Operational Taxonomic Unit)。根据图谱中OTU 的数目及其丰度通过BIO-DAP程序(http://nhsbig.inhs.uiuc.edu/wes/populations.html)计算样品的多样性指数 (H)、优势度指数(D)、丰富度指数 (SR) 和均匀度指数 (E)[18- 19]。同时,计算18个样品两两之间的Sorenson相似指数:Cs=2NAB/(NA+NB),式中NAB指A、B两个样品共有的条带数目(相差士l bp内算同一条带),NA、NB指A、B两样品各自的条带数。
1.5.2 聚类分析和主成分分析
根据T-RFs在不同样品图谱中的分布及丰度,采用SPSS软件对18个样品进行主成分分析(PCA)和聚类分析。
2 结果与分析
2.1 连作果园土壤样品的理化性状
由表1数据可以看出,磁窑、道朗和金城连作园的土壤样品间理化指标差异显著,各采样地行间、树穴和株间处理间的土壤样品间理化指标差异显著,且0—30 cm和30—60 cm土层的理化指标也差异显著(P≤0.05)。除个别样品外,0—30 cm土层的铵态氮(NH-N)、硝态氮(NO-N)、速效磷(P)、速效钾(K)和有机质(TOC)的含量要高于30—60 cm土层,且达显著性差异;金城连作园各处理的硝态氮、速效磷、速效钾和有机质含量均高于磁窑、道朗连作园,且达显著性差异;而磁窑和金城连作园0—30 cm土层各处理的铵态氮含量均高于道朗连作园,且达显著性差异,在30—60 cm土层各处理的铵态氮含量道朗、金城连作园均高于磁窑连作园。
2.2 不同样品的土壤真菌T-RFLP 分析结果
限制性内切酶的种类是影响T-RFLP 结果的关键因素[20]。不同限制性内切酶的酶切所获T-RFs 数量不同, 段魏魏[21]等研究发现酶HhaⅠ相对于Hae Ⅲ更适合分析真菌的群落多样性,本实验利用限制性内切酶HhaⅠ对磁窑、道朗和金城连作园样品的土壤真菌ITS 区进行酶切,T-RFLP 分析结果见图1。从图1 可以看出,酶切谱带清晰,T-RFs 比较明显,酶切片段在50—600 bp 之间,不同样品间真菌群落存在明显差异。
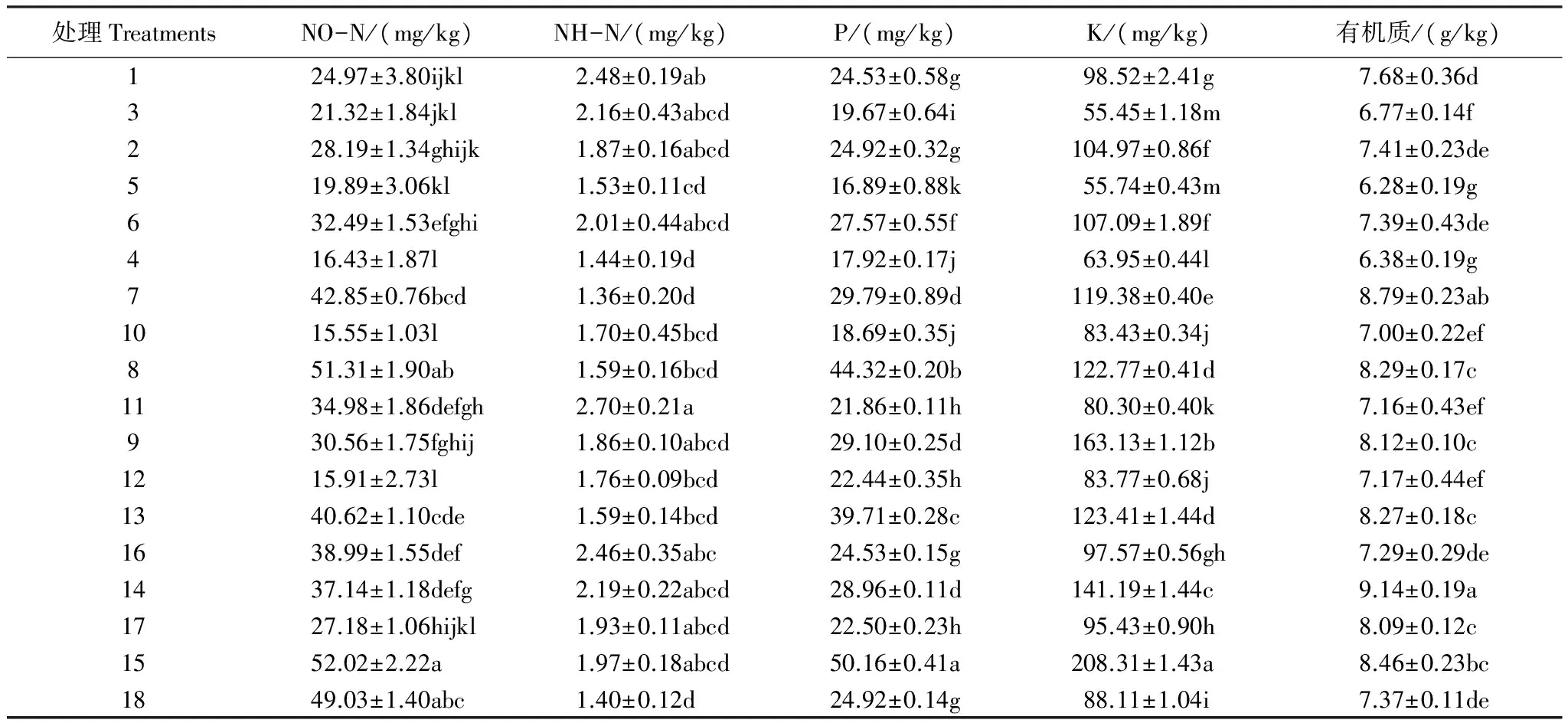
表1 样品的理化性状
Duncan′s 检测,同列不同小写字母表示 0.05 水平上差异显著;1. 磁窑行间0—30 cm(Ciyao inter-row top soil);2. 磁窑树穴0—30 cm (Ciyao tree hole top soil) ;3. 磁窑行间30—60 cm (Ciyao inter-row subsoil;4. 磁窑株间30—60 cm (Ciyao between the trees subsoil;5. 磁窑树穴30—60 cm(Ciyao tree hole subsoil);6. 磁窑株间0—30 cm (Ciyao between the trees top soil);7. 道朗行间0—30 cm (Daolang inter-row top soil);8. 道朗树穴0—30 cm (Daolang tree hole top soil);9. 道朗株间0—30 cm (Daolang between the trees top soil);10. 道朗行间30—60 cm (Daolang inter-row subsoil);11. 道朗树穴30—60 cm (Daolang tree hole subsoil);12. 道朗株间 30—60 cm (Daolang between the trees subsoil);13. 金城行间0—30 cm(Jincheng inter-row top soil);14. 金城树穴0—30 cm (Jincheng tree hole top soil);15. 金城株间0—30 cm(Jincheng between the trees top soil);16. 金城行间30—60 cm(Jincheng inter-row subsoil);17. 金城树穴30—60 cm (Jincheng tree hole subsoil);18. 金城株间30—60 cm(Jincheng between the trees subsoil)
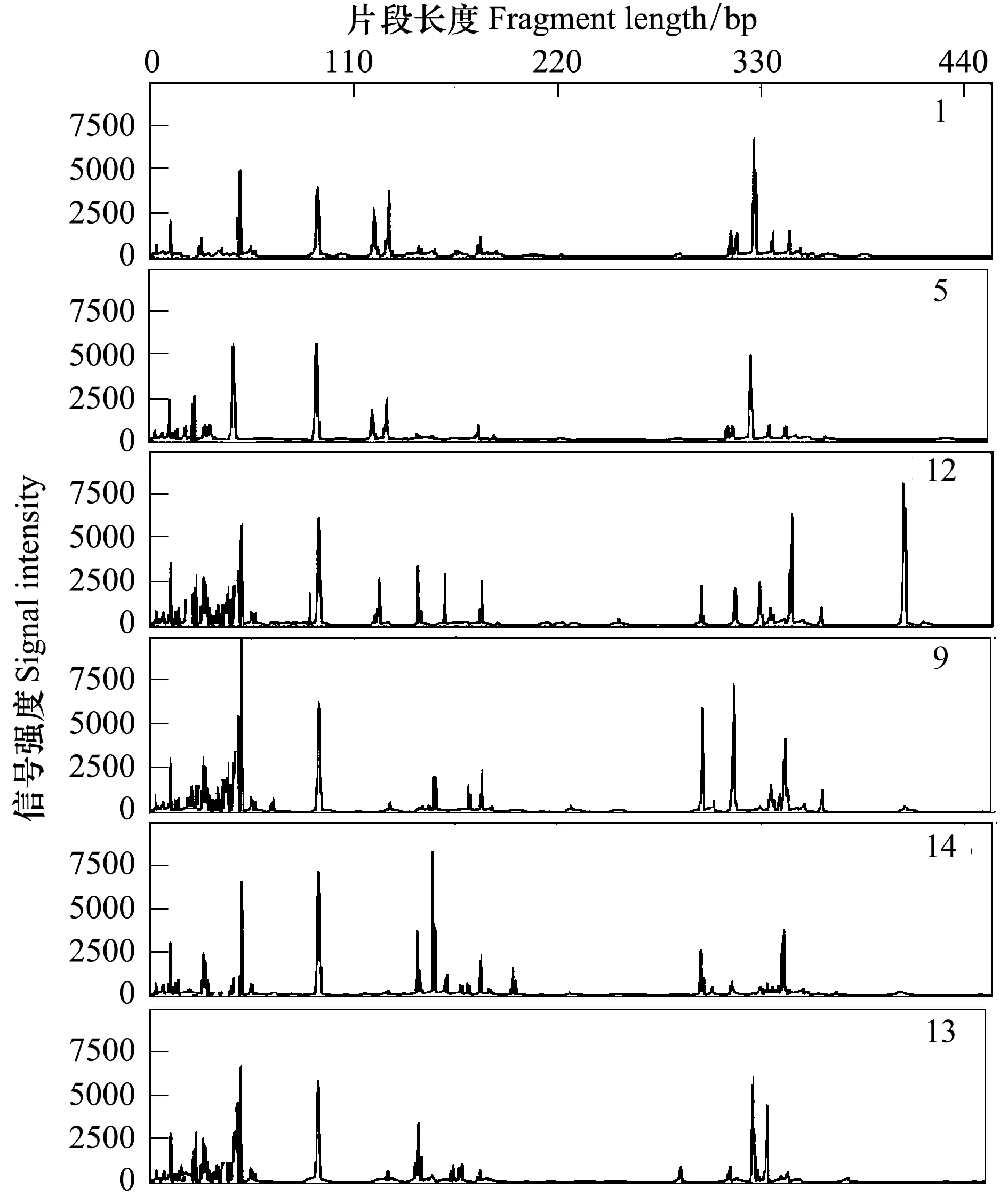
图2 连作果园的土壤样品的T-RFLP图谱Fig.2 T-RFLP profiles of soil samples in apple replanted ochard
2.3 不同样品的土壤真菌多样性分析
根据T-RFLP图谱中OTU的数量、种类及丰度,分别计算了3个地区18个土壤样品的真菌多样性指数(表2)。在0—30 cm土层,金城连作园树穴处理具有最高的多样性指数、均匀度指数、丰富度指数和最低的优势度指数;磁窑、道朗连作园的树穴处理也具有较高的多样性指数、均匀度指数、丰富度指数和较低的优势度指数。在30—60 cm土层,磁窑连作园的行间、树穴和株间处理均具有最低的多样性指数、均匀度指数、丰富度指数和最高的优势度指数,而除金城行间外,道朗、金城连作园的行间、树穴和株间处理均具有较高的多样性指数、均匀度指数、丰富度指数和较低的优势度指数。总体来说,除道朗株间处理外,0—30 cm土层的土壤真菌的多样性指数、均匀度指数、丰富度指数均高于30—60 cm土层,优势度指数的趋势正好相反。
2.4 不同样品间相似性分析
根据18个样品间相同的T-RFs计算出相似系数(表3),根据T-RFs及其相对峰面积对各样品进行了聚类分析(图3)。
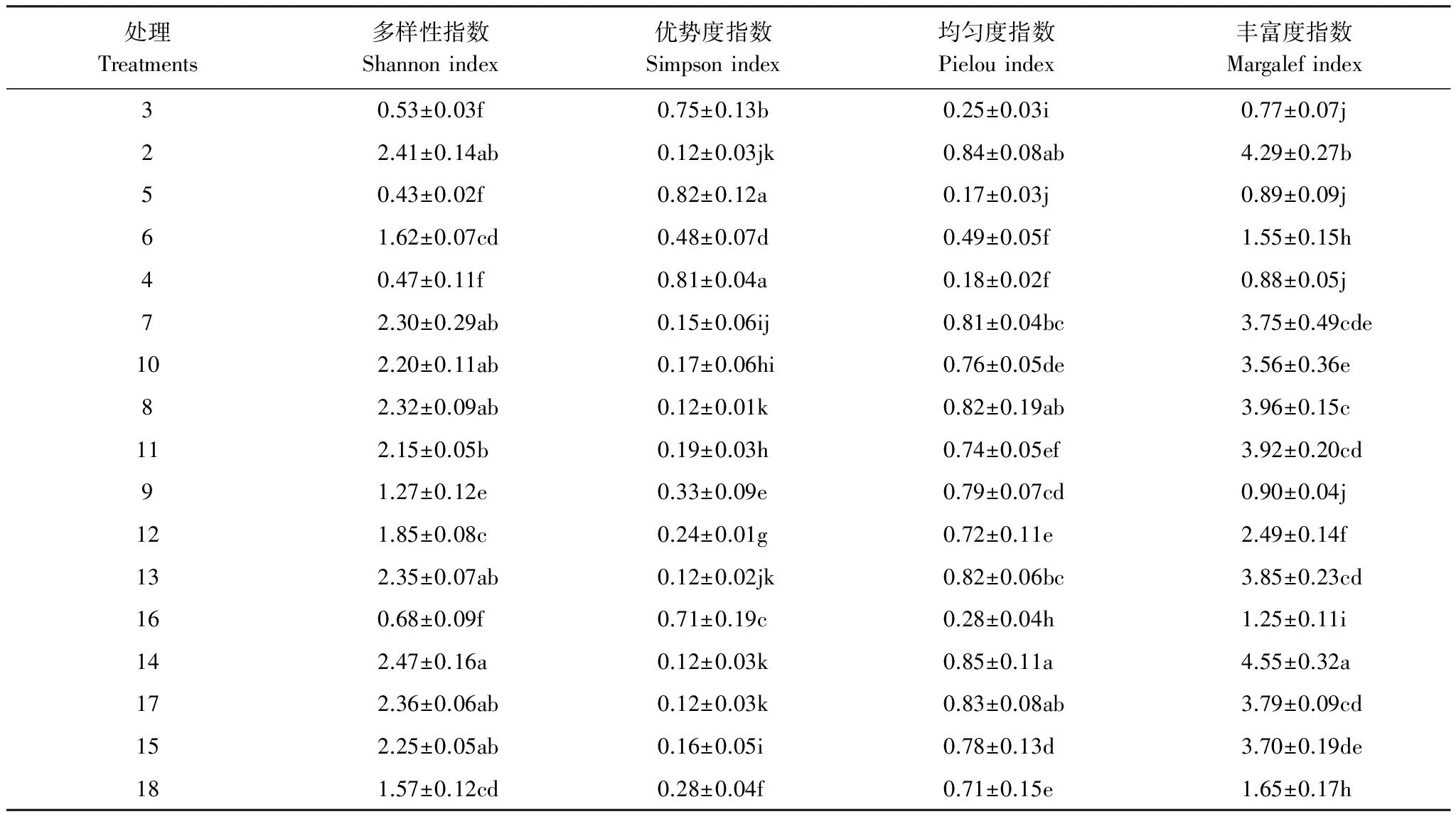
表2 土壤真菌多样性分析
Duncan′s 检测,同列不同小写字母表示 0.05 水平上差异显著
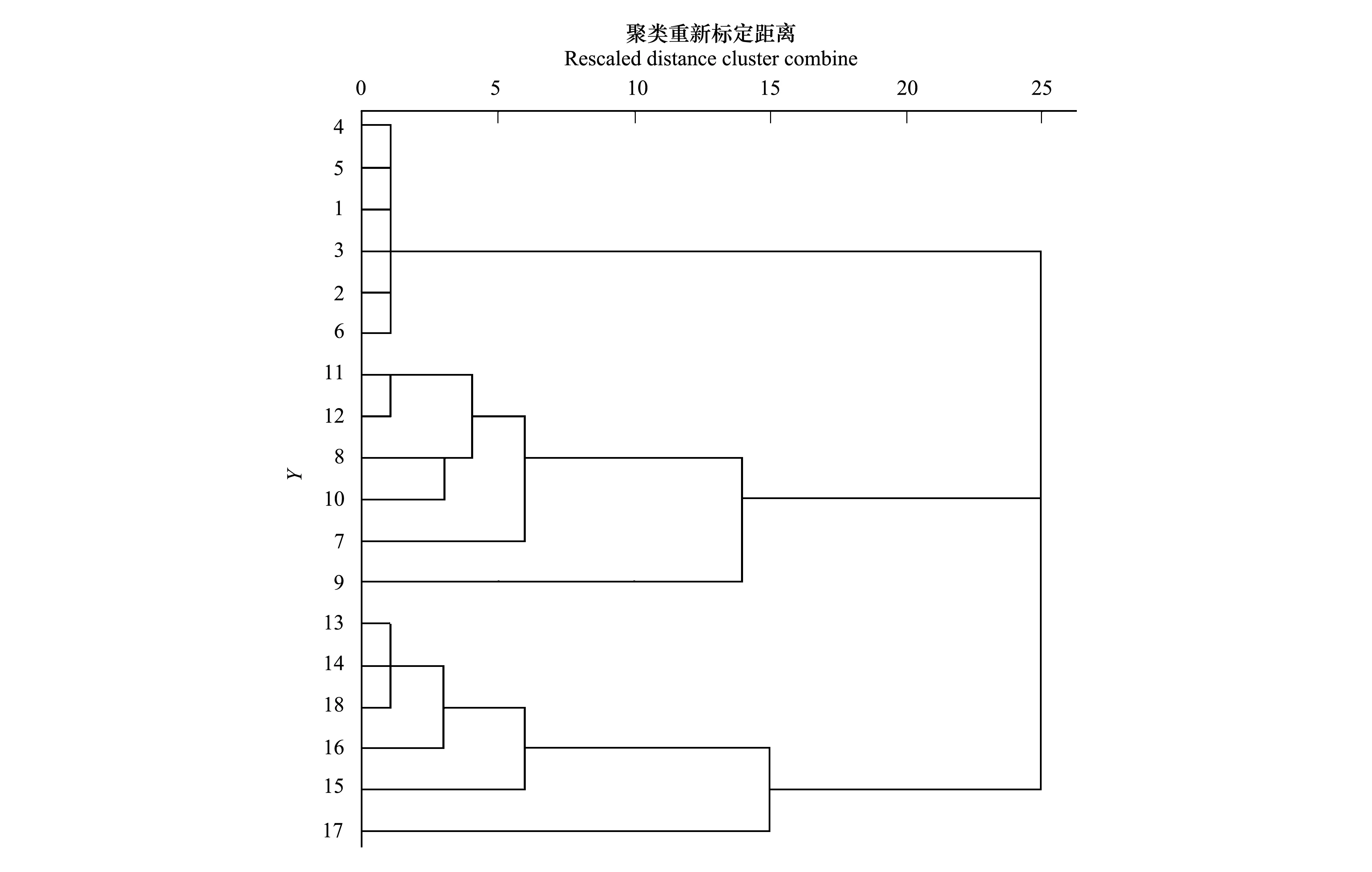
图3 不同样品间T-RFLP图谱的聚类分析Fig.3 Cluster analysis of T-RFLP patterns of different samples
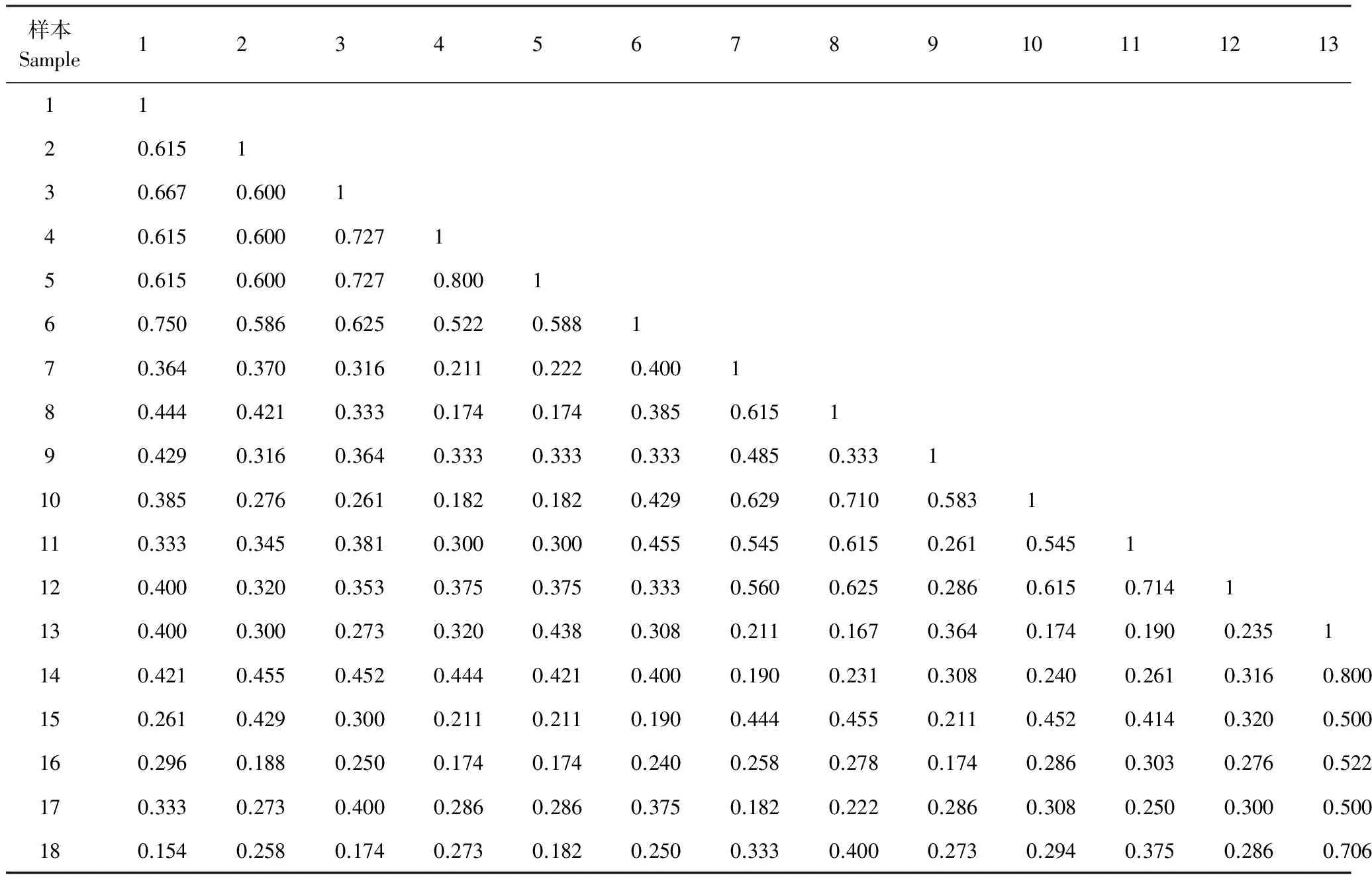
表3 各样品间相似系数
根据Jaccard[22]相似性系数原理,当Cs值为0.00—0.25时,为极不相似;当Cs值为0.25—0.75时,为中等相似;当Cs值为0.75—1.00时,为极相似。由各样品间的相似系数和聚类分析可知,磁窑连作园各样品之间土壤真菌相似性系数很高,在0.522—0.800之间,根据Jaccard 相似性原理,处于极相似与中等相似之间,以4号(磁窑株间30—60 cm)与5号(磁窑树穴30—60 cm)样品之间的相似度最高,相似系数达到0.800;道朗连作园各样品之间土壤真菌相似性系数在0.261—0.714之间,处于中等相似与中等不相似之间,以11号(道朗树穴30—60 cm)与12号(道朗株间30—60 cm)样品之间的相似度最高,相似系数达到0.714;金城连作园各样品之间土壤真菌相似性系数在0.435—0.800之间,金城30—60 cm土层行间、树穴、株间各样品之间处于中等相似与中等不相似之间,其他各样品之间处于极相似与中等相似之间。磁窑、道朗和金城连作园的各样品之间土壤真菌群落结构的相似性则处于极不相似与中等不相似之间。
2.5 基于T-RFLP的主成分分析
根据主成分的提取原则,被选的主成分所代表的主轴总长度占所有主轴长度之和的大约85%即可,本文对各样品获得的所有数据进行主成分分析,前3个主成分特征值的贡献率总和为83.8%,后面的特征值的贡献越来越少,所以本文选取3个主成分来进行分析(图4)。由图4可以看出,磁窑、道朗和金城连作园的所有样品可以分为3个相对独立的群,磁窑连作园的所有样品具有最高的第一主成分得分和较低的第二、第三主成分得分;道朗连作园的所有样品仅具有最高的第二主成分得分;金城连作园的所有样品仅具有最高的第三主成分得分。磁窑、道朗和金城连作园的土壤真菌群落结构均有明显差异,各自构成1个独立的群落结构。
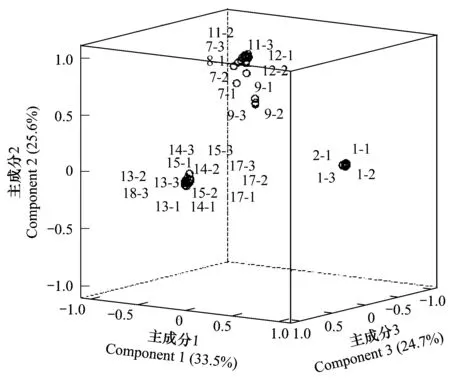
图4 不同样品间T-RFLP图谱的主成分分析Fig.4 PCA for T-RFLP patterns of different samples图中阿拉伯数字1,2,3代表每个样品进行的3次平行重复
3 讨论
连作障碍的发生与根际微生态系统的失衡密切相关,长期连作可导致根际微生物群落结构和功能多样性改变,降低有益微生物数量,增加土传病害菌数量,从而导致作物减产[23- 24]。果树连作障碍不仅导致病原菌如疫霉、腐霉和丝核菌等种群数量的明显增加,而且还影响土壤微生物的种群结构,在未栽培果树土壤中以腐生真菌、巨大芽孢杆菌和洋葱伯克霍尔德菌等细菌为主,而连作土壤则以病原真菌为主[25]。已报道与苹果连作障碍有关的主要致病真菌属有柱孢属、镰刀属、丝核属、疫霉属和腐霉属等[26- 27]。Tewoldemedhin[5]从连作果园苹果腐烂的根中分离到了大量的尖孢镰刀菌。Van Schoor[4]研究发现在南非所有连作苹果园中土壤有害真菌镰刀属、柱孢属以及腐霉属是引起连作障碍的主要原因,真菌是某些地区导致苹果连作障碍的主要原因,病原菌往往是许多真菌组成的真菌复合体。
多样性分析结果显示连作苹果园不同取样位置的真菌多样性存在差异,磁窑、道朗和金城三片连作园中均表现为树穴处理具有最高的多样性指数、均匀度指数、丰富度指数和最低的优势度指数,可能是因为树穴中残留许多老果树根系向土壤环境释放的代谢产物,其主要包括糖类、蛋白质、氨基酸、维生素以及有机酸、酚类等化合物[28],其中很多低分子量的化合物可作为化感物质影响植物根际土壤中微生物群落[29- 30]。当根系分泌物中自毒物质积累较少时,根系分泌物给病原菌提供丰富的营养,从而使病原菌数量和种类较丰富,多样性指数较高[31]。张淑香等[32]和刘金波等[33]证明连作后根系分泌物的数量增多会诱导土壤真菌数量的增加。众多研究也表明,连作导致致病真菌的增加绝不是偶然现象,而是与连作及连作产生分泌物密切相关[34]。这些物质对微生物和植株具有自毒作用,连续种植可导致其积累,进而发生连作障碍[35]。
微生物是土壤生态系统中最具活力的组成部分。根际是植物与土壤环境接触的重要界面,植物根系以多种形式向周围的土壤释放有机物质,并以其自身的活动影响这部分土壤的理化及生物学性状,特别是影响微生物区系的发育[36]。自然条件下,不同的植物根系有不同的分泌物、不同的根部碎片和其它有机成分,形成根际独特而稳定的微生物区系[37]。砧木、树势及季节变化等因子对土壤微生物的种群结构、分布和数量均有显著影响[38]。马宁宁等[39]研究发现对于土壤土著微生物来说,土著真菌的群落结构稳定性优于土著细菌,优势种群没有因为受到温度、湿度、人为耕作措施等的影响而消失。PCA和聚类分析结果显示磁窑、道朗和金城连作园的土壤真菌群落结构均有明显差异,且磁窑、道朗和金城连作园的土壤真菌群落结构处于极不相似与中等不相似之间,说明磁窑、道朗和金城连作园土壤中已经形成了稳定的土著真菌群落,这些群落能够适应磁窑、道朗和金城连作园各自土壤环境中的变化并成为环境的优势群落,各自构成1个独立的群落结构。
苹果连作障碍的病因复杂,土壤真菌对重茬再植植株的影响起着重要的作用,不同地区病因不同,即使同一地区,主要病因也存在细微差别[3]。导致连作障碍发生的原因很多,如植物种类、土壤类型、栽培措施、连作年限等,果树的长期定植引起了土壤理化性质及土壤微生物数量、活性、多样性及种群结构的改变,果园土壤有机质含量降低、土壤酸化、微生物数量减少、活性及多样性改变是土壤质量退化的标志[40],但最重要的是连作改变了土壤微生物的种群结构和数量,一些依赖于植物及其代谢产物的微生物种群(尤其是病原菌)数量逐渐转变为优势种群,相反,一些受植物代谢产物抑制的微生物种群(一些有益微生物)数量将逐渐降低。连作后的这种有益与有害微生物种群结构和数量的失衡,土壤真菌群落结构变化可能是导致连作障碍严重发生的重要原因之一。
[1] Tewoldemedhin T Y, Mazzola M, Mostert L, McLeod A.Cylindrocarponspecies associated with apple tree roots in South Africa and their quantification using real-time PCR. European Journal of Plant Pathology, 2011, 129(4): 637- 651.
[2] Sun H B, Mao Z Q, Zhu S H. Changes of phenolic acids in the soil of replanted apple orchards surrounding Bohai Gulf. Acta Ecologica Sinica, 2011, 31(1): 90- 97.
[3] Manici L M, Ciavatta C, Kelderer M, Erschbaumer G. Replant problems in South Tyrol: Role of fungal pathogens and microbial population in conventional and organic apple orchards. Plant and Soil, 2003, 256(2): 315- 324.
[4] van Schoor L, Denman S, Cook N C. Characterisation of apple replant disease under South African conditions and potential biological management strategies. Scientia Horticulturae, 2009, 119(2): 153- 162.
[5] Tewoldemedhin Y T, Mazzola M, Botha W J, Spies C F J, McLeod A. Characterization of fungi (FusariumandRhizoctonia) and oomycetes (PhytophthoraandPythium) associated with apple orchards in South Africa. European Journal of Plant Pathology, 2011, 130(2): 215- 229.
[6] Urashima Y, Sonoda T, Fujita Y, Uragami A. Application of PCR-Denaturing-Gradient Gel Eleetrophoresis (DGGE) method to examine microbial community structure in asparagus fields with growth inhibition due to continuous cropping. Microbes and Environments, 2012, 27(1): 43- 48.
[7] Li Y M, Hu J C, Zhang J, Wang S L, Wang S J. Microbial diversity in continuously planted Chinese fir soil. Chinese Journal of Applied Ecology, 2005, 16(7): 1275- 1278.
[8] Li K, Guo X W, Sun Y N, Zhang L H, Hu X X. Effects of grape-replanting on soil bacterial and fungal populations. Chinese Journal of Applied Ecology, 2009, 20(12): 3109- 3114.
[9] Horton T R, Bruns T D. The molecular revolution in ectomycorrhizal ecology: Peeking into the black-box. Molecular Ecology, 2001, 10(8): 1855- 1871.
[10] Bridge P, Spooner B. Soil fungi: Diversity and detection. Plant and Soil, 2001, 232(1/2): 147- 154.
[11] Yu S L, Wu X L, Qian Y. Application and optimization of T-RFLP method for microbial community analysis. Journal of Chinese Applied and Environmental Biology, 2006, 12(6): 861- 868.
[12] Wang H Y, Guan H S, Jiang X L. Molecular approaches studying on microbial ecology and T-RFLP technique. Journal of Chinese Biotechnology, 2004, 24(8): 42- 47.
[13] Bao S D. Soil Chemical Analysis. 3rd ed. Beijing: China Agriculture Press, 2000: 34- 35, 81- 83, 106- 107.
[14] Shao L, Wang L X, Zhang M, Sun Z J. Effects of different controlled-release fertilizers and nitrogen level on N, P, K use efficiency. Journal of Soil and Water Conservation, 2009, 23(4): 170- 175.
[15] Fierer N, Schimel J P, Holden P A. Influence of drying-rewetting frequency on soil bacterial community structure. Microbial Ecology, 2003, 45(1): 63- 71.
[16] Manzano M, Morán A C, Tesser B, Gonzalez B. Role of eukaryotic microbiota in soil survival and catabolic Performance of the 2, 4-D herbicide degrading bacteriaCupriavidusnecatorJMP134. Antonie van Leeuwenhoek, 2007, 91(2): 115- 126.
[17] Lukow T, Dunfield P F, Liesack W. Use of the T-RFLP technique to assess spatial and temporal changes in the bacterial community structure within an agricultural soil planted with transgenic and non-transgenic potato plants. FEMS Microbiology Ecology, 2000, 32(3): 241- 247.
[18] Sun J, Liu D Y. The application of diversity indices in marine phytoplankton studies. Acta Oceanologica Sinica, 2004, 26(1): 62- 75.
[19] Yuan S Q, Xue Y F, Gao P, Wang W D, Ma Y H. Microbial diversity in Shengli petroleum reservoirs analyzed by T-RFLP. Acta Microbiologica Sinica, 2007, 47(2): 290- 294.
[20] Jia J T, Song L S, Li J. T-RFLP technique and its application in research on microbial community structure. Marine Science, 2004, 28(3): 64- 68.
[21] Duan W W, Lou K, Zeng J, Hu R, Shi Y W, He Q, Liu X C, Sun J, Chao Q F. Analysis on fungal diversity of air microbial communities from sandstorm source areas of the Taklamakan desert in Xinjiang. Xinjiang Agricultural Sciences, 2011, 48(4): 769- 775.
[22] Jaccard P. étude comparative de la distribution florale dans une portion des Alpes et des Jura. Bulletin del la Société vaudoise des Sciences Naturelles, 1901, 37: 547- 579.
[23] Zhang Z Y, Chen H, Yang Y H, Chen T, Lin R Y, Chen X J, Lin W X. Effects of continuous cropping on bacterial community diversity in rhizosphere soil ofRehmanniaglutinosa. Chinese Journal of Applied Ecology, 2010, 21(11): 2843- 2848.
[24] Liu J G, Zhang W, Li Y B, Sun Y Y, Bian X M. Effects of long-term continuous cropping system of cotton on soil physical-chemical properties and activities of soil enzyme in oasis in Xinjiang. Scientia Agricultura Sinica, 2009, 42(2): 725- 733.
[25] Mazzola M. Transformation of soil microbial community structure andRhizoctonia-suppressive potential in response to apple roots. Phytopathology, 1999, 89(10): 920- 927.
[26] Dullahide S R, Stirling G R, Nikulin A, Stirling A M. The role of nematodes, fungi, bacteria, and abioticfactors in the etiology of apple replant problems in the Granite Belt of Queensland. Australian Journal of Experimental Agriculture, 1994, 34(8): 1177- 1182.
[27] Mazzola M. Elucidation of the microbial complex having a causal role in the development of apple replant disease in Washington. Phytopathology, 1998, 88(9): 930- 938.
[28] Kong C H, Wang P, Zhao H, Xu X H, Zhu Y D. Impact of allelochemical exuded from allelopathic rice on soil microbial community. Soil Biology and Biochemistry, 2008, 40(7): 1862- 1869.
[29] Landi L, Valori F, Ascher J, Renella G, Falchini L, Nannipieri P. Root exudate effects on the bacterial communities, CO2evolution, nitrogen transformations and ATP content of rhizosphere and bulk soils. Soil Biology and Biochemistry, 2006, 38(3): 509- 516.
[30] Broeckling C D, Broz A K, Bergelson J, Manter D K, Vivanco J M. Root exudates regulate soil fungal community composition and diversity. Applied and Environmental Microbiology, 2008, 74(3): 738- 744.
[31] Zhao X L, Liu X H, He J Z, Wan C X, Gong M F, Zhang L L. Effects of cotton root exudates on available soil nutrition, enzyme activity and microorganism quantity. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(7): 1426- 1431.
[32] Zhang S X, Gao Z Q, Liu H L. Continuous cropping obstacle and rhizospheric microecology Ⅲ. Soil phenolic acids and their biological effect. Chinese Journal of Applied Ecology, 2000, 11(5): 741- 744.
[33] Liu J B, Xu Y L, Lü G Z, Li C J, Zhao Z H, Wei W. Black soil regionFusariumpopulation structure and quantity in soybean rhizosphere of different rotation system. Soybean Science, 2009, 28(1): 97- 102.
[34] Wang S Q, Han X Z, Qiao Y F. Allelopathy of root exudates and their effects on rhizosphere microorganism. Chinese Journal of Soil Science, 2007, 38(6): 1219- 1225.
[35] Qiu L Y, Qi Y C, Wang M D, Jia X C. Relationship between secondary metabolite autotoxic to plant and continuous cropping obstacles. Soils, 2010, 42(1): 1- 7.
[36] Nihorimbere V, Ongena M, Smargiassi M, Thonart P. Beneficial effect of the rhizosphere microbial community for plant growth and health. Biotechnology, Agronomy, Society and Environment, 2011, 15(2): 327- 337.
[37] Xu Y X, Wang G H, Jin J, Liu J J, Zhang Q Y, Liu X B. Bacterial communities in soybean rhizosphere in response to soil type, soybean genotype, and their growth stage. Soil Biology and Biochemistry, 2009, 41(5): 919- 925.
[38] Xu H, Yang H S, Xu Y, Mao Z Q, Shu H R. Research progress on rhizosphere environment of fruit trees. Journal of Shandong Agricultural University: Natural Science Edition, 2004, 35(3): 476- 480.
[39] Ma N N, Li T L. Effect of long-term continuous cropping of protected tomato on soil microbial community structure and diversity. Acta Horticulturae Sinica, 2013, 40(2): 255- 264.
[40] Li Z W, Wang C, Chen W, Shu H R. Biological characteristics of soil microorganisms in apple orchards with different ages. Chinese Journal of Soil Science, 2011, 42(2): 302- 306.
参考文献:
[2] 孙海兵, 毛志泉, 朱树华. 环渤海湾地区连作苹果园土壤中酚酸类物质变化. 生态学报, 2011, 31(1): 90- 97.
[7] 李延茂, 胡江春, 张晶, 汪思龙, 王书锦. 杉木连栽土壤微生物多样性的比较研究. 应用生态学报, 2005, 16(7): 1275- 1278.
[8] 李坤, 郭修武, 孙英妮, 张立恒, 胡禧熙. 葡萄连作对土壤细菌和真菌种群的影响. 应用生态学报, 2009, 20(12): 3109- 3114.
[11] 余素林, 吴晓磊, 钱易. 环境微生物群落分析的T-RFLP 技术及其优化措施. 应用与环境生物学报, 2006, 12(6): 861- 868.
[12] 王洪媛, 管华诗, 江晓路. 微生物生态学中分子生物学方法及T-RFLP 技术研究. 中国生物工程杂志, 2004, 24(8): 42- 47.
[13] 鲍士旦. 土壤农化分析 (第三版). 北京: 中国农业出版社, 2000: 34- 35, 81- 83, 106- 107.
[14] 邵蕾, 王丽霞, 张民, 孙治军. 控释肥类型及氮素水平对氮磷钾利用率的影响. 水土保持学报, 2009, 23(4): 170- 175.
[18] 孙军, 刘东艳. 多样性指数在海洋浮游植物研究中的应用. 海洋学报, 2004, 26(1): 62- 75.
[19] 袁三青, 薛燕芬, 高鹏, 汪卫东, 马延和. T-RFLP技术分析油藏微生物多样性. 微生物学报, 2007, 47(2): 290- 294.
[20] 贾俊涛, 宋林生, 李筠. T-RFLP 技术及其在微生物群落结构研究中的应用. 海洋科学, 2004, 28(3): 64- 68.
[21] 段魏魏, 娄恺, 曾军, 胡蓉, 史应武, 何清, 刘新春, 孙建, 晁群芳. 新疆沙尘暴源区塔克拉玛干空气真菌群落的T-RFLP 分析. 新疆农业科学, 2011, 48(4): 769- 775.
[23] 张重义, 陈慧, 杨艳会, 陈婷, 林瑞余, 陈新建, 林文雄. 连作对地黄根际土壤细菌群落多样性的影响. 应用生态学报, 2010, 21(11): 2843- 2848.
[24] 刘建国, 张伟, 李彦斌, 孙艳艳, 卞新民. 新疆绿洲棉花长期连作对土壤理化性状与土壤酶活性的影响. 中国农业科学, 2009, 42(2): 725- 733.
[31] 赵小亮, 刘新虎, 贺江舟, 万传星, 龚明福, 张利莉. 棉花根系分泌物对土壤速效养分和酶活性及微生物数量的影响. 西北植物学报, 2009, 29(7): 1426- 1431.
[32] 张淑香, 高子勤, 刘海玲. 连作障碍与根际微生态研究 Ⅲ. 土壤酚酸物质及其生物学效应. 应用生态学报, 2000, 11(5): 741- 744.
[33] 刘金波, 许艳丽, 吕国忠, 李春杰, 赵志慧, 魏巍. 黑土区不同轮作系统大豆根际镰孢菌种群结构和数量. 大豆科学, 2009, 28(1): 97- 102.
[34] 王树起, 韩晓增, 乔云发. 根系分泌物的化感作用及其对土壤微生物的影响. 土壤通报, 2007, 38(6): 1219- 1225.
[35] 邱立友, 戚元成, 王明道, 贾新成. 植物次生代谢物的自毒作用及其与连作障碍的关系. 土壤, 2010, 42(1): 1- 7.
[38] 许衡, 杨和生, 徐英, 毛志泉, 束怀瑞. 果树根际微域环境的研究进展. 山东农业大学学报: 自然科学版, 2004, 35(3): 476- 480.
[39] 马宁宁, 李天来. 设施番茄长期连作土壤微生物群落结构及多样性分析. 园艺学报, 2013, 40(2): 255- 264.
[40] 李智卫, 王超, 陈伟, 束怀瑞. 不同树龄苹果园土壤微生物生态特征研究. 土壤通报, 2011, 42(2): 302- 306.
Assessment of fungal diversity in apple replanted orchard soils by T-RFLP analysis
YIN Chengmiao1, WANG Gongshuai1, LI Yuanyuan2, CHEN Xuesen1, WU Shujing1, MAO Zhiquan1,*
1StateKeyLaboratoryofCropBiology,CollegeofHorticultureScienceandEngineering,ShandongAgriculturalUniversity,Tai′an,Shandong271018,China2QingdaoBrightMoonBlueseaBio-TechCo,LTD,Qingdao,Shandong266400,China
Apple replant disease (ARD) has been reported from all major fruit-growing regions of the world. ARD is a serious problem in about half of old orchard sites surveyed, with typical symptoms including stunted above- and below-ground tree growth, necrosis of feeder roots, water stress and nutrient deficiencies. The etiology of ARD is complex and causal agents vary among different sites and regions. In most sites, biotic factors seem to be prevalent, including nematodes, bacteria, actinomycete, oomycetes and fungi species thought thatPratylenchuspenetranswas the primary nematode species involved in ARD. Although several bacterial genera and species have been associated and suggested as being involved in ARD, most bacteria likely impaired plant at inordinately high densities. Evidence for the involvement of actinomycetes in ARD is circumstantial. However, most researches demonstrated fungal and oomycete genera were the main reason for apple replant disease, i.e. fungal genera:Fusarium,Rhizoctonia,Cylindrocarpon; oomycete genera:Phytophthora,Pythium. To investigate the spatial structure of soil fungal community structure in replanted orchards, three replanted orchards in Ciyao, Daolang and Jincheng town were used to take soil samples, which were collected from 0—30 cm and 30—60 cm depth of the row, inter-row and tree hole, respectively. T-RFLP (Terminal Restriction Fragment Length Polymorphism) was applied in the analysis of soil fungal diversity. Based on the T-RFLP pattern differences, diversity index analysis, cluster analysis and principal component analysis (PCA) were combined to do the further analysis of soil fungal diversity from different orchards. The results indicated that soil fungal diversity differed in three orhcards, Shannon diversity index, Pielou evenness index and Simpson index in all samples were between 0.43—2.47, 0.17—0.85 and 0.12—0.81, respectively. The highest Margalef richness index (R=4.55) was observed at 0—30 cm soil layer of tree hole in Jincheng and the lowest value (R=0.77) was obtained at 30—60 cm soil layer of tree inter-row in Ciyao. In all investigated sites and soil layers, original tree hole showed the highest diversity index, evenness index, richness index and the lowest Simpson index. Soil fungal diversity index, evenness index, richness index of 0—30 cm soil layer were higher than those of 30—60 cm soil layer; however, Simpson index expressed a reverse trend. PCA and cluster analysis indicated that soil fungi of Ciyao, Daolang and Jincheng formed independent community structure, respectively, and these communities could adapt to their own specific soil environment and became the dominant population.
apple replanted orchards; soil fungi; T-RFLP
现代农业产业技术体系建设专项资金资助项目(CARS- 28); 山东省农业重大应用技术创新课题资助项目; 教育部长江学者和创新团队发展计划资助项目(IRT1155)
2013- 06- 24;
2013- 11- 08
10.5846/stxb201306241765
*通讯作者Corresponding author.E-mail: mzhiquan@sdau.edu.cn
尹承苗, 王功帅, 李园园, 陈学森, 吴树敬,毛志泉.连作苹果园土壤真菌的T-RFLP分析.生态学报,2014,34(4):837- 846.
Yin C M, Wang G S, Li Y Y, Chen X S, Wu S J, Mao Z Q.Assessment of fungal diversity in apple replanted orchard soils by T-RFLP analysis.Acta Ecologica Sinica,2014,34(4):837- 846.
