多不饱和脂肪酸及其抗癌作用研究进展*
2014-08-08姚世勇殷钟意郑旭煦
姚世勇, 刘 通, 刘 荣, 殷钟意, 郑旭煦,**
(1.重庆工商大学 环境与生物工程学院,重庆 400067;2.重庆工商大学 催化与功能有机分子重庆市重点实验室,重庆 400067)
近年来的研究已发现多不饱和脂肪酸(Polyunsaturated fatty acids,PUFAs)具有多重生物活性功能,它可以降低血液中胆固醇和甘油三酯的含量、降低血液黏稠度、调节心脑血管、改善血液微循环、增强记忆力和思维能力、提高脑细胞的活性、增强人体防御系统的功能等[1],特别是n-3和n-6型PUFAs通过深入的实验研究及临床应用而被人们所熟知,引起了社会各界的广泛关注。随着人们对PUFAs认识的不断深入,PUFAs的抗癌和预防癌症作用已被多项研究报道。将在归纳总结PUFAs的分类和来源基础上,着重介绍PUFAs的抗癌作用研究进展。
1 PUFAs的分类
PUFAs是指含有两个或者两个以上非共轭顺式双键,碳链长度为16~22个碳原子的直链脂肪酸,双键愈多,不饱和程度愈高,又称多烯脂肪酸[2]。根据不饱和脂肪酸甲基端第一个双键所连碳原子的位置不同,PUFAs可分为n-3、n-6、n-7和n-9等型(也可以用ω编号表示),如表1所示。
n-3和n-6型PUFAs具有重要生物学意义并与人类健康密切相关,很多情况下,这两族PUFAs在功能上相互协调制约,共同调节生物体的生命活动。同时,n-3和n-6型中许多脂肪酸都是人体不可缺少的脂肪酸,如亚油酸、α-亚麻酸、γ-亚麻酸和花生四烯酸等,它们也是许多其它不饱和脂肪酸合成途径中的中间产物,如α-亚麻酸在人体内通过去饱和酶和碳链延长酶的催化作用,最后合成EPA和DHA。
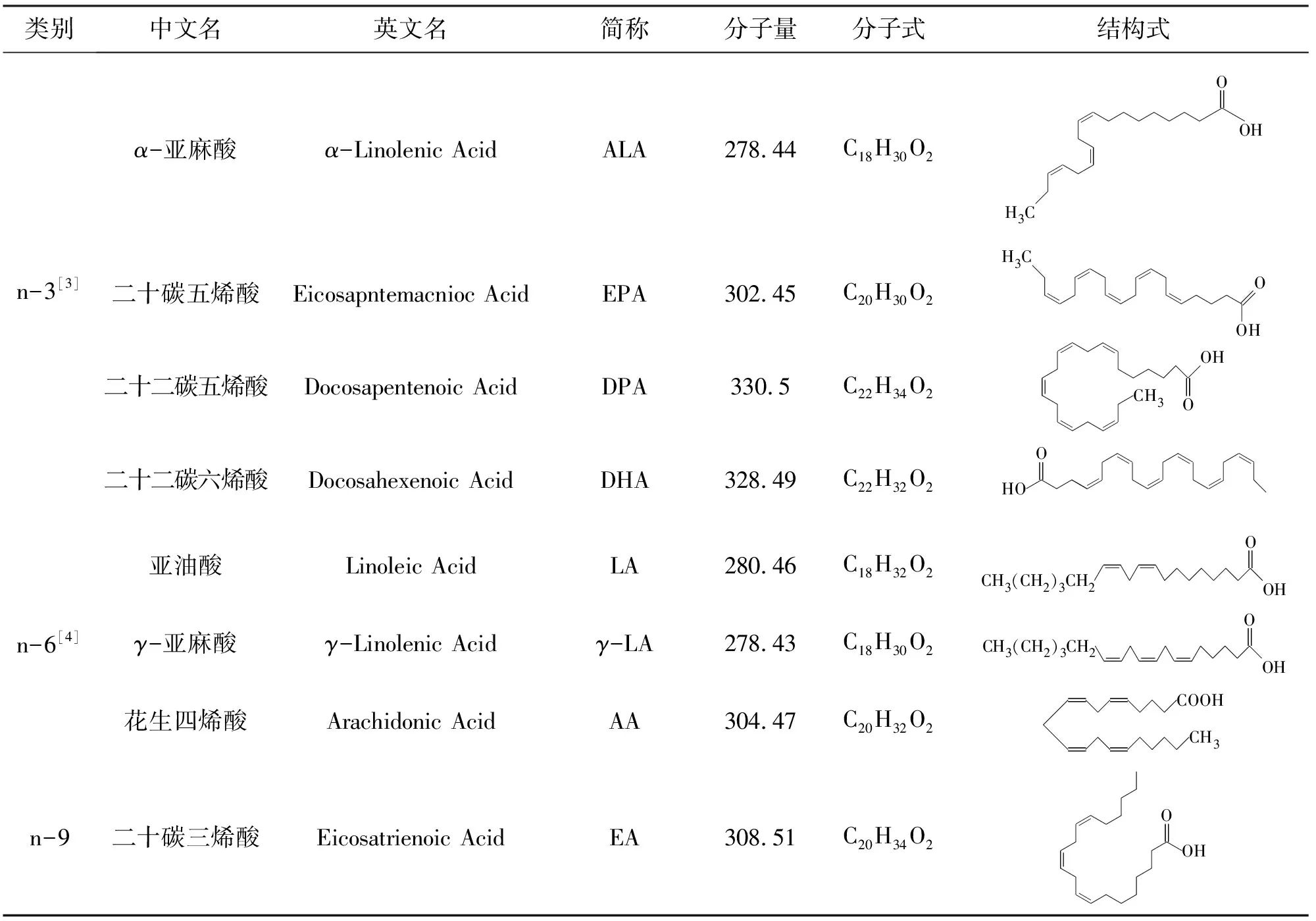
表1 多不饱和脂肪酸的分类
2 PUFAs的来源
2.1 n-3型PUFAs的主要来源
2.1.1 α-亚麻酸的主要来源
α-亚麻酸主要来源于植物油。亚麻籽油、胡桃仁油、牡丹籽仁油和花椒籽仁油中含极丰富的α-亚麻酸,其中以亚麻籽油含量最高(高达57%),花椒籽仁油含量达34.1%[5];常见食用油中大豆油的α-亚麻酸含量较多,而橄榄油的α-亚麻酸含量相对较少。另外,部分食草反刍动物,如牛、羊肉与其奶制品,也可为我们提供α-亚麻酸。
2.1.2 EPA和DHA的主要来源
EPA和DHA这两种高不饱和脂肪酸主要存在于海洋生物中[6],如鱼类、虾类、海藻等,尤其在高脂鱼类及海洋哺乳动物中,EPA和DHA的含量最高。在各种藻类中,金藻纲、黄藻纲、绿藻纲的藻类都能产生高含量的EPA。大型海藻中虽含EPA很高(占其脂类成分30%以上),DHA含量却极少或者不含,但在甲藻纲中,却具有高含量的DHA。另外在某些动物性食物中,尤其是蛋黄、肉、肝及其他内脏中,也含有一定量的EPA。
2.2 n-6型PUFAs的主要来源
2.2.1 亚油酸的主要来源
亚油酸主要存在于植物油脂中,一般植物油脂含有30%以上的亚油酸。其中亚油酸含量较高的有葵花籽油、红花籽油、核桃油,此外玉米油、棉籽油、燕麦油、芝麻油、大豆油、月见草油中都含有较多的亚油酸。
2.2.2 γ-亚麻酸的主要来源
γ-亚麻酸的部分来源为富含多不饱和脂肪酸的植物油。某些不常见的油,如月见草油、琉璃苣油和黑加仑籽油含有较高的γ-亚麻酸,其中月见草油是目前γ-亚麻酸的主要来源。在海洋生物中,螺旋藻属的钝顶螺旋藻和巨大螺旋藻中的PUFAs含量较高,以γ-亚麻酸最具特色。
2.2.3 花生四烯酸的主要来源
花生四烯酸分布较为广泛,许多动物的肝脏、血液磷脂和肾上腺、鱼油、微生物(原生动物、变形虫、微藻类以及真菌)中都含有花生四烯酸。在人脑和神经组织中花生四烯酸的含量可达到总量的40%,传统的花生四烯酸的来源主要有蛋黄、动物脏器和深海鱼油[7]。
3 PUFAs的抗癌作用
3.1 PUFAs的抗癌机制
(1) 诱导肿瘤细胞凋亡。研究发现,n-3型PUFAs可以诱导肿瘤细胞的凋亡。Slagsvold等[8]在结肠癌实验中观察到,在DHA治疗后的动物模型中,抗凋亡因子Bcl家族中的Bcl-2和Bcl-XL的表达下调,促凋亡蛋白、DNA损伤相关基因53∕C∕EBP的同源蛋白表达上调。Blanckaert V等[9]在DHA治疗乳腺癌的试验中发现,caspase-3酶活性升高,肿瘤细胞核中出现染色质固缩等细胞凋亡现象。
(2) 调节肿瘤细胞脂质过氧化。Li等[10]应用前氧化剂枸椽酸铁能有效提高其杀瘤作用,而应用抗氧化剂维生素E或自由基清除剂SOD则将减弱甚至阻断这一作用,表明n-3型PUFAs对肿瘤细胞的杀伤效应可能是由于脂质过氧化反应。
(3) 影响癌基因编码蛋白。Collett等[11]研究表明,给予YAMC-Ras结肠癌细胞系50 μmol/L DHA培养,可以有效抑制其DNA合成,影响癌基因编码相应的蛋白,从而抑制肿瘤细胞增殖。
(4) 抑制肿瘤细胞新生血管形成。肿瘤生长、侵袭和转移需要新生的血管来获得营养物质和能量,在肿瘤的治疗过程中,血管的改变是影响肿瘤大小能否被控制或缩小的关键因素。在小鼠乳腺癌模型研究中,Colas等[12]发现化疗之前给予富含DHA饲养,瘤体的血管密度较对照组降低43%,完成化疗后血管密度降低更加明显。
3.2 PUFAs的抗癌作用研究现状
膳食中的PUFAs对多种癌细胞诱变有独特的调控作用[13]。
(1) 肝癌方面。Lim等[14]研究发现PUFAs中的EPA和DHA对Huh7、HepG2 、Hep3B 3种人肝癌细胞株的增殖均有抑制作用,且DHA的抑制作用更强。Griffitts等[15]发现非哺乳动物的n-3型PUFA脱氢酶基因可以通过将n-6型转化成n-3型PUFAs,从而预防了肝癌的发生。Lee等[16]的研究表明,DHA可减少MHCC97L肝癌细胞在S期和G2/M期的数量,抑制细胞周期进程,从而达到抗癌作用。
(2) 卵巢癌细胞方面。汪成芬等[17]的研究表明,n-3型PUFAs能显著抑制卵巢癌细胞生长,并诱导期凋亡。
(3) 结直肠癌方面。n-3型PUFAs对结直肠癌的治疗作用主要表现为抑制癌细胞增殖和转移,诱导其分化和凋亡,通过抑制胞内信号传导途径,有效抑制结直肠癌细胞的扩散,提高癌症病人的存活率。王思平等[18]在观察血PUFAs水平与结直肠癌的关系试验中得出结论:结直肠癌患者体内血偏低,以n-6型PUFAs更明显,n-3型PUFAs中EPA也显著低于正常人群,这可能与结直肠癌的发生发展有一定的关系。
此外,研究证实,PUFAs也能在一定程度上有效预防前列腺癌、胰腺癌、乳腺癌和胃癌的发生。由此可见,PUFAs可以抑制多种恶性肿瘤细胞增殖,促进细胞凋亡并降低其侵袭力。
3.3 PUFAs对癌症患者术后的影响
癌症患者术后一般伴有严重的癌症并发症。癌症并发症是指在治疗过程中因手术、放化疗而难以避免所产生的一系列综合病症,临床发现:乳腺癌术后并发症主要有炎症反应、上肢淋巴水肿、皮下积液和皮瓣坏死等症状;胰腺癌术后并发症主要有表现为畏寒、高热、腹胀、胃蠕动障碍和白细胞计数增高的腹内脓肿、炎症反应、腹腔出血、消化道出血等严重症状;胃癌术后常见的主要并发症有倾倒综合症、免疫功能失调、呼吸功能障碍和炎症反应等症状。
n-3型PUFAs对癌症患者术后的多种生理功能恢复有益。刘流等[19]在研究华西医院胃肠外科中心确诊并行恶性肿瘤根治性手术的40例胃癌和结直肠癌患者的术后炎症反应和营养状态的影响过程中发现:n-3型PUFAs能够有效减轻胃肠道恶性肿瘤患者术后的炎症反应,改善患者的术后营养状态。庄波等[20]在研究胃癌病人术后凝血功能、抗氧化系统和胃肠蠕动功能中发现:应用n-3型PUFAs对患者身体的凝血功能产生一定的影响,并有一定的抗氧化作用,而且还有利于肠蠕动功能的恢复,减少术后并发症的发生。周锋等[21]也在研究胃癌患者术后炎性反应和术后疲劳综合症中得出结论:n-3型PUFAs能减轻胃癌病人术后的炎性反应和疲劳,促进胃癌患者术后康复。黄凤昌等[22]在研究n-3型PUFAs对恶性胃肠道肿瘤术后病人血液中前降钙素(PCT)水平的影响试验中得到结论:n-3型PUFAs能明显降低恶性胃肠道肿瘤术后病人血液中PCT水平,并能有效地减轻术后全身炎症反应。
4 PUFAs的其他生理功能
PUFAs除了具有降低血液中甘油三酯含量、降低血液黏稠度、增强大脑记忆力和思维能力、改善血液微循环、提高脑细胞的活性、防癌抗癌等多种生理功能外,还具有增强胰岛素、影响细胞生长和肥胖等作用。
4.1 PUFAs具有增强胰岛素的作用
研究发现PUFAs中的γ-亚麻酸有防治糖尿病的作用。由γ-亚麻酸而来的前列腺素等活性物质,可以提高胰岛β-细胞分泌胰岛素的功能,提高肝细胞中胰岛素受体的敏感性,恢复糖尿病人细胞的脂肪酸去饱和酶的活性,使受损的葡萄糖耐受性恢复正常,对糖尿病有防治作用。乐嘉静等[23]利用胰岛素抵抗型糖尿病大鼠模型,研究了海狗油n-3型PUFAs对2型糖尿病的药理学作用,结果表明,海狗油n-3型PUFAs能有效地改善因高血糖、高密度脂蛋白和高甘油三脂血症引起的胰岛素抵抗综合症,提高机体对胰岛素的敏感性。由此可见,PUFAs与胰岛素效用的高低有密切的关系,具有增强胰岛素的作用。
4.2 PUFAs与细胞生长的关系
关于n-3和n-6型PUFAs是如何影响特定组织生长的资料甚少。现有研究显示DHA是脑细胞和视网膜细胞中主要的多不饱和脂肪酸,对脑、视网膜和神经等组织发育有重要的影响。研究发现,对于成年人而言,PUFAs缺乏表征现象极少见,但对于胎儿和婴幼儿生长发育的影响显著。近年来关于在婴幼儿奶中添加长链多不饱和脂肪酸(Long-chain Polyunsaturated Fatty Acids,LCPUFAs)的临床实验和研究大多显示其可促进视力发育。
4.3 PUFAs与肥胖的关系
近年来研究显示,PUFAs与肥胖的发生有密切关系,肥胖的发生不仅取决于膳食脂肪量,也取决于脂肪酸种类和构成,特别是PUFAs的种类和构成,且膳食脂肪酸的构成变化可能是肥胖发生的重要原因。王彦武等[24]的研究发现,α-亚麻酸具有控制肥胖模型大鼠体重增长及减轻肥胖模型大鼠体内脂肪堆积的作用,即α-亚麻酸具有减肥作用。
5 结 语
综上所述,PUFAs是人体中不可缺少的重要营养物质,有着重要的生理和药理作用,特别是n-3型PUFAs和n-6型PUFAs在体内的平衡是维持人体健康的重要因素。随着人们对PUFAs功能作用的认识不断加深,其在食品工业、健康辅料、化妆品、高档保健药品和生物医药工程等领域将具有广泛的应用前景,有助于提高全人类的生活水平和质量。
参考文献:
[1]RAPOPOR S I, RAO J S, IGARSHI M. Brain metabolism of nutritionally essential polyunsaturated fatty acids depends on both the diet and the liver[J]. Prostaglandins Leukot Essent Fatty Acids.2007,77(5-6):251-261
[2]孙翔宇,高贵田,段爱莉,等. 多不饱和脂肪酸的研究进展[J]. 食品工业科技,2012,33(7):418-423
[3]李殿鑫,陈银基,周光宏,等. n-3多不饱和脂肪酸分类,来源与疾病防治功能[J]. 中国食物与营养, 2006(6):52-54
[4]张艳荣,单玉玲,李玉. 姬松茸n-6多不饱和脂肪酸对高血脂鼠的降血脂作用[J]. 吉林大学学报, 2006, 32(6):960-963
[5]边凤霞,郑旭煦,殷钟意,等. 压榨花椒籽仁油的制备及其氧化稳定性[J]. 食品科学,2013,34(6):46-51
[6]GARG M L,LEITCH J,BLAKE R J,et al. Long chain n-3polyunsaturated fatty acid incorporation into human atrium following fish oil supplementation[J]. Lipid, 2006,41:1127-1132
[7]于长青,李丽娜. 花生四烯酸研究进展[J]. 农产品加工, 2007(4):10-12
[8]SlAGSVOLD J E,PETTERSEN C H,STORVOLD G L, et al. DHA alters expression of target proteins of cancer therapy in chemo-therapy resistant SW 620 colon cancer cells[J]. Nutr Cancer, 2010,62(5):611-621
[9]BLANCKAERT V, UlMANN L, MIMOUNI V, et al. Docosahexaenoic acid intake decreases proliferation,increases apoptosis and decreases the invasive potential of the human breast carcinoma cell line MDA-MB-231[J]. Int J Oncol, 2010,36(3):737-742
[10]LI M, KONG Z M, LIU Z H. Antioxidant enzyme activities and lipid peroxidation induced by eicosapentaenoic acid (EPA) in PC 12 cells[J]. Cell Biol Toxicol, 2006,22(5):331-337
[11]COLLETT E D, DAVIDSON L A, FAN Y Y, et al.n-6 and n-3 polyunsaturated fatty acids differentially modulate oncogenicRas activation in colonocytes[J]. Am J Physiol Cell Physiol, 2001,280(5):1066-1075
[12]COLAS S, MAHEO K, DENIS F, et al. Sensitization by dietary docosahexaenoic acid of rat mammary carcinoma to anthracycline: a role for tumor vascularization[J]. Clin Cancer Res, 2006,12(9):5879-5886
[13]王雪青,苗惠,胡萍. 膳食中多不饱和脂肪酸营养与生理功能的研究进展[J]. 食品科学, 2004(11):337-339
[14]LIM K, HAN C, DAI Y, et al. Omega-3 polyunsaturated fatty acids inhibit hepatocellular carcinoma cell growth through blocking beta-catenin and cyclooxygenase-2[J]. Mol Cancer Ther, 2009,8(11):3046-3055
[15]GRIFFITTS J, SAUNDERS D, TESIRAN Y A, et al. Non-mammalian fat-1 gene prevents neoplasia when introduced to a mouse hepatocarcinogenesis model Omega-3 fatty acids prevent liver neoplasia[J]. Biochim Biophys Acta, 2010(10):1133-1144
[16]LEE C Y, SIT W H, FAN S T, et al. The cell cycle effects of docosahexaenoic proliferation[J]. Int J Oncol, 2010,36(4):991-998
[17]汪成芬,崔玉兰,马鑫,等. ω-3多不饱和脂肪酸对卵巢癌细胞生长作用的实验研究[J]. 中国优生与遗传杂志, 2013,21(4):20-22
[18]王思平,谢杰,李红,等. 结直肠癌患者血中多不饱和脂肪酸水平与其疾病的相关性分析[J]. 中国临床药理学杂志, 2013,29(11):810-811,817
[19]刘流,庄文,陈忠. 对胃肠道恶性肿瘤患者术后炎症反应和营养状态的影响[J]. 中国普外基础与临床杂志, 2009(12):964-967
[20]庄波,刘纳新,刘栋,等. ω-3多不饱和脂肪酸对胃癌术后病人凝血功能和肠蠕动的影响[J]. 温州医学院学报, 2010,40(1):16-18
[21]周锋,张培趁,余震,等. ω-3多不饱和脂肪酸对胃癌病人术后炎性反应和疲劳综合征的影响[J]. 肠外与肠内营养, 2012,19(1):8-15
[22]黄凤昌,殷亮,张云飞,等. ω-3多不饱和脂肪酸对恶性胃肠道肿瘤术后病人前降钙素水平的影响[J]. 肠外与肠内营养, 2013,20(2):87-88
[23]乐嘉静,李湛君,徐康森. 海狗油ω-3多不饱和脂肪酸对胰岛素抵抗型糖尿病大鼠的降糖作用研究[J]. 中国临床药理学与治疗学, 2005,10(3):321-325
[24]王彦武,赵鹏,刘荣珍,等.α-亚麻酸减肥功能的实验研究[J].中国热带医学,2005,5(4):863-864
