乙异羟肟酸在硝酸溶液中的稳定性
2014-08-08曹晓军王锦花吴明红包伯荣郑卫芳张生栋
曹晓军,王锦花,*,李 倩,吴明红,包伯荣,郑卫芳,何 辉,张生栋
(1.上海大学 射线应用研究所,上海 200444;2.中国原子能科学研究院 放射化学研究所,北京 102413)
目前,全世界运行的核电机组约440座,每年从核电站卸出的乏燃料约1万吨,累计已产生29万吨左右的乏燃料,其中约9万吨乏燃料已被后处理[1]。到目前为止,中国大陆已有13个核电机组投入商业运营,根据我国的核电建设规划到2020年每年卸出的乏燃料总量约1 750 t[2]。我国采用核燃料闭式循环的技术路线,即对乏燃料进行后处理,分离和回收乏燃料中可再利用的U和Pu,同时进一步分离长寿命裂变元素和次锕系元素,使其得到安全处置,降低放射性核素对生物圈的长期潜在危害[3]。Purex流程是目前唯一成熟的乏燃料后处理流程,该流程利用U、Pu和Np与裂片元素之间的萃取行为差异来实现U、Pu和Np与裂片元素的分离,然后再用选择性还原剂将U和Pu、Np分离。乙异羟肟酸(AHA)具有很好的亲水性能且几乎不溶于30%TBP/煤油。文献[4-6]报道:在U(Ⅵ)存在下,AHA能与Pu(Ⅳ)和Np(Ⅳ)形成稳定的亲水性络合物,且能迅速将Np(Ⅵ)还原至不被30%TBP/煤油萃取的Np(Ⅴ),而U(Ⅵ)不受影响。AHA是仅由C、H、O和N 4种元素组成的无盐试剂,结构简单易破坏,因此AHA很有希望用于乏燃料后处理中U和Pu、Np的分离。本文主要研究AHA在硝酸溶液中的稳定性和水解产物,同时研究温度和甲基肼对AHA稳定性及其水解产物的影响,为AHA应用于乏燃料后处理提供参考依据。
1 实验
1.1 主要试剂
AHA,纯度为98%,Aldrich试剂公司;三氯乙酸,纯度为99%,上海豪申化学试剂有限公司;三氯化铁、乙酸铵,分析纯,国药集团化学试剂有限公司。
1.2 实验仪器
TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;瑞士万通研究型离子色谱仪,瑞士万通公司。
1.3 样品准备
AHA浓度为0.2 mol/L,HNO3浓度为0、0.2、0.5、1.0和2.0 mol/L。当HNO3浓度≤0.5 mol/L时,溶液直接配制。当HNO3浓度≥1.0 mol/L时,为防止HNO3局部过浓导致AHA被氧化,采取以下方法配制:称取一定量的AHA并以适量超纯水溶解;在冰水浴中边搅拌边滴加适量0.5 mol/L HNO3,然后继续滴加稍稀释的浓HNO3,最后在容量瓶中定容,摇匀。
AHA浓度为0.2 mol/L,HNO3浓度为1.0 mol/L,甲基肼浓度分别为0.05、0.1、0.2 mol/L溶液的配制:先取一定量的AHA,用适量超纯水溶解,加入甲基肼,在冰水浴中边搅拌边滴加适量的0.5 mol/L HNO3溶液,然后继续滴加所需HNO3,最后在100 mL容量瓶中定容,摇匀。
样品放置一定时间后,取样、中和,分析AHA及其水解产物的浓度。
2 结果与讨论
2.1 AHA及其水解产物的分析
1) AHA的分析
AHA在酸性条件下发生水解反应[7],故AHA溶液储存一定时间后,AHA的浓度会减少。

CH3COOH+NH3OH+
(1)
AHA可与Fe3+形成稳定配合物[8]。

(CH3CONHO)3Fe+3H+
(2)
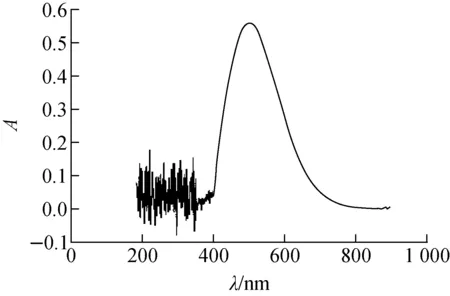
图1 AHA-Fe配合物的紫外-可见光谱
图1示出AHA-Fe配合物水溶液在紫外-可见光区的色谱。由图1可知:该配合物在502 nm处有最大吸收峰,故可用紫外-可见分光光度法测定AHA浓度。
AHA的定量分析采用外标法[9]:配制AHA浓度为0、0.2、0.4、0.6和0.8 g/L的标准溶液,分别取1.00 mL至10 mL容量瓶,再分别加入3.00 mL FeCl3溶液(w=10%)和4.00 mL CCl3COOH溶液(w=2.5%),定容,摇匀。以3.00 mL 10%FeCl3与4.00 mL 2.5%CCl3COOH的混合溶液定容至10 mL作为参比溶液,在502 nm处测定其吸光度,得到测定AHA的工作曲线为y=114.38x+0.014 2,R2=0.999 4。根据该工作曲线可对样品中的AHA浓度进行定量分析。
2) AHA水解产物的分析
由式(1)可知:在酸性条件下,AHA水解生成乙酸和羟胺。用离子色谱法分析了硝酸存在下AHA的水解产物,结果表明:溶液中只有乙酸,无羟胺,这与文献[10]报道的结果一致。羟胺是还原剂,硝酸是氧化剂,故羟胺与硝酸可能会发生下列反应[11]:

(3)
可见溶液中无羟胺。将AHA的水溶液于室温放置一定时间后,用离子色谱进行分析,溶液中有乙酸,而无羟胺。由式(1)可知,AHA水解应产生等量的乙酸和羟胺,而实验并未检测到羟胺。原因可能是羟胺与水中的溶解氧反应而被消耗掉。乙酸的定量分析采用外标法。测得的乙酸工作曲线为y=1 357.1x-1.237 8,R2=0.995 6。
2.2 硝酸浓度对AHA稳定性的影响
在Purex流程中,U与Pu和Np的分离是在一定浓度的硝酸溶液中进行的,因此研究了一定温度下,不同浓度的硝酸对AHA溶液稳定性的影响。将HNO3-0.2 mol/L AHA溶液放置一段时间后,取样、中和,用紫外-可见分光光度法分析样品中AHA的浓度,用离子色谱法分析乙酸的浓度。溶液中AHA和乙酸浓度随时间和硝酸浓度的变化如图2所示。
由图2可知,随着储存时间的延长,HNO3-0.2 mol/L AHA溶液中的AHA浓度逐渐降低;另外,在相同的储存时间内,HNO3浓度越大,溶液中的AHA浓度越低。在后处理工艺流程中,AHA在分离槽停留的时间约为30 min。当硝酸浓度为0、0.2、0.5、1.0和2.0 mol/L,t=30 min时,AHA的水解率分别为0.46%、2.40%、5.32%、7.61%和8.37%;HNO3-AHA溶液储存5 h后,AHA的水解率分别为4.51%、6.77%、13.91%、21.64%和32.64%。由此可知,在一定时间内,AHA在0~2.0 mol/L硝酸溶液中具有较好的稳定性。
AHA水解产生的乙酸浓度随时间和硝酸浓度的增加而增大,相比储存时间,硝酸浓度对AHA的稳定性影响更大。乙酸的最大浓度为53.6 mmol/L。由式(1)可知:溶液中H+浓度越大,反应越易向右移动,故随着硝酸浓度的增大,AHA的水解率增大,溶液中剩余的AHA浓度越低,乙酸浓度越大。此结论与Taylor等[7]和Tkac等[12]的报道一致。
2.3 温度对AHA稳定性的影响
在10、25和40 ℃条件下,0.2 mol/L AHA-1.0 mol/L HNO3溶液中AHA和乙酸浓度随时间的变化如图3所示。
在同一温度下,随着储存时间的延长,AHA浓度降低;不同温度下AHA浓度的降低速率随温度的升高明显加快,AHA稳定性降低。10和25 ℃时,在最初的1 h内,温度对AHA的稳定性影响不大,但随着时间的延长,二者的浓度差越来越大;40 ℃时,AHA浓度较25 ℃时的小很多,且随时间的延长而快速下降。这说明,温度对AHA的稳定性影响较大。
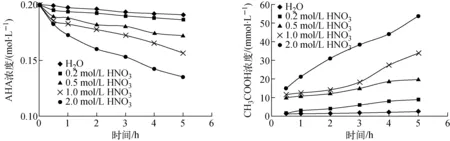
图2 室温下HNO3-0.2 mol/L AHA溶液中AHA和CH3COOH浓度与时间的关系
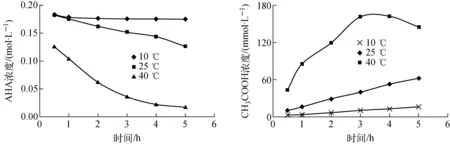
图3 不同温度下0.2 mol/L AHA-1.0 mol/L HNO3溶液中AHA和CH3COOH浓度与时间的关系
10和25 ℃时,乙酸浓度随时间的延长而增大。40 ℃时,在0.5~3 h内,乙酸浓度随时间的延长而增大;在3~4 h内,乙酸浓度随时间变化不大,但4 h后,乙酸浓度随时间的延长而略有减少。随着温度的升高,乙酸浓度明显增大,且40 ℃时的乙酸浓度远高于25 ℃时的。因乙酸有一定的挥发性,温度越高,挥发性越大,这可能是40 ℃时,0.2 mol/L AHA-1.0 mol/L HNO3溶液储存4 h后,溶液中的乙酸浓度随时间的延长而略有降低的原因。
综上可知,温度对AHA的稳定性有很大影响,在应用AHA的后处理工艺流程中应控制好温度,保证AHA的稳定性。温度对AHA水解的敏感性可用于AHA的去除。AHA应用于U与Pu和Np的分离后,剩余的AHA可利用升高温度,促进AHA水解来除去。
2.4 支持还原剂甲基肼对AHA稳定性的影响
在U与Pu和Np分离过程中,溶液中的HNO3辐解会产生亚硝酸,亚硝酸可能会影响AHA的稳定性。肼能快速与亚硝酸反应,但肼与亚硝酸反应会产生危险的叠氮酸。文献[13]报道:甲基肼与亚硝酸反应不会生成叠氮酸,因此,研究了甲基肼对AHA稳定性的影响。图4为甲基肼对硝酸溶液中AHA稳定性及乙酸浓度的影响。
由图4可知:随着甲基肼的加入,AHA的稳定性明显增加,乙酸浓度明显减少,且甲基肼的浓度越大,AHA的稳定性越高,而乙酸浓度越低。可见,甲基肼能显著提高AHA在硝酸中的稳定性。

图4 室温下CH3NHNH2-1.0 mol/L HNO3-0.2 mol/L AHA溶液中AHA和CH3COOH浓度与时间的关系
3 结论
AHA的稳定性随时间和硝酸浓度的增加而降低。温度对AHA在硝酸中的稳定性影响较大,温度升高,AHA稳定性降低,因此在应用AHA的后处理工艺流程中需控制好温度以保证AHA的稳定性。甲基肼能提高AHA在硝酸中的稳定性,在后处理工艺流程的应用过程中适当增加甲基肼的量可提高AHA稳定性。总之,在一定条件下,AHA在硝酸溶液中具有较好的稳定性,能满足后处理工艺的要求。
U与Pu和Np的分离是在辐射环境中进行的,下一步将开展AHA的辐照稳定性及分解产物的研究,为AHA的实际应用提供依据。
参考文献:
[1] 韦悦周. 国外核燃料后处理化学分离技术的研究进展及考察[J]. 化学进展,2011,23(7):1 272-1 288.
WEI Yuezhou. Progress and discussion on chemical separation technologies for nuclear fuel reprocessing developed abroad[J]. Process in Chemistry, 2011, 23(7): 1 272-1 288(in Chinese).
[2] 李金英,石磊,胡彦涛. 我国乏燃料后处理大厂建设的几点思考[J]. 核化学与放射化学,2011,33(4):204-210.
LI Jinying, SHI Lei, HU Yantao. Some consi-derations on the construction of a spent nuclear fuel reprocessing plant in China[J]. Journal of Nuclear and Radiochemistry, 2011, 33(4): 204-210(in Chinese).
[3] 叶国安,张虎. 核燃料后处理技术发展及其放射化学问题[J]. 化学进展,2011,23(7):1 289-1 294.
YE Guoan, ZHANG Hu. A review on the development of spent nuclear fuel reprocessing and its related radiochemistry[J]. Process in Chemistry, 2011, 23(7): 1 289-1 294(in Chinese).
[4] 叶国安. Purex流程中有机无盐试剂的应用分析[J]. 原子能科学技术,2004,38(2):152-158.
YE Guoan. Review on the study and application of organic salt-free reagent in Purex process[J]. Atomic Energy Science and Technology, 2004, 38(2): 152-158(in Chinese).
[5] 郑卫芳,江浩,朱建民,等. 短链羟肟酸对Pu(Ⅳ)的配位、还原及反萃[J]. 核化学与放射化学,2003,25(2):65-68.
ZHENG Weifang, JIANG Hao, ZHU Jianmin, et al. Complexation, reduction and stripping of Pu(Ⅳ) by simple hydroxamic acid[J]. Journal of Nuclear and Radiochemistry, 2003, 25(2): 65-68(in Chinese).
[6] 郑卫芳,刘黎明,常志远. 乙异羟肟酸改善Purex流程铀产品中U-Pu的分离[J]. 原子能科学技术,2000,34(2):110-115.
ZHENG Weifang, LIU Liming, CHANG Zhi-yuan. Improvement of separation of Pu from U of U-cycle in Purex process by acetohydroxamic acid[J]. Atomic Energy Science and Technology, 2000, 34(2): 110-115(in Chinese).
[7] TAYLOR R J, MAY I. The reduction of actinide ions by hydroxamic acids[J]. Czech J Phys, 1999, 49(1): 617-621.
[8] JAGDALE M H, SALUNKHE M M, SWAMI S S. Kinetics of nickel(Ⅱ) ion and cobalt(Ⅱ) ion catalysed hydroxamic acid format ion form formic acid[J]. J Indian Chem Soc, 1982, 59(3): 355-357.
[9] 郑卫芳,章泽甫. 乙异羟肟酸用于Purex流程中Np/U的分离[J]. 核科学与工程,2001,21(4):369-374.
ZHENG Weifang, ZHANG Zefu. Study on separation of Np from U by acetohydroxamic acid in Purex process[J]. Chinese Journal of Nuclear Science and Engineering, 2001, 21(4): 369-374(in Chinese).
[10] KARRAKER D G. Radiation chemistry of acetohydroxamic acid in the UREX process, WSRC-TR-2002-00283[R]. Aiken, South Carolina, US: Westinghouse Savannah River Company, 2002.
[11] MCKIBBEN J M, BERCAW J E. Hydroxylamine nitrate as a plutonium reductant in the Purex solvent extraction process, DP-1248[R]. US: Du Pont de Nemours (E. I.) and Co., Aiken, S. C. Savannah River Lab., 1971.
[12] TKAC P, MATTESON B, BRUSO J, et al. Complexation of uranium(Ⅵ) with acetohydroxamic acid[J]. Journal of Radioanalytical and Nuclear Chemistry, 2008, 277(1): 31-36.
[13] KOLTUNOV V S, BARANOV S M. Organic derivatives of hydrazine and hydroxylamines in the future technology of spent nuclear fuel reprocessing[C]∥Global, International Conference on Evaluation of Emerging Nuclear Fuel Cycle Systems. Versailles, France: Palais de Congrès, 1995: 577-584.
