P物质对大鼠DRG神经元H+门控电流的调制作用
2014-08-08师春梅赵奉波李之望
师春梅, 赵 斌, 谭 燕, 赵奉波, 李之望
(1惠州市第一人民医院老年科,广东 惠州 516000; 2广东医学院神经病学研究所,广东 湛江 524001;3广东医学院附属医院老年科,广东 湛江524001; 4华中科技大学同济医学院电生理实验室,湖北 武汉 430000)
酸敏感离子通道(acid-sensing ion channels, ASICs)也称H+门控离子通道(H+-gated ion channels),属于上皮钠通道/退化蛋白(epithelial Na+channel/degenerin,ENaC/DEG)超家族[1]。目前国内外对天然ASICs 的电流类型没有统一的划分。
ASICs广泛存在于哺乳动物中枢神经系统和外周神经系统[2-3],参与痛觉形成、伤害性刺激感受、味觉传导,同时也参与学习/记忆、突触可塑性和惊恐反射等过程,另外ASICs在炎症、缺血、癫痫等病理生理过程中发挥重要作用[4-5],尤其在脑缺血损伤和炎症痛方面发挥更为重要的病理生理学作用。
从物种进化方面来看,ASICs和另外一种通道FMRFAmide(苯丙-甲硫-精-苯丙氨酸多肽)门控的钠离子通道(FaNaCH)相近。该通道可被在软体动物上普遍存在的神经递质FMRFAmide激活,是目前所知道的唯一的肽门控离子通道。而哺乳动物体内没有FMRFamide,但存在FMRFamide相关肽。最近研究发现,哺乳动物体内的RF肽(RFamide)对ASICs有强有力的调制作用[6]。
P物质(substance P,SP)为11肽,是哺乳动物体内重要的肽类神经递质,广泛分布于神经系统和其它外周组织器官内。具有扩张血管、传递疼痛信息、影响心脑血管活动以及参与学习、记忆等多种病理生理过程。近年来有研究发现在外周传导痛觉神经节细胞中ASICs与SP共同表达,其表达密度都可被炎症所诱导[7]。另外研究发现在急性脑缺血后脑中SP的含量显著增加[8],与此同时脑缺血引起的酸中毒激活了脑内广泛存在的ASICs。ASICs激活所致的脑损伤已引起了国内外学者特别重视。因此,探讨SP和ASICs的相互作用在治疗脑缺血损伤中和周围炎症痛有着重要的意义,而目前有关SP对ASICs的调制作用国内外未见有报道。
材 料 和 方 法
1 标本制备
将256只SD大鼠麻醉后断头处死,取出胸腰段脊柱沿正中线剖成两半,置于O2饱和的pH 7.4的DMEM液中,溶液渗透压为340 mOsm/L。在体视显微镜下用精细弹簧剪和游丝镊清除背根神经节(dorsal root ganglion,DRG)表面相连神经和周围结缔组织被膜,然后将神经节尽可能地剪碎,置于盛有5 mL溶有胰蛋白酶0.5 g/L和胶原酶1.0 g/L的DMEM液的大试管中,在恒温水浴振荡器(35 ℃、50 times/min)中振荡孵育30~35 min,孵育毕加入大豆胰蛋白酶抑制剂1.25 g/L以终止酶的消化作用。将经上述酶和机械分离的DRG细胞悬液转移至35mm直径的培养皿中,在倒置显微镜的载物台上静置至少30 min后用充氧的细胞外液置换培养皿中加有消化酶的DMEM液。
2 电生理记录
全细胞膜片钳记录所用放大器为PC2C型膜片钳放大器(华中科技大学自控系生产),玻璃微电极所充内液成分为(mmol/L):KCl 150, MgCl22, HEPES 10, EGTA 11, ATP 4。用KOH将pH值调至7.2,用蔗糖将渗透压调为310 msOm/L,电极电阻2~4 MΩ。灌流用之标准细胞外液成分为(mmol/L):NaCl 150,KCl 5,CaCl22.5,MgCl21,HEPES 10,D-glucose 10。用NaOH将pH值调至7.4,用蔗糖将渗透压调为340 msOm/L。在电极和细胞之间形成高阻封接后(>1GΩ),进一步将细胞膜吸穿,调节电容和串联电阻补偿,除了特别标明以外,膜电位钳制于-60 mV,膜电流应用低通滤波(1 kHz,-3dB)。电极通过放大器探头与膜片钳放大器连接,放大器通过转换器将刺激信号转换为数据信号,存于计算机硬盘中。
3 给药
P物质、GR82334、GDP-β-S和WIN51708均为Sigma生产,其它药品为国内生产。GDP-β-S通过膜片钳玻璃内为插管加入到充灌电极的细胞内液行胞内透析。SP和GR82334均用标准外液配制。实验中所用的酸(pH 4.0~6.0)是标准外液加HCl(1 mol/L)调配而成。给药系通过微操纵器移动快速换液装置的排管进行,每管内径∶外径为200 μm∶500 μm,管口距所记录的细胞约100 μm。实验在室温22~25 ℃范围内进行。
4 统计学处理
数据以均数±标准差(mean±SD)表示,两组之间采用t检验进行分析;实验数据的处理、分析以及统计图形的绘制采用SigmaPlot软件进行。
结 果
1 大鼠DRG神经元H+门控电流的分类
在实验中记录的H+门控电流,观察到在pH 5.0时H+门控电流形状最为稳定,因此以pH 5.0时记录的电流为准划分H+门控电流的类型有4种,见图1。

Figure 1. Four types of H+-gated currents in rat DRG neurons, T(transient)-type, S(sustained)-type, B(biphasic)-type and O(opposite)-type.
(1) 短暂内向电流(T-type,transient inward current)——T型H+门控电流呈快激活和快失活的特点。(2) 持续内向电流(S-type, sustained inward current)—— S型H+门控电流呈快或中激活,无失活或极缓慢失活。(3) 双相内向电流(B-type, biphasic inward current)—— B型H+门控电流呈快速激活,其失活相包括快速失活和无失活或极缓慢失活2种成分。即失活相包括短暂和持续成分。(4) 反向电流(O-type, opposite current)—— O型H+门控电流包含内、外2个方向的电流成分。
2 共加SP和H+对H+门控电流的增强作用
在观察的100例细胞中发现有34例细胞SP对S型和B型中持续成分的H+门控电流有明显增强作用,这种电流幅值增强达(85.53±22.93)%,出乎意外的是约81.8%(9/11)细胞的这种增强效应不能被选择性的SP受体NK1拮抗剂GR82334(3.6×10-6mol/L;含有11个氨基酸肽类)阻断(n=11,P>0.05),GR82334单独作用未见有电流产生;而非肽类的SP受体NK1拮抗剂WIN51708(10-7mol/L) 对约75%的DRG神经元可明显阻断这种增强效应(n=8,P<0.05),见图2。

Figure 2. Enhancement of H+-gated currents caused by both SP and H+. A,B and C: current traces showed enhancement of the sustained component of H+-gated currents caused by both SP and H+ ;D: the enhancement could not be blocked by SP receptor antagonist, GR82334;E:other antagonist WIN51708 could block the enhancement; F: enhancement caused by both SP and H+ in the same single DRG neuron; G: GR82334 could not block the enhancement; H: WIN51708 could block the enhancement.Mean±SD.n=34,11 or 18. *P<0.05 vs pH 5.0; #P<0.05 vs pH 5.0+SP.
3 共加SP和H+对H+门控电流的抑制作用
在所观察的100例细胞中发现有35例SP对S型和B型中持续成分的H+门控电流有明显抑制作用,抑制的幅值达(48.46±4.45)%,并且约88.9%(8/9)细胞的这种抑制效应不能被SP受体NK1拮抗剂GR82334所阻断(n=9,P>0.05),见图3。
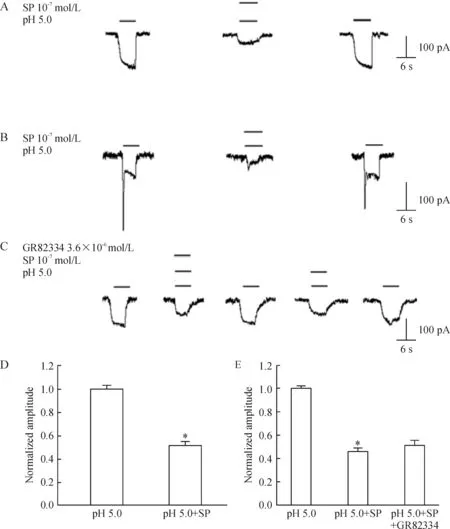
Figure 3. Inhibition of H+-gated currents by both SP and H+. A and B: current trace showed inhibition of the currents caused by both SP and H+; C: GR 82334 could not block the inhibitory effect of SP;D: shows inhibition of H+-gated current caused by both SP and H+ ;E: the inhibition could not be blocked by GR82334.Mean±SD.n=35 or 9.*P<0.05 vs pH 5.0.
4 胞内透析GDP-β-S后不能阻断SP对H+门控电流的调制作用
在所观察的2例细胞中发现通过胞内透析技术在细胞内液中加入GDP-β-S(5×10-4mol/L)后不能消除SP对ASICs电流的调制作用,见图4。为排除实验操作技术问题,在实验中做了2例SP(10-7mol/L)对ATP(10-6mol/L)的调制作用发现通过同样胞内透析技术操作在细胞内液中加入GDP-β-S(5×10-4mol/L)后可明显阻断SP对ATP的增强作用。目前SP对ATP的调制作用通过G-蛋白偶联的信号转导途径已基本明确。由此GDP-β-S不能阻断SP对ASICs电流的调制作用是很有意义的阴性结果。

Figure 4. After intracellular dialysis, GDP-β-S could not block the enhanced effects of SP on H+-gated currents.
讨 论
1981年Krishtal等[9]首次在大鼠三叉和背根神经节上对ASICs进行了描述。H+是目前仅知的ASICs激活物。
1 大鼠DRG神经元H+门控电流的分类
由于ASICs在生理和病理过程中发挥的重要作用,最近几年来越来越多的学者把焦点转向了对ASICs的研究。为了便于实验的研究,不少学者试着将记录到的ASICs电流类型分类,但很多学者对ASICs电流的类型的分类比较繁琐,不实用。到目前为止对ASICs电流的类型仍没有统一的划分。
我室依据在pH 5.0条件下记录的H+门控电流的动力学特征,将急性分离的DRG神经元上的H+门控电流分为4类:T型(短暂内向电流,transient inward current)、S型(持续内向电流,sustained inward current)、B型(双相内向电流,biphasic inward current)和O型(反向电流,opposite current)。T型H+门控电流呈快速激活和失活,即激活迅速并且立即可回复到原有电流水平;S型H+门控电流激活快但失活极其缓慢或无失活;B型H+门控电流激活快,但失活相包括快和持续2种成分,即快速失活到某一值后电流不再失活或失活非常缓慢;O型H+门控电流包括内、外2个方向的电流,先为内向电流同S型,在撤药时出现一外向电流成分。这4种电流类型较为全面地囊括了在急性分离的DRG神经元上记录的H+门控电流的形状和其各自独特的失活动力学特征。这种分类方法简单实用。我室Li等[10]依据此方法对ATP激活的电流类型分类已得到了国内外学者的普遍认可。
2 P物质对大鼠DRG神经元膜H+门控电流的调制作用及其机制
P物质是哺乳动物体内另一种由11个氨基酸残基组成的神经肽, 也是存在人体内主要的神经递质[11],由小的初级传入神经元释放并存在这些神经元内[12]。SP与 NKA、NKB共同组成哺乳动物的速激肽家族。秦立鹏等[13]人发现P物质还有增强失血性休克大鼠离体淋巴管的泵功能。近年来有研究发现ASICs在传导痛觉的外周神经节小细胞中与SP共同表达,其表达密度都可被炎症所诱导。另外很多证据表明大鼠DRG神经元膜上存在SP受体[14-15]。SP受体NK1属于G蛋白偶联受体,其激活后主要通过PLC-DAG-PKC通路发挥作用。那么ASICs和SP之间有什么样的互相作用呢?SP是否能作用于ASICs一直未见报道。
在急性分离的DRG神经元上记录的ASICs电流的4种类型中,S型占多数,O型包含有外向成分,电流成分较为复杂,另外T型主要集中在小细胞,且出现机率较少,B型中的持续成分形成机制同S型。所以本实验重点研究SP对S型和B型持续成分的调制作用。在实验中将SP的浓度定在10-7mol/L,H+的浓度为pH 5.0。结果发现SP对H+门控电流S型和B型持续成分的调制作用表现为:增强或抑制。在对所观察的100例细胞中这2种作用出现比率基本均等,但SP对H+门控电流幅值的增强作用强于其抑制作用。很显然,SP对H+门控电流的增强作用有着很重要的生理病理学意义,为SP和ASICs之间的相互作用加剧了炎症痛提供了电生理学的依据,从而为炎症痛的治疗找到了又一个可干预靶点。同时我们推测在中枢神经系统内也会同样存在SP对H+门控电流幅值的增强作用,两者的相互增强作用加剧脑缺血损伤。如果是这样,那么靶向SP和ASICs的治疗为脑卒中病人提供了又一个新的治疗思路。
可为什么在同种条件下SP对H+门控电流表现为抑制作用呢?目前无法解释做出合理的解释,值得探讨。
在实验中发现,非肽类的SP受体NK1拮抗剂 WIN51708 对75%急性分离的DRG神经元可明显阻断SP对H+门控电流的增强效应(P<0.05)。而对25%的DRG神经元则没有作用。由此推断对大部分的DRG神经元来说,NK1受体参与了SP对ASICs的调制作用。由于NK1受体属于G-蛋白偶联受体,其激活后主要通过PLC-DAG-PKC通路发挥作用。推测SP与NK1受体结合后,通过G蛋白偶联到PLC,后者将PIP2水解为IP3和DAG。IP3可促使内质网Ca2+释放,DAG可以激活PKC,而PKC磷酸化ASIC亚基从而增强H+门控电流的S型和B型持续成分。为了证实我们的推测,通过胞内透析技术往标准内液中加入G蛋白类似物GDP-β-S在所观察的2例细胞中发现加入GDP-β-S后不能阻断SP的作用,由此推测在一部分细胞上(很可能是小部分)SP是通过和ASICs的某一位点直接结合来发挥对ASICs的调制作用的。由于目前所做胞内透析的细胞例数较少尚需要进一步实验验证。
[参 考 文 献]
[1] Benos DJ,Stanton BA. Functional domains within the degenerin/epithelial sodium channel (Deg/ENaC) superfamily of ion channels[J]. J Physiol, 1999, 520(3): 631-644.
[2] Wemmie JA, Chen J, Askwith CC, et al. The acid-activated ion channel ASIC contributes to synaptic plasticity, learning, and memory[J]. Neuron, 2002, 34(3): 463-477.
[3] Varming T. Proton-gated ion channels in cultured mouse cortical neurons[J].Neuropharmacology, 1999, 38(12): 1875-1881.
[4] Xiong ZG, Zhu XM, Chu XP, et al. Neuroprotection in ischemia: blocking calcium-permeable acid-sensing ion channels[J]. Cell, 2004, 118(6): 687-698.
[5] Yermolaieva O, Leonard AS, Schnizler MK, et al. Extracellular acidosis increases neuronal cell calcium by activating acid-sensing ion channel 1a[J]. Proc Natl Acad Sci U S A, 2004, 101(17): 6752-6757.
[6] Chen X, Paukert M, Kadurin I, et al. Strong modulation by RFamide neuropeptides of the ASIC1b/3 heteromer in competition with extracellular calcium[J]. Neuropharmacology, 2006, 50(8):964-974.
[7] Voilley N, de Veille J, Mamet J, et al. Nonsteroid anti-inflammatory drug inhibit both the activity and the inflammation-induced expression of acid-sensing ion channels in nociceptors[J]. J Neurosci, 2001, 21(20): 8026-8033.
[8] Turner R,Vink R. Inhibition of neurogenic inflammation as a novel treatment for ischemic stroke[J]. Timely Top Med Cardiovasc Dis,2007, 11:E24.
[9] Krishtal OA, Pidoplichko VI. Receptor for protons in the membrane of sensory neurons [J]. Brain Res,1981, 214(1): 150-154.
[10] Li C, Peoples RW, Lanthornb TH, et al. Distinct ATP-activated currents in different types of neurons dissociated from rat dorsal root ganglion[J]. Neurosci Lett,1999, 263(1): 57-60.
[11] Dekoninck Y, Henry JL. Substance P-mediated slow excitatory postsynaptic potential elicited in dorsal horn neuronesinvivoby noxious stimulation[J]. Proc Natl Acad Sci U S A, 1991, 88(24): 11344-11348.
[12] McCarthy PW, Lowson SN. Cell type and conduction velocity of rat primary sensory neurons with substance P-like immunoreactivity[J]. Neuroscience, 1989, 28(3): 745-753.
[13] 秦立鹏,牛春雨, 赵自刚,等.P物质增强失血性休克大鼠离体淋巴管的泵功能[J].中国病理生理杂志, 2011, 27(7):1323-1328.
[14] Akasu T, Ishimatsu M, Yamada K. Tachykinins cause inward current through NK1 receptors in bullfrog sensory neurons[J]. Brain Res, 1996, 713(1-2): 160-167.
[15] Hu HZ, Li ZW, Si JQ. Evidence for the existence of substance P autoreceptor in the membrane of rat darsal root ganglion neurons[J]. Neuroscience, 1997, 77(2): 535-541.
