正常肠淋巴液对内毒素休克小鼠多器官损伤的作用*
2014-08-08杜会博张立民邢立强赵自刚牛春雨
杜会博, 宋 文, 张立民, 邢立强, 张 辉, 赵自刚, 牛春雨
(河北北方学院微循环研究所,基础医学院病理生理学教研室,河北 张家口 075029)
由严重感染引起的内毒素休克(endotoxic shock,ES)和脓毒症是临床常见的危重病理过程,其导致的多器官损伤是导致患者死亡的重要原因之一[1-2]。课题组前期研究表明,来自犬的正常肠淋巴液可有效改善静脉输入脂多糖(lipopolysaccharide,LPS,15 mg/kg)引起的内毒素休克大鼠的血液微循环与淋巴微循环障碍[3],改善肝、肾器官的血液灌注量[4],降低肝、肾组织的黏附分子水平、髓过氧化物酶活性、自由基含量与组织损伤[5-6];Cheng等[7]的研究也发现,正常肠淋巴液(normal mesenteric lymph,NML)能降低内毒素导致肺血管内皮细胞的黏附分子表达与炎症反应。这些研究均表明,正常肠淋巴液对内毒素休克具有一定的干预作用,可能是未来防治内毒素休克的有效药物靶点,但还需要进一步研究其精确的机制。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)在创伤、失血、感染导致炎症反应失控的发展进程中具有重要作用,是引起器官损伤的关键靶点[8],抑制MAPKs信号通路有利于拮抗内毒素的作用[9-10]。但正常淋巴液干预内毒素休克炎症反应与器官损伤的作用是否与MAPKs有关,还不清楚。为此,本研究观察正常肠淋巴液对内毒素休克小鼠多器官损伤的干预作用以及MAPKs信号通路主要信号分子p38 MAPK、细胞外信号调节激酶(extracellular signal-regulated kinases,ERK)1/2和c-Jun氨基末端蛋白激酶(c-Jun N-terminal kinase,JNK)磷酸化水平的影响。
材 料 和 方 法
1 动物与分组
36只SPF级BALB/c雄性小鼠[中国食品药品检定研究院,许可证号为SCXK(京) 2009-0017],体质量20~25 g。18只小鼠用于正常肠淋巴液引流;另外,18只小鼠随机均分为:假休克组(sham shock,SS)、内毒素休克组(ES)和正常肠淋巴液干预内毒素休克组(NML+ES,简称肠淋巴液干预组),每组动物6只。实验过程中动物处置符合动物医学伦理学标准。
2 引流正常淋巴液
1%戊巴比妥钠(50 mg/kg,北京化学试剂公司分装)经腹腔注射全身麻醉后,在小鼠腹部正中线偏右作长2 cm纵切口,打开腹腔,暴露肠系膜根部,行肠淋巴管插管,引流肠淋巴液60 min,量在20~60 μL之间,以1 500 r/min离心5 min,去细胞成分,取上清液(淋浆)置于低温冰箱-75 ℃冷冻备用。将每3份引流的正常淋巴液混合在一起用于1只内毒素休克小鼠的干预,淋巴液量在100~150 μL之间。
3 建立内毒素休克小鼠模型
小鼠经戊巴比妥钠(50 mg/kg)腹腔注射麻醉后,在手术显微镜下,进行股部手术,钝性分离股动脉,经股动脉注射1%肝素钠(1 mL/kg)全身抗凝后,插管,通过三通管连接RM6240BD型生物信号采集系统(成都仪器厂),连续监测平均动脉血压(mean artery pressure,MAP)。手术完成后稳定30 min,内毒素休克组与淋巴液干预组小鼠腹腔注射LPS(O111:B4,Sigma;质量分数0.5%,35 mg/kg),复制内毒素休克模型[11]。结合相关文献报道[12-13],由于小鼠的股静脉过细,故小鼠的输液治疗一般通过股动脉实施;因此,在LPS注射60 min后,淋巴液干预组小鼠经股动脉注射正常淋巴液;结合课题组前期实验,正常淋巴液的量为小鼠全血量的1/15(全血量为小鼠体重的1/13),然后推注少量生理盐水,确保正常淋巴液全部注入体内;内毒素休克组仅注射等量的生理盐水。假休克组小鼠仅实施与内毒素休克组、淋巴液干预组完全相同的手术,不腹腔注射LPS,不输入正常淋巴液,只是在相同时点输入等量生理盐水。
4 标本留取
在腹腔注射LPS后6 h或假休克组相应时点,小鼠在麻醉状态下,打开腹腔,用1 mL注射器经心尖部穿刺进入左心室,取血0.5 mL,至EP管,静置20 min后,以3 000 r/min的速度离心10 min(Labofuge 400R型高速低温离心机),留取血浆标本于EP管中,置于-75 ℃低温冰箱,用于反映器官功能的生化指标检测。取血后,迅速留取肺、心脏和肝脏;其中,选择固定位置的部分肺(左肺叶)、心肌(矢状切开后的左心室肌)和肝(肝左叶)组织置于4%多聚甲醛中固定,用于组织形态学观察;将余下的肺、心肌、肝组织置于EP管中,-75 ℃冻存(702型低温冰箱),用于MAPK信号分子的ELISA检测。
5 器官组织形态学观察
从多聚甲醛中取出固定的肺、心肌、肝组织,常规脱水、石蜡包埋、切片、脱蜡(二甲苯Ⅰ和二甲苯Ⅱ各15 min)、脱二甲苯(100%乙醇Ⅰ和100%乙醇Ⅱ各4 min,95%乙醇、90%乙醇、80%乙醇和75%乙醇各1 min)、水化(自来水3 min)、HE染色(苏木素染色10 min,自来水洗3次;盐酸乙醇分化,自来水洗3次,伊红液染色15 s,自来水洗3次)、梯度乙醇脱水、二甲苯透明、中性树胶封片,光镜下观察组织形态学变化,应用Motic Med 6.0医学图像分析系统(麦克奥迪实业集团中国有限公司)进行拍照。
6 反映器官功能的生化指标检测
应用7600-110型全自动生化分析仪(日立)检测各组小鼠血浆天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)活性以及总胆汁酸(total bile acids,TBA)含量,作为反映肝细胞损伤与功能的指标;检测乳酸脱氢酶1(lactic acid dehydrogenase 1,LDH-1)、肌酸激酶同工酶(creatine phosphokinase isoenzyme,CK-MB)的活性以及缺血修饰白蛋白(ischemia-modified albumin,IMA)含量,作为心肌细胞损伤的指标。其中,LDH-1采用连续监测法,AST和ALT采用酶法,TBA和CK-MB采用速率法,IMA采用终点法。
7 ELISA分析
取置于-75 ℃冻存的肺、肝、心肌组织,分析天平称重后,按1∶9比例,加入4 ℃的生理盐水,在冰浴环境中,应用组织匀浆器制备10%组织匀浆;0~4 ℃、3 000 r/min离心10 min,吸取上清;应用小鼠磷酸化的p38 MAPK、ERK1/2和JNK ELISA检测试剂盒(抗体由美国R&D公司生产、江苏镇江厚普生物科技有限公司合成),绘制p38 MAPK、ERK1/2和JNK标准曲线(分别为:y= 0.008x+0.0000149x2-0.000000079x3,R2= 0.9987;y=0.006x-0.000070x2-0.00000000442x3,R2=0.9966;y=0.004x-0.0000022x2+0.000000000276x3,R2=0.9979);按试剂盒说明书,检测各组织匀浆p38 MAPK、ERK1/2和JNK的磷酸化水平;组织匀浆蛋白定量应用Bradford法(碧云天生物技术研究所)。
8 统计学处理
数据以均数±标准误(mean±SEM)或均数±标准差(mean±SD)表示。应用SPSS 16.0统计软件处理,方差齐的资料多组间比较采用单因素方差分析,两组间或组内相比较应用t检验;方差不齐的资料采用Kruskal Wallis检验,以P<0.05为差异有统计学意义。
结 果
1 各组小鼠平均动脉血压变化
如图1所示,实验过程中,假休克组小鼠血压基本保持稳定;内毒素休克组小鼠在腹腔注射LPS后90 min开始下降,尤其在340 min以后下降更为明显,在90~360 min(除去100 min)均显著低于假休克组(P<0.05);肠淋巴液干预组小鼠血压亦出现了与内毒素休克组小鼠类似的变化,在腹腔注射LPS后110 min开始下降,在110~160 min和260~360 min的各时点显著低于假休克组(P<0.05);但肠淋巴液干预组小鼠血压在腹腔注射LPS后80 min、90 min、190 min、210 min、240 min、250 min、340 min、350 min和360 min等时点显著高于内毒素休克组(P<0.05)。

Figure 1. Changes of mean artery pressure (MAP) in mice from the sham shock (SS), endotoxic shock (ES), normal mesenteric lymph plus endotoxic shock (NML+ES) groups. Mean±SEM.n=6. *P<0.05 vs SS group; #P<0.05 vs ES group.
2 各组小鼠器官组织形态学变化
2.1肺组织形态学变化 假休克组小鼠的肺泡壁薄,结构基本正常,表面被覆肺泡上皮细胞,肺泡腔内无明显渗出物,见图2A、B;内毒素休克组小鼠肺泡间隔有增宽的表现,可见炎细胞浸润和单核细胞增生,肺泡腔内偶见有渗出的红细胞,见图2C、D;肠淋巴液干预组小鼠肺组织形态学表现与内毒素休克组相似,但肺泡间隔较窄,炎症细胞浸润程度较轻,见图2E、F。

Figure 2. Changes of pulmonary pathomorphology in mice (HE staining; A, C, and E: ×100; B, D and F: ×400). A and B: sham shock group; C and D: endotoxic shock group; E and F: normal mesenteric lymph plus endotoxic shock group.
2.2肝组织形态学变化 假休克组小鼠肝索呈放射状排列,血窦宽度基本正常,肝细胞排列正常,肝细胞核圆、居中,核仁明显,核膜清晰,可见双核,胞浆染色嗜酸、均质,见图3A、B;内毒素休克组小鼠的肝细胞排列稍紊乱,偶见水肿,见图3C、D;肠淋巴液干预组小鼠肝细胞损伤程度较内毒素休克组轻,肝小叶周边细胞可见轻度水肿,见图3E、F。
2.3心肌组织形态学变化 假休克组小鼠心肌细胞结构基本正常,核居中,核膜清晰,心肌细胞大小较一致,心肌纤维排列正常,见图4A、B;内毒素休克组小鼠心肌细胞结构基本正常,偶见心肌细胞水肿,见图4C、D;肠淋巴液干预组小鼠心肌细胞结构基本正常,见图4E、F。
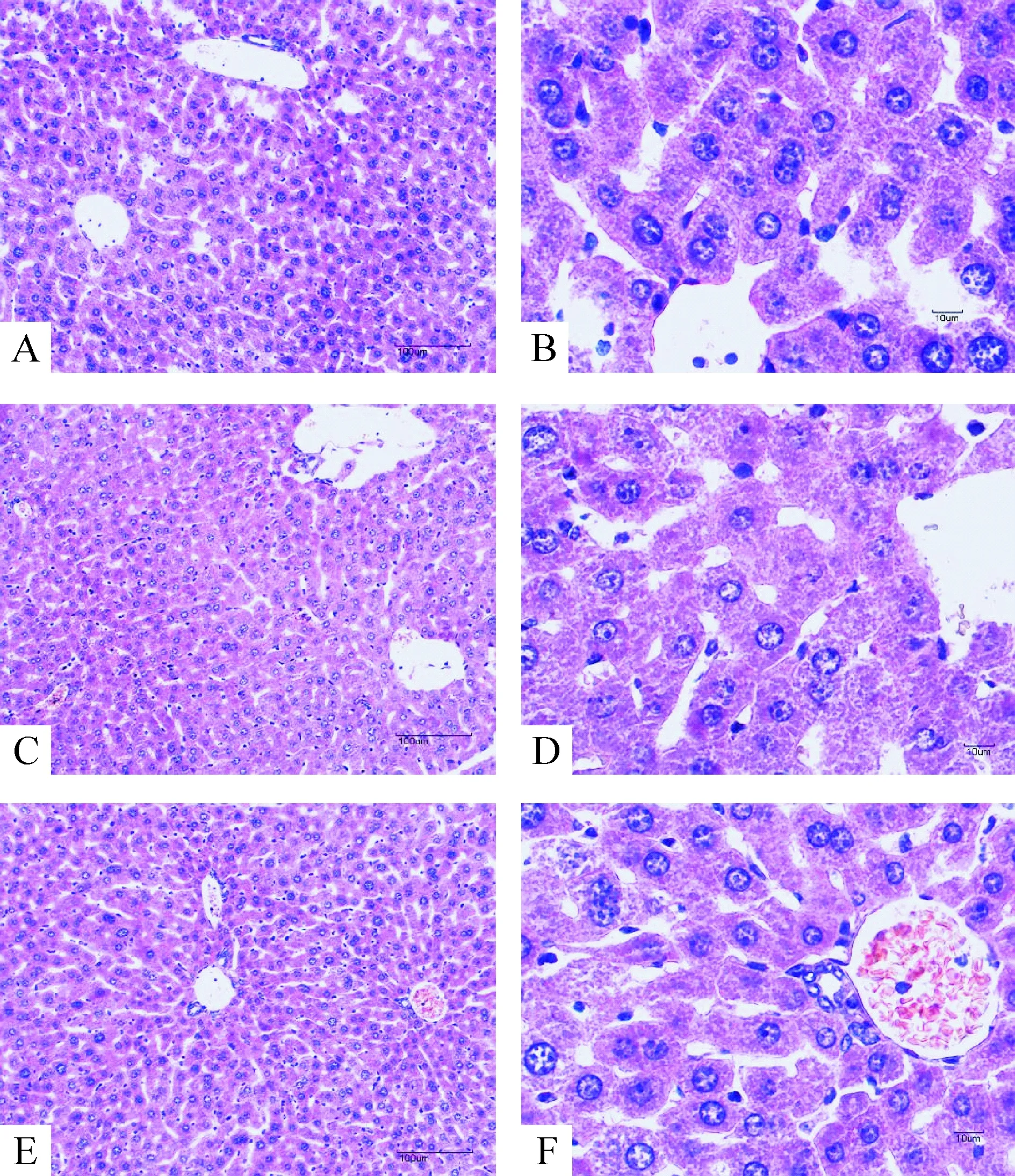
Figure 3. Changes of hepatic pathomorphology in mice (HE staining; A, C, and E: ×100; B, D and F: ×400). A and B: sham shock group; C and D: endotoxic shock group; E and F: normal mesenteric lymph plus endotoxic shock group.
3 各组小鼠器官功能生化指标的变化
3.1反映肝细胞坏死与功能的生化指标变化 内毒素休克组小鼠血浆AST和ALT含量显著高于假休克组(P<0.05);肠淋巴液干预组小鼠血浆AST含量显著低于内毒素休克组(P<0.05),与假休克组差异无统计学意义(P>0.05);3组小鼠血浆TBA含量差异无统计学意义(P>0.05),见表1。

表1 正常淋巴液对内毒素休克小鼠肝功能生化指标的影响
3.2反映心肌细胞坏死的生化指标变化 内毒素休克组与肠淋巴液干预组小鼠血浆CK-MB活性均显著高于假休克组(P<0.05);且肠淋巴液干预组小鼠血浆LDH-1活性显著低于内毒素休克组(P<0.05);3组小鼠血浆IMA水平未见显著差异(P>0.05),见表2。

表2 正常淋巴液对内毒素休克小鼠心肌生化指标的影响
4 各组小鼠器官MAPKs信号分子的变化
与假休克组比较,内毒素休克组小鼠肺组织p38 MAPK、ERK1/2和JNK磷酸化水平显著增高(P<0.05);心肌组织p38 MAPK、ERK1/2和JNK磷酸化水平有增高的趋势,但无显著差异(P>0.05);肝组织p38 MAPK、ERK1/2和JNK磷酸化水平无显著差异(P>0.05)。输入正常肠淋巴液降低了内毒素休克小鼠肺组织的p38 MAPK磷酸化水平以及心肌组织的p38 MAPK、ERK1/2和JNK磷酸化水平(P<0.05),见表3~5。

表3 正常淋巴液对内毒素休克小鼠多器官磷酸化p38 MAPK水平的影响

表4 正常淋巴液对内毒素休克小鼠多器官磷酸化ERK1/2水平的影响

表5 正常淋巴液对内毒素休克小鼠多器官磷酸化JNK水平的影响
讨 论
内毒素休克模型的建立有多种方法,如静脉输入LPS或菌液[14-15]、腹腔注射LPS或菌液[11-13, 16],也有盲肠结扎穿孔的方法[17-18],每一种模型均有一定的代表性和临床意义。为了进一步探讨正常肠淋巴液对内毒素休克的干预作用机制,本文在已证实正常肠淋巴液对静脉输入LPS导致内毒素休克大鼠模型具有良好干预作用的基础上,应用腹腔注射LPS这一更符合临床实践的方法建立了内毒素休克小鼠模型。在腹腔注射LPS建立内毒素模型的过程中,国内外学者使用LPS的剂量有所不同,有5~120 mg/kg。我们分析可能与动物种类不同、LPS来源的菌株不同或作者本身要观察内毒素休克的程度不同有关。Li等[11]分别腹腔注射大剂量(35 mg/kg)和小剂量(10 mg/kg)LPS建立内毒素休克小鼠模型,发现小剂量组动物的存活率为90%(仅有1只在30 h死亡),而大剂量组动物在注射LPS后的25 h内全部死亡。Noworyta-Sokoowska等[16]以10 mg/kg的剂量腹腔注射LPS,提高了羟自由基的产生,但并没有引起细胞外多巴胺(dopamine,DA)、谷氨酸盐(glutamate,GLU)和腺苷酸(adenosine,ADN)水平增高;反复给予5次(5 mg/kg)腹腔注射,则提高了细胞上DA、GLU和ADN的水平。
结合这些文献结果,本研究以腹腔注射35 mg/kg LPS建立了小鼠内毒素休克模型。腹腔注射LPS后90~360 min的多个时点MAP显著低于假休克组,也出现了内毒素休克较典型的血压变化,即:先下降,后缓慢回升,继续下降至较低水平(尤其是在340 min以后)。从肺、肝和心肌的组织形态学观察结果来看,各器官出现了一定的但并不重的结构损伤;从反映器官功能或损伤的生化指标来看,在LPS注射后6 h,小鼠血浆AST、ALT和CK-MB活性显著增强。MAP、器官形态与生化指标的结果证明了本实验中所用的内毒素休克模型是成功的。但是也应看到,在LPS注射后6 h,MAP虽然有所下降,但在60 mmHg左右;器官组织结构有了一定的损伤,生化指标有了一些改变,但损伤程度较轻;同时,血浆TBA、IMA等指标均未见明显差异。这说明,本研究所用模型是比较轻的一种内毒素休克模型,如果延长观察时间,可能会看到较为严重的损伤情况。同时,本实验中,在观察LPS注射后的6 h内,内毒素休克组与肠淋巴液干预组小鼠均全部存活;至于该模型小鼠的存活时间以及输入正常肠淋巴液对内毒素休克小鼠存活时间的影响,还有待进一步观察。
本研究也观察到,腹腔注射LPS并给予肠淋巴液后,MAP在注射LPS后80 min、90 min、190 min、210 min、240 min、250 min、340 min、350 min和360 min显著高于内毒素休克组;同时,在腹腔注射LPS后6 h,肠淋巴液干预组小鼠肺、肝和心肌的组织学损伤程度是轻的,且血浆AST和LDH-1活性低于内毒素休克组。这些结果表明,同源正常肠淋巴液对腹腔注射LPS导致的内毒素小鼠具有一定的干预作用。同时也应该注意到,在280~330 min内的各时点,肠淋巴液干预组与内毒素休克组小鼠的MAP比较接近,没有显著差异。究其原因,一方面可能是机体损伤与抗损伤作用斗争的结果;另一方面也说明正常肠淋巴液抗内毒素的作用具有一定的局限性,也可能与输入正常肠淋巴液的时间有关,器官组织学损伤的变化也能表明这一点。
已有的研究表明,MAPKs信号通路可通过G蛋白偶联受体[19]、Toll样受体[20]等多种途径在LPS诱导的细胞损伤和炎症反应中具有重要作用;下调MAPKs信号可降低炎症反应[21-22]。目前,已知MAPKs信号通路的关键信号分子有p38 MAPK、ERK1/2和JNK,故本研究从这3个关键信号分子的磷酸化水平探讨了正常肠淋巴液干预内毒素休克的作用机制。结果显示,小鼠注射LPS后6 h,肺组织p38 MAPK、ERK 1/2和JNK的磷酸化水平显著增高,提示内毒素休克引起的肺损伤可能与MAPKs的磷酸化水平增高有关,这与相关报道是一致的[23-24];而肠淋巴液干预降低了内毒素休克小鼠肺组织的p38 MAPK的磷酸化水平,提示肠淋巴液干预内毒素休克肺损伤的机制可能与p38 MAPK有关;但具体机制还需要进一步研究。
目前的研究表明,LPS引起的肝和心肌损伤与p38 MAPK和JNK的磷酸化水平增高有关[25-27]。但本文的研究结果显示,内毒素休克小鼠心肌和肝组织p38 MAPK、ERK 1/2和JNK的磷酸化水平未出现显著变化,这可能与本实验观察的时间过短有关,也可能与腹腔注射LPS的剂量有关。尽管内毒素休克并未引起小鼠心肌组织p38 MAPK、ERK 1/2和JNK的磷酸化水平出现明显变化,但输入正常肠淋巴液降低了心肌组织三者的磷酸化水平,这将有利于降低MAPKs介导的炎症反应,但这还需要进一步延长实验时间来验证。
我们前期实验表明,在静脉注射LPS后6 h血压降到60 mmHg左右[3-4];而相关文献报道,在血压降低初始血压的1/3以上时,视为出现了内毒素休克[24, 28],故在本实验中,我们选择了在腹腔注射LPS后6 h观察肺、心、肝等组织器官结构以及MAPKs磷酸化水平的变化。但在本实验中,在腹腔注射LPS后的60 min内,MAP维持在80~90 mmHg的一个较高范围内,其主要原因可能是注射至腹腔的LPS转移到血液循环需要一定时间,与静脉注射LPS引起的血压变化不同。
[参 考 文 献]
[1] Angus DC, van der Poll T. Severe sepsis and septic shock[J]. N Engl J Med, 2013, 369(9): 840-851.
[2] Maloney PJ. Sepsis and septic shock[J]. Emerg Med Clin North Am, 2013, 31(3): 583-600.
[3] 张利利,赵自刚,牛春雨,等. 淋浆对内毒素休克大鼠微循环障碍的干预作用[J]. 中国应用生理学杂志, 2011, 27(1): 75-80.
[4] 张利利,张 静,赵自刚,等. 淋浆对内毒素休克大鼠肾肝血流灌注量变化的干预作用[J]. 中国危重病急救医学, 2010, 22(12): 740-743.
[5] Zhao ZG, Niu CY, Zhang LL, et al. Exogenous normal lymph alleviates lipopolysaccharide- induced acute kidney injury in rats[J]. Ren Fail, 2013, 35(6): 806-811.
[6] Zhao ZG, Zhang LL, Niu CY, et al. Exogenous normal lymph reduces liver injury induced by lipopolysaccharide in rats[J]. Braz J Med Biol Res, 2014, 47(2):128-134.
[7] Cheng AM, Moore EE, Masuno T, et al. Normal mesenteric lymph blunts the pulmonary inflammatory response to endotoxin[J]. J Surg Res, 2006, 136(2): 166-171.
[8] Chu W, Li M, Li F, et al. Immediate splenectomy down-regulates the MAPK-NF-κB signaling pathway in rat brain after severe traumatic brain injury[J]. J Trauma Acute Care Surg, 2013, 74(6): 1446-1453.
[9] Niu X, Xing W, Li W, et al. Isofraxidin exhibited anti-inflammatory effectsinvivoand inhibited TNF-α production in LPS-induced mouse peritoneal macrophagesinvitrovia the MAPK pathway[J]. Int Immunopharmacol, 2012, 14(2): 164-171.
[10] Li W, Fan T, Zhang Y, et al. Effect of chelerythrine against endotoxic shock in mice and its modulation of inflammatory mediators in peritoneal macrophages through the modulation of mitogen-activated protein kinase (MAPK) pathway[J]. Inflammation, 2012, 35(6): 1814-1824.
[11] Li Y, Liu B, Fukudome EY, et al. Identification of citrullinated histone H3 as a potential serum protein biomarker in a lethal model of lipopolysaccharide-induced shock[J]. Surgery, 2011, 150(3): 442-451.
[12] Liu C, Zhang GF, Song SW, et al. Effects of ketanserin on endotoxic shock and baroreflex function in rodents[J]. J Infect Dis, 2011, 204(10): 1605-1612.
[13] Madonna R, Jiang J, Geng YJ. Attenuated expression of gelsolin in association with induction of aquaporin-1 and nitric oxide synthase in dysfunctional hearts of aging mice exposed to endotoxin[J]. Int J Immunopathol Pharmacol, 2012, 25(4): 911-922.
[14] Li S, Bao H, Han L, et al. Effects of propofol on early and late cytokines in lipopolysaccharide-induced septic shock in rats[J]. J Biomed Res, 2010, 24(5): 389-394.
[15] Pei H, Zhang Y, Wu H, et al. Relationship between iNOS expression and apoptosis in cerebral tissue, and the effect of sini injection in endotoxin shock rats[J]. J Tradit Chin Med, 2013, 33(4): 486-491.
[16] Noworyta-Sokoowska K, Górska A, Goembiowska K. LPS-induced oxidative stress and inflammatory reaction in the rat striatum[J]. Pharmacol Rep, 2013, 65(4): 863-869.
[17] Park EJ, Jang HJ, Tsoyi K, et al. The heme oxygenase-1 inducer THI-56 negatively regulates iNOS expression and HMGB1 release in LPS-activated RAW 264.7 cells and CLP-induced septic mice[J]. PLoS One, 2013, 8(10): e76293.
[18] Zhao T, Li Y, Liu B, et al. Novel pharmacologic treatment attenuates septic shock and improves long-term survival[J]. Surgery, 2013, 154(2): 206-213.
[19] Frazier WJ, Xue J, Luce WA, et al. MAPK signaling drives inflammation in LPS-stimulated cardiomyocytes: the route of crosstalk to G-protein-coupled receptors[J]. PLoS One, 2012, 7(11): e50071.
[20] Lee NY, Lee HY, Lee KH, et al. Vibrio vulnificus IlpA induces MAPK-mediated cytokine production via TLR1/2 activation in THP-1 cells, a human monocytic cell line[J]. Mol Immunol, 2011, 49(1-2): 143-154.
[21] Lugrin J, Ciarlo E, Santos A, et al. The sirtuin inhibitor cambinol impairs MAPK signaling, inhibits inflammatory and innate immune responses and protects from septic shock[J]. Biochim Biophys Acta, 2013, 1833(6): 1498-1510.
[22] Lee MH, Kang H, Lee K, et al. The aerial part ofTaraxacumcoreanumextract has an anti-inflammatory effect on peritoneal macrophagesinvitroand increases survival in a mouse model of septic shock[J]. J Ethnopharmacol, 2013, 146(1): 1-8.
[23] 马 涛, 刘 志. p38 MAPK-HSP27信号通路在内毒素致大鼠肺损伤中的作用[J]. 中国病理生理杂志, 2012, 28(11): 1943-1949.
[24] 詹丽英,李文澜,柯 伟,等. 内毒素急性肺损伤中p38MAPK、NF-κB与HO-1的关系[J]. 中国病理生理杂志, 2010, 26(9): 1790-1795.
[25] Finkelstein RA, Li Y, Liu B, et al. Treatment with histone deacetylase inhibitor attenuates MAP kinase mediated liver injury in a lethal model of septic shock[J]. J Surg Res, 2010, 163(1): 146-154.
[26] González-Terán B, Cortés JR, Manieri E, et al. Eukaryotic elongation factor 2 controls TNF-α translation in LPS-induced hepatitis[J]. J Clin Invest, 2013, 123(1):164-178.
[27] Yuan H, Perry CN, Huang C, et al. LPS-induced autophagy is mediated by oxidative signaling in cardiomyocytes and is associated with cytoprotection[J]. Am J Physiol Heart Circ Physiol, 2009, 296(2): H470-H479.
[28] 袁利华,刘承武,姚 琦,等. 内毒素休克小鼠肝脏血管内皮细胞特异性结合肽的体内筛选及初步鉴定[J]. 中国病理生理杂志, 2008, 24(11): 2191-2194.
