肝细胞生长因子(HGF)诱导肝癌Huh7细胞发生上皮间质转化(EMT)后细胞膜表面糖蛋白糖谱的变化
2014-08-07莫翠菊秦雪康晓楠彭契六江凯2宇隋靖喆翟励敏刘银坤2
莫翠菊秦 雪康晓楠彭契六江 凯2,卢 宇隋靖喆翟励敏刘银坤2,李 山△
(1广西医科大学第一附属医院检验科 南宁 530021;2复旦大学附属中山医院肝癌研究所 上海 200032;3复旦大学生物医学研究院 上海 200032)
肝细胞生长因子(HGF)诱导肝癌Huh7细胞发生上皮间质转化(EMT)后细胞膜表面糖蛋白糖谱的变化
莫翠菊1,2▲秦 雪1▲康晓楠3彭契六1江 凯2,3卢 宇1隋靖喆1翟励敏1刘银坤2,3李 山1△
(1广西医科大学第一附属医院检验科 南宁 530021;2复旦大学附属中山医院肝癌研究所 上海 200032;3复旦大学生物医学研究院 上海 200032)
目的应用凝集素芯片技术寻找肝癌细胞表面转移相关的特征性糖谱。方法应用肝细胞生长因子(hepatocyte growth factor,HGF)诱导建立肝癌上皮间质转化(epithelial mesenchymal transition,EMT)细胞模型。通过凝集素芯片比较诱导前后细胞膜的糖谱改变,采用凝集素印迹和荧光细胞凝集素免疫组化方法验证芯片结果。结果诱导后细胞对凝集素ACL、BPL、JAC、MPL、PHA-E、SBA和SNA的亲和作用减弱,而对凝集素 AAL、Con A、DBA、GSL Ⅱ、ECL、HAL、LCA、LTL、NML、NPL、PHA-L、PTL Ⅱ和 WFL的亲和作用增强。提示诱导后肝癌细胞表面出现了黏蛋白T/Tn抗原、平分型N-乙酰葡萄糖胺、α2,6唾液酸和末端α或β连接的N-乙酰半乳糖胺结构减少;而末端和核心岩藻糖、高甘露糖、N-乙酰葡萄糖胺β1,6分支和复杂型寡糖分支结构增多。结论肝癌细胞发生EMT过程中细胞膜表面糖链结构改变,提示糖链结构与肝癌的转移密切相关,为有效控制肝癌转移、改善预后提供了新思路。
凝集素芯片; 糖谱; 肝癌(HCC); 上皮间质转化(EMT); 肝细胞生长因子(HGF)
蛋白质糖基化是翻译时一种重要的共修饰方式,蛋白质糖基化修饰伴随多种肿瘤的发生和侵袭转移,并会随着病情而改变[1]。细胞表面糖基化与细胞识别、黏附、受体活化、癌变等过程紧密相关,因此寻找特征性改变的糖链结构对于肿瘤的早期诊断、病程监测和预后评估具有重要作用。肝细胞癌(hepatocellular carcinoma,HCC)是我国常见的高死亡率肿瘤,转移是肝癌得到有效治疗的主要障碍。肝细胞癌是一种上皮源性肿瘤,目前肿瘤侵袭转移能被机制是肿瘤研究的热点。
许多研究已证明上皮间质转化(epithelial mesenchymal transition,EMT)是上皮源性肿瘤转移的关键步骤[2]。EMT是指在一定条件下上皮细胞在形态学上发生向间质细胞表型转变,即失去细胞极性和紧密连接并获得了侵袭和迁移能力,同时上皮细胞和间质细胞标志物表达发生改变。经细胞、动物模型和临床试验证明,EMT与肝癌侵袭、肝内转移及低存活率密切相关[3]。研究表明蛋白质糖基化在肿瘤的发展转移中发挥重要作用,如甲胎蛋白核心岩藻糖基化(AFP-L3)是肝癌的特异性标志物,可用于肝癌的早期诊断和预后判断[4]。因此,寻找肝癌转移相关的特异性糖基化糖链结构将为有效控制肝癌转移、改善预后提供新思路。
本研究通过体外培养上皮性肝癌Huh7细胞株,用肝细胞生长因子(hepatocyte growth factor,HGF)诱导肝癌细胞发生EMT。利用凝集素芯片比较诱导前后肝癌细胞膜表面糖链结构变化,根据凝集素与糖链亲和的特异性判断细胞膜上的糖链类型,以寻找肝癌细胞表面转移相关的特征性糖谱。
材料和方法
材料肝癌细胞株Huh7(中国科学院上海生命科学研究院);高糖DMEM培养基(杭州吉诺生物医药技术有限公司);胎牛血清(美国Gibco公司);PCR引物(上海生工生物技术有限公司);Taq DNA聚合酶(日本Ta KaRa公司);PCR仪(美国Applied Biosystems公司);细胞裂解液和BCA法蛋白定量试剂盒(碧云天生物技术有限公司);ProteoExtractTM天然膜蛋白提取试剂盒(德国Merk公司);MemcodeTM染膜试剂盒(美国Pierce公司);HGF(R&D公司);E-钙黏蛋白、N-钙黏蛋白抗体(美国BD公司),Snail抗体(英国Abcam公司),GAPDH抗体(上海康成生物工程有限公司);凝集素(美国Vector公司);Cy5染料(美国GE公司);凝胶基质素芯片、芯片点样仪Smart Arrayer-48和荧光扫描仪LuxScan 3.0(北京博奥生物有限公司)。
细胞培养用含10%胎牛血清的DMEM培养基在37℃、5%CO2的培养箱里培养Huh7细胞。以1×105/孔接种于六孔板,24 h后将含血清DMEM换成无血清DMEM,加入10 ng/m L HGF诱导72 h,并以无血清DMEM培养细胞作为对照。倒置显微镜下观察细胞形态变化。
荧光定量PCR反应用Trizol试剂提取诱导前后细胞总RNA,以2 mg RNA为模板逆转录合成c DNA,然后以cDNA为模板进行定量PCR,qRTPCR反应体系:10μL SYBR Green PCR Master Mix,上下游引物各0.5μL,cDNA 1μL,补水至总体积20μL。扩增程序为:95℃,5 min;95℃,15 s,60℃,15 s,72℃,20 s;共40个循环。以β-actin为内参,采用2-ΔΔCt法计算基因相对表达量,各引物序列见表1。
Western hlot检测提取诱导前后细胞总蛋白,与5×加样缓冲液混匀,煮沸5 min。取20μg蛋白,用10%SDS-PAGE分离电转移至PVDF膜,用5%脱脂牛奶室温封闭1 h后,加入E-钙黏蛋白(1∶1 000)、N-钙黏蛋白(1∶2 000)、Snail(1∶1 000)及GAPDH (1∶10 000)抗体稀释液,4℃摇动孵育过夜。0.1%TBST洗膜3次,再加入HRP标记的二抗(1∶10 000),室温反应1 h;0.1%TBST洗膜3次,ECL化学发光检测蛋白条带。
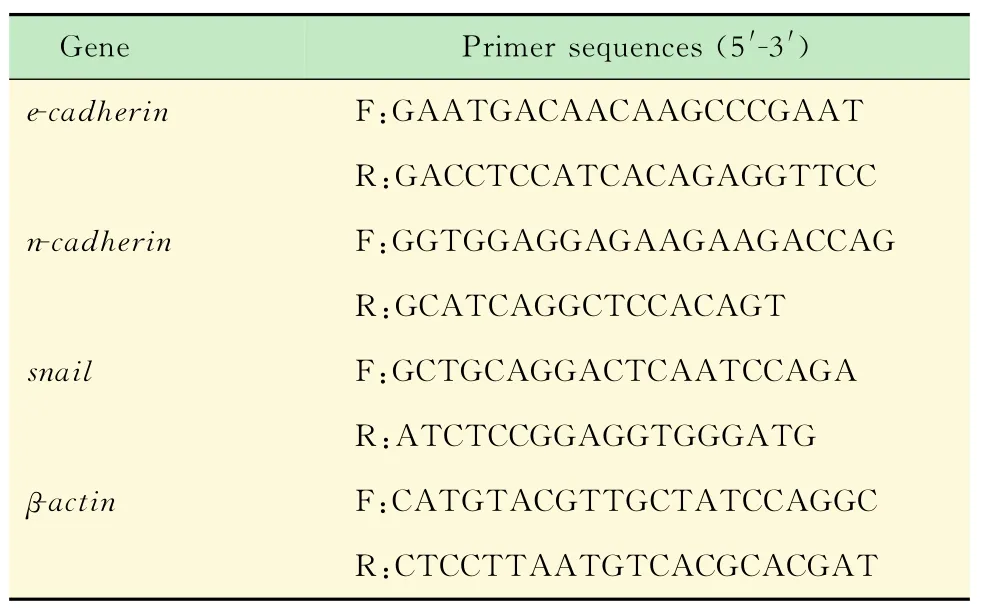
表1 荧光定量PCR反应各引物序列Tah 1 Primers of qRT-PCR
细胞侵袭实验将诱导前后的细胞用无血清的DMEM制成细胞悬液;取5×104个细胞种于铺有Matrigel基质胶的Transwell小室中,下室加入600 μL条件培养基(300μL已培养相应细胞的培养上清+300μL含10%胎牛血清的DMEM),置于5%CO2培养箱培养36 h。取出Transwell小室,吸弃小室内液体,用棉签擦净上室细胞,PBS漂洗后甲醇固定30 min;Giemsa染色30 min,PBS漂洗10 min,倒置显微镜下观察、计数并拍照。
细胞凝集素芯片技术及统计学处理用胰酶消化诱导前后细胞,4℃下125×g离心5 min,PBS清洗2次。细胞用3%戊二醛室温固定15 min,加入0.1 mol/L Na2CO3·Na HCO3标记的缓冲液(p H 9.3)300μL。用Na HCO3标记的缓冲液溶解Cy5染料,加液至100μL。将50μL染料加入300μL细胞悬液中混匀,37℃避光孵育1 h标记细胞膜表面糖蛋白,每10~20 min搅拌1次,避免细胞成团。4℃下125×g离心5 min,PBS漂洗2次,重悬细胞浓度调整为1×106/m L。
芯片每孔加入2%BSA-TBS 100μL,室温孵育1 h,用0.1%PBST洗3次,水平离心机1 000×g离心3 min,甩干液体。将标记好的细胞悬液加到芯片上,每孔100μL,37℃孵育3 h,水平均匀摇晃,以利于标记的膜蛋白和芯片上的凝集素结合。孵育后用0.1%PBST洗去未结合的细胞,水平离心机1 000×g离心3 min甩干液体。最后用荧光扫描仪LuxScan 3.0扫描细胞膜糖蛋白和凝集素的结合信号,将每个点的荧光信号读数减去背景荧光读数所得的值纳入后续统计分析。中位值矫正法矫正不同芯片荧光读数的荧光偏差,矫正后的值每6个重复点计算x¯±s,用SPSS 16.0软件进行t检验分析,倍数改变≥1.5和P<0.05为差异有统计学意义。
凝集素印迹依照天然膜蛋白提取试剂盒说明书提取诱导前后的细胞膜蛋白。30μg膜蛋白用10%SDS-PAGE分离电转移至PVDF膜,按照MemCode可逆蛋白染色试剂盒说明书对膜进行染色,对比两组样本上样量是否一致,同时作为内参。膜脱色后用3%BSA+0.1%TBST室温封闭1 h,然后加入生物素标记的凝集素室温孵育30 min;0.1%TBST洗膜后,加入抗生素蛋白D-HRP,室温孵育30 min;0.1%TBST洗膜,进行ECL化学发光检测,用Quantity One软件进行扫描结果分析。
荧光细胞凝集素免疫组化将对照组细胞和HGF诱导72 h的细胞接种于24孔板培养,筛选60%~80%融合的细胞进行实验。PBS漂洗后,甲醇固定15 min,PBS漂洗3次。每孔分别加入生物素标记的凝集素,室温摇30 min,PBS漂洗3次。加入Streptavidin-Alexa fluor 488(1∶1 000),室温振摇30 min,PBS漂洗3次。细胞核用DAPI染色(1∶2 000),室温孵育5 min,PBS漂洗3次。24孔板置于荧光倒置显微镜下观察,相同的显微镜设置条件均拍摄细胞图像。
结 果
HGF诱导前后Huh7细胞的形态学变化与诱导前比较,经HGF诱导72 h后,上皮来源的Huh7细胞由多边形向成纤维样细胞形态改变(图1)。

图1 HGF诱导前后Huh7细胞的形态变化(200×)Fig 1 Morphological changes of Huh7 cells hefore and after HGF treatment(200×)
HGF诱导前后Huh7细胞EMT相关标志物的表达变化E-钙黏蛋白是典型的上皮细胞标志物,而N-钙黏蛋白、Snail则是间质细胞标志物,荧光定量PCR和 Western blot结果显示(图2),经 HGF诱导72 h后E-钙黏蛋白mRNA和蛋白质表达水平较对照组明显减少,而N-钙黏蛋白和Snail的mRNA和蛋白质表达水平均增加,且差异具有统计学意义(P<0.05)。
HGF诱导前后Huh7细胞侵袭能力的改变Transwell小室侵袭实验检测HGF诱导后细胞的侵袭能力改变,结果显示诱导后穿过胶质膜的细胞数明显增加(P=0.03,图3),说明HGF处理后细胞的侵袭能力增强。
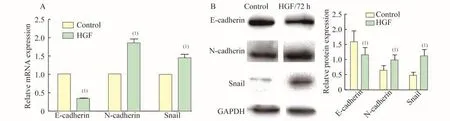
图2 HGF诱导前后Huh7细胞EMT相关基因mRNA和蛋白质的表达变化Fig 2 The expressions of mRNA and protein in Huh7 cells hefore and after HGF treatmentA:qRT-PCR analysis;B:Western blot analysis.vs.Control,(1)P<0.05.
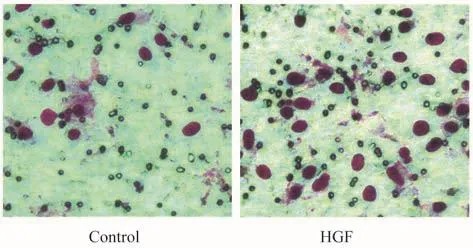
图3 HGF诱导前后Huh7细胞侵袭实验的结果(200×)Fig 3 Matrigel cell invasion assay of Huh7 cells hefore and after HGF treatment(200×)
HGF诱导Huh7发生EMT后细胞膜糖蛋白糖谱变化采用本实验室点制有50种肿瘤相关凝集素的芯片,比较诱导前后细胞膜糖蛋白糖谱,重复实验3次。结果发现,诱导后细胞对凝集素ACL、BPL、JAC、MPL、PHA-E、SBA和SNA的亲和作用减弱,而对凝集素 AAL、Con A、DBA、GSL Ⅱ、ECL、HAL、LCA、LTL、NML、NPL、PHA-L、PTLⅡ和WFL的亲和作用增强(图4)。提示诱导后肝癌细胞表面出现了黏蛋白T/Tn抗原(T/Tnantigen)、平分型 N-乙酰葡萄糖胺 (bisecting Glc NAc)、α2,6唾液酸和末端α或β连接的N-乙酰半乳糖胺(N-GlaNAc)结构减少;而末端和核心岩藻糖(terminal or core fucose)、高甘露糖(high mannose)、α或β连接N-乙酰半乳糖胺、N-乙酰葡萄糖胺β1,6分支(β1,6 Glc NAc branching)和复杂型寡糖分支结构增多。
选取生物素标记的凝集素PHA-E、SNA、AAL、LCA和PHA-L,通过凝集素印迹方法和荧光细胞凝集素免疫组化验证芯片结果(图5、6),验证结果与芯片结果一致,说明芯片结果是可靠的。
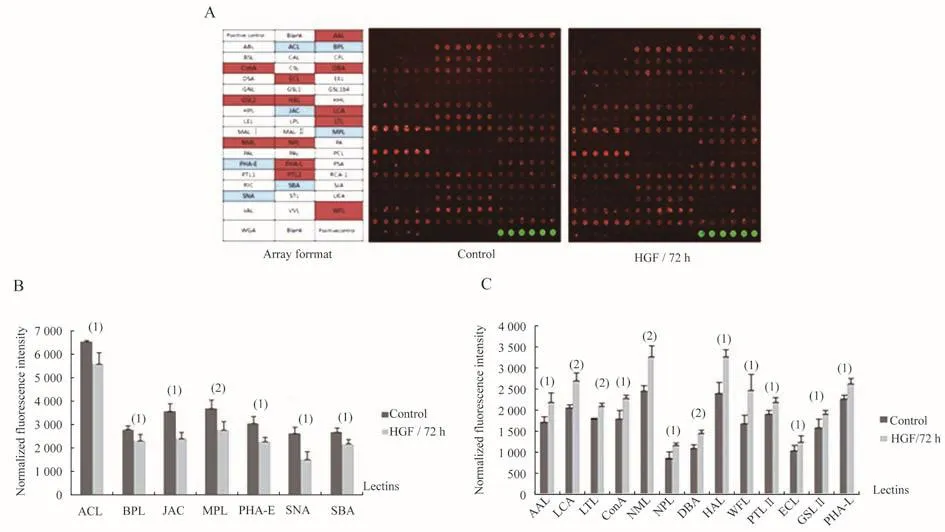
图4 HGF诱导前后Huh7细胞膜糖蛋白糖谱变化Fig 4 The alteration of cell surface glycan profiling in Huh7 cells hefore and after HGF treatmentA:Lectin microarray system;B:Reduced cell surface glycan pattern in EMT;C:Raised cell surface glycan pattern in EMT.Data were showed ass of 3 independent assay.vs.control,(1)P<0.05,(2)P<0.01.

图5 HGF诱导前后Huh7细胞与凝集素相结合的凝集素印迹图Fig 5 The affinity of Huh7 cells and lectin hlot hefore and after HGF inductionM:Marker;C:Control.

图6 HGF诱导前后Huh7细胞与凝集素相结合的荧光细胞凝集素免疫组化图(100×)Fig 6 The affinity of Huh7 cells and lectin hefore and after HGF treatment analyzed hy fluorescence cell lectin-immunochemistry(100×)
讨 论
EMT是肿瘤侵袭转移过程中的关键环节,EMT的发生可受环境刺激或胞外基质因子调节。HGF是肝细胞分泌的种多功能细胞因子,在一些肿瘤模型中,HGF可诱导EMT出现,降低肿瘤细胞间的黏附并增强侵袭力。在本实验中,我们通过HGF诱导成功建立了肝癌Huh7细胞EMT模型。诱导后细胞的形态呈现纺锤样变化,侵袭能力比诱导前明显增强,且EMT相关指标E-钙黏蛋白表达减低,而N-钙黏蛋白和转录因子Snail表达增高。E-钙黏蛋白表达下调可以启动细胞的EMT[5],而N-钙黏蛋白的表达增加也与EMT呈正比[6],E-钙黏蛋白向N-钙黏蛋白转化可以指示肿瘤细胞的EMT进程。Snail是多条信号通路共同的下游靶点,在EMT调节中发挥作用。本研究的基因和蛋白质结果与以往研究一致,提示HGF可以诱导肝癌细胞的EMT转化。
异常改变的细胞膜糖链在肿瘤细胞免疫逃避和转移中发挥作用,如细胞膜唾液酸化和β1,6支链N-聚糖可促进肿瘤细胞的分化增殖、转移[7-8]。亲和色谱技术、质谱技术、核磁共振等糖分析技术均不适合全面分析糖谱变化,也不能进行高通量分析。凝集素芯片技术是一种新出现的快速糖分析技术,具有高通量性和高敏感性。本实验中,我们用凝集素芯片检测完整的细胞膜表面糖谱,直接将Cy5标记的细胞与芯片杂交,洗去未结合细胞后,将结合在凝集素芯片上的细胞直接用于荧光扫描。我们所用的是一种凝胶基质凝集素芯片,曾用来鉴别标准糖蛋白去唾液酸胎球蛋白(asialofetuin,ASF)和胎球蛋白(fetuin,FET)的糖链差异,得出了准确结果,还成功用于区分不同来源的AFPN-糖谱[9]。这些前期工作保证了这种凝集素芯片系统检测结果的准确性。
糖链结构改变与肿瘤的进展密切相关。Guan等[10]和Freier-de-Lima等[11]在TGF-β诱导EMT进程中发现糖苷神经鞘脂类下调而胚胎纤连蛋白O-糖基化程度增加[10-11]。Chammas等[12]利用基因芯片发现了40种与EMT相关的糖基因,如GALNT2、GALNT10等糖基转移酶基因在细胞EMT过程中表达上调。目前对肿瘤细胞侵袭过程中糖谱表达变化的研究较少见。在本研究中,我们采用凝集素芯片筛选出20种参与肝癌EMT细胞膜糖蛋白亲和强度改变的凝集素。发生EMT的细胞组对PHA-L的亲和作用强于PHA-E,这两种凝集素分别识别β1,6分支和平分型N-GlcNAc结构,而这两种结构分别由N-乙酰氨基葡萄糖基转移酶V(Gn T-V)和N-乙酰氨基葡萄糖基转移酶Ⅲ(Gn T-Ⅲ)催化生成,Gn T-Ⅲ催化UDP-N-乙酰氨基葡萄糖(UDP-GlcNAc)中的GlcNAc转移至N-聚糖核心的β-Man上,生成β1,4-Glc NAc,也称为平分型N-GlcNAc。据文献报道,Gn T-Ⅲ是一种肿瘤转移抑制基因,其过表达抑制肿瘤转移的机制为:增加细胞-细胞间的黏附及下调细胞-细胞外基质间的粘附。Gn T-Ⅲ催化合成的平分型结构抑制α3β1和α5β1整合蛋白与细胞外基质层黏连蛋白(laminins)结合而参与细胞迁移[13]。Deb等[14]证明Gn T-Ⅲ介导E-钙黏蛋白N-糖基化可促进TGF-β1诱发EMT,而抑制Gn T-Ⅲ可以使EMT改变恢复到MET状态。Xu等[15]发现过表达Gn T-Ⅲ可以抑制TGF-β1诱导EMT和β-catenin的核定位及细胞迁移;而下调Gn T-Ⅲ表达和上调Gn T-V表达可增强TGF-β1诱导EMT。Gn T-V催化UDP-GlcNAc中的GlcNAc转移到N-糖链核心α1,6臂的α-Man上,形成N-糖链的β-1,6分支结构。与Gn T-Ⅲ抑制肿瘤转移相反,Gn T-Ⅴ与细胞的恶性转化和肿瘤的侵袭转移密切相关。Gn T-V催化增加的β-1,6分支通过降低整合蛋白介导的黏附和细胞内信号传导途径,减少细胞黏附,增加肿瘤细胞的迁移和侵袭能力[13]。在Gn T-V转基因鼠中发现,Gn T-V通过增强EGF受体信号来促进EMT和角质细胞侵袭[16]。在本研究中我们用凝集素芯片成功捕捉到这一经典转移相关的糖链改变。同样,我们采用凝集素印迹和荧光细胞免疫化学方法在细胞膜蛋白和细胞表面检测到了这一糖链结构变化,验证了芯片结果的准确性。
核心岩藻糖,即α1,6岩藻糖,是肝癌转移的一种重要糖基化修饰。甲胎蛋白岩藻糖基化,即AFPL3是肝癌诊断的特异指标,预示更高的转移可能性[3]。核心岩藻糖由α1,6岩藻糖基转移酶(α1,6 Fuc T)催化形成,α1,6 Fuc T与肿瘤细胞的增殖、侵袭、转移高度相关。本研究发现特异亲和岩藻糖结构的凝集素AAL和LCA在EMT模型中信号增强。Dai等[17]发现组织和细胞内蛋白的核心岩藻糖基化程度随肝癌转移潜能的增加而增加。T/Tn抗原是肿瘤细胞表面黏蛋白相关的一种糖抗原标志物,可被凝集素ACL、BPL、JAC和MPL所识别。T/Tn抗原常在结肠癌和乳腺癌中表达增高,且与肿瘤的转移预后相关[18-19]。我们发现在肝癌EMT中T/Tn抗原表达减少,这为肝癌转移研究提供了参考数据。通过凝集素芯片技术我们还发现,在诱导发生EMT后肝癌细胞表面的高甘露糖结构增多,而α2,6唾液酸结构减少,有研究报道甘露糖结构增加可能与肿瘤恶性表型相关,在人和鼠肝癌中均可见甘露糖结构修饰增多的GGT[20]。我们的研究结果与孙海艳等[21]的报道一致,即α2,6唾液酸结构在转移性肝癌中表达下调,但也有研究显示唾液酸结构增加可减少肿瘤细胞对胞外基质的黏附[7]。细胞EMT转化的机制十分复杂,可能有多种因素参与,因此鉴定与这些结构改变相关的糖蛋白并阐明其在EMT进程中的作用机制是未来研究的重点。
用凝集素芯片捕获细胞膜表面糖链结构表达谱变化存在一定的局限性,如凝集素结合糖链结构并非专一性,因此只能推测细胞膜糖链结构类型;凝集素与糖链的亲和力小,在洗去未结合细胞时,可能同时洗掉一些表面糖链表达低的细胞,致其无法被检测出来。但鉴于凝集素芯片技术的快速和高通量性,可对细胞膜表面糖链结构变化进行动态、通量的检测。我们利用这一技术捕获了肝癌细胞EMT过程中细胞膜糖蛋白糖谱变化,而与之对应的糖蛋白或糖基转移酶基因可能成为阻止发生EMT的干预靶点,从而为防治肝癌转移和改善预后提供新的依据。
[1] Apweiler R,Hermjakob H,Sharon N.On the frequency of protein glycosylation,as deduced from analysis of the SWISS-PRo T database[J].Biochim Biophys Acta,1999,1473(1):4-8.
[2] Turley EA,Veiseh M,Radisky DC,et al.Mechanisms of disease:epithelial-mesenchymal transition-does cellular plasticity fuel neoplastic progression?[J].Nat Clin Pract Oncol,2008,5(5):280-290.
[3] Yang MH,Chen CL,Chau GY,et al.Comprehensive analysis of the independent effect of twist and snail in promoting metastasis of hepatocellular carcinoma[J].Hepatology,2009,50(5):1464-1474.
[4] Meany DL,Chan DW.Aberrant glycosylation associated with enzymes as cancer biomarkers[J].Clin Proteomics,2011,8(1):7.
[5] Liu YN,Liu Y,Lee HJ,et al.Activated androgen receptor downregulates E-cadherin gene expression and promotes tumor metastasis[J].Mol Cell Biol,2008,28(23):7096-7108.
[6] Yoon WH,Song IS,Lee BH,et al.Differential regulation of vimentin mRNA by 12-O-tetradecanoylphorbol 13-acetate and all-trans-retinoic acid correlates with motility of Hep 3B human hepatocellular carcinoma cells[J].Cancer Lett,2004,203(1):99-105.
[7] Dennis J,Waller C,Timpl R,et al.Surface sialic acid reduces attachment of metastatic tumour cells to collagen type IV and fibronectin[J].Nature,1982,300(5889):274-276.
[8] Dennis JW,Laferté S,Waghorne C,et al.Beta 1-6 branching of Asn-linked oligosaccharides is directly associated with metastasis[J].Science,1987,236(4801):582-585.
[9] Chen P,Liu Y,Kang X,et al.Identification of N-glycan of alpha-fetoprotein by lectin affinity microarray[J].J Cancer Res Clin Oncol,2008,134(8):851-860.
[10] Guan F, Handa K, Hakomori SI.Specific glycosphingolipids mediate epithelial-to-mesenchymal transition of human and mouse epithelial cell lines[J].Proc Natl Acad Sci USA,2009,106(18):7461-7466.
[11] Freire-de-Lima L,Gelfenbeyn K,Ding Y,et al.Involvement of O-glycosylation defining oncofetal fibronectin in epithelial-mesenchymal transition process[J].Proc Natl Acad Sci U S A,2011,108(43):17690-17695.
[12] Chammas R,Maupin KA,Sinha A,et al.Glycogene expression alterations associated with pancreatic cancer epithelial-mesenchymal transition in complementary model systems[J].PLoS ONE,2010,5(9):e13002.
[13] Pinho SS,Seruca R,Gärtner F,et al.Modulation of E-cadherin function and dysfunction by N-glycosylation[J].Cell Mol Life Sci,2011,68(6):1011-1020.
[14] Deb S,Pinho SS,Oliveira P,et al.Loss and recovery of Mgat3 and Gn T-Ⅲmediated E-cadherin N-glycosylation is a mechanism involved in epithelial-mesenchymalepithelial transitions[J].PLoSONE,2012,7(3):e33191.
[15] Xu Q,Isaji T,Lu Y,et al.Roles of NAcetylglucosaminyltransferaseⅢin epithelial-tomesenchymal transition induced by transforming growth factorβ1 (TGF-β1)in epithelial cell lines[J].J Biol Chem,2012,287(20):16563-16574.
[16] Terao M,Ishikawa A,Nakahara S,et al.enhanced epithelial-mesenchymal transition-like phenotype in NAcetylglucosaminyltransferase V transgenic mouse skin promotes wound healing[J].J Biol Chem,2011,286(32):28303-28311.
[17] Dai Z,Liu YK,Cui JF,et al.Identification and analysis of alteredα1,6-fucosylated glycoproteins associated with hepatocellular carcinoma metastasis[J].Proteomics,2006,6(21):5857-5867.
[18] Itzkowitz SH,Yuan M,Montgomery CK,et al.Expression of Tn,sialosyl-Tn,and T antigens in human colon cancer[J].Cancer Res,1989,49(1):197-204.
[19] Konska G,Guerry M,Caldefie-Chezet F,et al.Study of the expression of Tn antigen in different types of human breast cancer cells using VVA-B4 lectin.[J].Oncol Rep,2006,15(2):305-310.
[20] Furmanski P,Phillips PG,Lubin M.Cell surface interactions with concanavalin A:determination by microhemadsorption[J].Proc Soc Exp Biol Med,1972,140(1):21621-9.
[21] 孙海艳,李岩,郭坤,等.肝癌转移相关的骨桥蛋白表达及其糖基化的改变[J].中华肝脏病杂,2011,19(12):904-907.
Changes of glycan profiling in cell surface after hepatocyte growth factor(HGF)induced epithelial mesenchymal transition(EMT)in Huh7 hepatocellular carcinoma cells
MO Cui-ju1,2▲,QIN Xue1▲,KANG Xiao-nan3,PENG Qi-liu1,JIANG Kai2,3,LU Yu1,SUI Jing-zhe1,ZHAI Li-min1,LIU Yin-kun2,3,LI Shan1△
(1Department of Clinical Laboratory,First Affiliated Hospital of Guangxi Medical University,Nanning530021,Guangxi Zhuang Autonomous Region,China;2Liver Cancer Institute,Zhongshan Hospital,Fudan University,Shanghai200032,China;3Institute of Biomedical Sciences,Fudan University,Shanghai200032,China)
lectin microarray; glycan profiling; hepatocellular carcinoma(HCC); epithelial mesenchymal transitions(EMT); hepatocyte growth factor(HGF)
R 392.12
A
10.3969/j.issn.1672-8467.2014.02.010
2013-05-13;编辑:段佳)
国家重点基础研究发展计划项目(973计划)(2011CB 910604,2013CB 910501);国家自然科学基金(81060199);广西自然科学基金(2012GXNSFAA053088)
▲Co-first authors
△Corresponding author E-mail:lis8858@163.com
【Ahstract】 OhJectiveTo search the specific cell surface glycan profiling related with hepatocellular carcinoma(HCC)metastasis by lectin microarray.MethodsHepatocyte growth factor(HGF)induced epithelial mesenchymal transition(EMT)model in Huh7 cells was established.Cell surface glycan profiling of Huh7 cells treated with or without HGF were compared by lectin microarray,thenthe results from lectin microarray were verified by lectin blot and fluorescence cell lectinimmunochemistry.ResultsThe binding affinities to 7 lectins ACL,BPL,JAC,MPL,PHA-E,SBA and SNA were reduced in HGF induced EMT cells,meanwhile the affinities to bind 13 lectins,AAL,Con A,DBA,GSLⅡ,ECL,HAL,LCA,LTL,NML,NPL,PHA-L,PTL Ⅱand WFL,were increased with statistic significance.It implied that the decreased T/Tn-antigen,NA2 and bisecting Glc NAc,Siaα 2-6 Gal/Gal NAc,terminalαorβGal NAc structures,and the increased terminal and core fucose,high mannose,β1,6 Glc NAc branching and tetraantennary complex oligosaccharides structures may be involved in the changed glycan profiles as EMT process happened in Huh7 cells.ConclusionsCell surface glycan altered in the EMT process and it may be closely related to the metastasis of HCC.This finding provides a new idea for HCC metastasis and prognosis.
*This work was supported hy the National Research Program of China(973 Program)(2011CB 910604,2013CB 910501);the National Natural Science Foundation of China (81060199)and the National Natural Science Foundation of Guangxi,China(2012GXNSFAA053088).
