CT导向肝脏肿瘤射频消融病灶定位的研究*
2014-08-07杨福奎陈德路
杨福奎 陈德路
(山东省聊城市中医医院CT室,聊城 252000)
·临床论著·
CT导向肝脏肿瘤射频消融病灶定位的研究*
杨福奎 陈德路**
(山东省聊城市中医医院CT室,聊城 252000)
目的探讨CT导向肝脏肿瘤射频消融的技术和方法。方法2011年1月~2013年5月,选择67例肝脏肿瘤患者共75个肿瘤,直径2.1~6 cm,其中<3.5 cm 64个,>3.5 cm 11个。把CT定位图像导入肿瘤精确放射治疗计划系统内,将直径>3.5 cm的11个肿瘤共划分成52个直径<3.5 cm的肿瘤,共按照116个直径<3.5 cm的小肿瘤,在CT导向下,利用研制的肿瘤穿刺辅助器械进行定位和穿刺,利用肿瘤精确放射治疗计划系统对穿刺效果和消融灶进行验证评估,采用RITA多极射频肿瘤消融仪对每个小肿瘤进行射频消融。结果116个小肿瘤在空间内的平均穿刺误差2.9 mm(1~5 mm),肝内75个肿瘤全部被消融灶包含,消融过程中和消融后无严重并发症发生。术后4~6周复查增强CT,75个肿瘤及其消融灶边缘均无强化。术后3个月肝脏CT增强扫描,75个肿瘤所在区域为低密度,动脉期未见强化。均为完全消融。结论借助CT导向和肿瘤穿刺辅助器械对肝脏肿瘤进行穿刺和射频消融,穿刺准确,消融彻底安全。
肝脏; 癌; 射频消融
肝癌及肝转移癌是我国常见的恶性肿瘤,预后较差,中晚期肝癌往往手术无法切除,采用全身化疗、介入、栓塞等治疗方法效果也不满意。近年来,经皮射频消融(radiofrequency ablation,RFA)在肝癌及肝转移癌治疗中得到广泛的应用,并取得较好的疗效[1]。但在整个治疗过程中,仍存在需要反复穿刺扫描、膈顶部肿瘤难以获得理想穿刺、消融灶与病灶出现偏移不一致、大病灶多个消融灶之间易出现漏空等问题[2]。2011年1月~2013年5月,我们利用自制肿瘤穿刺辅助器械和美国瓦里安公司肿瘤精确放射治疗计划系统(therapy planning system,TPS),在CT导向下进行肝脏肿瘤穿刺和射频消融,取得较理想效果,报道如下。
1 临床资料与方法
1.1 一般资料
本组67例,均为病情或身体条件不宜手术或患者不同意手术,病灶<6 cm的患者。男61例,女6例。年龄36~71岁,中位年龄51岁。术前均行CT增强扫描、MRI及超声检查。CT增强扫描病灶符合快进快出典型肝细胞肝癌表现者47例,表现为混杂密度灶边界不清者8例,转移性肝癌12例(有胃窦癌切除术史6例,直肠癌切除术史5例,胆囊癌切除史1例)。单发灶59例,双发灶8例,共75个肿瘤,直径2.1~6 cm,其中<3.5 cm肿瘤64个,>3.5 cm肿瘤11个。肝功能Child-pugh分级A级52例,B级15例。血甲胎蛋白(AFP)>400 μg/L 47例,25~330 μg/L 11例,0~25 μg/L 9例。
根据中华人民共和国卫生部原发性肝癌临床诊断标准[3],满足下列条件中①+②A或者①+②B+③时,可以确立肝细胞肝癌(hepatocellular carcinoma,HCC)的临床诊断:①具有肝硬化及乙型肝炎病毒(HBV)和(或)丙型肝炎病毒(HCV)感染(HBV和HCV抗原阳性)的证据。②典型的影像学特征:同期多排CT或动态增强MR检查显示快进快出影像学特征:A.如果肝脏占位>2 cm,CT和MR两项影像学检查有一项显示肝脏占位具有上述肝癌特征,即可诊断HCC;B.如果肝脏占位直径为1~2 cm,则需要CT和MR两项影像学检查都显示肝脏占位有上述肝癌特征,方可诊断HCC。③血清AFP>400 μg/L持续1个月,或>200 μg/L持续2个月,并能排除其他原因引起的AFP升高,包括妊娠、生殖系胚胎肿瘤、活动性肝病及继发性肝恶性肿瘤。
本组原发性肝癌都符合上述临床诊断标准。术前常规进行心、肺、肝、肾功能及血常规检查,无射频消融禁忌证。根据医院技术委员会和伦理委员会的批准文件(批文号:2010003),患者及家属完全知情并签字同意。
1.2 方法
常规皮肤准备,术前禁食4~6 h,术前半小时予苯巴比妥或地西泮肌内注射,手术区域常规消毒、铺巾,穿刺点局部麻醉,然后进行穿刺和射频消融术。
1.2.1 肿瘤穿刺辅助器械的结构和原理 示意图见图1。箭托可以带动箭杆绕半圆形穿刺弓移动;穿刺针尖端恒定位于穿刺弓圆心点(等中心点);箭杆可以带动穿刺针沿穿刺弓半径穿刺,并能够利用箭杆上的挡块将穿刺针尖端挡停在圆心点(等中心点);穿刺弓以固定螺丝A和B的连线(穿刺弓直径)为轴转动和锁止。借助以上结构,穿刺针的穿刺路径可以在以圆心为球心的半个球体的任意半径中随意选择,穿刺针尖端恒定被挡停在圆心点,其穿刺机械精度为1 mm。滑动x、y、z轴三方向滑块可以带动穿刺弓圆心在x、y、z轴三方向上移动(三维空间转移),各滑块滑动机械精度均为0.5 mm,弧形板可以与CT床板紧密结合。
1.2.2 呼吸状态记录开关的原理和使用方法 示意图见图2。红外线发射器和接收器是点对点对应关系。使用时,先利用皮肤贴把红外线发射器固定在呼吸动度最大处的皮肤上,再调整红外线接收器的位置,使红外线接收器在固定体位下,患者平静呼吸的吸气末接收到红外线,光电开关接通,信号灯亮和蜂鸣器响,如果患者体位发生改变或呼吸状态不同,引起红外线移动距离超过2 mm,光电开关断开,声光信号中断。
1.2.3 选择固定患者体位、CT定位扫描、测量肿瘤中心与皮肤标记点的位置关系 利用肿瘤穿刺辅助器械的弧形板,把辅助器械的基座固定在CT床板上,再放置放射治疗固定患者体位用的负压袋,根据患者体位舒适稳定的要求和肝内肿瘤的位置,选择患者体位并用负压袋抽真空固定,像精确放射治疗的CT定位一样,粘贴直径1 mm的金属皮肤标记点,安装调整呼吸状态记录开关,在患者平静呼吸的吸气末信号灯亮蜂鸣器响,嘱咐患者看到信号灯亮或听到蜂鸣器响时屏气,进行3次屏气训练。在患者屏气状态下,进行2 mm层厚CT定位扫描,图像导入CT影像工作站内的肿瘤放射治疗计划系统(TPS),在肿瘤区(gross target volume,GTV)名目下勾画出肿瘤范围,并测量肿瘤中心与皮肤标记点在x、y、z轴三方向上的空间距离,见图3、图4。
1.2.4 安装调整滑块和穿刺弓,通过移动x、y、z轴三方向滑块实现圆心(等中心)空间转移 安装调整各滑块,x轴方向滑块和y轴方向滑块处于中间0刻度位置,z轴方向滑块处于最高点,安装穿刺弓,穿刺弓和箭杆都处于垂直0°位。根据肿瘤深度调整套针外露长度和针具盒与箭杆位置,使套针尖端位于圆心点,固定并记录箭杆上挡块的位置,移动x、y、z轴三方向滑块,使套针尖端位于皮肤标记点处(图5),记录x、y、z轴三方向滑块在此位置的数据。根据上述测量所得肿瘤中心与皮肤标记点在三维空间内的距离数据,移动x、y、z轴三方向滑块,使弓圆心(等中心)位于肿瘤中心(图6)。
1.2.5 穿刺和实际消融灶验证 参考图像上肿瘤大小和在肝脏内的位置,避开重要的组织和器官,选择最佳穿刺角度,根据细电极针呈伞状打开后,形成球形消融灶的球心与肿瘤中心重合的原则,计算套针尖端与肿瘤中心的距离,根据该距离再次调整箭杆上挡块的位置,使套针尖端停留的位置满足消融灶的球心与肿瘤中心重合的要求(图7)。根据选择的穿刺角度,调整并固定穿刺弓的倾斜角度(头足方向)和箭杆的倾斜角度(左右方向),常规皮肤消毒、麻醉,嘱咐患者听到蜂鸣器声或看到信号灯亮时屏气,医生在1~2 s时间内用手掌快速顶推箭杆直至被挡停,CT扫描验证套针尖端位置,释放细电极针,再次CT扫描验证细电极针形成的消融灶,图像导入TPS内,在GTV名目下勾画出肿瘤范围,在计划靶区(planning target volume,PTV)名目下勾画出细电极针形成的实际消融灶范围,在TPS的三维图像内观察实际消融灶是否完全包含肿瘤范围(图8)。如果肿瘤直径>3.5 cm,在TPS内把肿瘤分割成若干个直径<3.5 cm的小肿瘤并在GTV名目下分别进行勾画,分别命名为GTV1、GTV2……,各个小GTV之间可以有交叉重叠,但是其外缘必须紧密相连,包全肿瘤外缘,不得有漏空。标出各个小GTV的中心,按照独立小肿瘤逐个进行穿刺、实际消融灶验证,在PTV名目下勾画消融灶,分别命名为PTV1、PTV2……,最后在TPS的三维图像内进行叠加后的消融灶与肿瘤范围验证。
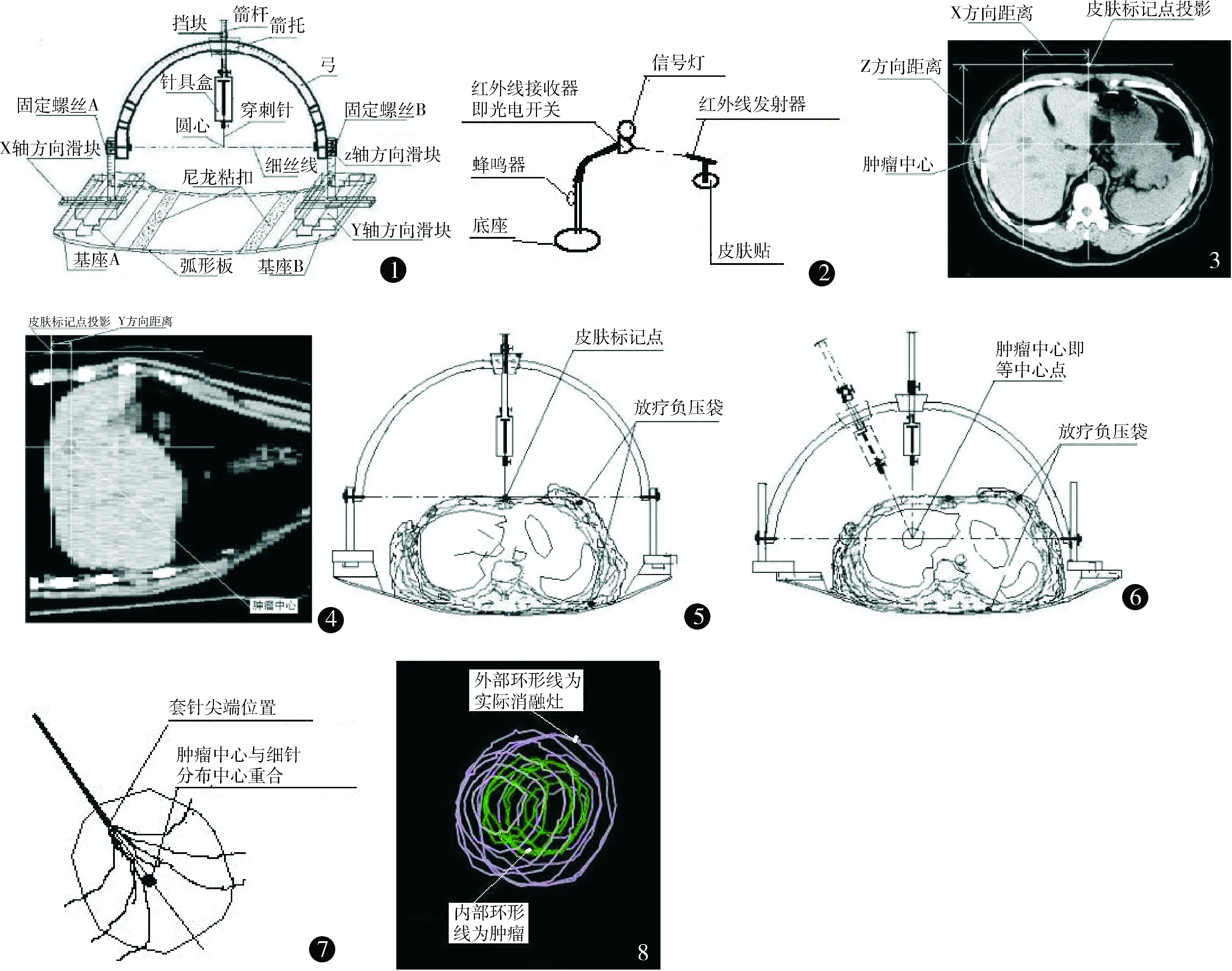
图1 肿瘤穿刺辅助器械结构和原理示意图 图2 呼吸状态记录开关原理示意图 图3 应用TPS测量肿瘤中心与皮肤标记点在x、z轴方向距离 图4 应用TPS测量肿瘤中心与皮肤标记点在y轴方向距离 图5 坐标转移前皮肤标记点为等中心点 图6 坐标转移后肿瘤中心为等中心点 图7 套针尖端与肿瘤中心位置关系 图8 应用TPS验证实际消融灶
1.2.6 射频消融 采用美国瑞达公司RITA1500X多极射频肿瘤消融仪,用电极套针经皮穿刺到肝内肿瘤,释放细电极针,根据肿瘤、形状设计和验证消融灶,再根据形成消融灶的直径采用相应消融程序,治疗靶温度90 ℃,射频输出功率70~150 W,治疗全程心电监护并吸氧,常见并发症对症处理,无严重并发症发生。
1.2.7 疗效判定标准(中国抗癌协会肝癌专业委员会)[4]治疗后1个月复查肝脏三期CT/MRI或超声造影以评价消融疗效:①完全消融(complete response,CR),肝脏三期CT/MRI或超声造影随访,肿瘤所在区域为低密度(超声表现为高回声),动脉期未见强化;②不完全消融(incomplete response,ICR),肝脏三期CT/MRI或超声造影随访,肿瘤病灶内局部动脉期有强化,提示有肿瘤残留。
2 结果
2.1 定位结果
11个直径>3.5 cm的肿瘤共划分成了52个直径<3.5 cm的小肿瘤进行穿刺和射频消融,<3.5 cm的肿瘤直接进行穿刺和消融,总共按照116个小肿瘤进行穿刺和消融。
把CT定位图像和CT验证图像导入TPS,利用其精确放疗空间误差测量与计算方法,对穿刺套针尖端空间穿刺误差进行测量与计算,116个小肿瘤套针尖端在空间内的穿刺误差1~5 mm,平均2.9 mm。在GTV名目下勾画肿瘤体积,在PTV名目下勾画细电极针形成的消融灶体积,GTV全部被PTV包含,即每位患者消融灶的体积包括了全部肿瘤的体积。
2.2 射频消融结果
术后4~6周复查增强CT扫描,75个肿瘤及消融灶边缘均无强化。术后3个月肝脏CT增强扫描,75个肿瘤所在区域为低密度,动脉期未见强化。均为完全消融(CR)。
3 讨论
射频消融的原理是在肿瘤组织内施以一定频率的射频电流,产生高频率电磁波,组织内分子发生高速震荡产生摩擦,将射频能转化为热能,当温度达到90 ℃时可以有效地快速杀死局部肿瘤细胞[5]。根据射频消融的原理,射频消融的范围(消融灶)必须完全包含所有肿瘤体积,由于细电极针释放后形成的是一个球形轮廓,其直径理论上最大可达到5 cm,但由于肿瘤挤压等原因,实际直径比理论直径小[6],根据我们的观察,对于直径<3.5 cm的肿瘤,只要肿瘤中心和细电极针形成的球形轮廓中心重合,细电极针形成的消融灶就可以完全包含肿瘤体积。只有进行肿瘤精确定位和穿刺,才能实现上述两个中心重合,避免消融灶与肿瘤之间出现偏移不一致。
肿瘤穿刺辅助器械利用肿瘤精确放射治疗的精确定位和等中心转移原理及GTV和PTV的勾画方法[7],实现肿瘤精确定位和穿刺,根据细电极针形成的球形轮廓中心与套针尖端的距离,利用TPS精确计算套针尖端的停留位置,为肿瘤中心和细电极形成的球形轮廓中心重合提供了可靠数据。套针尖端在三维空间内的平均穿刺误差是2.9 mm,对于<3.5 cm的肿瘤,该误差不会影响消融灶完全包含肿瘤体积。在TPS内把>3.5 cm的肿瘤划分成为若干个小肿瘤,再按照独立肿瘤进行定位穿刺和射频消融,在PTV名目下逐个勾画出各个小射频消融灶,在三维图像内观察各个小消融灶的总体积是否包全肿瘤体积,如有遗漏,可以再次在GTV名目下勾画出遗漏的肿瘤体积,再次按照独立肿瘤进行定位穿刺和消融,这些过程可以确保所有肿瘤得到射频消融。
肝内肿瘤的位置受呼吸运动影响较大,影响穿刺的准确性和射频消融的效果,肝内肿瘤射频消融必须考虑呼吸运动的影响[8]。呼吸状态记录开关可以精确记录患者体位和呼吸状态,能够确保CT定位扫描时、穿刺过程、套针尖端位置CT验证扫描时、细电极针释放后实际消融灶CT扫描时4个过程中,患者体位和呼吸状态一致,能够为肿瘤准确定位穿刺和布局细电极针及评估消融灶的安全性提供有力帮助,对于需要多肿瘤消融的患者,由于患者体位保持时间较长,容易发生体位改变,呼吸状态和体位的记录更为重要,只有患者呼吸状态和体位一致,才能保障肿瘤穿刺和消融灶的准确性和安全性[9]。
肝内肿瘤是一个立体的体积,评估消融灶是否安全合理必须在三维图像内进行消融灶体积与肿瘤体积比较[10],TPS能够精确计算肿瘤体积和消融灶体积,可以准确、直观判断消融灶体积是否完全包含肿瘤体积,为肿瘤是否能够被完全消融提供可靠信息。TPS的三维图像能够为科学设计穿刺路径、避开重要的组织器官及判断消融灶是否包含重要组织器官提供帮助,结合穿刺辅助器械可以任意选择穿刺路径的特点,可以最大程度地减少穿刺和射频消融的并发症。总之,利用CT导向和肿瘤穿刺辅助器械进行肝脏肿瘤穿刺和射频消融,能够将肝脏内肿瘤所有体积完全消融,严重并发症少,安全有效。
1 张智坚,吴孟超,陈 汉,等.射频消融肝脏恶性肿瘤并发症的防治.中国微创外科杂志,2005,5(2):113-115.
2 马庆久,吴金生,高得明,等.B超引导下多弹头射频治疗肝癌100例.中华外科杂志,2000,38(4):272-274.
3 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版).临床肿瘤学杂志,2011,16(10):929-946.
4 中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤学协作专业委员会,中华医学会肝病学分会肝癌学组,等.肝癌局部消融治疗规范的专家共识.中华肝脏病杂志,2011,19(4):257-259.
5 马宽生.肝脏良性肿瘤的射频消融治疗.中国微创外科杂志,2006,6(1):11-12.
6 谢广伦,储勤军,管 生,等.清醒镇静镇痛状态下肝癌射频消融术临床观察.中华放射学杂志,2009,43(11):1224-1225.
7 胡逸民.肿瘤放射物理学.北京,原子能出版社,1999.421-436.
8 骆 平,陈志刚,刘晓蕾,等.CT导向射频消融治疗中晚期肝癌疗效观察.临床医学,2006,26(7):29.
9 刘宝东,刘 磊,李 岩,等.CT引导下射频消融治疗肺癌的学习曲线.中国微创外科杂志,2012,12(2):160-162.
10 朱晓峰,何晓顺,陈敏山,等.原发性肝癌三种根治性方法疗效的多中心对比研究.中华肝胆外科杂志2011,17(5):372-375.
(修回日期:2013-12-02)
(责任编辑:王惠群)
TheStudyofRadiofrequencyAblationunderComputerTomography
YangFukui,ChenDelu.
ComputerTomographyDivision,ChineseMedicineHospitalofLiaochengCity,Liaocheng252000,China
ObjectiveTo investigate the method and skill of CT guided radiofrequency ablation (RFA).MethodThe clinical data of 67 patients with 75 hepatic tumor from January 2011 to May 2013 were analyzed. The diameters of the tumors were within 2.1-6.0 cm, with 64 tumors being smaller than 3.5 cm and 11 tumors larger than 3.5 cm. Import all CT images into the accurate radiation therapy system, and 11 tumors with a diameter of more than 3.5 cm were divided into 52 smaller tumors. The final result was 116 tumors smaller than 3.5 cm. We used medical device such as puncture needle to locate all the 116 tumors and evaluated the likely effect of our therapy with accurate radiation therapy system. After this, multielectrode RFA was used to melt the tumor.ResultsThe average puncture error was 2.9 mm (1.0-5.0 mm). All 75 tumors were fully exposed to radiation and no serious complications were noted during the procedure. About 4-6 weeks after the radiation therapy, CT scan showed no enhancement layer around the target tumors. Three months after the surgery, CT scan showed complete ablation in all of the 75 hepatic lesions.ConclusionCT guided RFA is safe and effective for hepatic cancer.
Liver; Carcinoma; Radiofrequency ablation
聊城市卫生科技计划项目(2011B016)
R735.7
:A
:1009-6604(2014)02-0105-04
10.3969/j.issn.1009-6604.2014.02.003
2013-07-26)
**通讯作者(放疗中心),E-mail:cdl1234567890@sina.com
