奥拉西坦对奥美拉唑在健康志愿者体内药动学的影响
2014-08-06张志清杨秀岭刘秀菊肖若璇
杜 杰,张志清,杨秀岭,刘秀菊,肖若璇
(1.河北省邢台市人民医院药剂科,邢台 054016;2.河北医科大学第二医院药学部,石家庄 050000;3.西北农林科技大学2011级本科生,西安 712100)
奥美拉唑为质子泵抑制剂,能显著抑制H+,K+-ATP酶,阻断胃酸分泌,从而减少溃疡创面扩大,促进黏膜组织再生,是一种新型、强效的抗溃疡药,临床主要用于十二指肠溃疡、胃溃疡、卓-艾综合征和反流性食管炎[1]。目前,奥美拉唑作为一种主要的质子泵抑制剂还被广泛应用于脑外伤、卒中、中枢神经系统感染等疾病,以达到预防应激性溃疡的目的。奥拉西坦是新一代脑代谢改善药,属于γ-氨基丁酸(GABA)的环形衍生物。本品可促进磷酰胆碱和磷酰乙醇胺的合成,提高大脑中三磷腺苷(ATP)/二磷腺苷(ADP)的比值,使大脑中蛋白质和核酸的合成增加,主要用于治疗脑损伤引起的记忆与智能障碍、老年性痴呆和神经功能缺失等疾病[1]。基于两药的药理作用,在脑外伤、卒中、细菌性或病毒性脑炎、一氧化碳中毒等疾病的治疗中,奥美拉唑和奥拉西坦存在联合用药的指征。但奥拉西坦是否会对奥美拉唑的体内代谢产生影响,目前尚无人体试验的研究资料。本研究采用HPLC法测定奥美拉唑血药浓度,考察奥拉西坦是否对奥美拉唑在健康志愿者体内的药动学产生影响,为两者联合用药的安全性评价提供理论依据。
1 材 料
1.1 仪器 Waters 高效液相色谱系统,包括515色谱泵、486紫外检测器、Empower Application 色谱工作站(美国Waters公司);Diamonsil C18色谱柱(济南赛畅科学仪器有限公司);GL-20G-Ⅱ 冷冻离心机(上海安亭科学仪器厂);XW-80A涡旋混合器(上海医科大学仪器厂); HZ F-B1200万分之一电子天平(美国康州HZ电子有限公司);CPA225D电子分析天平(德国Sartorius公司);KL512J数控恒温水浴氮吹仪(北京康林科技有限公司);AP-01抽滤器(天津市协同仪器有限公司);KQ-300B超声清洗器(江苏省昆山市超声仪器有限公司)。
1.2 药品和试剂 奥美拉唑肠溶胶囊(规格:20 mg/粒,产品批号ME 9000,分装批号1008075)、奥美拉唑对照品(含量99.60%,批号73139E09,阿斯利康制药有限公司);卡马西平对照品(含量100.0%,批号H1426,北京诺华制药有限公司);奥拉西坦胶囊(规格:0.4 g/片,批号128101207,石药集团欧意药业公司);乙腈(色谱纯)、甲醇(色谱纯)、二氯甲烷(分析纯,天津市康科德科技有限公司)。
1.3 试验对象 本试验经河北医科大学第二医院药物临床试验伦理委员会批准。选择10例健康志愿者,年龄(21±1)岁,体重(63±5) kg。志愿者均不过量吸烟、饮酒,试验前2周未用任何药物。试验前向志愿者说明试验方案、药物特性及可能出现的药物不良反应(ADRs),志愿者签署知情同意书。试验前、后均进行常规体检,血液生化检查,以及心、肝、肾功能检查。
2 方法和结果
2.1 色谱条件 Diamonsil C18色谱柱(250 mm×4.6 mm,5.0 μm),柱温:25 ℃,流动相:乙腈-水(45∶55),流速:1.0 ml/min,检测波长:302 nm,进样量:20 μl,以卡马西平为内标。
2.2 溶液的配制 (1)奥美拉唑对照品溶液:精密称取奥美拉唑对照品约10 mg,置50 ml棕色量瓶中,加0.01 mol/L NaOH溶液9 ml溶解,用蒸馏水定容,配制成浓度约为200 μg/ml的奥美拉唑对照品储备液,4 ℃避光保存。精密量取储备液5 ml置100 ml棕色量瓶中,用蒸馏水定容,得到10 μg/ml的奥美拉唑对照品溶液。(2)卡马西平对照品溶液:精密称取卡马西平对照品约10 mg,置100 ml棕色量瓶中,用蒸馏水定容,得100 μg/ml的卡马西平对照品储备液,4 ℃保存。取储备液适量,用蒸馏水稀释成4和2 μg/ml的卡马西平对照品溶液作为内标溶液。
2.3 给药方案及血样采集 10例男性健康志愿者随机分为2 组,每组5 人。试验组口服奥拉西坦胶囊0.8 g/次,对照组口服空胶囊,bid,连续服用6 d。志愿者于第6天20:00禁食,第7天8:00口服奥美拉唑肠溶胶囊40 mg,用100 ml温开水送服。服药2 h后可饮水,4 h后可进食低脂、低蛋白标准餐。志愿者于服药前及服药后0.5、1.0、1.5、2.0、3.0、4.0、6.0、8.0、10、12 h取前臂静脉血3 ml,置5 ml棕色具塞玻璃试管中,用肝素钠抗凝,201.24×g离心10 min。取血浆1 ml置具塞试管中,-40 ℃避光保存。经2周洗脱期后,试验组和对照组交叉用药。试验过程中,对照组和试验组各有1 例志愿者分别由于发热和服用大环内酯类药物退出试验。
2.4 血浆样品预处理 冷冻血浆在室温下自然解冻,2.236×103×g离心5 min,取上清液0.5 ml,加磷酸盐缓冲液(pH=7.83)100 μl,加4 μg/ml内标溶液50 μl,混匀后加二氯甲烷5 ml,涡旋振荡1 min,201.24×g离心5 min,弃去上清液,取二氯甲烷层,在40 ℃水浴中以氮气流吹干[2]。用100 μl甲醇溶解残渣,混匀,作为供试品溶液。
2.5 专属性实验 取空白血浆、奥美拉唑对照品溶液、2 μg/ml内标溶液以及血浆样品处理液,分别按2.1项色谱条件进样测定,得到色谱图见图1。由图1可见,奥美拉唑和卡马西平的保留时间分别约为5.9和7.6 min,峰形良好,血浆内源性杂质不干扰测定。配制浓度约1 μg/ml的奥美拉唑对照品溶液,倍比稀释后进行测定,直至S/N≥10,测得该方法的最低定量限为0.005 μg/ml。
2.6 标准曲线的绘制 精密吸取2.2项的奥美拉唑对照品溶液适量,加入空白血浆中,得到奥美拉唑系列浓度为0.01、0.05、0.10、0.25、0.50、1.00、2.00、3.00 μg/ml的标准曲线工作液,按2.4项下方法预处理后进样测定。以奥美拉唑与卡马西平的峰面积比值(Y)对血药浓度(X)进行线性回归,得到标准曲线方程:Y=3.221X-0.015(r=0.999 9),表明奥美拉唑血浆浓度在0.01~3.00 μg/ml范围内具有良好的线性关系。
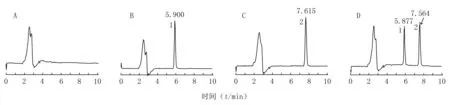
图1 奥美拉唑的HPLC谱图
2.7 回收率和精密度实验 取空白血浆15 份,分为3 组,每组5 份,分别加入适量奥美拉唑对照品溶液,制备低、中、高浓度(0.05、0.25、2.00 μg/ml)血浆样品,按2.4项操作预处理,得到血浆样品溶液,按2.1项色谱条件进样测定。提取回收率=血浆样品溶液的峰面积/等浓度的奥美拉唑对照品溶液峰面积×100%。方法回收率=根据标准曲线方程计算的实际浓度/加入的理论浓度×100%。在同1 d内测定5 次,计算奥美拉唑的日内精密度;每天测定1次,连续测定5 d,计算日间精密度,结果见表1。
表1 奥美拉唑的回收率和精密度实验结果
Table 1 Results of recovery and precision tests of omeprazole

表1 奥美拉唑的回收率和精密度实验结果
(ρB/μg·ml-1)RSDRSD0.05 78.63±3.84 98.97±2.07 2.79 4.140.25 82.61±1.88 99.48±2.14 5.37 3.952.00 74.54±1.93 92.67±1.10 1.00 2.47
2.8 稳定性实验 取空白血浆,加入奥美拉唑对照品溶液适量,制备浓度为0.25 μg/ml的血浆样品共17 份,按2.4项操作预处理,得到血浆样品溶液,即刻进样测定。取5份血浆样品在室温放置1、2、3、4 h各测定1 次,考察血浆样品在室温下的稳定性,计算得到RSD=3.87%(n=5)。取6份血浆样品于-40 ℃避光保存4 d后测定浓度,计算得到RSD=2.10%(n=6)。取6份血浆样品反复冻融3 次后测定浓度,计算得到RSD=2.59%(n=6)。
2.9 药动学参数和药-时曲线 根据对照组和试验组各个时间点的血药浓度绘制药-时曲线,见图2。采用DAS 2.1.1药动学软件处理相关数据,自动拟合统计距,得到主要药动学参数见表2。采用SPSS 13.1统计学软件比较药动学参数的组间差异。对tmax、cmax、t1/2、AUC0~t和AUC0~∞分别进行正态性检验,结果均符合正态分布。采用两个独立样本的配对t检验进行分析,结果P值均>0.05。由此可以推断,健康志愿者服用奥拉西坦对奥美拉唑的药动学没有显著性影响。
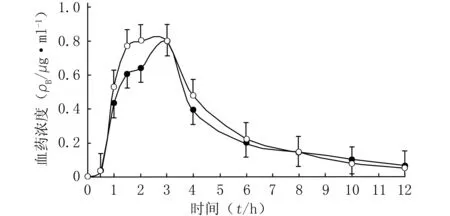
图2 健康志愿者单剂量口服40 mg奥美拉唑胶囊后的平均血药浓度-时间曲线
表2健康志愿者单剂量口服40mg奥美拉唑胶囊后的主要药动学参数
Table2Mainpharmacokineticparametersofomeprazoleafterasingleoraldoseof40mgomeprazolecapsulesinhealthyvolunteers

tmax(t/h)cmax(ρB/μg·ml-1)t1/2(t/h)AUC0~t(A/mg·min·L-1)AUC0~∞(A/mg·min·L-1)2.31±1.10 1.14±0.77 1.50±0.83 3.32±3.08 3.33±3.232.00±0.85 1.32±0.60 1.66±0.69 3.69±3.15 3.79±3.29
3 讨 论
健康志愿者口服奥拉西坦后再服用奥美拉唑,对奥美拉唑的药动学参数无显著性影响。结果提示,在两药联合使用过程中无需调整药物剂量,为临床应用提供了理论依据。本研究结果与大鼠体内的实验数据不符[3],其原因可能为种属差异,具体原因有待进一步的研究证实。奥美拉唑经肝脏P450酶系催化代谢,其主要的代谢途径为经CYP2C19酶代谢生成5-羟基-奥美拉唑,再经CYP3A4代谢生成5-羟基-磺基-奥美拉唑。CYP2C19酶活性是奥美拉唑药动学和药效学的重要影响因素[4]。本研究还可以间接证明,在人体内奥拉西坦对CYP2C19酶没有明显的促进或抑制作用。奥美拉唑的血药浓度个体间差异较大,原因是志愿者中存在CYP2C19基因表型多态性[5]。奥美拉唑在碱性条件下稳定,故本研究配制奥美拉唑对照品储备液时,以0.01 mol/L的NaOH溶液溶解,既可以增大奥美拉唑的溶解度,又可以增加其稳定性。奥美拉唑为苯并咪唑类衍生物,见光不稳定,易分解[6]。因此血浆样品应置于棕色具塞试管中,保存在自制避光盒内,处理和测定过程均要求严格避光。稳定性实验结果表明,采取上述避光措施,基本可满足实验要求。
【参考文献】
[1] 陈新谦,金有豫,汤 光.新编药物学[M].17版.北京:人民卫生出版社,2011:320,469.
Chen XinQian,Jin YouYu,Tang Guang.New materia medica[M].17th ed.Beijing:People’s Health Press,2011:320,469.In Chinese.
[2] 李 珍,胡晋红,金桂兰.进口与国产奥美拉唑注射剂在健康人体内药代动力学过程比较[J].中国药学杂志,2001,36(2):109-111.
Li Zhen,Hu JinHong,Jin GuiLan.Pharmacokinetic comparison of domesticvsimported omeprazole infusion preparations[J].Chin Pharm J,2001,36(2):109-111.In Chinese with English abstract.
[3] 杜 杰,张志清,杨秀岭,等.奥拉西坦对奥美拉唑在大鼠体内药代动力学的影响[J].药物分析杂志,2013,33(12):2109-2113.
Du Jie,Zhang ZhiQing,Yang XiuLing,etal.Influence of oxiracetam on pharmacokinetics of omeprazole in rats[J].Chin J Pharm Anal,2013,33(12):2109-2113.In Chinese with English abstract.
[4] 罗 薇,王鹤尧,刘丽宏,等.CYP2C19多态性对奥美拉唑药代动力学的影响[J].临床药物治疗杂志,2013,11(2):22-26.
Luo Wei,Wang HeYao,Liu LiHong,etal.Effect ofCYP2C19 polymorphisms on pharmacokinetics of omeprazole[J].Clin Med J,2013,11(2):22-26.In Chinese with English abstract.
[5] 付良青,黄 丰,吴德政,等.中国CYP2C19强代谢者和弱代谢者的奥美拉唑及其代谢产物的药动学比较[J].中国药学杂志,2004,39(8):614-616.
Fu LiangQing,Huang Feng,Wu DeZheng,etal.Pharmacokinetic comparison of omeprazole and its metabolites between Chinese CYP2C19 EMs and PMs subjects[J].Chin Pharm J,2004,39(8):614-616.In Chinese with English abstract.
[6] 刘 云,潘祺琦.HPLC法测定奥美拉唑的血药浓度[J].江苏医药,2010,36(7):837-839.
Liu Yun,Pan QiQi.Determination of plasma concentration of omeprazole by HPLC method[J].Jiangsu Med J,2010,36(7):837-839.In Chinese.
