麝香保心丸促进血管新生作用的活性成分筛选
2014-08-06黄慧梅畅婉琳柳润辉福建中医药大学药学院福建福州350108
吕 超,黄慧梅,畅婉琳,柳润辉 (福建中医药大学药学院,福建 福州 350108)
血管新生过程主要涉及到基底膜降解、内皮细胞增殖、迁移及管腔结构形成等步骤,这些过程受到一些生长因子的严密控制,当调节失衡会导致机体处于病理状态,如缺血性疾病、肿瘤等[1]。目前,缺血性疾病是威胁人类健康的严重疾病之一,这类疾病的治疗与血管新生密不可分。
麝香保心丸(Shexiang Baoxin pill, SBP)是迄今为止发现的第一个具有促进血管新生作用的中成药,它能够治疗由心肌缺血导致的心绞痛、胸闷等心脏疾病[2],主要由人参、麝香、肉桂、冰片、蟾酥、苏合香、牛黄七味中药配伍组成。现代药理学研究表明,麝香保心丸不仅能够保护血管内皮、抑制动脉粥样硬化、减少梗死面积,还能促进心肌缺血区域的血管新生,建立侧枝循环,实现药物性心脏“自身搭桥”,全面改善心脏功能[3-6]。目前,已有研究证实麝香保心丸具有促血管新生作用[7],但主要的有效活性成分尚不明确。本实验通过采用人脐静脉内皮细胞(HUVECs)体外培养体系对麝香保心丸及其20种单体入血进行血管新生活性成分的筛选,明确药效物质,并对其在体外促进血管新生作用进行研究。
1 材料
1.1动物 SD大鼠[上海斯莱克实验动物有限公司,许可证号:SCXK(沪)2012-0002],雄性,体重180~200 g。动物饲养于第二军医大学药学院动物房,适应1周后开始实验。
1.2药物准备 麝香保心丸由上海和黄药业有限公司提供。将麝香保心丸研磨成粉末,制成浸膏,精密称取1.5 mg,用1.5 ml含1% FBS的MCDB131基础培养基完全溶解,配制成1 mg/ml的母液,然后按比例稀释成10-4、10-3、10-2μg/ml的工作液(麝香保心丸含有挥发性成分,最好现用现配)。各单体化合物人参皂苷Rg1、Rb1、Rb2、Rc、Re、Rd、Rg3、Rh2、肉桂醛、肉桂酸、去氧胆酸、胆酸、鹅去氧胆酸、熊去氧胆酸、猪去氧胆酸、麝香酮、蟾毒灵、华蟾酥毒基、日蟾毒它灵、酯蟾毒配和龙脑由中国药品生物制品检定所提供,纯度为98%以上。精密称取各单体化合物,用DMSO完全溶解,制成10 mmol/L的母液,用时用含1% FBS的MCDB131基础培养基稀释成1、5、10 μmol/L的工作液(其中麝香酮、肉桂醛、龙脑为挥发性成分,最好现用现配)。
1.3试剂 MCDB131完全培养基、MCDB131基础培养基(美国AllCells公司);M199培养基、胎牛血清、0.25%胰蛋白酶(美国Gibico公司);磷酸盐缓冲液(美国Hyclone公司);细胞周期检测试剂盒(碧云天生物技术有限公司);Matrigel基质胶(美国Sigma公司)。
1.4仪器与设备 实时细胞分析仪(Real-Time Cell Analyzer, RTCA, xCELLigence检测系统,瑞士Roche公司)、细胞增殖培养板(E-16 Plates,瑞士Roche公司)、细胞迁移培养板(CIM-16 Plates,瑞士Roche公司);电子分析天平(瑞士Mettler Toledo公司);倒置相差显微镜(日本Olympus公司);二氧化碳培养箱(日本Sanyo公司);台式高速离心机(德国Eppendorf公司)。
2 方法
2.1细胞培养 原代人脐静脉内皮细胞(HUVEC,美国ALLCELLs公司)采用MCDB131完全培养基培养(内含10% FBS 、5 U/ml肝素和30 ml内皮细胞生长添加剂),于37℃、5% CO2培养箱中培养,待细胞达到80%融合度后以1:4的比例传代。
2.2细胞增殖与细胞迁移实验
2.2.1xCELLigence系统 系统主要由分析检测器、装置工作站和放置细胞培养板的微电极平台三部分组成。,其主要通过检测细胞的阻抗值并计算细胞指数(cell index,CI)来衡量细胞数的多少。CI计算公式:
(Zi是实验过程中每次检测细胞时的电阻,Z0是开始检测的基准电阻)。
2.2.2细胞增殖实验 采用含有微阵列检测电极的细胞增殖培养板E-16 Plates(16孔板)培养细胞(图1)。取对数生长期的细胞,每孔加入100 μl细胞悬液(3×104个/ml),接种到培养板,室温放置30 min,将培养板置于微电极平台,开始动态检测,待细胞贴壁良好以后,将细胞培养液换成含1% FBS和不同浓度药物的MCDB131基础培养基,继续动态检测,以获得药效达到最佳的作用时间,根据CI值绘制曲线(分组:10-4、10-3、10-2μg/ml SBP组;1、5、10 μmol/L各单体化合物组;对照组为含等量DMSO的不含药培养基)。
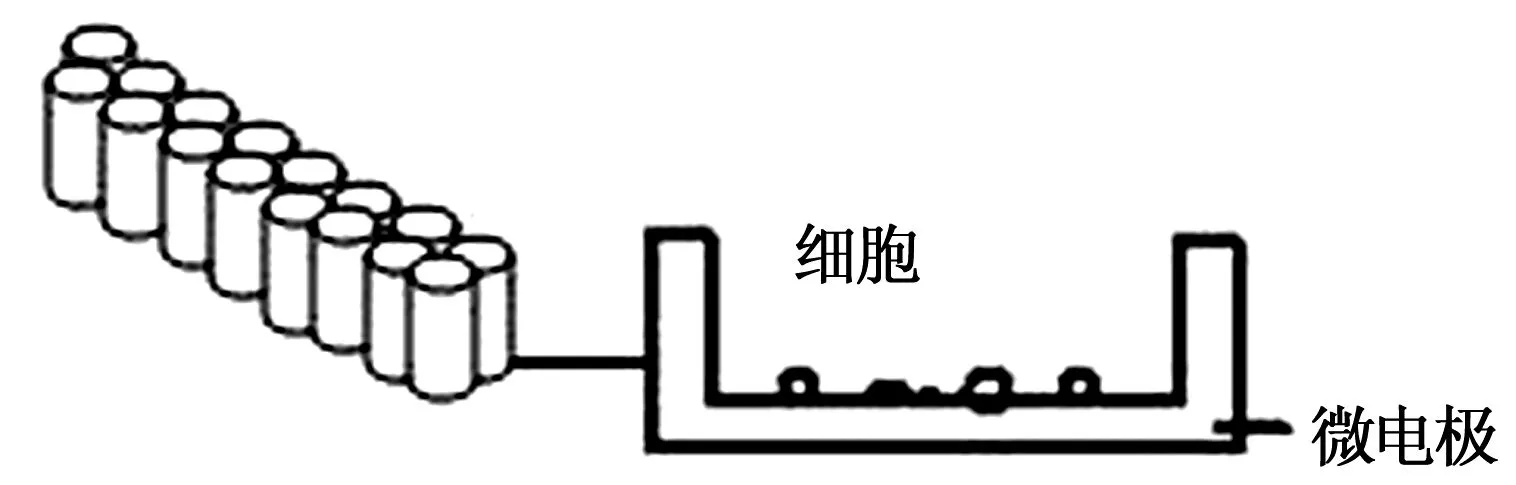
图1 细胞增殖培养板E-16 Plates
2.2.3细胞迁移实验 采用细胞迁移培养板CIM-16 Plates(16孔板)培养细胞,每个培养板由上室板和下室板两部分组成,由上室板底部的8 μm孔径大小的半渗透薄膜隔开,膜下包被微阵列检测电极(图2)。取对数生长期的细胞,用MCDB131基础培养基制成细胞悬液(2×105个/ml),加药孵育,室温,30 min(分组:10-4、10-3、10-2μg/ml SBP组;1、5、10 μmol/L具有增殖作用单体化合物组;对照组为含等量DMSO的不含药培养基 )。在下室板中加入相应培养液(含有20 ng/ml VEGF和20% FBS的MCDB131基础培养基,160 μl/孔),将上室板和下室板安装在一起,在上室板中加入已经孵育好的细胞悬液(100 μl/孔),将培养板置于微电极平台,开始动态检测,以获得药效达到最佳的作用时间,根据CI值绘制曲线。
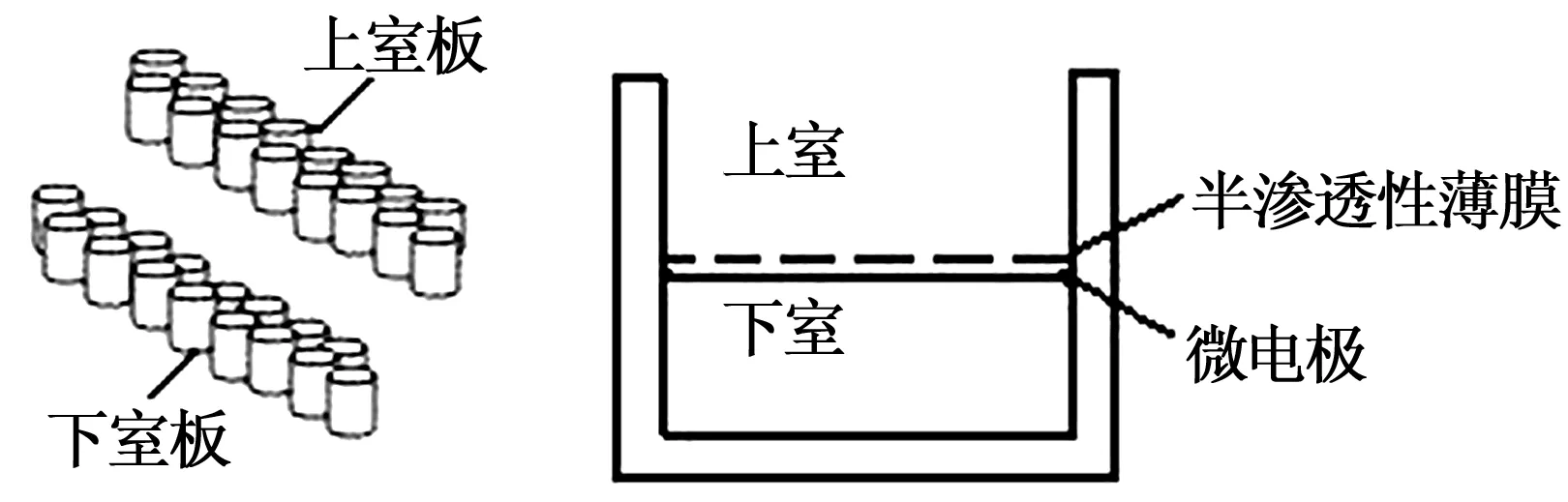
图2 细胞迁移培养板CIM-16 Plates
2.3体外成管实验 在96孔中加入基质胶(matrigel)50 μl/孔,置于37℃、5% CO2培养箱中30 min,待胶凝固后使用。取对数生长期的细胞,用含1% FBS的MCDB131基础培养基制成细胞悬液(5×105个/ml),加入预包被的96孔板中(100 μl/孔),加药孵育4 h后,在40倍显微镜下随机选取5个视野拍照并计数(分组同2.2.3)。
2.4主动脉环体外成管实验 取180~200 g SD大鼠,10%水合氯醛麻醉,用75%乙醇将体表消毒,转移至超净台内,将大鼠胸部沿一侧剪开,小心剥离结缔组织,切取3 cm长的胸主动脉,迅速放入预冷的PBS(含100 U/ml青霉素和100 U/ml链霉素),反复清洗,将血管内外表面的残余血细胞去除干净,用消毒后的锋利刀片切取1 mm宽度的动脉环,选取大小相似的置于预冷的M199培养基中备用。在24孔板中加入稀释好的matrigel胶(400 μl/孔,用不含血清的M199培养基以1:1的比例稀释),每孔随机植入1个动脉环,使其尽量置于孔的中央并紧贴孔底,于37℃、5% CO2培养箱中放置30 min,待胶凝固,每孔加入 200 μl含药培养基(分组同2.2.3)。隔天换液一次,6 d后在倒置显微镜下分别由4名不同观察者观察计数,根据内皮细胞出芽情况,评价动脉环血管新生[8](以0~5分范围作为评价标准,0分:内皮细胞无芽生,5分:内皮细胞大量芽生)。
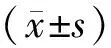
3 结果
3.1细胞增殖实验 xCELLigence检测SBP和各单体入血成分对HUVECs增殖的影响。结果如图3所示,CI值呈时间依赖性增加;与对照组相比,SBP与HUVECs共孵育24 h,在10-4、10-3、10-2μg/ml浓度下CI值依次增加,说明SBP能够诱导HUVECs增殖,并且呈现时间和剂量依赖关系(P<0.05)。在SBP的各单体入血成分中,只有人参皂苷Rg3和Rh2具有较明显的促进细胞增殖的作用,二者在1、5、10 μmol/L浓度下均表现出显著的药效(P<0.05)。因此,我们将对不同浓度的SBP(10-4~10-2μg/ml)、Rg3(1~10 μmol/L)和Rh2(1~10 μmol/L)在体外促进血管新生活性作用进行研究。
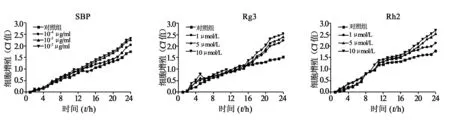
图3 不同浓度SBP、Rg3及Rh2对HUVECs增殖的影响,P<0.05,与对照组比较
3.2细胞迁移实验 xCELLigence检测SBP、Rg3和Rh2对HUVECs迁移的影响。结果如图4所示,CI值呈时间依赖性增加, SBP(10-4、10-3、10-2μg/ml)、Rg3(1、5、10 μmol/L)和Rh2(1、5、10 μmol/L)加药组的CI值均比对照组明显增加,具有统计学意义(P<0.05)。提示,SBP、Rg3和Rh2均能显著诱导HUVECs迁移。
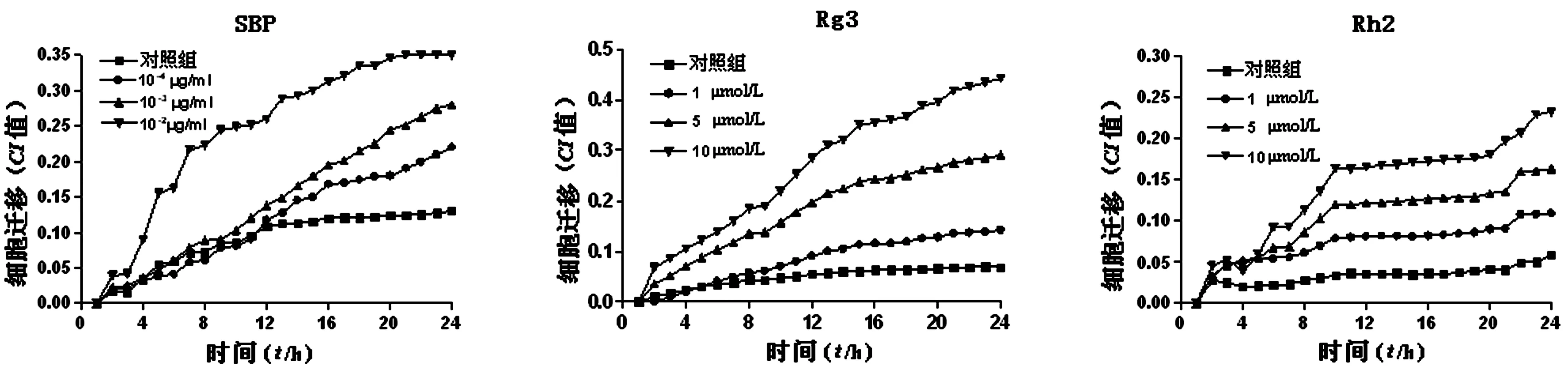
图4 不同浓度SBP、Rg3及Rh2对HUVECs迁移的影响,P<0.05,与对照组比较
3.3体外成管实验 如图5所示,与对照组相比,加入SBP、Rg3和Rh2后,管腔形成数目明显增多,小管间距变小并逐渐交织成网状结构。对管状分支点计数后发现:对照组分支点数目为18/视野,SBP组在10-4、10-3、10-2μg/ml浓度下分别为34、41、48/视野,Rg3组在1、5、10 μmol/L浓度下分别为26、32、40/视野,Rh2组在1、5、10 μmol/L浓度下分别为35、36、42/视野,与对照组相比均有显著性差异(P<0.01)。结果显示,SBP、Rg3和Rh2均能促进HUVECs管腔结构形成,并呈现一定的量效关系。
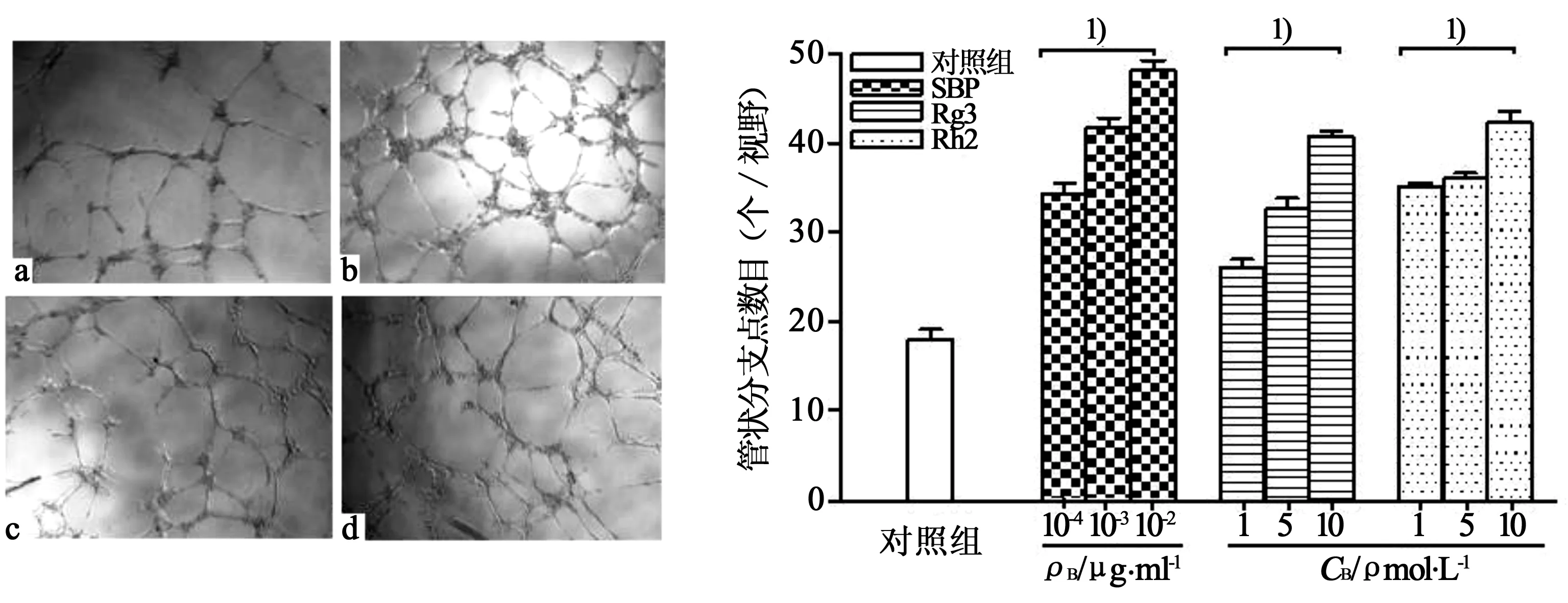
图5 不同浓度SBP、Rg3及Rh2对HUVECs管腔形成的影响
3.4主动脉环体外成管实验 如图6所示,在实验6 d期间,对照组动脉环仅有很少的内皮细胞芽生,评分为0.9分;与对照组相比,加入SBP (10-2μg/ml)、Rg3 (10 μmol/L)和Rh2(5、10 μmol/L)后,内皮细胞出芽显著增多,分别评为3.6、3.5、2.1、3.2分(P<0.001),而SBP和Rg3在其他浓度下对内皮细胞出芽并无明显影响(P>0.05)。结果显示,SBP、Rg3和Rh2均能促进主动脉环体外血管新生,并且在高浓度下效果比较显著。
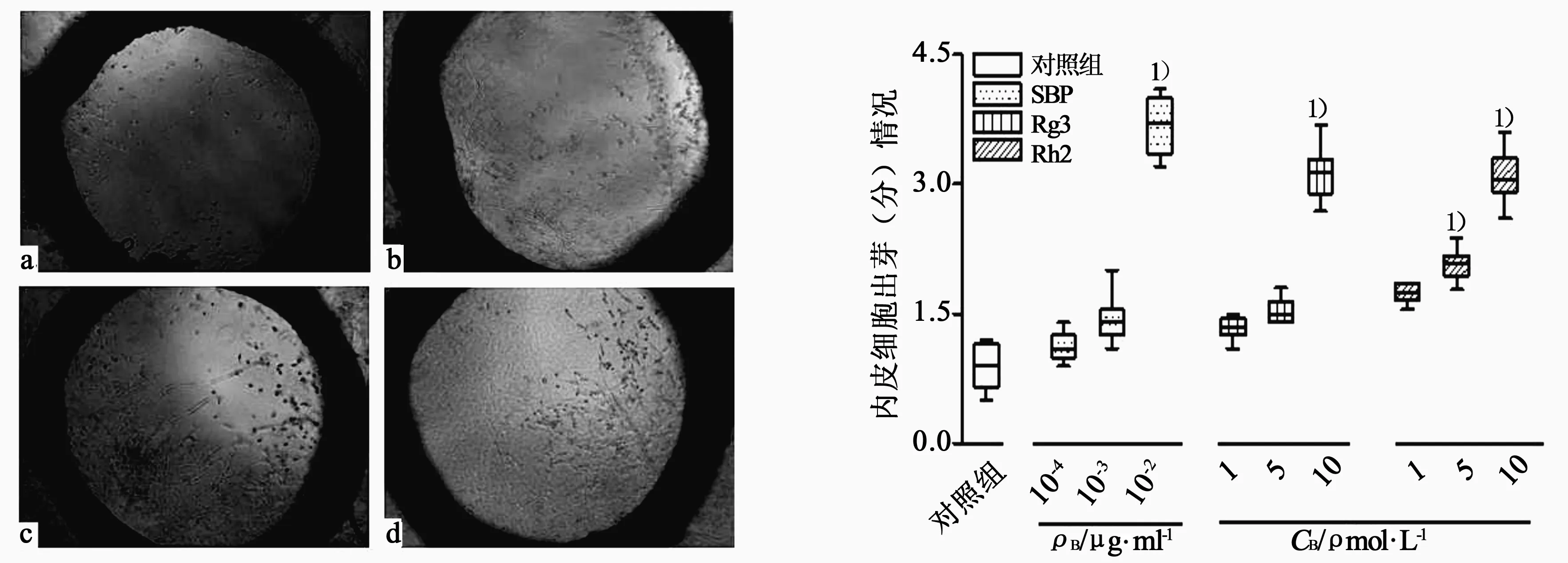
图6 不同浓度SBP、Rg3及Rh2对主动脉环血管新生的影响
4 讨论
麝香保心丸源自于《太平惠民和剂局方》,具有芳香温通、益气强心的功效,能够促进缺血心肌血管新生,增加冠脉血流量,从根本上治疗冠心病。临床研究显示,长期服用SBP能够有效增加心肌灌注,心肌缺血症状得到好转,胸闷、心绞痛发作频率降低,治疗后血管新生在本病治疗中也发挥重要作用[9]。已有动物实验结果证实,SBP具有促进血管新生活性,增加缺血心肌血管密度[4,6]。本研究则通过利用人脐静脉内皮细胞和大鼠主动脉环体外培养模型对SBP及其20种单体入血成分进行促血管新生活性研究,结果得出,SBP及单体化合物人参皂苷Rg3、Rh2具有显著的诱导内皮增殖活性。继而,细胞迁移实验和管腔形成实验研究表明,SBP、Rg3、Rh2在体外具有促进血管新生的活性,并在大鼠主动脉环模型上得到证实。
自2004年以来,实时细胞分析仪开始用于监测细胞的实时动态变化过程。系统的核心是把微电子细胞传感器芯片整合到表面适于细胞生长的细胞检测板的底部或细胞迁移板的微孔膜,当电场加在上
面的时候可以测量到一个基线阻抗,细胞的有无以及贴壁程度的改变都会影响电极传感器表面电子和离子的通过。没有细胞时,检测孔底部排列的微电极阵列的阻抗分布近似均匀;加入细胞后,细胞会和电极表面接触黏附,影响电极和溶液间的离子环境,导致阻抗的升高,细胞越多阻抗增加越多。细胞在上述表面上的贴壁、生长以及贴壁紧密程度可引起各个电极阵列的电极结构的阻抗变化,黏附在电极表面的细胞越多,CI越大。当细胞生物状态发生变化时,系统可以实时并自动获取其模拟电信号,并可以转换成数字信号(CI)以进行进一步的分析[10,11]。
内皮细胞增殖在血管新生过程中发挥关键的调控作用,已有研究表明三七皂苷Ft1具有较好的促进细胞增殖的活性,甚至在10 μmol/L浓度下活性优于20 ng/ml VEGF[12]。人参皂苷Rg3和Rh2的结构与Ft1十分相似,都属于达玛烷型四环三萜皂苷,本研究通过利用实时细胞分析仪监测人参皂苷Rg3和Rh2处理后的HUVECs的动态变化过程发现,Rg3、Rh2在1、5、10 μmol/L浓度下能够诱导CI值依次增加,说明Rg3、Rh2可促进HUVECs增殖,并呈现浓度依赖性。而已有研究报道Rg3和Rh2均具有抗血管新生活性,抑制肿瘤生长[13-15],推测可能由于细胞类型或研究体系的不同而导致与本实验的结果相悖。
Nicosia于 l 984年首次报道主动脉环血管生成模型,此模型取材简单,便于观察,更接近于体内环境,是体内外血管新生研究体系的桥梁,弥补了血管新生模型的缺憾[16]。本实验结果表明,高浓度下的SBP、Rg3和Rh2能够明显促进主动脉环内皮细胞芽生,中、低剂量则无显著药效(P>0.05),这进一步证实SBP、Rg3和Rh2的体外促进血管新生活性,为将来的机制研究提供了理论依据。
【参考文献】
[1] Cao Y. Angiogenesis: What can it offer for future medicine[J]. Exp Cell Res,2010,316(8):1304-1308.
[2] 陈 静. 麝香保心丸血管新生作用为世界瞩目——剑桥大学加大对麝香保心丸研究力度[J]. 中国社区医师,2010,(12):16.
[3] 杨雪英, 郑晓晖, 王彦方. 麝香保心丸对缺血性心脏病患者内皮功能及心功能的影响[J]. 中成药,2007,29(2):171-173.
[4] 储 敏, 宋国秀. 麝香保心丸对狗及大鼠实验性心肌梗塞的保护作用[J]. 中成药,1996,18(5):30-31.
[5] 李天奇, 李 勇, 范维琥. 麝香保心丸和辛伐他汀对兔股动脉粥样硬化斑块稳定性的影响[J]. 中华老年心脑血管病杂志,2006,8(5):296-299.
[6] 汪姗姗, 李 勇. 麝香保心丸对实验性心肌梗塞大鼠心脏的促血管生成作用[J]. 中成药,2002,24(6):446-449.
[7] 李 勇. 麝香保心丸促进治疗性血管新生的实验研究[J]. 中国社区医师,2006,22(9):19-20.
[8] O′Rourke M, Ward C, Worthington J,etal. Evaluation of the antiangiogenic potential of AQ4N[J]. Clin Cancer Res,2008,14(5):1502-1509.
[9] 曾群英,王礼春,高修仁,等. 急性冠脉综合征早期辅助应用麝香保心丸治疗的作用及安全性临床研究[J]. 中西医结合心脑血管病杂志,2003,1(4):221-223.
[10] Atienza JM, Yu N, Kirstein SL,etal. Dynamic and label-free cell-based assays using the real-time cell electronic sensing system[J]. Assay Drug Dev Technol,2006,4(5):597-607.
[11] Solly K, Wang X, Xu X,etal. Application of real-time cell electronic sensing (RT-CES) technology to cell-based assays[J]. Assay Drug Dev Technol,2004,2(4):363-372.
[12] Shen K, Ji L, Gong C,etal. Notoginsenoside Ft1 promotes angiogenesis via HIF-1α mediated VEGF secretion and the regulation of PI3K/AKT and Raf/MEK/ERK signaling pathways[J]. Biochem Pharmacol, 2012,84(6):784-792.
[13] 耿怀成, 陈龙邦, 王靖华, 等. 人参皂苷 Rg3 抗肿瘤新生血管形成的实验研究[J]. 医学研究生学报,2002,15(6):493-495.
[14] 杨成明, 刘 伟, 赵燕颖, 等. 人参单体皂苷 Rh2 抑制缺氧条件下人视网膜血管内皮细胞增殖及整合素 αvβ3表达的研究[J]. 中国老年学杂志, 2008,28(6):557-559.
[15] Kim YS, Jin SH, Lee YH,etal. Differential expression of protein kinase C subtypes during ginsenoside Rh2-induced apoptosis in SK-N-BE (2) and C6Bu-1 cells[J]. Arch Pharm Res,2000,23(5):518-524.
[16] Nicosia RF, McCormick JF, Bielunas J. The formation of endothelial webs and channels in plasma clot culture[J]. Scan Eelect Microl, 1983,793-799.
