米格列奈钙片健康人体药动学研究
2014-08-06恽芸蕾高守红樊成辉缪海均第二军医大学附属长征医院药学部上海200003
恽芸蕾,高守红,樊成辉,缪海均(第二军医大学附属长征医院药学部,上海 200003)
米格列奈是继瑞格列奈、那格列奈后第3个格列奈类药物,是苯丙氨酸的衍生物。米格列奈的作用机制类似于磺酰脲,但用药后的起效速度比磺酰脲快;而且该药的作用持续时间不长,仅降低糖尿病患者用餐后血糖过高而避免持续降糖引发的血糖过低,其具有半衰期短、安全性高、体内无蓄积等特点[1,2]。该药通过关闭胰腺β细胞膜上的ATP依赖性K+通道,造成Ca2+内流,使细胞内Ca2+浓度增加而使细胞内含胰岛素的囊泡脱粒,从而刺激胰岛素的分泌。国内外文献报道,米格列奈血药浓度测定方法主要有LC-UV、LC-MS、HPLC和LC-MS/MS法[3-8]。本研究参考了相关文献,建立了测定血浆中米格列奈钙浓度的LC-MS/MS法,并用于健康受试者口服米格列奈钙后体内血药浓度测定和药动学研究,为临床合理用药提供依据。
1 材料和方法
1.1仪器 Agilent 6410A型三重四极杆串联质谱仪,包括Agilent 1200 G1311A四元泵、G1322A真空脱气机、G1329A自动进样器、G1316A柱温箱。使用的仪器还有MassHunter软件控制系统及数据处理器(美国Agilent公司);XW-01定时可调速旋涡混合器(上海医科大学仪器厂);TGL-16G台式高速离心机(上海安亭科学仪器厂)和北利DT5-3低速台式离心机;Sartorius BP211D(德国赛多利斯)。
1.2药品与试剂 米格列奈片(上海秀龙中药有限公司,规格:5 mg/粒)。内标为格列齐特(Sigma公司)。甲醇、乙腈(德国Merck公司,色谱纯),醋酸铵(美国天地公司,色谱纯),乙酸乙酯、正己烷(CALEDON公司,色谱纯),纯净水,盐酸(国药集团化学试剂有限公司)。
1.3色谱条件 色谱柱(迪马公司):Dikma Inertsil ODS-3,2.1 mm×50 mm,5 μm;流动相:甲醇-10 mmol/L醋酸铵(65:35),流速0.25 ml/min,进样量10 μl,分析时间2.5 min;柱温40 ℃。
1.4质谱检测条件 采用ESI离子源、正离子检测,选择MRM工作方式进行一/二级质谱分析。质谱检测工作参数如下:干燥气温度 350 ℃,干燥气流速10 L/min,雾化气压力 35 psi,毛细管电压4 000 V,MS1温度 100℃,MS2温度 100 ℃,毛细管出口电压125 V,碰撞能量16。
用于定量分析的离子反应分别为m/z316.2→m/z298.2(米格列奈),m/z324.2 →m/z126.9(内标格列齐特)。
1.5血浆样品处理 取血浆200 μl置于10 ml具塞玻璃离心管内,加入20 μl内标溶液(200 ng/ml)混匀,加入1 mol/L HCl 100 μl酸化,涡旋混合30 s,加入3 ml乙酸乙酯正己烷(98:2)提取液,涡旋混合3 min,于3 500 r/min离心10 min,吸取上清液于45 ℃离心浓缩仪氮气流下吹干,残渣用甲醇:水(55:45)100 μl溶解,于12 000 r/min高速离心10 min,吸取上清液10 μl进样,以米格列奈和内标的峰面积比,内标法定量分析。
1.6受试者 30例健康受试者(男、女各15名),年龄(23.93±1.60)岁、身高(169.27±9.71)cm、体重(60.13±8.89)kg、体重指数均在19~24,女性尿妊娠试验均阴性,血常规、尿常规、粪常规、肝肾功能和心电图等检查均正常,无心血管系统、呼吸系统、消化系统、泌尿系统、中枢神经系统、代谢系统的明确病史或其他显著疾病,无药物与食物过敏史,无烟、酒嗜好或滥用药(毒)品史,筛选前2周内未服用过其他药物,入选前3个月内未参加过其他药物的临床试验且无献血史。受试者在试验前均签署知情同意书。本临床试验方案经上海长征医院医学伦理学委员会审核批准,在试验过程中受其指导。
1.7试验设计 30例健康受试者随机分成3组,每组10人,于正式试验前1 d入住Ⅰ期临床试验病房,隔夜禁食12 h后,空腹给药。按不同剂量组分别每人口服米格列奈钙片5、10、20 mg,用 50 g葡萄糖粉溶于200 ml的温水中送服。服药2 h后可以饮水,4 h 和10 h 后统一进食清淡的午餐及晚餐。于给药前(0 h)和给药后5、10、15、20、30和45 min,1、2、3、4、6、8和10 h由肘静脉取血4 ml,肝素抗凝,血样3 000 r/min离心10 min,分离血浆于另一具塞试管中,于-20°C 冰箱中冷冻保存至测定。详细记录服药时间、采样准确时间,临床医生及研究者随时观察药物不良反应(事件)并记录。从开始进入试验至试验结束,要求受试者禁烟、酒、茶、咖啡等,服药后避免长时间静卧或剧烈运动。
1.8数据处理 采用统计矩法计算药动学参数,Cmax和tmax均采用实测值;AUC采用梯形面积法计算;λz为末端相消除速率常数,用末端相浓度对数与时间回归直线求得;t1/2=0.693/λz。
2 结果
2.1方法的专属性 将一定浓度的标准溶液和内标溶液进样,在ESI 电离方式下进行产物离子全扫描分析(图1-A、1-B);分别选择性对m/z316.2(米格列奈)和m/z324.2(内标格列齐特)进行产物离子全扫描分析(图1-C、1-D);米格列奈和内标格列齐特生成的主要碎片离子分别为m/z298.2和m/z126.9,将以上碎片离子作为定量分析时监测的产物离子。在本试验的色谱条件下,米格列奈的保留时间约1.8 min,内标格列齐特的保留时间约1.3 min。
观察了来自6份不同受试者的空白血浆,样品和内标峰形良好,血浆中的杂质不干扰样品和内标峰检测,本法具有较高的专属性。空白血浆、米格列奈和内标、空白血浆中添加米格列奈和内标以及受试者服药后的血浆样本色谱图见图2。

图1 米格列奈LC-MS/MS质谱图

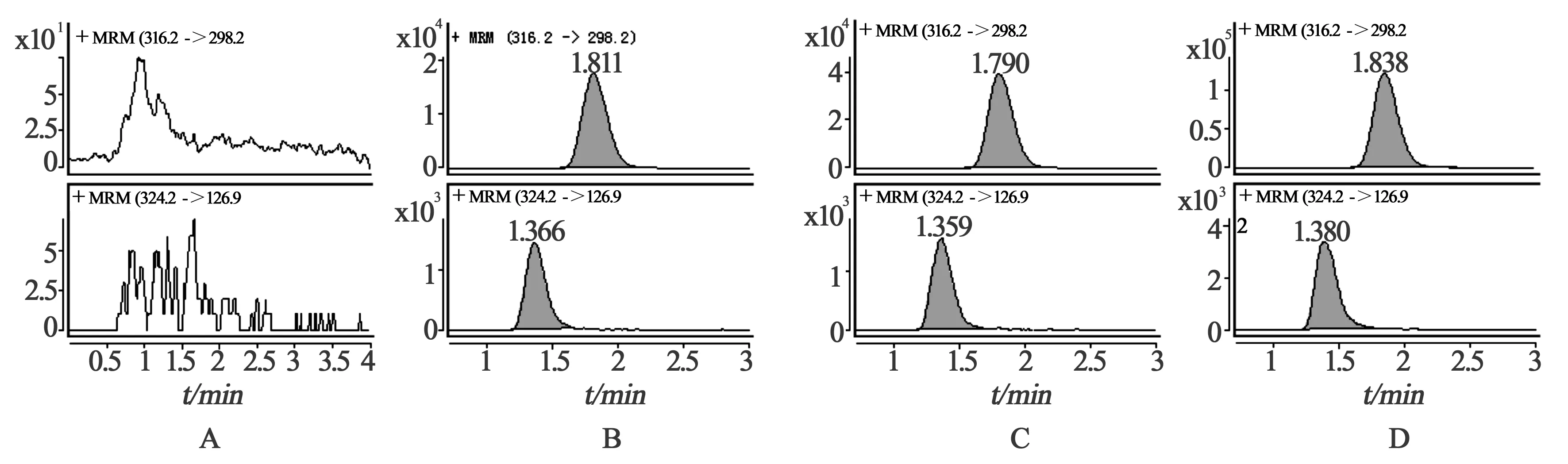
图2 米格列奈LC-MS/MS色谱图
2.2标准曲线及最低定量浓度 精准配制含米格列奈1.0、2.0、10.0、20.0、100.0、200.0、1 000.0、2 000.0和4 000.0 ng/ml的标准血浆样品。按上述血浆样品预处理步骤操作,每种浓度各平行制作5份样品,并进行LC-MS/MS分析。以米格列奈对照品与内标峰面积的比值对相应的浓度(μg/L)进行加权(1/c2)线性回归,得加权标准曲线方程:Y=26.399 4c+0.020 5,r2=0.996 1(n=5),线性范围1.0~4 000.0 ng/ml。配制浓度1.0 ng/ml的样品6份,进行最低定量限检测,结果为0.900±0.068,RSD为7.6%,说明本法测定血浆中米格列奈的最低定量限为1.0 ng/ml。
2.3精密度与准确度 分别配制成相当于米格列奈浓度为2.0、20.0、200.0 和2 000.0 ng/ml的血浆质控样品,按血浆样品处理依法操作,进行精密度试验。结果表明,米格列奈的上述4个浓度批内及批间变异均<15%,测定的准确度在85%~115%。
2.4回收率试验 取空白血浆,配制成相当于米格列奈血浆浓度为2.0、20.0、200.0和2 000.0 ng/ml的血浆质控样品,按血浆样品处理依法操作,同时配制相当于米格列奈浓度为2.0、20.0、200.0和2 000.0 ng/ml的标准溶液样品,按同法操作,计算方法回收率。4个浓度米格列奈血浆样品回收率>90%(95.04%~96.17%)、RSD<5%(0.2%~2.0%),表明该法的准确性符合生物样品分析要求。
2.5稳定性考察和质控 本试验考察了米格列奈血浆样品经样品处理后室温放置的稳定性、血浆样品经历3次冷冻与解冻循环稳定性和血浆样品长期冷冻条件下的稳定性。配制米格列奈浓度为2.0、20.0、200.0和2 000.0 ng/ml的血浆质控样品,按血浆样品前步骤同法操作,每一浓度水平进行3样本分析,结果处理后的血浆样品室温放置24 h、经3次冻融试验、放置-20℃冰箱冷冻保存30 d后的稳定性均良好。
2.6米格列奈钙健康人体药-时曲线和药动学参数 3组健康受试者分别单次口服米格列奈钙片5、10、20 mg的平均血药浓度-时间曲线见图3,主要的药代动力学参数详见表1。
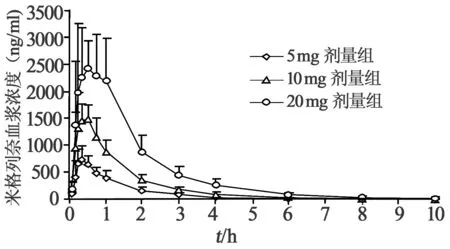
图3 受试者单次口服米格列奈钙片后的平均血药浓度-时间曲线
表1单次给药后米格列奈的药动学参数
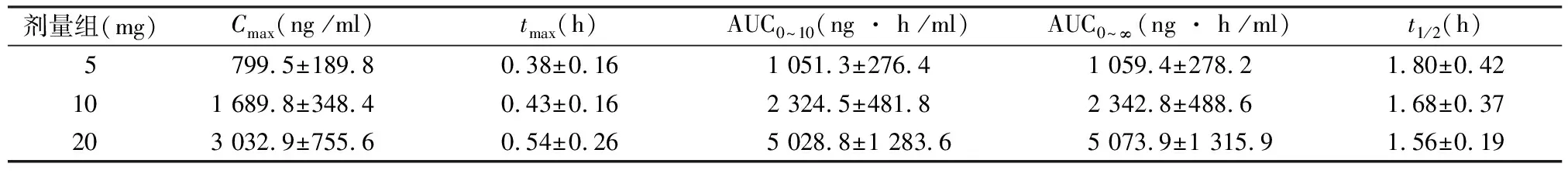
剂量组(mg)Cmax(ng /ml)tmax(h)AUC0~10(ng · h /ml)AUC0~∞(ng · h /ml)t1/2(h)5799.5±189.80.38±0.161 051.3±276.41 059.4±278.21.80±0.42101 689.8±348.40.43±0.162 324.5±481.82 342.8±488.61.68±0.37203 032.9±755.60.54±0.265 028.8±1 283.65 073.9±1 315.91.56±0.19
2.7安全性评价 整个药试期间,受试者无严重不良反应(事件)发生;经物理检查、实验室检查及心电图检查,均未发生有临床意义的异常改变。
3 讨论
本研究建立的血浆米格列奈钙浓度LC-MS/MS测定方法,样品经液-液萃取后进样,具有灵敏度高、准确性高和精密度好等特点,适用于临床药动学的研究。
因米格列奈的降血糖作用较弱,故在禁食12 h后给药试验中用200 ml含50 g葡萄糖的温水送服米格列奈,以避免低血糖反应的发生。
健康受试者口服米格列奈钙片后,具有口服吸收迅速、体内代谢较快的特点;其药代动力学参数Cmax与AUC与给药剂量呈正相关;其主要药代动力学参数与文献报道相一致[7,8]。
【参考文献】
[1] Kumashiro N,Yoshihara T,Kanazawa Y,etal.Long-term effect of combination therapy with mitiglinide and once daily insulin glargine in patients who were successfully switched from intensive insulin therapy in short-termstudy[J].Endocr J,2007,54(1):163-166.
[2] Sunaga Y,Gonoi T,Shibasaki T,etal.The efects ofmitiglinide (KAD-1229)a new antidiabetic drug,on ATP-sensitive-K channels and insulin secretion:comparison with the sulfonylureas and nateglinide[J].Eur J Pharmacol,2001,431(1):119.
[3] Lushan Y,Su Z.Determination of mitiglinide in rat plasma by high performance liquid chromatography with UV detection[J]. Chromatogr B Anal Technol Biomed Life Sci,2006,834(1-2):204-207.
[4] Jin HW,Yu QX.SPE and LC-ESI-MS for quantitative analysis of mitiglinide in human plasma in a bioequivalence study[J].Chromatographia,2009,70(11-12):1715-1719.
[5] Liang J,Tian Y,Zhang Z,etal.High-performance liquid chromatography/electrospray ionization mass spectrometry determination of mitiglinide in human plasma and its pharmacokinetics[J].J Mass Spectrom,2007,42(2):171-177.
[6] Cai S, Huo TG, Feng WY,etal. Quantitative determination of mitiglinide in human plasma by ultra-performance liquid chromatography/electrosprayionization tandem mass spectrometry[J]. J Chromatogr B, 2008,868,83-87.
[7] Zhang Y, Ding L, Tian Y,etal. Liquid chromatography-electrospray ionization tandem mass spectrometry for the quantification of mitiglinide in human plasma: validation and its application to pharmacokinetic studies[J]. Biomed Chromatogr,2008,22(8):873-878.
[8] 赵秀丽 ,王淑民 ,武 峰,等.米格列奈钙片在健康人体内的药代动力学[J].中国临床药理学杂志,2010,9(26):53-55.
