伏马霉素通过上调TGF-β信号通路促进HepG2细胞增殖
2014-08-04曾甜甜卢小东陈路芳陈园园邵启祥
曾甜甜,卢小东,陈路芳,陈园园,邵启祥
(江苏大学基础医学与医学技术学院,江苏镇江212003)
伏马霉素通过上调TGF-β信号通路促进HepG2细胞增殖
曾甜甜,卢小东,陈路芳,陈园园,邵启祥
(江苏大学基础医学与医学技术学院,江苏镇江212003)
目的:研究伏马霉素B1(Fumonisin B1,FB1)对人肝癌HepG2细胞株增殖的作用及相关机制。方法:人肝癌HepG2细胞株接种至培养皿,分别设0、0.5、1.0、10、50μmol/L伏马霉素浓度的DMEM培养液,处理48 h后,倒置显微镜观察细胞生长情况并计数。在此基础上,通过CCK-8实验观察FB1对细胞增殖的影响,实时荧光定量PCR检测转化生长因子-β1(transforming growth factor-β1,TGF-β1)、Smad4(Drosophila mothers against decapentaplegic 4,Smad4)、纤溶酶原激活物抑制物1(plasminogen activator inhibitor1,PAI-1)mRNA的表达。结果:FB1作用后,倒置显微镜下观察HepG2细胞有丝分裂象明显增加;CCK-8实验结果显示,不同浓度FB1处理48 h后,HepG2细胞增殖随FB1浓度的增加而增加,呈剂量依赖性。实时定量PCR结果显示,与对照组相比,10μmol/L组和50μmol/L组Smad4,PAI-1mRNA表达均显著上调,而0.5μmol/L组和1.0μmol/L组与对照组相比,差异无统计学意义;各浓度组TGF-β1mRNA均较对照组显著上调。结论:FB1可以有效促进HepG2细胞增殖,其机制可能与上调TGF-β1,Smad4,PAI-1mRNA表达,即TGF-β信号通路有关。
伏马霉素;细胞增殖;转化生长因子-β1;信号通路;HepG2细胞
伏马霉素B1(Fumonisin B1,FB1)是一种由串珠镰刀菌(Fusarium verticillioides)污染玉米和玉米食品产生的真菌毒素[1]。伏马霉素不仅可以引起猪肺水肿综合征、马脑白质软化症和鼠肝肾损伤,还可对其他畜禽及实验动物造成多种毒性作用进而诱发肿瘤,而且与人类食管癌、肝癌的发生也有着非常密切的关系[2-3]。伏马霉素主要通过抑制神经鞘氨醇的生物合成,阻碍鞘脂类代谢,进而诱发肝癌、食管癌[4]。
现已知伏马霉素可诱导多种细胞凋亡,对人、动物具有潜在的致癌作用,但具体致癌机制目前还不明确[5]。近来研究发现,伏马霉素在一定条件下可促进细胞增殖,可能为其又一致癌机制[6]。本实验将伏马霉素作用于人肝癌HepG2细胞,观察其促进细胞增殖的情况,同时测定TGF-β信号通路相关蛋白转化生长因子-β1(transforming growth factor-β1,TGF-β1)、Smad4(Drosophila mothers against decapentaplegic protein4,Smad4)、纤溶酶原激活物抑制物1(plasminogen activator inhibitor1,PAI-1)mRNA表达水平,以进一步探讨伏马霉素诱导癌症发生的机制。
1 材料与方法
1.1 主要仪器与材料
人肝癌HepG2细胞株由本室提供;伏马霉素购自Enzo Life Sciences公司;小牛血清购自杭州四季青公司;细胞计数试剂盒(Cell Counting Kit8,CCK8)购自碧云天生物研究公司;Trizol购自Invitrogen公司;反转录试剂盒和荧光定量试剂盒购买自大连TaKaRa公司;RT-PCR涉及的引物均由上海Invitrogen有限公司设计;MQX200酶标仪购自Gene公司;AXIO Observer A1型光学显微镜为Carl Zeiss公司产品;荧光定量PCR仪为Bio-Rad公司产品。
1.2 方法
1.2.1 人肝癌细胞株HepG2的培养 用含10%小牛血清,100 U/L青霉素,100 mg/L链霉素的DMEM于37℃,5%CO2孵育箱中培养人肝癌HepG2细胞株。细胞呈贴壁成长,选择对数生长期的细胞,随机分为对照组和处理组。
1.2.2 伏马霉素处理HepG2细胞 将对数生长期人肝癌HepG2细胞株分别接种于6孔(105/孔)、96孔(104/孔)培养板,37℃,5%CO2恒温箱中培养24 h,分别设0、0.5、1.0、10、50μmol/L伏马霉素浓度的DMEM,培养液处理48 h后,继续进行下一步实验。
1.2.3 伏马霉素处理后细胞增殖状态观察 伏马霉素处理48 h后,取接种于96孔培养板的HepG2细胞于光学显微镜下观察生长状态,并拍照。
1.2.4 CCK-8法测定细胞增殖 取对数生长期的HepG2细胞株,分别接种于96孔板中,104/孔,培养24 h;取伏马霉素浓度为0、0.5、1.0、10、50μmol/L的系列培养基各100μL,分别加入对应的孔,其中0 μmol/L为阴性对照组,同时设立空白孔(含培养基不含药物与细胞)进行校正,每组样本3个复孔。培养48 h后,于对应的孔加入CCK-8试剂10μL,继续培养2 h。酶标仪450 nm波长下检测各孔的光密度(D)值。
1.2.5 实时荧光定量PCR测定TGF-β信号通路相关基因 人肝癌HepG2细胞株经0、0.5、1.0、10、50 μmol/L浓度伏马霉素处理48 h后,弃培养基,加入Trizol试剂,提取总RNA。用紫外分光光度计测定RNA浓度及纯度,反转录合成cDNA。反应体系:总RNA 500 ng,5×反转录聚合酶链反应缓冲液2μL,去RNA酶蒸馏水补足至10μL;反应条件:37℃15 min,85℃5 s,4℃保存。以合成的cDNA进行荧光定量PCR。反应体系:样品cDNA 1.5μL、上下游引物各0.5μL、实时荧光定量反应混合液5μL、双蒸水2.5μL,总体积为10μL;反应条件:95℃30 s,95℃5 s,GAPDH 60℃(TGF-β1 56℃,Smad4 59℃,PAI-1 58℃)10 s,72℃30 s,40个循环后制作熔解曲线。实验结果以公式2-ΔΔCt进行处理,以GAPDH为内参照,以未加药组基因的mRNA相对表达量为1.0,定量分析各处理组基因mRNA的相对表达水平。各基因引物序列见表1。

表1 引物序列
1.3 统计学处理
数据处理采用SPSS 13.0软件进行多组间均数比较与单因素方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 伏马霉素对人肝癌细胞HepG2分裂和增殖的影响
不同浓度伏马霉素处理HepG2细胞48 h后,呈分裂象的细胞数明显增加,与阴性对照组相比,0.5 μmol/L组、1.0μmol/L组有丝分裂像细胞差异无统计学意义,而10μmol/L、50μmol/L处理组分裂像细胞明显增加,并呈剂量依赖性。与阴性对照组相比,0.5μmol/L组、1.0μmol/L组细胞增殖速度无明显变化(P均>0.05),而10μmol/L、50μmol/L组细胞增殖速度明显增加(P均<0.05),且呈剂量依赖性。见图1~2。

图1 不同浓度伏马霉素对HepG2细胞分裂数的影响

图2 不同浓度伏马霉素对HepG2细胞增殖的影响
2.2 伏马霉素对TGF-β信号通路的影响
用不同浓度伏马霉素处理人肝癌HepG2细胞48 h后,与阴性对照组相比,各浓度处理组TGF-βmRNA表达均显著上调,且呈剂量依赖性(F=42.91,P<0.05)。同样,与阴性对照组相比,各浓度处理组Smad4、PAI-1 mRNA表达水平皆显著上调(Smad4:F=28.95,P<0.000 1;PAI-1:F=33.86,P<0.000 1),其中0.5μmol/L组、1.0 μmol/L组Smad4 mRNA水平和0.5μmol/L组PAI-1 mRNA水平与阴性对照组相比,差异均无统计学意义,其余组别与阴性对照组比较,差异均有统计学意义(P均<0.05)。见图3。
3 讨论
自1988年首次分离出伏马霉素后,其毒性在人畜体内、体外实验中陆续得到证实[7]。玉米中伏马霉素的污染现象在全球非常普遍,且常与其他致癌性霉菌毒素(如黄曲霉毒素、杂色曲霉素及脱氧雪腐镰刀菌烯醇等)混合污染[8]。流行病学调查发现,国内外某些地区食管癌发病率与当地粮食中伏马霉素的污染情况成正相关,且动物实验结果表明,伏马霉素可诱发某些啮齿类动物肝脏及肾脏肿瘤的发生[9]。现已知伏马霉素可诱导多种细胞凋亡,对人、动物存在潜在的致癌作用,但其引起细胞凋亡和致癌的机制目前仍然不清楚[10]。
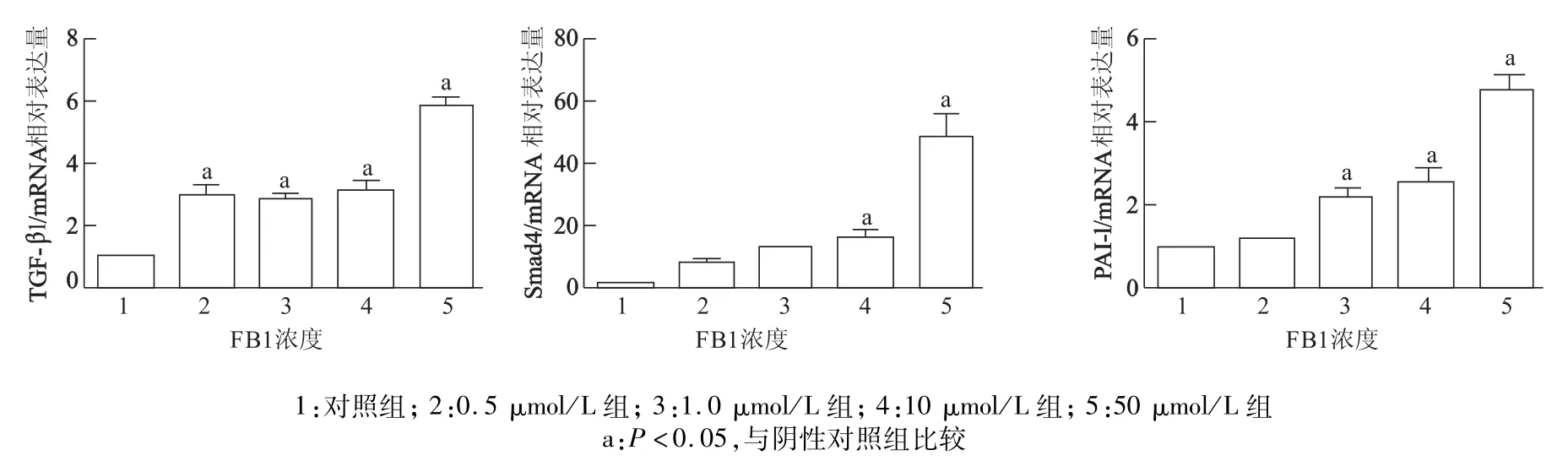
图3 伏马霉素处理后TGF-β1,Smad4和PAI-1 m RNA的表达水平
细胞有增殖、分化和凋亡三方面的特性,其中,增殖是细胞生命活动的重要特征之一,在保持细胞数目的恒定、衰老与更新等方面起着重要的作用。机体创伤愈合、组织再生、病理组织修复等,都要依赖细胞增殖[11]。细胞的异常增殖可导致疾病的产生,如再生障碍性贫血、前列腺肥大、动脉粥样硬化、高IgM血症和恶性肿瘤等[12-14]。细胞增殖加快导致分化不全,即低分化、去分化或逆分化,进而导致肿瘤发生[15]。本研究结果显示,FB1处理HepG2细胞48 h后,细胞增殖明显增加,其机制可能与FB1抑制了神经酰胺合酶从而促进HepG2细胞增殖有关。
TGF-β具有调节信号转导、促进细胞外基质的形成、调节细胞周期、促进血管生成和骨髓造血、趋化和免疫等功能[16]。近来研究表明,TGF-β在肿瘤发生早期有抑制作用[17],但随着肿瘤的发生发展,即抑癌基因失活、原癌基因突变以及染色体易位,TGF-β的抑制作用转变为加强肿瘤的运动、侵袭和转移[18]。另有研究指出,TGF-β信号通路可通过影响脂类代谢从而促进疾病的发生发展[19]。本实验结果表明,随着伏马霉素浓度的增加,HepG2细胞的增殖呈明显上升趋势,且TGF-β,Smad4,PAI-1 mRNA的表达显著上调。伏马霉素是神经酰胺合酶的抑制剂[20],其抑制机制可能与鞘氨基醇竞争结合神经酰胺合酶有关[21],研究证实神经酰胺合酶在体外对肝癌起抑制作用[22]。本结果显示,伏马霉素对人肝癌HepG2株细胞增殖有明显的促进作用,并且呈剂量依赖性,其机制可能与神经酰胺合酶的合成受到阻碍有关[23],具体有待进一步研究。另外,本实验采用荧光定量PCR检测TGF-β信号通路相关蛋白mRNA的变化,结果显示TGF-β Smad4 PAI-1轴mRNA表达均不同程度上调,且呈剂量依赖性。这提示了伏马霉素促进细胞增殖的机制可能与TGF-βSmad4 PAI-1信号通路的上调有关,但其促进细胞增殖的具体机制目前仍不清楚,有待进一步研究。
[1] Gelderblom WC,Jaskiewicz K,MarasasWF,et al.Fumonisins—novel mycotoxins with cancer-promoting activity produced by Fusarium moniliforme[J].Appl Environ Microbiol,1988,54(7):1806-1811.
[2] Alizadeh AM,Rohandel G,Roudbarmohammadi S,et al.Fumonisin B1 contamination of cereals and risk of esophageal cancer in a high risk area in northeastern Iran[J].Asian Pac J Cancer Prev,2012,13(6):2625-2628.
[3] Persson EC,Sewram V,Evans AA,et al.Fumonisin B1 and risk of hepatocellular carcinoma in two Chinese cohorts[J].Food Chem Toxicol,2012,50(3/4):679-683.
[4] Mullen TD,Jenkins RW,Clarke CJ,et al.Ceramide synthase-dependent ceramide generation and programmed cell death:involvement of salvage pathway in regulating postmitochondrial events[J].J Biol Chem,2011,286(18):15929-15942.
[5] Igarashi D,Bethke G,Xu Y,et al.Pattern-triggered immunity suppresses programmed cell death triggered by fumonisin b1[J].PLoSOne,2013,8(4):e60769.
[6] Halasiddappa LM,Koefeler H,Futerman AH,et al.Oxidized phospholipids induce ceramide accumulation in RAW 264.7 macrophages:role of ceramide synthases[J].PLoSOne,2013,8(7):e70002.
[7] MarasasWF,Jaskiewicz K,Venter FS,et al.Fusarium moniliforme contamination ofmaize in oesophageal cancer areas in Transkei[J].SAfr Med J,1988,74(3):110-114.
[8] Yoshinari T,Tanaka T,Ishikuro E,et al.Inter-laboratory study of an LC-MS/MSmethod for simultaneous determination of fumonisin B1,B2 and B3 in corn[J].Shokuhin Eiseigaku Zasshi,2013,54(4):266-276.
[9] Gelineau-van Waes J,Starr L,Maddox J,et al.Maternal fumonisin exposure and risk for neural tube defects:mechanisms in an in vivo mouse model[J].Birth Defects Res A Clin Mol Teratol,2005,73(7):487-497.
[10] Gelderblom WC,Abel S,Smuts CM,et al.Fumonisininduced hepatocarcinogenesis:mechanisms related to cancer initiation and promotion[J].Environ Health Perspect,2001,109(Suppl2):291-300.
[11] Merrill AH Jr.,van Echten G,Wang E,et al.Fumonisin B1 inhibits sphingosine(sphinganine)N-acyltransferase and de novo sphingolipid biosynthesis in cultured neurons in situ[J].J Biol Chem,1993,268(36):27299-27306.
[12] Humpf HU,Schmelz EM,Meredith FI,et al.Acylation of naturally occurring and synthetic 1-deoxysphinganines by ceramide synthase.Formation of N-palmitoyl-aminopentol produces a toxicmetabolite of hydrolyzed fumonisin,AP1,and a new category of ceramide synthase inhibitor[J].JBiol Chem,1998,273(30):19060-19064.
[13] 唐宁,金洁,邓云,等.人源性长寿保障基因2通过与V-ATPase作用抑制肝癌细胞的生长[J].生理学报,2010,62(3):196-202.
[14] Chung Y,Fu E.Crosstalk between Shh and TGF-βsignaling in cyclosporine-enhanced cell proliferation in human gingival fibroblasts[J].PLoS One,2013,8(7):e70128.
[15] Yin LM,Jiang HF,Wang X,et al.Effects of sodium copper chlorophyllin on mesenchymal stem cell function in aplastic anemiamice[J].Chin J Integr Med,2013,19(5):360-366.
[16] Liu R,Li J,Teng Z,et al.Overexpressed microRNA-182 promotes proliferation and invasion in prostate canc-er PC-3 cells by down-regulating N-myc downstream regulated gene 1(NDRG1)[J].PLoS One,2013,8(7):e68982.
[17] Zotes TM,Arias CF,Fuster JJ,et al.PI3K p110γdeletion attenuatesmurine atherosclerosis by reducingmacrophage proliferation but not polarization or apoptosis in lesions[J].PLoSOne,2013,8(8):e72674.
[18] Dzieran J,Fabian J,Feng T,et al.Comparative analysis of TGF-β/Smad signaling dependent cytostasis in human hepatocellular carcinoma cell lines[J].PLoSOne,2013,8(8):e72252.
[19] Halder SK,Beauchamp RD,Datta PK.A specific in
hibitor of TGF-βreceptor kinase,SB-431542,as a potent antitumor agent for human cancers[J].Neoplasia, 2005,7(5):509-521.
[20] Zhang L,Zhou F,Ten Dijke P.Signaling interplay between transforming growth factor-βreceptor and PI3K/AKT pathways in cancer[J].Trends Biochem Sci,2013,38(12):612-620.
[21] Katz LH,Li Y,Chen JS,etal.Targeting TGF-βsignaling in cancer[J].Expert Opin Ther Targets,2013,17(7):743-760.
[22] Matsubara T,Tanaka N,Patterson AD,et al.Lithocholic acid disrupts phospholipid and sphingolipid homeostasis leading to cholestasis in mice[J].Hepatology,2011,53(4):1282-1293.
Fumonisin B1 promoted HepG2 cell proliferation by up-regulating TGF-βsignaling pathway
ZENG Tian-tian,LU Xiao-dong,CHEN Lu-fang,CHEN Yuan-yuan,SHAO Qi-xiang
(School of Medical Science and Laboratory Medicine,Jiangsu University,Zhenjiang Jiangsu 212003,China)
Objective:To investigate the influence of Fumonisin B1(FB1)on the proliferation of HepG2 cells and its possiblemechanism.M ethods:HepG2 cellswere cultured 48 h in prepared DMEM with different concentrations of0.5,1.0,10,50μmol/L FB1,themorphology of each group were observed under inverted microscope.Cell proliferation was evaluated by Cell Counting Kit8(CCK-8)assay.The mRNA expression levels of transforming growth factor-β1(TGF-β1),Drosophila mothers against decapentaplegic 4(Smad4)and plasminogen activator inhibitor-1(PAI-1)were detected by quantitative real-timePCR.Results:Microscope showed that cell division was increased in parallelwith the increase of FB1 concentration.CCK-8 assay revealed that cell proliferation was remarkably increased after treatment of FB1.In the 0.5 and 1.0μmol/L groups,mRNA expression of Smad4 and PAI-1 in HepG2 cells showed no significant difference compared with control group,while in the10 and 50μmol/L groupswere increased dramatically.Conclusion:FB1 could promote cell proliferation effectively,and the elevated level of TGF-β1,Smad4 and PAI-1 in TGF-βpathway may be one ofmechanisms for promoting cell proliferation in HepG2 cells.
Fumonisin B1;cell proliferation;transforming growth factor-β1;signaling pathway;HepG2 cells
R329.28;R979.1
A
1671-7783(2014)02-0114-04
10.13312/j.issn.1671-7783.y140008
曾甜甜(1986—),女,硕士研究生;卢小东(通讯作者),副教授,硕士生导师,E-mail:xiaodonglu2013@163.com
2014-01-07 [编辑] 刘星星
