聚酰胺固相萃取-超高效液相色谱-串联质谱法同时检测饲料中的6种全氟化合物
2014-08-03付凤富陈国南郑小严
林 钦, 付凤富, 陈国南, 郑小严, 戴 明
(1.福州大学食品安全分析与检测教育部重点实验室,福建 福州350116;2.福建省产品质量检验研究院,福建 福州350002)
近年来,全氟化合物(PFCs)的残留问题越来越引起全球的关注,原因是全氟化合物在环境中性质稳定,难以降解;大量的调查研究发现,全氟辛烷磺酸(PFOS)、全氟辛酸(PFOA)被认为是一类具有神经毒性[1]、肝脏毒性[2]等全身多脏器毒性的环境污染物。目前,国内外已有许多关于全氟化合物对环境的污染情况[3]及检测技术的报道[4,5],检测方法主要采用了液相色谱-串联质谱技术[6-12]、气相色谱-质谱联用法[13]、气相色谱法[14]和高效液相色谱/四极杆-飞行时间串联质谱法[15]等。迄今为止,我国已发布了多个针对食品包装材料、食品接触材料和化工产品等的PFOA、PFOS残留检测标准[16-18]。由于全氟化合物的高稳定性,它们被广泛应用于生产涂料、装潢材料、塑料、包装材料等,因此,环境中普遍存在着全氟化合物的污染,并通过食物链传导到生物体。饲料生产中大量使用到鱼粉和油脂等原料,这些都有可能受到全氟化合物的污染,所以,有必要加强对饲料中全氟化合物含量的监测。目前已见采用液相色谱-串联四极杆质谱测定动物源食品、食品接触材料、土壤、底泥和活性污泥、环境水、纺织品与饮用水中的全氟化合物,尚未见对饲料产品中全氟化合物残留的分析方法研究报道。迄今为止,国际、国内尚未出台饲料中全氟化合物测定的标准方法。因此,开展饲料中全氟化合物残留的检测技术研究,对于研究饲料中全氟化合物的污染状况并制定相关产品的限量指标具有积极的意义。
1 实验部分
1.1 仪器与试剂
超高效液相色谱仪Waters Acquity UPLC系统,配Quattro Premier XE串联四极杆质谱仪(美国沃特世公司);1 2管固相萃取装置(美国安捷伦公司);冷冻高速离心机(美国贝克曼公 司,Avanti J-E);Milli-Q 超 纯 水 纯 化 系 统(美国 Millipore公司);分析天平(赛多利斯北京有限公司)。
所用试剂除特别标注外均为分析纯试剂,水为超纯水;甲醇和乙腈(色谱纯,山东禹王);全氟辛酸(perfluorooctanoic acid,PFOA)(CAS 3 3 5-6 7-1,C8HF15O2,纯 度 9 8.0%);全 氟 辛烷磺 酸 钾 (perfluorooctane sulfonic acid potassium salt,PFOS)(CAS 2 7 9 5-3 9-3,C8F17KO3S,纯度9 8.5%),购自德国 Dr.Ehrenstorfer Gm-bH;全氟丁基磺酸钾(perfluorobutane sulfonic acid potassium salt,PFBS)(CAS 2 9 4 2 0-4 9-3,C4F9KO3S,质量浓 度 5 0 mg/L);全 氟 己 烷 磺酸钾(perfluorohexane sulfonic acid potassium salt,PFHxS)(CAS 3 8 7 1-9 9-6,C6F13KO3S,质量浓度5 0 mg/L);全氟庚酸(perfluoroheptanoic acid,PFHpA)(CAS 3 7 5-8 5-9,C7HF13O2,质量 浓 度 5 0 mg/L);全 氟 壬 酸 (perfluorononanoic acid, PFNA ) (CAS 3 7 5-9 5-1,C9HF17O2,质量浓度5 0 mg/L),购自挪威 Chiron公司;全氟辛酸同位素内标(MPFOA,13C8HF15O2,质 量 浓 度 5 0 mg/L),购 自 美 国Cambridge Isotope Laboratories公司。
1.2 溶液配制
1.2.1 标准溶液和内标溶液的配制
分别准确称取50 mg全氟辛酸和全氟辛烷磺酸钾标准品,加入甲醇溶解、定容到100 mL作为标准储备液;移取该储备液1.00 mL用乙腈稀释到100 mL作为标准中间液;移取该中间液1.00 mL并移取全氟丁基磺酸钾、全氟己烷磺酸钾、全氟庚酸和全氟壬酸标准溶液各100μL,用乙腈稀释到10 mL,配成约500μg/L的6种全氟化合物混合标准中间溶液;移取全氟辛酸同位素内标1.00 mL,用乙腈稀释到50 mL,配成1 000μg/L的内标溶液。
1.2.2 基质加标标准溶液的配制
取空白饲料样品按1.4节样品处理方法处理,在最后的空白样品溶液中加入适量混合标准中间溶液和内标溶液,配成0.5~25μg/L的系列基质加标标准溶液,内标质量浓度为5.0μg/L。
1.3 聚酰胺固相萃取小柱制作
取3 mL的固相萃取用空柱,下端放一筛板,将100~200目的聚酰胺粉加入甲醇成浆状,湿法装填,使上筛板用玻璃棒压实后聚酰胺填料的厚度约为1.5 cm,使用前用3 mL5%(v/v)氨水/甲醇(5.0 mL氨水用甲醇定容100 mL)、3 mL甲醇和3 mL 0.5%(v/v)甲酸水溶液(2.5 mL甲酸用水定容500 mL)淋洗活化。
1.4 样品处理方法
称取5.00 g均匀样品,置于50 mL聚丙烯离心管中,加入20μL内标和20.0 mL酸化乙腈(0.5%甲酸乙腈:2.5 mL甲酸用乙腈定容500 mL),盖紧盖子,振摇混匀,置于超声波振荡器中提取30 min;取出,于4℃、15 000 r/min离心5 min;取5.0 mL上清液于10 mL刻度试管中,用乙腈饱和正己烷涡旋萃取净化3次,每次2 mL,吸出正己烷层弃去,40℃水浴中氮吹除去残余正己烷并用乙腈定容至5 mL,再用10.0 mL0.5%甲酸水溶液转入50 mL离心管中;于4℃、15 000 r/min离心5 min,将上清液通过聚酰胺小柱,控制流速1~2 mL/min,依次用3 mL0.5%甲酸水溶液、3 mL酸化乙腈和2 mL水淋洗小柱,真空抽干5 min,用3.0 mL5%氨水甲醇以1~2 mL/min流速洗脱并收集,置于40℃水浴中氮吹近干,再用50%(v/v)甲醇水溶液定容到1.0 mL,混匀,用0.2μm 聚四氟乙烯(PTFE)滤膜过滤后检测。
除不加样品外,同时做空白试验,应确保所使用的试剂、耗材等不含全氟化合物本底。
1.5 液相色谱条件
色谱柱:Waters BEH C18(100 mm×2.1 mm,1.7μm);柱温:35 ℃;进样量:10μL;流速:0.3 mL/min;流动相及梯度:A为5 mmol/L乙酸铵/甲醇(95/5,v/v)溶液,B为乙腈;0~0.5 min,60%A;0.5~3.5 min,60%A~30%A;3.5~5.0 min,5%A;5.0~7.0 min,60%A。
1.6 质谱条件
电离源:大气压电喷雾离子源,负离子模式(ESI(-));毛细管电压3.00 kV;源温度120℃;脱溶剂气温度400℃;脱溶剂气流量700 L/h;锥孔反吹气流量50 L/h;碰撞气为氦气,碰撞室压力0.27 Pa;电子倍增管电压650 V;检测方式:多反应监测(MRM)模式;特征离子见表1。
2 结果与讨论
2.1 质谱条件的选择
分别取约500μg/L的6种全氟化合物标准溶液,由注射泵直接进样,首先作一级质谱全扫描。在ESI(-)模式下,全氟丁基磺酸钾母离子为m/z 299.0,全氟己烷磺酸钾母离子为 m/z 399.0,全氟庚酸母离子为m/z 363.0,全氟壬酸母离子为m/z 463.0,全氟辛酸母离子为 m/z 413.0,全氟辛烷磺酸钾母离子为m/z 499.0,全氟辛酸同位素内标母离子为m/z 421.0。再对母离子进行子离子扫描,通过优化碰撞能量等参数得到6种全氟化合物的子离子,最终确定6种全氟化合物的定量和定性子离子及相应的质谱参数如表1。
2.2 色谱条件的优化
考察了纯水/乙腈体系、0.02%(v/v)甲酸/乙腈体系、0.1%(v/v)甲酸/乙腈体系、0.3%(v/v)甲酸/乙腈体系、0.5% (v/v)甲酸/乙腈体系和 5 mmol/L乙酸铵/乙腈体系作为流动相的分离效果,实验发现纯水/乙腈体系出峰完全变形,而5 mmol/L乙酸铵/乙腈体系具有最佳的峰形、分离度和灵敏度。由于纯乙酸铵水溶液易长细菌发生沉淀,因此在5 mmol/L乙酸铵流动相中加入5%甲醇来防止细菌生长。调整洗脱梯度为1.5节条件时,6种全氟化合物的色谱分离图见图1。
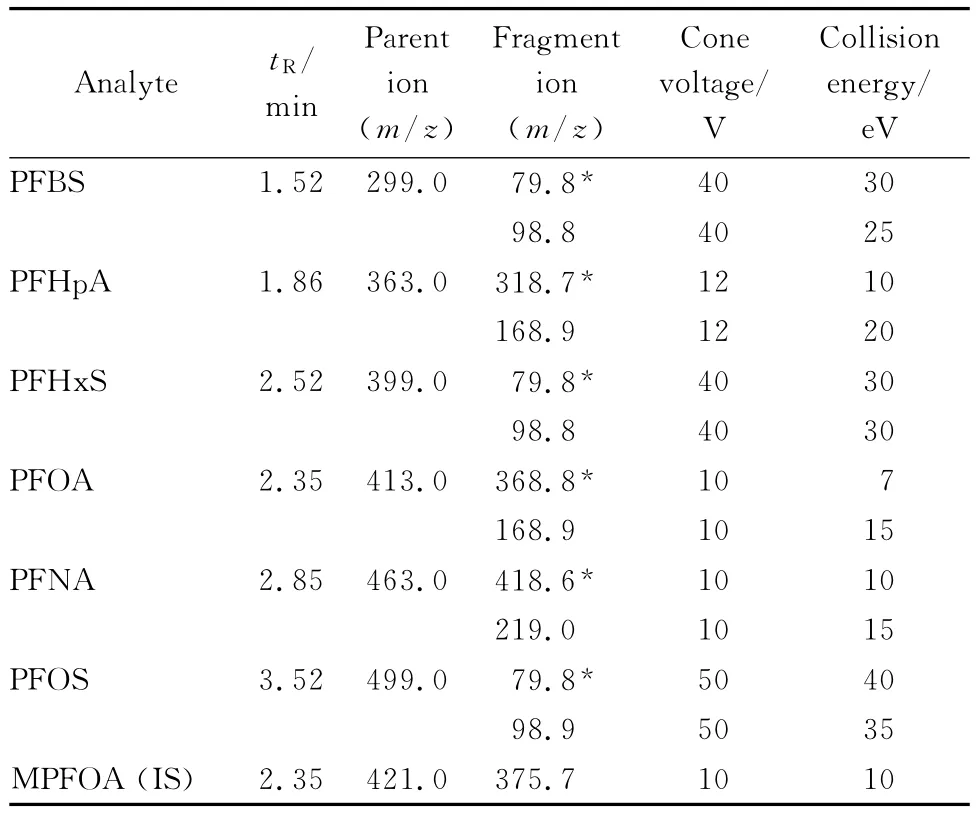
表1 全氟化合物和内标的质谱采集参数Table 1 MS parameters of the six PFCs and internal standard
2.3 前处理条件的优化
本实验采用酸化乙腈为提取剂[6],该提取剂对饲料中的全氟化合物具有良好的提取效率;同时,本实验对样品提取液的净化方法和步骤进行了深入的优化。目前,文献报道的用于全氟化合物的固相萃取柱主要有 Oasis WAX 柱[12]、Oasis HLB 柱[9,10]、Agilent SampliQ OPT 固相萃取小柱[7]、C18固相萃取柱[11]以及C18填料和石墨化炭黑(GCB)分散固相萃取[8]等。由于Oasis WAX柱、Oasis HLB等柱的价格均较昂贵,因此,本文第一作者曾使用廉价、自装填的聚酰胺固相萃取柱萃取了动物源食品中的全氟化合物PFOA和PFOS[6],取得了良好的效果,但对饲料中全氟化合物的萃取效果尚缺少研究。本研究使用聚酰胺填料对饲料中的全氟化合物进行富集和净化,并对聚酰胺固相萃取柱的装填、过柱溶液、淋洗液和洗脱液等进行了优化。
2.3.1 填料厚度选择
实验使用3 mL固相萃取空柱管,下端放一筛板,将100~200目的聚酰胺粉加入甲醇制成浆状,采用湿法装填,上筛板用玻璃棒压实。实验分别装填了0.5、1.0、1.5、2.0、2.5和3.0 cm6种厚度的聚酰胺小柱,回收率结果见图2,结果表明1.5 cm以上的聚酰胺小柱对6种全氟化合物均有95%以上的回收率,最后确定采用1.5 cm的聚酰胺小柱。
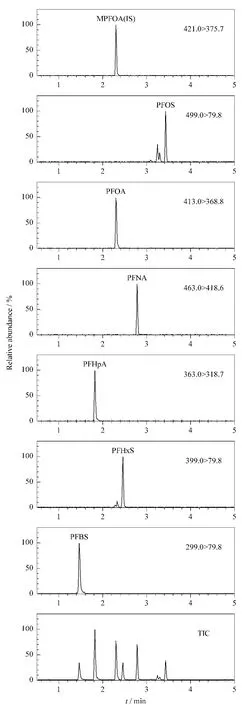
图1 6种全氟化合物和内标的总离子流图和定量离子监测图Fig.1 TIC and quantitative ion chromatograms of the six PFCs
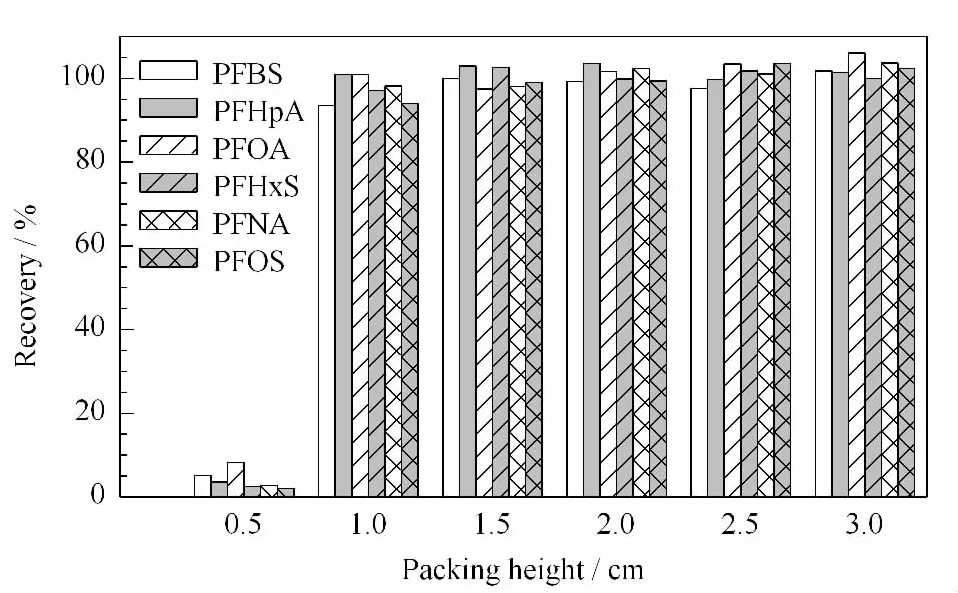
图2 填料厚度对6种全氟化合物的回收率的影响Fig.2 Effect of packing height on the recoveries of the six PFCs
2.3.2 过柱溶液的制备
取5.0 mL样品加标溶液,按样品溶液与0.5%甲酸水溶液5∶0(v/v)、5∶5(v/v)和5∶10(v/v)的比例稀释并离心,过聚酰胺柱净化后检测;同时,实验还比较了采用 Waters Oasis WAX60 mg/3 mL柱按5∶10(v/v)的比例稀释后净化的结果,6种全氟化合物的回收率结果见图3。结果表明,采用聚酰胺柱按5∶10(v/v)的稀释比例对6种全氟化合物的回收率均接近100%并优于WAX净化柱。由于饲料中含有大量脂肪等杂质,加水稀释后会产生严重的混浊现象,高速离心也难以去除,严重影响了样品溶液过柱的速度。因此,实验采用乙腈饱和正己烷萃取去除提取液中的油脂和非极性杂质,氮吹去除多余正己烷后再稀释过柱。

图3 6种全氟化合物在聚酰胺柱上不同稀释比例条件下及在WAX柱上的回收率Fig.3 Effect of dilution rate for polyamide SPE column and WAX SPE column on the recoveries of the six PFCs
2.3.3 淋洗液的选择
为了尽可能地去除杂质的干扰,实验使用了3mL0.5%甲酸水溶液和3 mL酸化乙腈淋洗小柱,发现在酸性条件下,全氟化合物能牢固吸附在柱上而大量杂质被淋洗去除,6种全氟化合物的回收率均在95%以上。因此,本实验采用3 mL0.5%甲酸水溶液淋洗后再用3 mL酸化乙腈淋洗小柱。
2.3.4 洗脱液体积的选择
采用5%(v/v)氨水/甲醇作为洗脱剂,比较了使用1.0、2.0、3.0和4.0 mL洗脱聚酰胺小柱后于40℃水浴中氮吹近干,再溶解定容到1.0 mL后检测的效果,结果见图4。当洗脱液体积在3.0 mL以上时6种全氟化合物的回收率均在95%以上。由于酸化乙腈淋洗后用氨水/甲醇洗脱会生成大量的甲酸铵,在氮吹后会有大量晶体析出,因此,实验在酸化乙腈淋洗后再用2 mL水淋洗小柱,真空抽干5 min后再洗脱,从而得到更纯净的样品溶液。
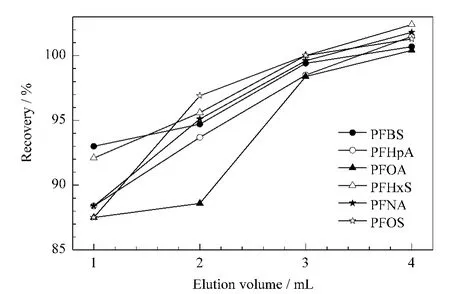
图4 洗脱液体积对6种全氟化合物回收率的影响Fig.4 Effect of elution volume on the recoveries of the six PFCs
2.3.5 定容液的选择
实验发现用甲醇或乙腈溶解样品,进样10μL时,色谱峰发生严重的扩展,无法进行准确的定性和定量;但随着溶剂中水含量的提高,色谱峰的展宽得到改善。最终确定以50%(v/v)甲醇水溶液作为溶剂既能保证良好的峰形,又能保证全氟化合物完全溶解并让样品溶液易于过滤。
2.3.6 净化效果的比较
实验比较了加标猪饲料的未净化样品提取液、正己烷萃取净化提取液和聚酰胺固相萃取柱净化后的谱图,结果表明聚酰胺固相萃取柱具有明显的净化效果,大大减少了离子抑制,峰高明显增大(见图5),有效地提高了检测的灵敏度。
2.4 线性范围和检出限
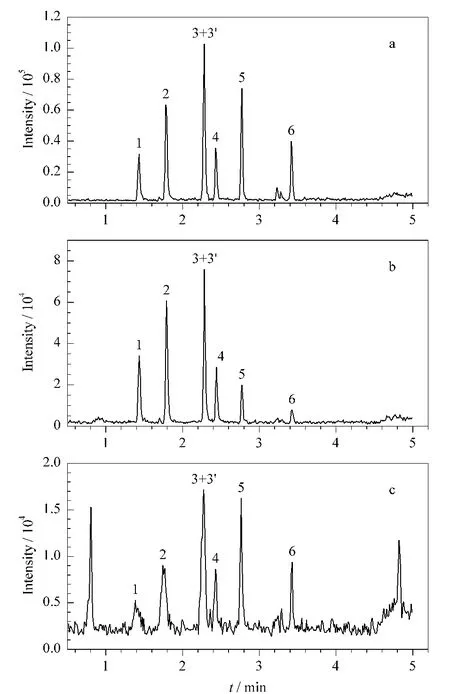
图5 加标猪饲料提取液净化前后的总离子流图Fig.5 TIC chromatograms of spiked pig feedbefore and after purification
取标准中间液用空白样品基质液配成0.5~25 μg/L的系列标准溶液,以全氟化合物的质量浓度为横坐标(X),全氟化合物峰面积与全氟辛酸内标峰面积的比值为纵坐标(Y),绘制6种全氟化合物的标准工作曲线,线性方程和相关系数见表2。同时,用0.5μg/L样品加标提取液的峰高按3倍噪声峰高和10倍噪声峰高确定6种全氟化合物的检出限和定量限(见表2)。
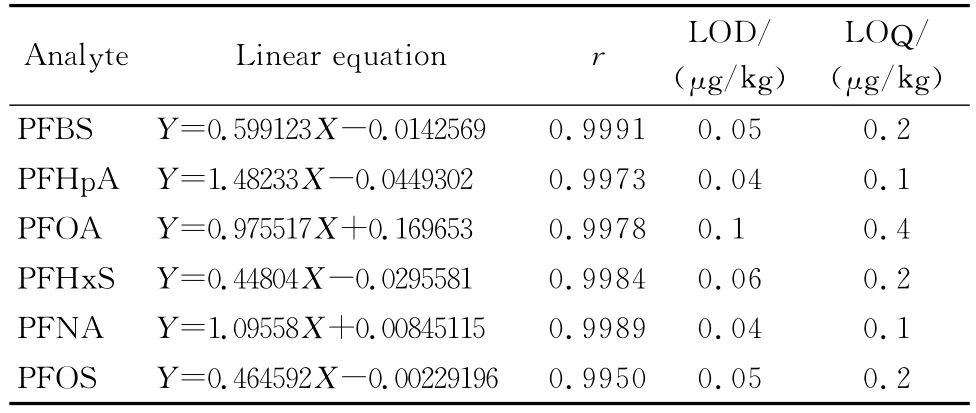
表2 饲料样品中6种全氟化合物的线性方程、相关系数、检出限与定量限Table 2 Linear equations,correlation coefficients(r),LODs and LOQs for the six PFCs in feed
2.5 回收率和精密度试验
取不含全氟化合物的大猪配合饲料、鳗鱼饲料、肉鸡全价料、母猪浓缩饲料、乳猪复合预混料和鱼粉等6种样品进行标准添加试验,每个添加量做5个平行试验,试验结果见表3。
由表3可以看出,该方法对6种全氟化合物的回收率在94.2%~108.9%之间,精密度在1.8%~8.6%之间。
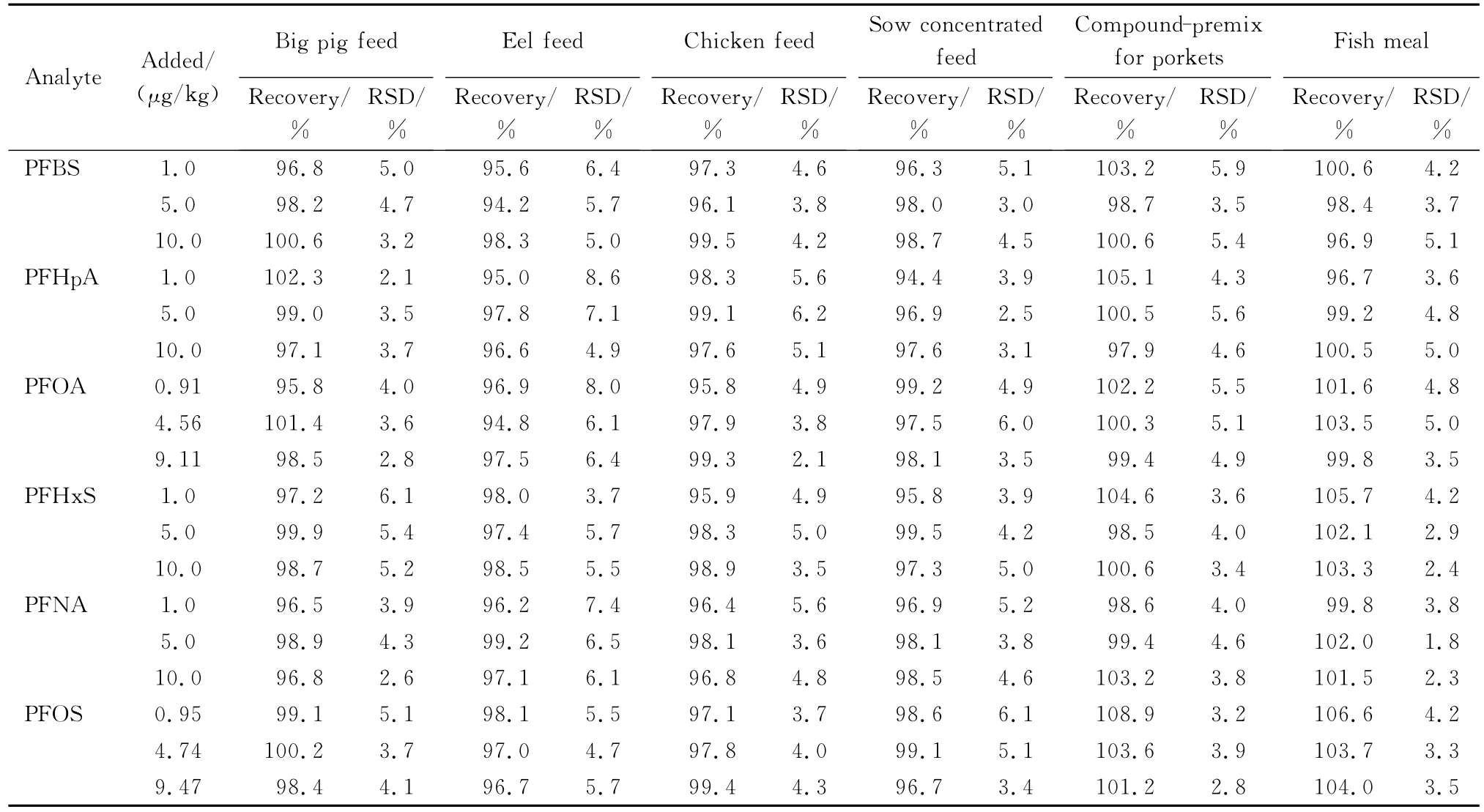
表3 不同饲料中6种全氟化合物的加标回收率和精密度(n=6)Table 3 Recoveries and precisions in different feed samples(n=6)
2.6 实际样品检测
采集饲料生产企业和市场上的配合饲料、浓缩饲料、预混料、鱼粉等样品50个批次,采用本方法进行检测。结果有20个批次的样品检出了全氟化合物,主要为全氟壬酸、全氟辛烷磺酸钾和全氟辛酸的污染(见表4)。其中有些样品的全氟辛烷磺酸钾的含量较高,但其含量均低于10μg/kg,该暴露量不会对动物健康造成大的影响[19],但高于7个氟代碳原子的全氟化合物在生物体具有生物富集效应[20],易造成动物产品中全氟化合物含量的提高,如2007年,香港城市大学的王媛等在中国8个地区采集的鸡蛋中全部检出了PFOS,特别是蛋黄中PFOS含量可高达107μg/kg[21]。
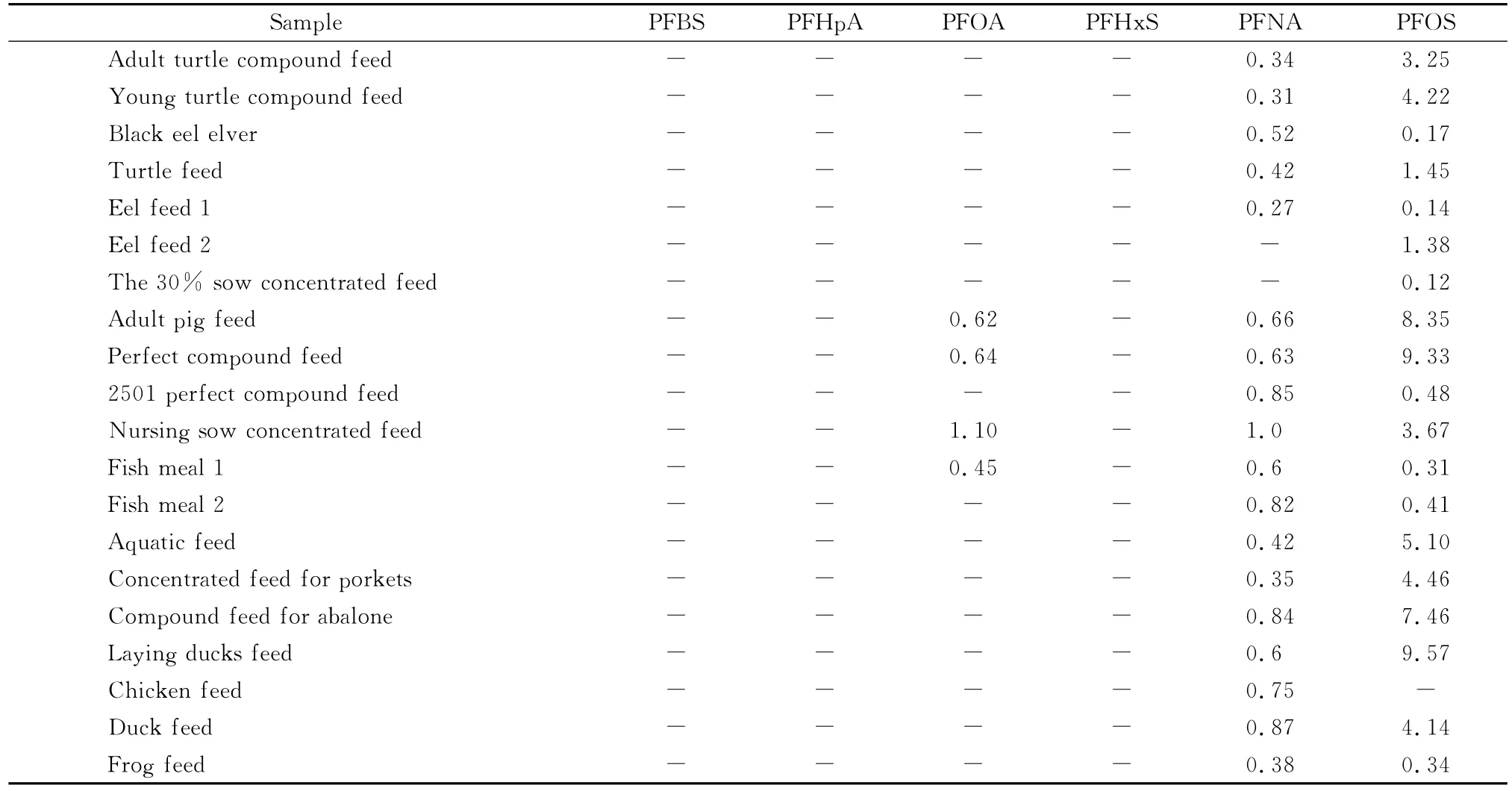
表4 阳性饲料样品中6种全氟化合物的含量Table 4 Contents of the the six PFCs in positive feed samples μg/kg
3 结论
本文建立了一种基于聚酰胺固相萃取结合超高效液相色谱-串联四极杆质谱分析检测饲料中全氟化合物的方法。所建立的分析方法具有前处理成本低、效果好、灵敏度较高、稳定性较好和操作简单等优点,在调查饲料中的全氟化合物污染状况的检验工作中具有很好的应用价值。
[1] Li L,Zhao K F,Li Y M,et al.Journal of Environmental Hygiene(李玲,赵康峰,李毅民,等.环境卫生学杂志),2013,3(2):167
[2] Peng S Y,Yan L J,Zhang J,et al.Chinese Journal of Chromatography(彭思远,严丽娟,张洁,等.色谱),2012,30(2):123
[3] Shi Y L,Pan Y Y,Wang J M,et al.Progress of Chemistry(史亚利,潘媛媛,王杰明,等.化学进展),2009,21(2/3):369
[4] Chen J J,Fang K,Hu M Y.Chemical Production and Technology(陈剑君,方凯,胡鸣韵.化工生产与技术),2011,18(3):9
[5] Chen H M,Zhao M.Textile Auxiliaries(陈红梅,赵梅.印染助剂),2008,25(8):42
[6] Lin Q.Food Science(林钦.食品科学),2013,34(10):241
[7] Ran X R,Zhang Z X,Zhang Z X.Environmental Chemistry(冉小蓉,张政祥,张之旭.环境化学),2009,28(3):459
[8] Guo M M,Wu H Y,Li Z X,et al.Chinese Journal of Analytical Chemistry(郭萌萌,吴海燕,李兆新,等.分析化学),2013,41(9):1322
[9] Liu L Z,Guo X D,Fang J,et al.Journal of Instrumental Analysis(刘莉治,郭新东,方军,等.分析测试学报),2013,32(7):862
[10] Wang Y,Kong D Y,Shan Z J,et al.Environmental Chemistry(王懿,孔德洋,单正军,等.环境化学),2012,31(1):113
[11] Tseng C L,Liu L L,Chen C M,et al.J Chromatogr A,2006,1105:119
[12] Wang J M,Shi Y L,Pan Y Y,et al.Chinese Sci Bull,2010,55(31):3550
[13] Wang L B,LüG,Liu S C,et al.Chinese Journal of Analysis Laboratory(王利兵,吕刚,刘绍从,等.分析试验室),2007,26(2):94
[14] Yu H P,Rong H,Lu L J,et al.China Dyeing &Finishing Journal(于徊萍,荣会,卢利军,等.印染),2007(13):37
[15] Guo R,Cai Y Q,Jiang G B.Environmental Chemistry(郭睿,蔡亚岐,江桂斌.环境化学),2006,25(6):674
[16] GB/T23243-2009
[17] GB/T24169-2009
[18] SN/T2257-2009
[19] Ji Y B,Wu H,Lang L.The Proceedings of China Environmental Science Society of Academic Annual Meeting.Beijing:China Environmental Science Press(季宇彬,吴昊,郎朗.中国环境科学学会学术年会论文集.北京:中国环境科学出版社),2010:4135
[20] Wu J P,Guan Y T,Li M Y,et al.Ecology and Environmental Sciences(吴江平,管运涛,李明远,等.生态环境学报),2010,19(5):1246
[21] Wang Y,Yang W X,Yamashita N,et al.Chinese Science Bulletin(王媛,杨伟贤,山下信义,等.科学通报),2008,53(2):147
