液相色谱-电感耦合等离子体质谱法测定稻米中的5种砷形态
2014-08-03巩佳第曹晓林曹赵云卞英芳于莎莎陈铭学
巩佳第, 曹晓林, 曹赵云, 卞英芳, 于莎莎, 陈铭学
(中国水稻研究所 农业部稻米及制品质量监督检验测试中心,浙江 杭州310006)
水稻是除饮用水以外,人体对砷摄入的最主要来源[1]。大量研究表明,稻米中砷主要以无机态的砷酸盐、亚砷酸盐,以及有机态的二甲基砷(DMA)、一甲基砷(MMA)和少量的砷甜菜碱(AsB)等形式存在[2-4]。由于无机砷的毒性高于有机砷,目前国内外仅对稻米中的无机砷限量做出规定,但研究表明,有些有机砷可能与癌细胞活性有关,也存在毒性[5-7]。因此,对稻米中各种砷形态进行全面的分析才能科学、客观地对稻米砷安全做出评价,并开展相关的风险评估工作。
在稻米砷形态分析中,如何实现对各形态完全提取,同时又要避免形态间的相互转化,是其主要的技术难点[8,9]。研究认为稻米基质中的巯基化合物(如谷胱甘肽、半胱氨酸等)在低氧化还原环境中,可将砷酸根[As(V)]部分还原为亚砷酸根[As(Ⅲ)],而使得As(Ⅴ)测定结果偏低;若采用过强的氧化体系提取,则导致As(Ⅲ)的响应降低,甚至不能被测定[10-12]。目前,基于酸体系结合热辅助提取技术被认为是解决上述问题的有效途径,如近几年报道的硝酸热辅助提取法、甲醇-HNO3热超声浸提法、三氟乙酸微波萃取法等[13-15]。但这些技术的提取效率存在明显的差异,且酸介质对后续的色谱分离非常不利,如极易引起常规离子交换柱的柱效下降及柱压上升等。此外,在加热方式上,与本文采用的石墨消解仪相比,微波消解存在分析效率较低、分析成本较高的问题,而电热板的控温能力相对较弱。由此可见,针对稻米中5种砷形态的提取、分离方法,还有待于进一步完善和统一。
本工作采用石墨消解法提取,以耐酸较强的Dionex IonPac AS19阴离子交换柱为色谱分离材料,在对几种常用 的砷形 态 提取方法[13,14,16,17]进 行比较的基础上,对提取试剂的浓度、提取时间和提取温度等条件进行了优化,结合ICP-MS高灵敏度检测,成功地建立了稻米中5种砷形态的检测方法,方法简单、准确、耐用。
1 实验部分
1.1 仪器
1200高效液相色谱仪(美国Agilent公司)、X-series 2电感耦合等离子体质谱仪(ICP-MS,美国ThermoFisher公司)、PM400电子天平(瑞士 METTLER公司)、PHS-3C精密pH计(上海雷磁仪器公司)、MS3 basic漩涡振荡仪(德国IKA公司)、Cyclotec 1093旋风研磨仪(丹麦Foss公司)、KQ-800TED型超声波清洗器(昆山市超声仪器有限公司)、Primo R离心机(美国 ThermoFisher公司)、DigiBlock ED-54石墨消解仪(莱伯泰科公司),Oasis MAX小柱(3 mL/60 mg,美国 Waters公司)。
1.2 试剂与材料
磷酸二氢钠、无水乙酸钠、乙二胺四乙酸二钠(分析纯,Fluka),硝酸钾(分析纯,Aldrich),氢氧化钠(分析纯,ACROS),乙醇(色谱纯,Merck),三氟乙酸(TFA,纯度≥95.0%,ACS),硝酸(68%~70%,上海安谱科学仪器有限公司),甲醇(色谱纯,Merck);实验室用水为Milli-Q高纯水。
砷标准溶液:As(V)(GBW08667)、As(Ⅲ)(GBW08666)、 AsB (GBW08670)、 MMA(GBW08668)、DMA(GBW08669)以及砷单标准储备液(1 000 mg/L)均购于国家标准物质中心。5种砷形态混合标准储备液:用纯水将5种砷形态稀释成质量浓度均为2 mg/L(以As计)的混合标准储备液,置于4℃冰箱中避光保存。砷标准工作液和混合标准工作液现用现配。
实验室稻米样品随机采购于当地农贸市场。
1.3 砷形态分析
1.3.1 样品预处理
取待测稻米样品于旋风研磨仪中粉碎,过80目筛,准确称取样品1.000 g,置于50 mL聚丙烯离心管中,加入10 mL 0.3 mol/L硝酸水溶液,涡旋混匀,再置于石墨消解仪中在95℃下提取90 min。将提取液冷却至室温,在8 000r/min下离心15 min,上清液过0.22μm滤膜后,供LC-ICP-MS分析。
1.3.2 仪器条件
液相色谱条件中的流动相参考国家标准[18];流速0.9 mL/min;进样体积20μL。阴离子保护柱IonPac AG19(50 mm×4 mm,Dionex);阴离子分析柱IonPac AS19(250 mm×4 mm,Dionex)。
ICP-MS工作参数:功率1 224 W,辅助气流量0.8 L/min,冷却气流量12 L/min,雾化气流速0.95 L/min,采集质量数砷75,载气(氩气)纯度≥99.999%。
1.4 总砷含量的测定
总砷含量测定参照国家标准[19]。随机选取了一个稻米样品,按该方法测定,其结果为235.7 μg/kg(n=5),用于下文中对提取方法的优化研究。
2 结果与讨论
2.1 提取试剂的选择
目前针对砷形态的提取溶剂主要有有机试剂、无机试剂以及复合试剂,另外还有酶试剂提取等[15,20-22]。比较了50%(v/v)甲醇水溶液(含1%(v/v)硝酸水溶液)、0.3 mol/L硝酸水溶液、3%(v/v)三氟乙酸(TFA)水溶液和水4种提取试剂对5种砷形态的提取效率。其中,甲醇提取法于55℃下超声30 min,提取液在6 000 r/min下离心15 min,上清液过MAX柱后上机分析;0.3 mol/L硝酸水溶液提取按1.3节样品预处理方法进行;3%三氟乙酸提取法于80℃下浸提2 h;水提取法于90℃下浸提3 h,三氟乙酸水溶液和水提取法所得提取液都以8 000 r/min离心15 min,上清液过0.22μm滤膜后上机分析。上述4种提取剂对5种砷形态的提取效果见图1。

图1 4种提取试剂对5种砷形态的提取量(n=3)Fig.1 Extraction amounts of the five arsenic species with the four extraction reagents(n=3)
由图1可以看出,以0.3 mol/L硝酸水溶液对总砷(这里指各形态之和)的提取量最多(232.5 μg/kg),其提取效率达98.6%;水和 TFA其次,对应的提取效率分别为93.8%和88.9%;而50%甲醇最低,提取效率仅为49.2%。其次,从各砷形态的提取量来看,总体上仍以0.3 mol/L硝酸水溶液效果最好,其中 As(Ⅴ)、MMA、DMA、As(Ⅲ)和 AsB的提 取 量 分 别 为 35.1、6.9、58.1、130.9、1.5 μg/kg,而TFA和甲醇试剂几乎不能将MMA提取出来。此外,纯水的总体提取效果虽仅次于0.3 mol/L硝酸水溶液,但对As(Ⅴ)和DMA的提取效果较差,其提取量仅为0.3 mol/L硝酸水溶液的86.3%和81.1%。综合考虑,以0.3 mol/L硝酸水溶液对稻米中砷形态的提取效果最好。
2.2 提取条件的优化
2.2.1 硝酸浓度对5种砷形态提取效率的影响
将提取温度和提取时间设为95℃和90 min,分别考察了0、0.15、0.3和0.45 mol/L硝酸水溶液对各形态砷的提取效率及形态转化的影响,提取过程按1.3.1节样品预处理方法进行,结果见图2。
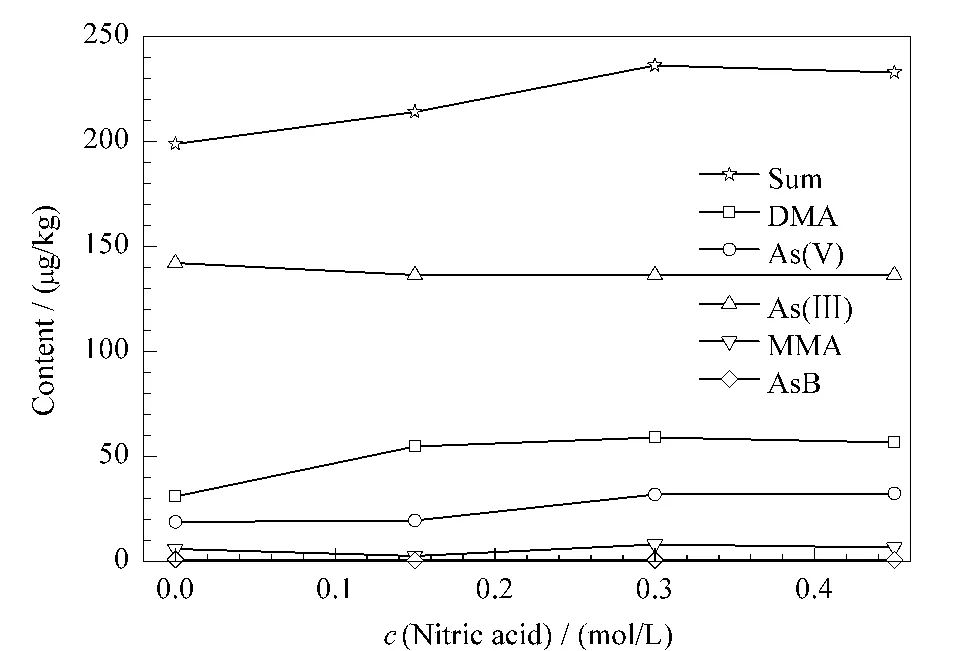
图2 不同硝酸浓度下5种砷形态的提取量(n=3)Fig.2 Extraction amounts of different concentrations of nitric acid on the five arsenic species(n=3)
由图2可以看出,当试样采用不同浓度的硝酸提取时,其对As(Ⅲ)和AsB的提取量影响不明显,而DMA、As(V)和MMA的提取量总体上均随着硝酸浓度的增加而提高,且当硝酸浓度为0.3 mol/L时,这3种砷形态的提取量基本均达到最大,同时,总砷提取效率也达到最高(100.2%)。
从硝酸对As(V)和As(Ⅲ)的转化影响来看,只有当硝酸浓度≥0.15 mol/L时,稻米基质中还原性物质才能得到完全抑制,相应地As(V)提取量则有了明显的上升,之后便保持稳定。对于As(Ⅲ)而言,与不含硝酸的提取液相比,其在0.15 mol/L的硝酸水溶液中仅下降4%,基本不影响测定;而当硝酸浓度再增大时,则几乎不发生变化。综合考虑,选择0.3 mol/L为最佳硝酸浓度。
2.2.2 提取温度的选择
以0.3 mol/L硝酸水溶液为提取剂,提取时间设为90 min,考察了不同温度(65、75、85、95、105℃)对5种砷形态的提取效率的影响,结果见图3。

图3 不同温度下5种砷形态的提取量(n=3)Fig.3 Extraction amounts at different temperatures of the five arsenic species(n=3)
图3表明,随着提取温度的升高,除AsB和DMA的提取效率无明显变化外,其余3种形态砷的提取效率总体呈上升趋势。当温度提高至95℃时,5种砷形态的提取量基本均达到最大,与65℃时相比,As(Ⅲ)、As(V)和 MMA的提取量分别上升了24.4%、38.8%和73.9%,且总砷提取效率也达到最高(100.8%)。从各形态变化趋势看,As(Ⅲ)在85℃时提取量就有明显的提升且之后便趋于稳定。而对于As(V)和MMA,只有温度提高至95℃时,其提取量才有明显的上升,之后保持稳定。因此,选择最佳提取温度为95℃。
此外,还考察了提取时间对5种砷形态提取效率的影响。提取时间在30~180 min内,每隔30 min进行测定。结果发现,除提取时间少于60 min时的提取率低以外,其余时间点对稻米中各形态砷的提取效率无明显差异。为取得较好的提取效率和稳定的结果,选择提取时间为90 min。
2.3 对5种砷形态转化的考察
为进一步考察样品提取过程中砷形态是否发生转化,对空白稻米(仅As(Ⅲ)有检出,含量为1.93 μg/kg)分别进行100μg/kg的单一形态加标试验(n=3)。按照1.3.1节的步骤进行处理,结果表明,稻米中添加As(V)后,对应的检出值为93.66 μg/kg,回收率为93.7%,并没有As(Ⅲ)及其他形态检出。同样,对As(Ⅲ)、AsB、MMA和 DMA的添加试验表明,其回收率为92.5%~98.5%,也未发现有砷形态之间相互转化的现象。以上研究结果与Huang等[9]以及 Zhang等[23]的结果相似。因此,采用0.3 mol/L的硝酸于95℃下消解1.5 h,可避免稻米中5种砷形态的相互转化。
2.4 线性范围和检出限
将5种砷形态的混合标准溶液分别配制成含AsB和 DMA0.05、0.5、5、50、200μg/L,As(Ⅲ)和MMA0.1、1、10、100、400μg/L,As(V)0.15、1.5、15、150、600μg/L的混合溶液。在最佳的仪器条件下进样测定,测定结果以各形态的质量浓度为横坐标(x,μg/L),峰面积为纵坐标(y)绘制标准曲线,得到的线性方程和相关系数见表1。结果表明,目标分析物在相应的质量浓度范围内具有较好的线性关系,各分析物标准曲线的相关系数不低于0.999 9。
取5种砷形态的混合标准溶液,按确定的方法测定,以不低于3倍信噪比(S/N≥3)确定方法的检出限(LOD),以S/N≥10确定方法的定量限(LOQ)。结果如表1所示,5种砷形态的LOD为0.15~0.45μg/kg,LOQ为0.50~1.50μg/kg。

表1 5种砷形态的线性范围、线性方程、相关系数(r)、检出限(LOD)与定量限(LOQ)Table 1 Linear ranges,linear equations,correlation coefficients(r),limits of detection(LODs)and limits of quantification(LOQs)of the five arsenic species
2.5 方法的准确度和精密度
本工作分别通过国家大米标准物质(GBW10010)结合加标回收方式考察方法准确度和精密度。由表2可看出,本方法对大米标准物质中各形态之和(Sum)的测定结果为99.15μg/kg,与其标准值(102±8)μg/kg基本一致。
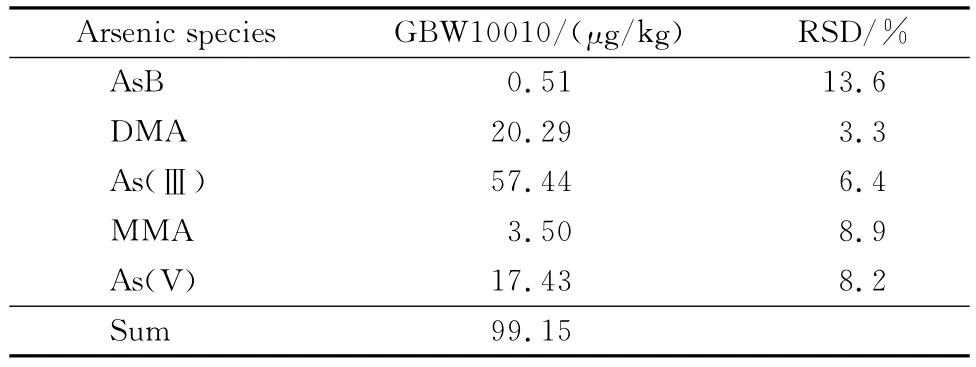
表2 GBW10010中5种砷形态含量和相对标准偏差(n=5)Table 2 Contents and RSDs of the five arsenic species in GBW10010(n=5)
本工作在粉碎的大米中加入5、50μg/kg的AsB和 DMA,10、100μg/kg的 As(Ⅲ)和 MMA,15、150μg/kg的As(V),按照1.3.1节的步骤进行处理,分别测定5种砷形态的回收率及其精密度,结果见表3。结果表明,在2个加标水平上,各形态的回收率为89.6%~99.5%,RSD 为0.6%~3.6%。两种验证结果表明,该方法回收率高,结果稳定可靠。
2.6 实际样品测定
利用建立的方法对市场上15份稻米样品进行了测定(n=3),结果如表4所示:15份样品中无机砷(iAs,As(Ⅲ)与As(V)之和)的含量均低于限量值(200μg/kg),全部符合我国食品卫生标准[5]。从各形态的检测结果看,稻米中砷主要以As(Ⅲ)形式存在,对应的含量为35.96~150.83μg/kg;其次为DMA和 As(V),对应的含量分别为5.24~98.13 μg/kg和4.18~13.63μg/kg;仅13号样品中检出少量的AsB,其含量为0.61μg/kg。

表3 大米基质中5种砷形态的加标回收率和相对标准偏差(n=5)Table 3 Recoveries and RSDs of the five arsenic species spiked in rice(n=5)
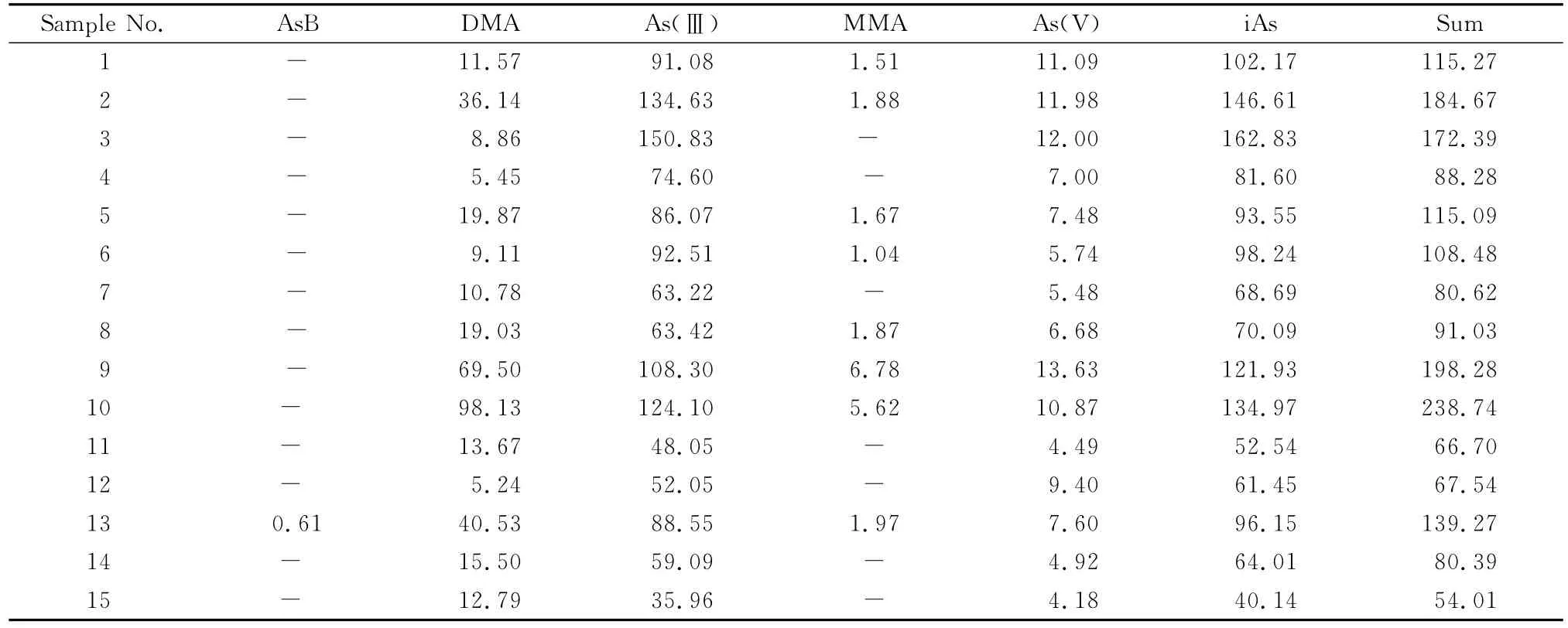
表4 稻米样品中5种砷形态的测定结果(n=3)Table 4 Results of the five arsenic species in rice samples(n=3) μg/kg
5种砷形态混合标准溶液(10μg/L)的色谱图见图4,两个大米实际样品(15号和13号)的色谱图见图5。从这些色谱图中可以看出,采用所建立的样品预处理方法及仪器条件,5种砷形态均得到基线分离,且峰形良好、灵敏度较高,说明该方法能满足稻米中砷形态分析的要求。

图4 5种砷形态的混合标准溶液的LC-ICP-MS色谱图Fig.4 LC-ICP-MS chromatogram of the mixture of the five standards of arsenic species
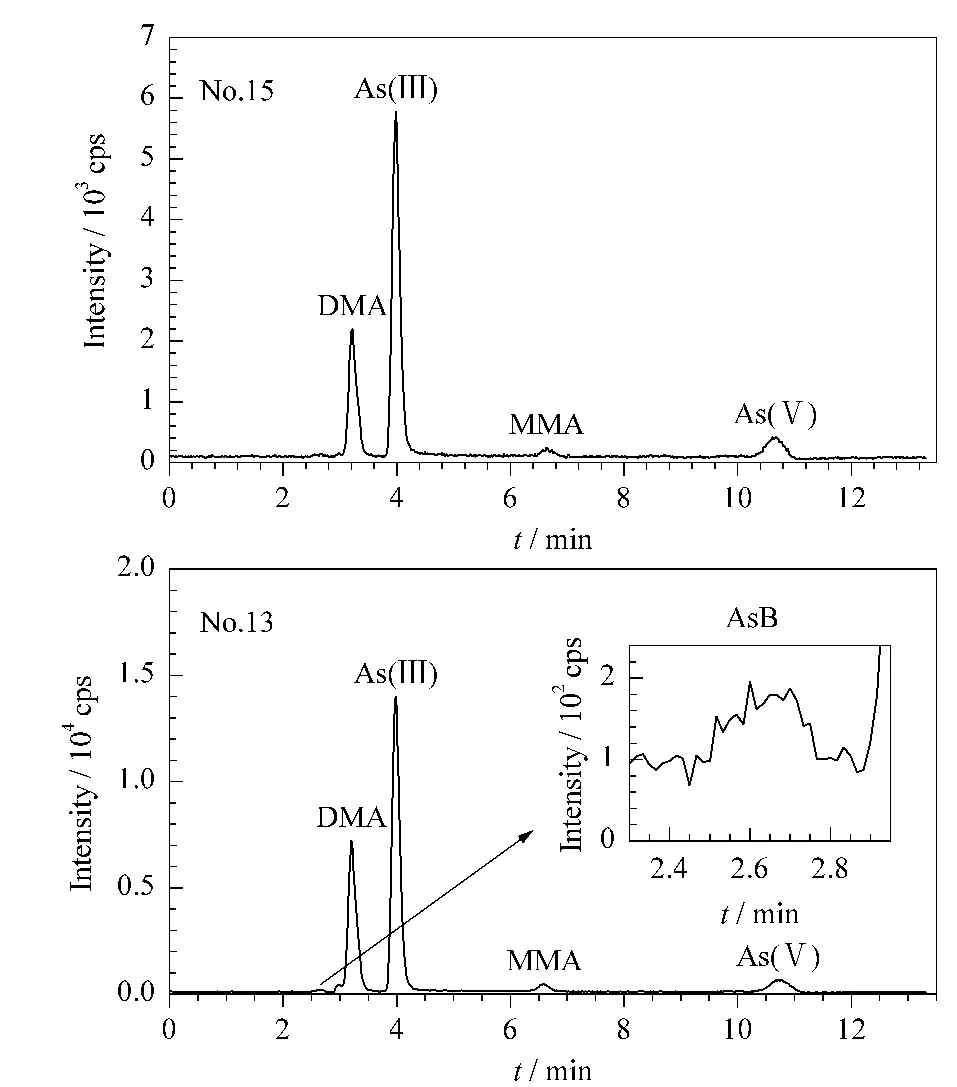
图5 15号和13号大米样品中5种砷形态的 LC-ICP-MS色谱图Fig.5 LC-ICP-MS chromatograms of the five arsenic species in rice samples No.15 and No.13
3 结论
以0.3 mol/L硝酸水溶液为提取剂,基于石墨消解仪控温提取,解决了目前对稻米中5种砷形态提取效率低、各形态间易转化的难题。结果表明,该提取方法回收率高、操作简单,尤其适合于高通量分析。此外,本研究采用Dionex IonPac AS19阴离子交换柱对5种砷形态进行分离和ICP-MS检测,极大地提高了方法的耐用性和分析灵敏度。由此可见,本方法适合于稻米中5种砷形态的准确定性、定量分析。
[1] Stroud J L,Norton G J,Islam M R.Environ Pollut,2011,159:947
[2] Kim J Y,Kim W I,Kunhikrishnan A,et al.Food Sci Biotechnol,2013,22(6):1509
[3] Arao T,Kawasaki A,Baba K,et al.Environ Sci Technol,2011,45(4):1291
[4] Zheng M Z,Li G,Sun G X,et al.Plant Soil,2013,365:227
[5] GB2762-2012
[6] Brown J L,Kitchin K T,George M.Teratogenesis Carcinog Mutagen,1997,17:71
[7] Watanabe T,Hirano S.Arch Toxicol,2013,87(6):969
[8] Maher W,Foster S,Krikowa F.Environ Sci Technol,2013,47:5821
[9] Huang J H,Ilgen G,Fecher P.J Anal At Spectrom,2010,25:800
[10] Carey A M ,Scheckel K G,Lombi E,et al.Plant Physiol,2010,152:309
[11] Raber G,Stock N,Hanel P,et al.Food Chem,2012,134:524
[12] Pan H,Li X W,Gong Z Y,et al.Journal of Wuhan Polytechnic University(潘浩,李筱薇,宫智勇,等.武汉工业学院学报),2012,31(3):1
[13] Yun H X,Zhang L,Li X W,et al.Journal of Hygiene Research(云洪霄,张磊,李筱薇,等.卫生研究),2010,39(3):316
[14] Narukawa T,Chiba K.J Agric Food Chem,2010,58:8183
[15] Juskelis R,Li W X,Nelson J,et al.J Agric Food Chem,2013,61:10670
[16] Paik M K,Kim M J,Kim W I.J Korean Soc Appl Biol Chem,2010,53(5):634
[17] Huang J H,Fecher P,Ilgen G,et al.Food Chem,2012,130:453
[18] GB/T23372-2009
[19] GB/T5009.11-2003
[20] Yang L J,Hu Q R,Guo W,et al.Chinese Journal of Chromatography(杨丽君,胡巧茹,郭伟,等.色谱),2011,29(5):394
[21] Heitkemper D T,Vela N P,Stewart K R,et al.J Anal At Spectrom,2001,16:299
[22] Yue B,Liu L P,Xie K,et al.Chinese Journal of Food Hygiene(岳兵,刘丽萍,谢科,等.中国食品卫生杂志),2013,25(3):238
[23] Zhang C H,Wang Y,Ge Y.Anal Lett,2013,46:1573
