SO3 脱除技术实验研究
2014-08-03陈晓露赵钦新鲍颖群王云刚李钰鑫
陈晓露,赵钦新,鲍颖群,王云刚,李钰鑫
(西安交通大学能源与动力工程学院,西安710049)
煤炭是我国最主要的能源类型,其生产和消耗量均达到能源总量的70%以上,其中50%左右的原煤直接用于发电和供热.2008年,火力发电的总煤耗达到1.353 517×109t.大量的原煤直接用于燃烧会产生各种污染物.2011年国家电力行业节能减排指标显示,二氧化硫和烟尘的排放量较2010年均有所下降:电力行业二氧化硫排放量约为9.13×106t,二氧化硫的排放量为2.3g/(kW·h);烟尘年排放量约为1.55×106t,烟尘的排放量为0.4 g/(kW·h)[1].SOx和NOx的大量排放是产生酸雨现象的主要原因,导致湖泊和土壤酸化、农作物减产、森林和草原也受到严重影响.而烟尘的大量排放增加了空气中可吸入颗粒物的浓度,给人体健康带来巨大威胁.
SO3是少量存在于燃煤电站烟气中的一种污染物质,但其存在危害很大,不仅对电站的正常稳定运行产生潜在威胁,同时也会对大气环境产生严重污染.其主要危害有:形成“蓝羽”[2],增加排烟不透明度;烟气中的SO3与水蒸气结合生成H2SO4蒸气,能显著提高烟气酸露点,在低温受热面上冷凝形成酸液,并与碱性灰和金属壁面反应,造成低温腐蚀;与水蒸气和NH3反应生成硫酸氢铵和硫酸铵,硫酸氢铵和硫酸铵会沉降在催化剂表面,堵塞微孔,导致催化剂失效等[3];SO3对人体健康也有不利影响.因此,研究如何有效脱除SO3具有重要意义.目前,脱除SO3的方法主要有:燃用低硫煤、混煤;开发低SO2氧化率的选择性催化还原(SCR)催化剂;湿法脱硫;湿式静电除雾器[4];吸收剂喷射吸收脱除SO3技术等.
笔者在恒温加热炉上研究SCR 催化剂对SO2的氧化作用,探索不同温度下SO2的氧化率,并将催化产生的SO3用于固定床反应系统.在固定床反应系统中,对镁基吸收剂Mg(OH)2和MgO、钙基吸收剂Ca(OH)2和CaO 吸收烟气中SO3的吸附特性进行基础实验研究,分析温度和反应时间对SO3吸附率的影响,比较这4种吸收剂的吸附效果.
1 实验部分
1.1 实验系统及装置
实验系统原理图见图1,系统主要包括配气系统、流量控制系统、反应器系统、水蒸气发生系统、SO3吸收系统和烟气分析系统.
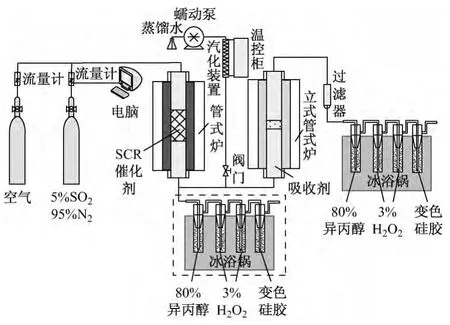
图1 实验系统原理图Fig.1 Schematic diagram of the experimental system
1.2 实验和分析方法
1.2.1 SO3的测量方法
实验时需要对烟气中的SO3含量进行采样分析,采用美国环保署(EPA)推荐的钍试剂滴定法和钍试剂-钡分光光度法分别进行研究,对比后采用钍试剂-钡分光光度法.
钍试剂-钡分光光度法的基本原理是朗伯-比尔(Lambert-Beer)定律,吸光度与溶液的浓度成线性关系.实验中取不同体积的标准溶液(以此溶液体积为曲线横坐标)定容至相同体积,以配制成不同浓度的溶液,将BaCl2和钍试剂加入到各浓度溶液中制成标准硫酸根离子色列,测定标准色列溶液的吸光度,并汇制标准曲线.分光光度计在测量出样品的吸光度后,即可在标准曲线上直接读出样品中的浓度,从而间接得出烟气中SO3的含量.实验所得标准曲线见图2.
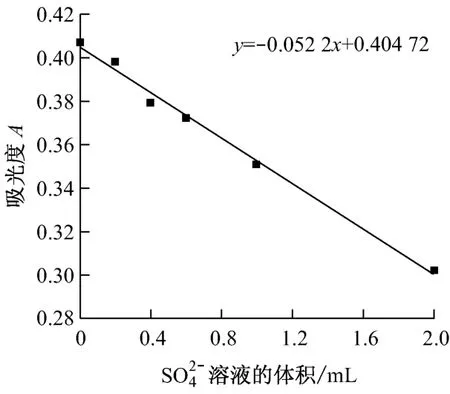
图2 浓度标准曲线Fig.2 Standard curve ofconcentration
1.2.2 表面特征分析
对吸收剂样品进行了一系列表面特征分析,如BET、孔容积和微孔容积等.
1.2.3 表面形貌分析
采用扫描电子显微镜对吸收前后的吸收剂样品进行表面形貌分析.
2 结果与讨论
2.1 SCR 催化剂对SO2 的氧化率
为了研究SCR 催化剂对SO2/SO3转化率的影响,在250~400 ℃内进行实验.空气体积流量为400mL/min,SO2体积流量为20 mL/min(SO2体积分数5%),SCR 催化剂长度为25mm.实验采用的催化剂为电厂广泛应用的V2O5-WO3/TiO2型蜂窝催化剂,节距为5.0mm、壁厚为1.0mm.
图3 给出了不同温度下SCR 催化剂的SO2/SO3转化率.从图3 可以看出,SCR 催化剂在200℃时SO2/SO3转化率较低,为7.6%;当温度升高至400 ℃时,SO2/SO3转化率为13.8%,且在整个实验温度范围内呈现出良好的线性关系.
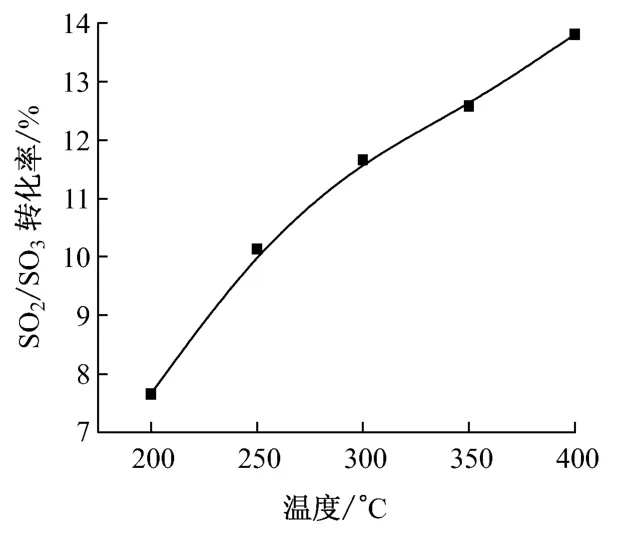
图3 不同温度下SCR 催化剂的SO2/SO3 转化率Fig.3 SO2/SO3conversion rate under the action of SCR catalyst at different temperatures
2.2 吸收剂表面特征
实验前,首先对4种吸收剂粉末的表面特征和微观特性进行分析,结果见表1.由表1 可以看出,Mg(OH)2的比表面积是其他3种吸收剂的4~50倍,高达55.712 6 m2/g,同时存在的微孔最多;Ca(OH)2的比表面积次之,几乎不存在微孔;MgO的比表面积居第三,几乎不存在微孔;CaO 的比表面积最小,存在的微孔数量最少.孔容积的比较结果与比表面积相似,Mg(OH)2的孔容积仍然最大,Ca(OH)2和MgO 的孔容积居中,CaO 的孔容积最小.
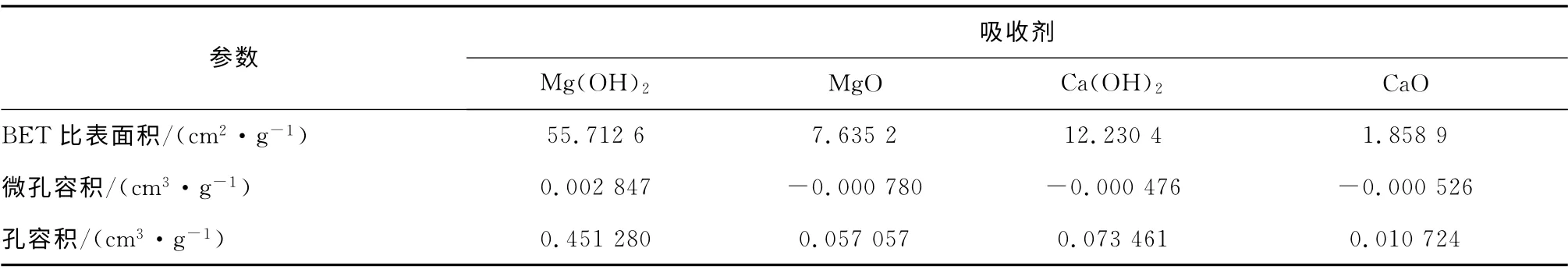
表1 4种吸收剂的表面特征分析结果Tab.1 Surface characterization of the four sorbents
2.3 温度对SO3 吸附特性的影响
图4给出了温度对镁基吸收剂吸附SO3特性的影响.从图4可以看出,温度从350 ℃升高到400℃时,2种吸收剂对SO3的吸附率均有所提高.在图4(a)中,取样初期,350 ℃时Mg(OH)2对SO3的吸附率为65.6%,而400 ℃时达到74.9%,吸附率明显提高.且在整个取样时间内,影响规律始终保持一致.在图4(b)中,取样初期,MgO 在350 ℃时SO3吸附率为50.5%,在400 ℃时SO3吸附率为61.2%,较350 ℃时提高11%左右.
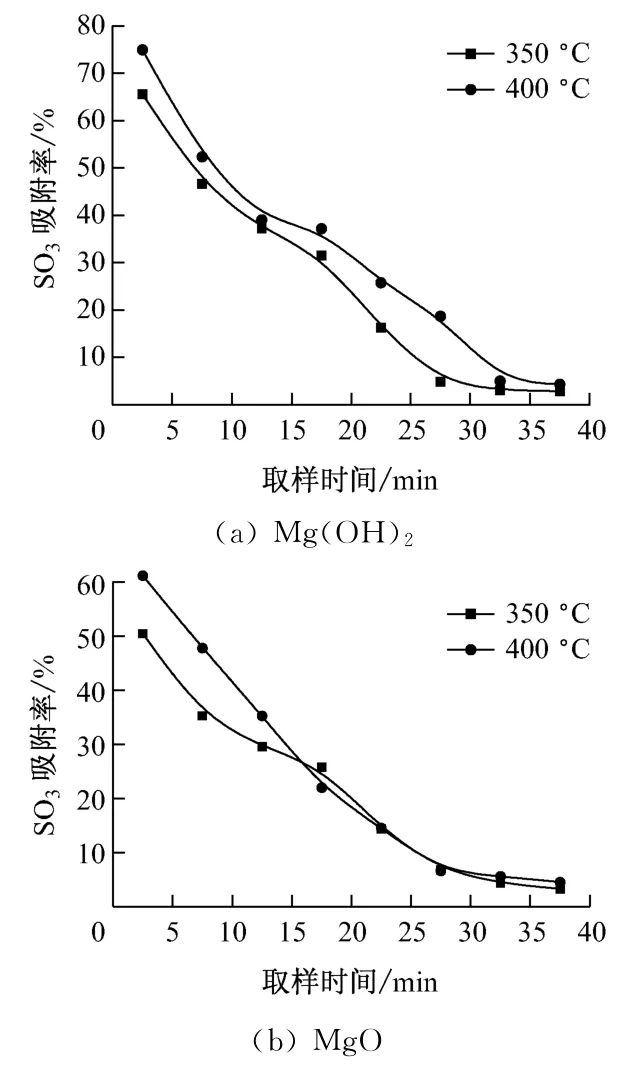
图4 温度对镁基吸收剂吸附SO3 特性的影响Fig.4 Effect of temperature on SO3adsorption by Mg-based sorbent
图5给出了温度对钙基吸收剂吸附SO3特性的影响.在图5(a)中,反应初期,温度对SO3吸附率的影响比较明显,350 ℃时为50.4%,400 ℃时为71.3%.在图5(b)中,与其他3种吸收剂相比,350℃时CaO 反应初期的SO3吸附率最小,为40.9%,其随温度升高而增大的趋势也最为明显.根据Arrhenius定律,温度越高,活化能越大,反应速率增加得越快,吸收剂在相同时间内吸附的SO3越多.
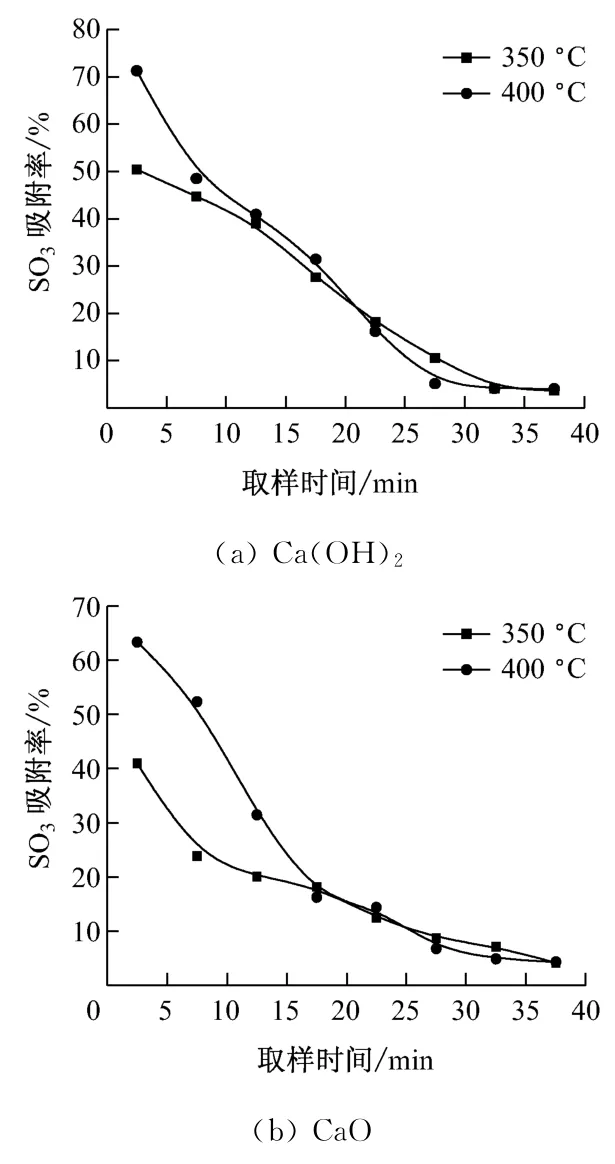
图5 温度对钙基吸收剂吸附SO3 特性的影响Fig.5 Effect of temperature on SO3adsorption by Ca-based sorbent
2.4 反应时间对SO3 吸附特性的影响
由图4和图5可以看出,各吸收剂的SO3吸附率均在前5min内较大,随着反应时间的推移,SO3吸附率逐渐降低,大约30 min 后趋于平缓,此时SO3吸附率低于10%,穿透曲线在此处有一个特别的拐点.这是由于在反应初期,影响吸附反应进行的主要因素是SO3与吸收剂的反应速率,因此SO3吸附率平稳减小;随着反应的进行,吸收剂表面形成了硫酸镁、硫酸钙,越来越厚的硫酸盐覆盖在吸收剂表面,阻碍了SO3与吸收剂的接触,限制了SO3的扩散.根据菲克定律,气体扩散速度与扩散系数和浓度梯度相关,而与温度关系不大.因此,在350 ℃和400 ℃时,穿透曲线的拐点出现的时间相近.
对于Mg(OH)2和MgO,生成的MgSO4的摩尔体积是Mg(OH)2和MgO 的2~3倍.这也使得Mg(OH)2和MgO 的孔隙变小,甚至堵塞,致密的产物同时阻碍了SO3与镁基吸收剂的反应.此时,反应开始进入第二阶段,即产物层扩散控制阶段.这一阶段的反应以离子扩散为主,即Mg2+通过MgSO4产物层界面向外扩散,这是一个体积膨胀的过程.同理,对于Ca(OH)2和CaO,CaSO4的摩尔体积约是Ca(OH)2和CaO 的2~3倍,CaSO4的生成明显阻碍了SO3吸附反应的进行.
2.5 不同吸收剂吸附效果的比较
在喷射吸收剂脱除SO3的实际应用中,吸收剂在炉内或烟道内的停留时间很短,因此笔者主要讨论反应初期各吸收剂的SO3吸附率.图6和图7分别给出了350 ℃和400 ℃下各吸收剂吸附SO3的对比曲线.
从图6 和图7 可以看出,在4 种吸收剂中,Mg(OH)2的吸附效果最佳,Ca(OH)2和MgO 的吸附效果差不多,CaO 的吸附效果最差.在400 ℃时,Mg(OH)2和Ca(OH)2的吸附效果要明显好于MgO 和CaO.吸收剂气固相吸附-脱附反应过程主要分为6个步骤[5],烟气中的SO3先扩散到吸收剂的外表面,再扩散到内部的微孔中,在微孔内表面发生吸附反应和脱附反应,脱附之后SO3又扩散到吸收剂的外表面,最终回到烟气中.SO3通过吸收剂层的扩散活化能约为40kJ/mol,扩散系数约为10-8cm2/s.因此,吸附率主要受晶内扩散控制,与吸收剂的粒径和孔隙率有关[6].通过比较实验中4种吸收剂的比表面积和孔容积,结果表明:吸收剂比表面积越大,微孔越多,扩散速度越快,SO3吸附率就越高.
目前,有关镁基、钙基吸收剂与SO3和H2SO4反应机理的研究还很少.当Mg(OH)2加热到350℃时会失去部分水生成MgO,所以镁基吸收剂与SO3的吸附反应可视为MgO 与SO3的反应.从化学反应活性进行分析,MgO 的物质活性远大于Ca(OH)2和CaO,Ca(OH)2的物质活性又大于CaO,所以镁基吸收剂对SO3的吸附效果一般高于钙基吸收剂[7].
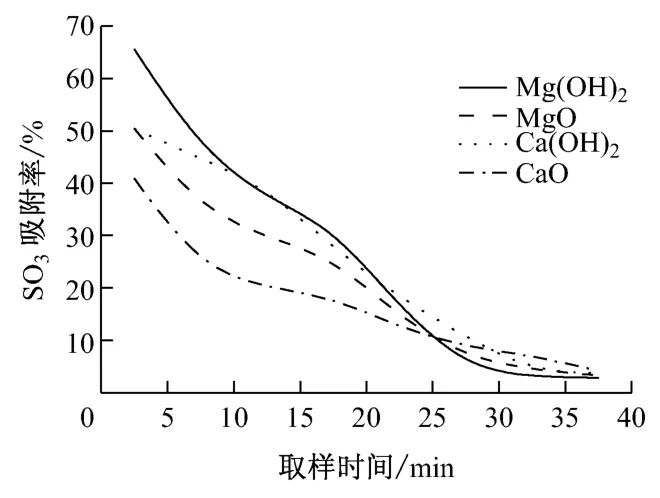
图6 350 ℃时不同吸收剂SO3 吸附率的对比Fig.6 SO3adsorption rate of different absorbents at 350 ℃
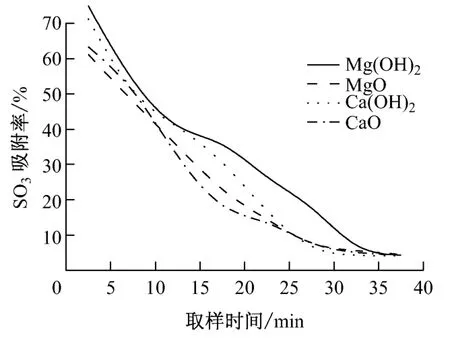
图7 400 ℃时不同吸收剂SO3 吸附率的对比Fig.7 SO3adsorption rate of different absorbents at 400 ℃
2.6 反应前后吸收剂的变化
实验所用吸收剂在反应前为分析纯,其中Ca(OH)2、Mg(OH)2和MgO 纯度均为98%,CaO的纯度为95%.对反应后的样品再进行表面形貌分析.由于混合气体中除了SO3外,还有大量的SO2被吸附,影响吸收剂的吸附效果.MgO 与SO2的反应速度很慢,一般可认为是惰性的.反应前后吸收剂的对比见图8~图11.
在中等放大倍数下观察反应前后镁基吸收剂的变化,反应前Mg(OH)2颗粒大小均匀,颗粒间隙较大,反应后出现了明显的大颗粒;反应前MgO 较为疏散,反应后团聚现象明显.
在较高放大倍数下观察反应前后钙基吸收剂的变化.在图10中,反应前Ca(OH)2表面晶粒间有许多孔隙结构,反应后晶粒间孔隙变小了.在图11中,反应前后CaO 变化比较大,反应前物质表面很圆润,反应后物质表面出现了许多细小晶粒,将表面微孔堵塞,使得SO3在其内部的扩散受阻.

图8 反应前后Mg(OH)2 的变化Fig.8 Microscopy analysis of Mg(OH)2before and after adsorption

图9 反应前后MgO 的变化Fig.9 Microscopy analysis of MgO before and after adsorption

图10 反应前后Ca(OH)2 的变化Fig.10 Microscopy analysis of Ca(OH)2before and after adsorption

图11 反应前后CaO 的变化Fig.11 Microscopy analysis of CaO before and after adsorption
3 结 论
(1)对于实验采用的商用SCR 催化剂,温度较低时,SCR 催化剂的SO2/SO3转化率较低,随着温度的升高,SCR 催化剂的SO2/SO3转化率也提高,且在反应温度范围内呈现良好的线性关系.
(2)对于镁基吸收剂Mg(OH)2和MgO 以及钙基吸收剂Ca(OH)2和CaO,在反应的初期,SO3吸附率随温度的升高而增大,而在反应后期,温度对SO3吸附效果的影响不明显.不同温度下,反应初期的5min内吸附率最大,随着反应的继续进行,吸附率快速减小,随后减小速度变慢,穿透曲线出现了明显的拐点.通过对350 ℃和400 ℃时4种不同吸收剂的吸附效果进行比较,结果表明:实验用4种吸收剂吸附SO3的效果依次为:Mg(OH)2>Ca(OH)2>MgO>CaO.
(3)反应前后,各吸收剂的表面特征均发生了变化.其中,反应后Mg(OH)2颗粒变大,但颗粒大小仍较为均匀,而反应后MgO 出现了明显的团聚现象;对于Ca(OH)2,反应后表面晶粒间孔隙变小,而CaO 反应前颗粒表面很圆润,反应后表面出现了许多细小晶粒.
[1]陈学婧,彭源长.中电联:电力行业节能减排能力持续增强[N].中国电力报,2012-03-02.
[2]MOSER R E.SO3's impacts on plant O&M:part I[J].Power,2006,150(8):10-15.
[3]ZHUANG Ye,LAUMB Jason,LIGGETT Richard,etal.Impacts of acid gases on mercury oxidation across SCR catalyst[J].Fuel Processing Technology,2007,88(10):929-934.
[4]刘鹤忠,陶秋根.湿式电除尘器在工程中的应用[J].电力勘测设计,2012(3):43-47.
LIU Hezhong,TAO Tiugen.Exploration application of wet electric dust catcher to engineering[J].Electric Power Survey &Design,2012(3):43-47.
[5]由长福,祁海鹰,王伟,等.中温烟气生石灰脱硫模型[J].燃烧科学与技术,2002,8(3):193-198.
YOU Changfu,QI Haiying,WANG Wei,etal.Model for sulphur absorption of middle temperature flue gas with lime[J].Journal of Combustion Science and Technology,2002,8(3):193-198.
[6]郝吉明,王书肖,陆永琪,等.燃煤二氧化硫污染控制技术手册[M].北京:化学工业出版社,2002.
[7]鲍颖群.三氧化硫催化生成及吸附的实验研究[D].西安:西安交通大学,2013.
