封闭群稀有鮈鲫对几种常见化学品的敏感性
2014-08-03吴本丽王剑伟中国科学院水生生物研究所湖北武汉430072中国科学院大学北京100049华中农业大学水产学院湖北武汉430070
吴本丽,曹 岩,罗 思,王剑伟 (1.中国科学院水生生物研究所,湖北 武汉 430072;2.中国科学院大学,北京 100049;3.华中农业大学水产学院,湖北 武汉 430070)
国际上对化学品的生产、进口及使用等均已形成了相应的许可制度和法律法规.我国对有毒化学品的进出口也进行了严格控制,先后颁布了《新化学物质环境管理办法》、《化学品测试导则》等法规和标准,要求新化学物质申报需“在中国境内用中国的供试生物完成的生态毒理学特性测试报告”.出于化学品环境管理和维护我国生态安全的需要,本土生物毒性测试技术体系成为亟待解决的问题.在我国化学品毒性测试推荐的试验用鱼中,稀有鮈鲫(Gobiocypris rarus)是唯一的我国特有鱼种,有关其毒性测试的国家标准正在研究中.
稀有鮈鲫是一种小型鲤科鱼类,因具有生长周期短、产卵批次多等生物学特征使其成为一种理想的实验鱼材料[1],现已广泛应用到胚胎学、遗传学、毒理学等多个领域,尤其是在环境毒理学研究方面[3-8].过去我国所用的稀有鮈鲫实验鱼,多是野生个体的后代,无明确繁育体系和品系背景.为了促进实验用鱼来源和种源的标准化,中国科学院水生生物研究所先后建立了稀有鮈鲫的近交系(HAN)和封闭群(Ihb:IHB)[9-12].封闭群是指在不从外部引入新个体的条件下,以非近亲交配的方式至少繁殖 4代以上而得到的实验动物群体[13].由于封闭群动物遗传组成较接近于自然状态下的动物群体结构,就个体而言,封闭群动物在遗传上具有高度的杂合性;就整体而言,封闭群的遗传特性又保持相对稳定,因此封闭群十分适合生态毒理学研究和毒性测试[14].对稀有鮈鲫封闭群的生物学及遗传质量监测表明,封闭群与野生种群在形态特征、脏器系数以及生长和繁殖指标上均无明显差异,且保持了野生群体的遗传多样性,各代间遗传特性也比较稳定[12].然而关于稀有鮈鲫封闭群对化学品的敏感性还缺乏研究,该群体是否可作为化学品测试的种源尚需实验验证.本文选择重铬酸钾、五氯酚、氯化汞、对氯苯胺、氯化镉等几种常见的具有危害性的化学品进行毒性测试,以此来评价IHB应用于毒性测试的敏感性和适宜性,为促进稀有鮈鲫毒性测试技术体系的标准化及应用提供参考.
1 材料与方法
1.1 受试生物
稀有鮈鲫野生群(WG)于2011年10月采自四川汉源县,体长为(26.5±2.3)mm,体重(0.292±0.02)g,实验前在室内驯养 2周以上.封闭群稀有鮈鲫为中国科学院水生生物研究所培养的 IHB第 6 代个体,体长(25.7±1.9)mm,体重(0.267±0.01)g;用于 7d亚慢性毒性测试和胚胎-卵黄囊吸收阶段试验的受精卵和仔鱼均来自该封闭群.
1.2 实验用水及化学药品
实验中所用稀释水采用分析纯和去离子水配制,总硬度为(250.4±20)mg/L,以 CaCO3计(GB 7477-87).重铬酸钾(K2Cr2O4,基准工作试剂,99.95%~100.05%,中国国药上海化学试剂公司),储备液浓度10g/L,浓度以Cr6+计.五氯酚(PCP,分析纯,>99%,美国 Sigma公司),用二甲基亚砜(DMSO)配制成10.0g/L,现配现用.氯化汞(HgCl2,分析纯,≥99.5%,贵州省铜仁市云场坪化工矿产经营部),储备液浓度 1.0g/L,浓度以 Hg2+计.对氯苯胺(ClC6H4NH2,分析纯,98%,ACROS ORCANICS 公司),储备液用丙酮配制成 1.0g/L.氯化镉(Cadmium Chloride,CdCl2,分析纯,100%,ACROS ORCANICS 公司),储备液浓度10.0g/L,浓度以Cd2+计.
1.3 实验控制条件
急性毒性试验容器为 20cm×20cm×20cm规格的无缝玻璃缸,实测承载量约 0.5g/L.亚慢性毒性试验容器为直径 12cm 的玻璃结晶皿,容积约500mL.试验容器均浸泡在水浴中,实测温度为(25.2±0.20)℃;试验期间光暗周期 12h:12h;试验水体溶氧为 7.02~7.85mg/L, pH 7.35~8.19.
1.4 实验方法
1.4.1 96h急性毒性测试 参考《化学品测试方法》[15],通过观察实验过程中受试鱼的反应和死亡情况等,分析稀有鮈鲫对几种常见化学品的敏感程度.实验前将受试鱼置于实验相同条件下暂养7d,暂养期间每天投喂2次,实验前1d停止投喂,实验期间不投喂.实验开始按低浓度到高浓度的顺序随机并快速的将受试鱼转入实验缸,转移过程在15min以内,初放入30min内持续观察,其后每1h观察一次,12h后根据受试鱼的实际反应情况适当延长观察时间间隔.每隔 24h按低浓度到高浓度顺序更换一半实验液,更换前后测定pH值、溶氧等水质指标.记录实验期间不同药物浓度下实验鱼的异常反应、死亡情况、水质变化等,并及时捞出死亡个体.
通过预实验确定受试鱼全部死亡的最低浓度和全部存活的最高浓度,以此来设置正式实验浓度范围,按几何级数设置试验浓度组(表 1).为了进行直观比较,野生群和封闭群对比实验采用相同的浓度梯度;由于野生个体数量有限,故未对其开展 Cd2+和对氯苯胺急性毒性试验.预实验规模为5尾/缸,不设平行组;每个实验容器盛放实验液5L,正式实验10尾/缸.每个浓度设置3个平行,并设空白对照.其中五氯酚实验增加助溶剂DMSO对照组,各组用DMSO配平使助溶剂一致,实验液中最终助溶剂添加量为0.015mL/L.
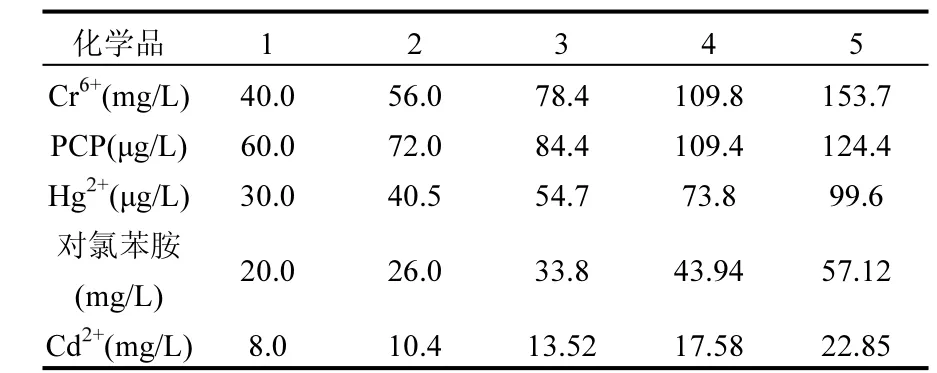
表1 96h急性毒性测试浓度梯度Table 1 The concentration gradient of 96h acute toxicity test
1.4.2 胚胎-卵黄囊吸收阶段毒性测试 参照《化学品测试方法》和OECD鱼类胚胎-卵黄囊吸收阶段的短期暴露试验方法进行[15-16].解剖镜下观察胚胎早期发育,取受精成功 8h(约原肠胚期)的胚胎进行实验.对氯苯胺浓度组分别为1.0,2.0,4.0,8.0,16.0,32.0mg/L及对照组, Cd2+浓度组分别为0.05,0.10,0.20,0.40,0.80mg/L及对照组,同一浓度设3个平行.每个结晶皿盛放400mL实验液,随机放入30枚受精卵,每24h更换一次实验液.观察记录各实验容器中的死亡受精卵和仔鱼数及仔鱼的畸形情况,并及时挑出死亡个体.实验进行到某一浓度组卵黄囊被完全吸收时结束,实验周期 7~8d,实验期间不投喂.实验结束时存活个体用100mg/L的MS-222麻醉后测量体长,记录畸形情况;安乐死后的仔鱼在104 ℃下6h烘干后用1/105g电子天平称量干重.
1.4.3 7d亚慢性毒性测试 参照 USEPA黑头软口鲦7d亚慢性毒性试验[17]及有关稀有鮈鲫的亚慢性毒性试验文献进行[3,13].实验用鱼为孵化后1d表现正常的仔鱼,一次实验采用同对亲鱼所产的同批鱼卵孵化的仔鱼.实验所用换水方法及实验浓度设计与胚胎-卵黄囊吸收阶段毒性测试相同.每个实验容器盛放受试仔鱼 15尾,每天投喂2次丰年虫无节幼体,投喂30min后清除残饵,将死鱼挑出并作记录,实验持续 7d,实验结束前12h停止投喂,将各试验容器存活个体麻醉,在解剖镜下测量体长;安死后的仔鱼在104 ℃下6h烘干后用1/105g电子天平称量干重.
1.5 数据分析
实验所得数据采用SPSS16.0软件进行分析,主要得出24,48,72,96h的半致死浓度及95%置信区间等,采用经验公式推算安全浓度,SC=0.1×96h LC50,通过t检验比较不同化学品对不同来源稀有鮈鲫半致死浓度的差异性.采用单因素方差分析(one-way ANOVA)和Dunnett’S多重比较得出各组孵化率、仔鱼畸形率、累计死亡率、体长和体重的差异等.数据分析中所用浓度为设置浓度.
2 结果
2.1 急性毒性测试
2.1.1 中毒表现 急性毒性试验的对照组均未发现死亡和行为异常的情况,某些暴露组中的实验鱼出现了明显的中毒症状.重铬酸钾暴露时鱼体出现了浮游水面、呼吸急促等类似浮头的现象,其后鱼动作迟缓,身体逐渐失去平衡,各鳍从端部向根部渐渐溃烂、甚至脱落.五氯酚、对氯苯胺、氯化汞和氯化镉暴露时的中毒表现与此类似,所不同的是实验鱼死亡时,身体有不同程度的弯曲,颌及鳃盖多呈张开状态,鳍基部有充血现象等.
将急性毒性测试后的存活个体放入标准稀释水中饲喂观察7d,其中重铬酸钾实验中出现明显中毒症状的个体在 7d内基本死亡,损伤无法恢复;未出现死亡情况的低浓度组个体基本存活,但活动能力较对照组弱.氯化汞实验高浓度组的存活个体有部分死亡,少量存活,低浓度组存活个体基本存活.PCP实验各个浓度的存活个体在放入标准稀释水中饲喂后基本能存活,且活动状态良好.
2.1.2 反应时间 稀有鮈鲫对不同药物的反应时间有所不同,封闭群和野生群对同一种药物的反应时间也有所不同.在不同浓度 PCP暴露下,野生群和封闭群受试个体死亡基本都发生在实验开始 48h内;而对于重铬酸钾和氯化汞,在8~96h内均有个体死亡的情况发生(表2).
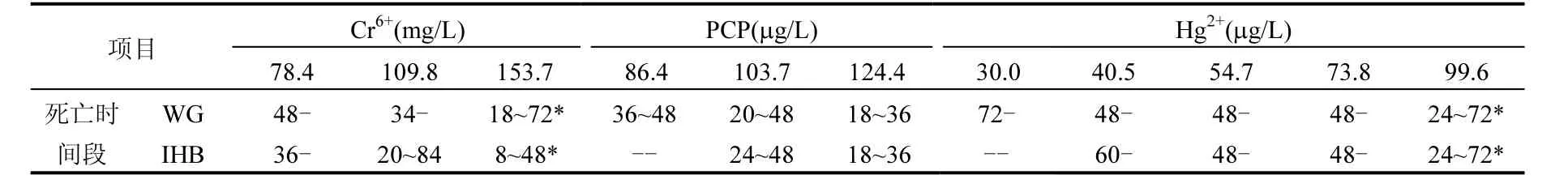
表2 稀有鮈鲫野生群和封闭群对3种化学品的急性毒性反应时间(h)Table 2 The response time of wild group and Ihb:IHB under different chemicals in 96h acute toxicity test (h)
2.1.3 效应浓度 由于实测浓度在设置浓度的 90%~110%范围内,因此直接按设置浓度计算LC50和SC(表3).稀有鮈鲫对5种化学品的敏感性从高到低的顺序为Hg2+> PCP > Cd2+> 对氯苯胺 > Cr6+.对比野生群和封闭群在同一浓度梯度下不同时间的半致死浓度,只有重铬酸钾暴露下有所差异(P<0.05),Hg2+和 PCP无明显差异(P>0.05).总体看来,稀有鮈鲫封闭群对上述 3种化学药品的敏感性不亚于野生群(表 3).

表3 稀有鮈鲫野生群和封闭群对几种化学品的半致死浓度及95%置信区间Table 3 The LC50 and 95% confidence interval of acute toxicity test on wild group and Ihb:IHB respectively
2.2 胚胎-卵黄吸收阶段及7d亚慢性毒性测试
2.2.1 中毒表现 对氯苯胺实验中胚胎时期出现胚胎发育迟缓、仔鱼畸形等情况.畸形仔鱼的表现有:脊柱弯曲、卵黄囊吸收延迟鳔充气延迟或鳔不充气、围心腔水肿、难以自由游动,活动能力差等.氯化镉对稀有鮈鲫胚胎和仔鱼产生致畸和致死作用,畸形主要表现与对氯苯胺实验相似,如脊柱C形或S形弯曲等.
2.2.2 毒性效应 胚胎-卵黄囊吸收阶段毒性测试中,从仔鱼畸形率看,对氯苯胺1.0~4.0mg/L浓度组与对照组均无显著性差异,8.0,16.0和32.0mg/L浓度组与对照组差异显著.随浓度升高,仔鱼的畸形率会明显上升,由畸形率确定的最低无抑制浓度(NOEC)、最低有影响浓度(LOEC)和最大容许浓度(MATC)分别为 4.0,8.0和 5.66mg/L.从实验结束时仔鱼的平均体长和平均体重来看,1.0和2.0mg/L浓度组与对照组均无显著性差异,4.0mg/L浓度组开始与对照组之间差异显著,由此确定的NOEC、LOEC和MATC分别为2.0,4.0,2.83mg/L(表4).7d亚慢性毒性测试中,从死亡率情况来看,1.0~8.0mg/L浓度组与对照组之间无显著性差异,16.0,32.0mg/L浓度组与对照组之间差异显著.从试验结束时仔鱼的平均体长和干重的情况来看,1.0~4.0mg/L浓度组与对照组之间无显著性差异,8.0~32.0mg/L浓度组与对照组之间差异显著(表5),随着对氯苯胺浓度的增加,稀有鮈鲫仔鱼的死亡率增大,生长也受到非常明显的影响.由死亡率确定的NOEC、LOEC和MATC分别为 8.0,16.0,11.31mg/L,由仔鱼的平均体长和平均体重确定的NOEC、LOEC和MATC分别为4,8,5.66mg/L.
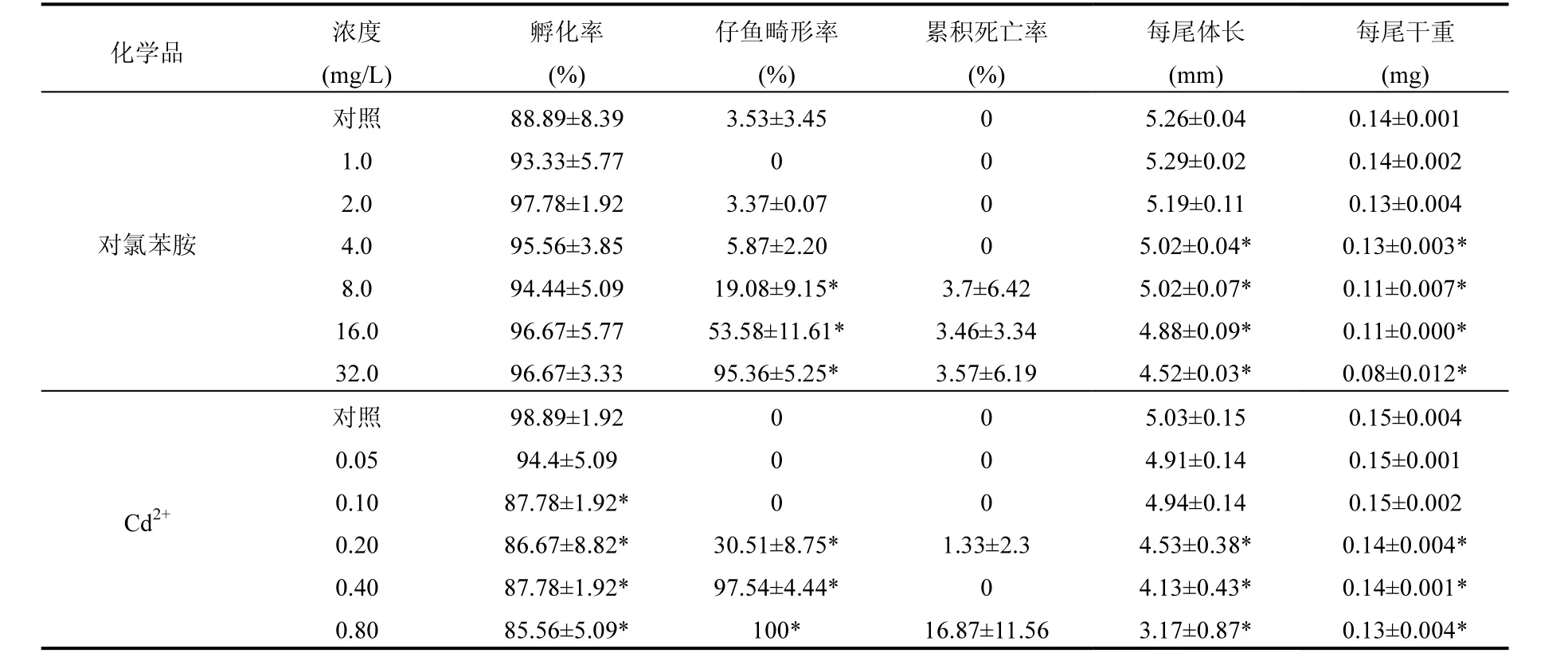
表4 对氯苯胺和氯化镉对封闭群稀有鮈鲫胚胎-卵黄囊吸收阶段毒性测试结果Table 4 Effect of p-Chloroaniline and CdCl2on hatching rate, abnormality rate, mortality and growth of G.rarus

表5 对氯苯胺和氯化镉对封闭群稀有鮈鲫的7d亚慢性毒性影响Table 5 Effects of p-Chloroaniline and CdCl2 on mortality and growth under 7-day subchronic toxicity test on larvae
当胚胎-卵黄囊吸收阶段暴露于不同浓度的氯化镉时,孵化率在0.05mg/L浓度组与对照组间无显著性差异(P>0.05),0.10mg/L浓度组开始与对照组差异显著;当浓度为0.05mg/L和0.1mg/L时仔鱼畸形率与对照组无显著性差异,0.20~0.80mg/L浓度组与对照组之间存在显著差异,从实验结束时仔鱼的平均体长和平均体重来看,0.05和0.10mg/L浓度组与对照组均无显著性差异,0.20mg/L浓度组开始与对照组之间差异显(表4);由畸形率和生长确定NOEC、LOEC和MATC均为0.10,0.20,0.14mg/L;7d亚慢性测试中,由0.2mg/L浓度组开始至0.8mg/L浓度组仔鱼的平均体长和干重与对照组有显著性的差异,随着镉离子浓度的升高,仔鱼的生长受到很明显的影响(表 5),由此推算的NOEC、LOEC和 MATC分别为 0.10,0.20,0.14mg/L.
3 讨论
3.1 急性毒性测试
结果表明,封闭群稀有鮈鲫对几种化学品参比物的敏感性不亚于其他常见实验鱼种[2,18-22].将本实验结果与2006年重铬酸钾和五氯酚对稀有鮈鲫毒性测试数据进行比较发现,其半致死浓度与本试验结果没有明显差异.2006年进行重铬酸钾和五氯酚的急性毒性测试的受试鱼为实验室繁育的普通后代(图1),说明稀有鮈鲫封闭群作为受试鱼进行毒性测试的敏感性较高且稳定,并有着有良好的重复性和可操作性.
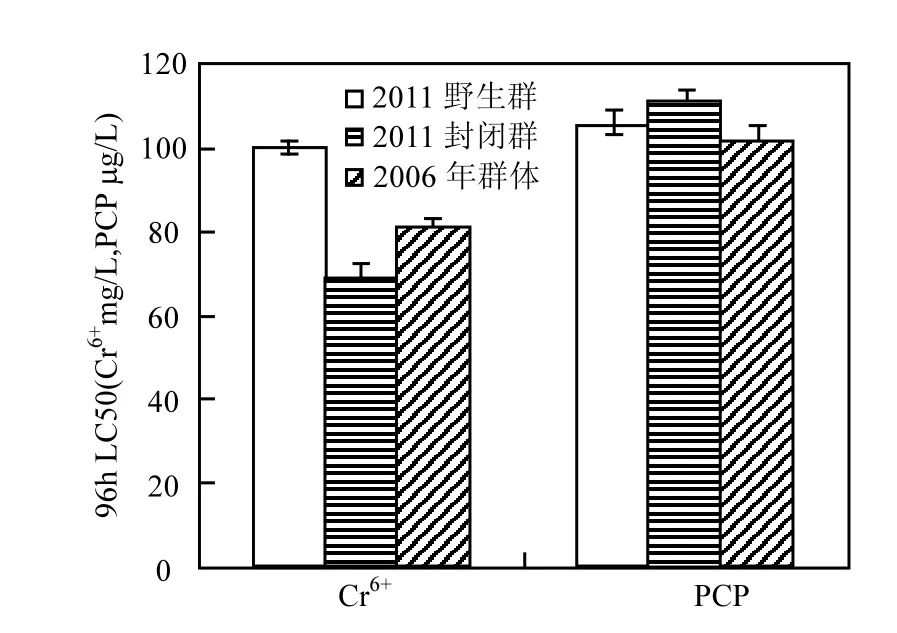
图1 2011年野生群和封闭群与2006年野生群后代对重铬酸钾和五氯酚96h半致死浓度对比Fig.1 The 96h LC50of wild group, Ihb:IHB and offspring of wild group respectively in 2011and 2006 on Cr6+and PCP
20世纪 70年代关于金鱼和黑头软口鲦对PCP的急性毒性试验表示,在一定范围内,不同年龄、不同规格受试鱼的半致死浓度相差不大[23].在本实验中,稀有鮈鲫也存在相似情况,野生群个体大小差异相对较大,日龄不确定,在同一个暴露浓度下,死亡情况随机发生,与受试鱼个体大小没有明显关系.周永欣等[4]对 2~24d稀有鮈鲫进行急性毒性测试显示,2,12,24日龄稀有鮈鲫对PCP的 96h LC50分别为 103.3,70.1,113.2μg/L;对 30日龄,体长为(9.5±2)mm的稀有鮈鲫进行PCP的96h毒性测试得到 LC50为 81μg/L[21],对超过 2月龄体长为(20±3)mm的稀有鮈鲫96h LC50为101.5μg/L[18],本研究野生群受试鱼体长为(26.5±2.3)mm,封闭群受试鱼体长为(25.7±1.9)mm(均大于 2月龄),对 PCP的 96h LC50分别为 105.6,111.5μg/L.总体看来,不同日龄和不同个体大小的稀有鮈鲫对PCP的敏感性存在一定差异,但对于30日龄以上的实验鱼,LC50的差异并不大.
事实上,在化学品测试的应用中,除了敏感性外,可重复性和可操作性也是测试技术体系需要关注的问题.已有研究表明,稀有鮈鲫的早期发育大致需要1个月左右,在这期间,仔鱼的器官逐渐发育,化学品可能对某些阶段的发育影响较大[24],当使用30日龄以下的仔鱼进行实验时,不同大小(日龄)的个体处于不同的发育期,容易导致结果的差异.而 1~3月龄的稀有鮈鲫,除了性腺之外,各器官均已发育完成,对化学品的敏感性相对稳定,适合用于毒性测试.考虑到在饲养、运输以及实验操作等方面的便利性,作者建议采用全长(30±10)mm(相应的体长为24mm左右)的鱼作为96h急性毒性测试用鱼.
3.2 胚胎-卵黄囊吸收阶段及 7d亚慢性毒性测试
胚胎-卵黄囊吸收阶段和 7d亚慢性毒性测试都属于短期暴露试验(表6),以鱼类的早期生活史阶段为材料,观测致死和亚致死毒性效应.对于稀有鮈鲫而言,这2个试验试验周期相近,但试验鱼所处的发育期不尽相同,因而在可操作性、观测指标等方面有一些差异.胚胎-卵黄囊吸收阶段毒性测试以卵黄囊吸尽为终点,通常包括胚胎期 3d和卵黄囊仔鱼期 4d,试验的观测指标主要包括孵化率,畸形率、死亡率、平均体长和干重等.7d亚慢性毒性测试的实验起点为初孵不久的仔鱼,试验周期 7d,实际包括卵黄囊仔鱼期 3~4d以及晚期仔鱼3~4d,试验周期内仔鱼由内源性营养转为外源性营养,成功摄食是仔鱼进一步发育和存活的关键[24-25].7d亚慢性毒性测试的观测指标主要包括死亡率、平均体长和干重等.胚胎期可能对有毒物质十分敏感,但是在亚慢性毒性测试中,其毒性效应不一定能从孵化率、胚胎畸形率等表观指标上反映出来.本研究的结果表明,除对 Cd2+的试验中孵化率指标较为敏感外,其余试验中均以生长指标(平均体长和干重)最为敏感,且2种亚慢性毒性测试的灵敏度相当.此外,从本文的结果以及文献数据来看[18,26-27],生长指标的灵敏度要高于死亡率指标,而平均体长和干重所确定的效应浓度基本相同.本研究表明,体长指标是稀有鮈鲫亚慢性试验中最方便的观测指标,与胡炜等[26]研究结果一致.
从实验的操作性来看,胚胎卵黄囊吸收阶段试验的起点为受精卵,一般在受精后8h内即开始试验,通常需要实验室专门饲养亲鱼才能进行该试验,对于小型实验室而言,实验存在成本和技术上的难题;而且,由于稀有鮈鲫卵具有较强的粘性,在分组等操作时既费时又容易导致受精卵损伤,从而影响实验结果.7d亚慢性毒性测试一般从孵出后 24h内开始实验,受精卵或仔鱼可以从繁育中心运抵实验室,因而材料获取上更为广泛.与胚胎卵黄囊吸收阶段试验相比,7d亚慢性毒性测试需正常饲养的方式投喂丰年虫幼体,在丰年虫卵的来源与保存、孵化方法、投喂操作等方面没有制约性的困难.因为投喂了食物,对照组或未受到毒性影响的仔鱼生长较快,从生长指标上观测毒性效应更为方便;同时,仔鱼的摄食率也可能成为潜在的观测指标.目前,在《化学品测试方法》以及已经颁布的有关化学品生态毒理学测试标准中考虑了胚胎卵黄囊吸收阶段试验,但未纳入7d亚慢性毒性试验,因此,后者更具有可操作性和推广前景,应加强稀有鮈鲫亚慢性毒性试验方法的优化,制定相关的技术规范和标准.

表6 胚胎-卵黄囊吸收阶段和7d亚慢性毒性测试的比较Table 6 The comparison of short-term toxicity test on embryo and sac-fry stages and 7-day standard reference toxicant test
4 结论
4.1 急性毒性试验结果表明,稀有鮈鲫封闭群(IHB)对Hg2+、五氯酚、 Cd2+、对氯苯胺和Cr6+等化学品敏感,对Hg2+、PCP和Cr6+的敏感性不亚于野生群体.对 PCP、Cr6+的实验结果重现性较好.
4.2 胚胎-卵黄囊吸收阶段和7d亚慢性毒性测试结果表明,Cd2+和对氯苯胺暴露后封闭群在孵化率、畸形率、死亡率、生长等方面均表现出毒性效应,其中体长生长指标较敏感并方便观察.两种试验的灵敏度相近,7d亚慢性毒性测试更具有可操作性和推广前景.
4.3 稀有鮈鲫封闭群 IHB适合于作为化学品生态毒理学测试的种源.使用封闭群作为测试生物,有助于在种源、种质、繁育及供应等方面促进稀有鮈鲫毒性测试技术体系的标准化,提高测试质量.
[1]曹文宣,王剑伟.稀有鮈鲫-一种新的鱼类实验动物 [J].实验动物科学与管理, 2003,S1:96-99.
[2]周永欣,成水平,胡 炜,等.稀有鮈鲫-一种新的鱼类毒性实验材料 [J].动物学研究, 1995a,16(1):59-63.
[3]周永欣,成水平,胡 炜.稀有鮈鲫(Gobiocypris rarus)7d亚慢性毒性试验 [J].环境科学学报, 1995b,15(3):375-380.
[4]MA-Taowu, WANG-Zijian, LIU-Jiankang.Endocrine disrupting effects on Chinese rare minnow (Gobiocypris rarus) fed with field collected Limnodrilus sp.[J].Journal of Environmental Sciences,2004,16(5):784-787.
[5]周群芳,傅建捷,孟海珍,等.水体硝基苯对日本青鳉和稀有鮈鲫的亚急性毒理学效应 [J].中国科学 B辑:化学, 2007,37(2):197-206.
[6]骆坚平,马 梅,刘 操,等.用沉积物、稀有鮈鲫和生物模拟采样器评价水体中PAHs和OCPs的生物富集和有效性 [J].环境科学, 2009,30(2):610-615.
[7]LI-Wei, ZHA-Jinmiao, LI-Zhaoli et al.Effects of exposure to acetochlor on the expression of thyroid hormone related genes in larval and adult rare minnow (Gobiocypris rarus) [J].Aquatic Toxicology, 2009,94:87-93.
[8]YUAN-Cong, ZHANG-Yingying, HU-Guojun et al.Expression of two zona pellucida genes is regulated by 17alphaethinylestradiol in adult rare minnow Gobiocypris rarus [J].Comparative Biochemistry and Physiology C-Toxicology and Pharmacology, 2013,158(1):1-9.
[9]王剑伟,王 伟,崔迎松.野生和近交稀有鮈鲫的遗传多样性 [J].生物多样性, 2000,8(3):241-247.
[10]LIAO-Xiaolin, WANG-Dang, YU-Xiaomu, et al.Characterization of novel microsatellite loci in rare minnow(Gobiocypris rarus) and amplification in closed related species in Gobioninae [J].Conserv.Genet., 2007,8:1003-1007.
[11]邵 燕,王剑伟,何勇凤,等.稀有鮈鲫近交系微卫星多态性分析[J].水生生物学报, 2009,33(4):650-655.
[12]顾党恩,王剑伟.应用微卫星标记对稀有鮈鲫封闭群建群过程中的遗传监测 [J].水生生物学报, 2012,36(2):197-203.
[13]方叶喜,邢瑞昌,贺争鸣.实验动物的遗传质量控制 [M].北京:中国标准出社, 2008:126-150.
[14]贺争鸣,李冠民.动物实验替代方法概论 [M].北京:学苑出版社, 2008,257-263.
[15]国家环境保护总局《化学品测试方法》编委会.化学品测试方法 [G].北京:中国环境科学出版社, 2004:188-237.
[16]Guideline for testing of chemicals 212: fish, short-term toxicity test on embryo and sac-fry stages.OECD, 2001 [S].
[17]Environmental response team standard operating procedures 7-day standard reference toxicant test using larval pimephales promelas.USEPA 2006 [S].
[18]姜福全.稀有鮈鲫急性、亚慢性毒性试验方法及其在东湖底泥毒性研究中的应用 [D].武汉:中科院水生生物研究所, 2007.
[19]潘厚军,吴淑勤,黄志斌,等.不同体征规格、性别的剑尾鱼对重铬酸钾和马拉硫磷的敏感性试验 [J].淡水渔业, 1996,26(增刊):83-871.
[20]卢 玲,沈英娃.酚类、烷基苯类、硝基苯类化合物和环境水样对剑尾鱼和稀有鮈鲫的急性毒性 [J].环境科学研究, 2002,15(4):57-59.
[21]宋志慧,王庆伟,杨鲁娜,等.三苯基锡和五氯酚对斑马鱼急性毒性作用和过氧化物酶活性的影响 [J].安徽农业科学, 2011,39(20):12202-12204.
[22]端正花,张斌田,朱 琳.双酚A对斑马鱼胚胎发育阶段的毒性及生物蓄积 [J].中国环境科学, 2008,28(3):260-26.
[23]Adelman I R, Smith L L, Siesennop G D.Effect of size or age of goldfish and fathead minnows on use of pentachlorophenol as a reference toxicant [J].Water Research, 1976,10(8):685-687.
[24]王剑伟,宋天祥,曹文宣.稀有鮈鲫胚后发育和幼鱼生长的初步研究 [J].水生生物学报, 1998,22(2):128-134.
[25]王剑伟,乔 晔,陶玉玲.稀有鮈鲫仔鱼的摄食和耐饥饿能力 [J].水生生物学报, 1995,19(2):97-103.
[26]胡 炜,成永平,周永欣.稀有鮈鲫亚慢性毒性试验 [J].水生生物学报, 1998,22(4):336-340.
[27]王朝晖,尹伊伟,许忠能,等.8种拟除虫菊酯农药对稀有鮈鲫的急性、亚慢性毒性研究 [J].应用与环境生物学报, 1998,4(4):379-382.
