氮磷限制条件下螺旋鱼腥藻产生土嗅素特征研究
2014-08-03贾晓燕储昭升胡小贞中国环境科学研究院湖泊环境创新基地环境基准与风险评估国家重点实验室北京0002北京科技大学土木与环境工程学院北京00083
贾晓燕,刘 聪,2,储昭升*,庞 燕,胡小贞 (.中国环境科学研究院湖泊环境创新基地,环境基准与风险评估国家重点实验室,北京 0002;2.北京科技大学土木与环境工程学院,北京 00083)
随着人类生活水平的不断提高,对水质量的要求越来越高,水体异味已成为研究关注的重点.异味问题广泛存在于各类淡水水体中,早在1883年就出现了有关水体异味的报道[1].已有研究表明了产生水体异味的主要原因[2]是水体富营养化,在富营养化水体中,由于营养物质过剩,藻类过度生长,由藻类代谢和腐烂分解产生的异味物质是水体中异味物质的主要来源.土霉味是淡水水体中存在最广泛、且最难闻的异味.引起水体土霉味的主要物质之一是土嗅素[3-5].螺旋鱼腥藻是一种常见的土嗅素产生藻.影响螺旋鱼腥藻产生土嗅素的因素主要有温度[6]、光照[7]和营养盐[8-9].
目前国内关于水体异味及土霉味的研究主要集中在异味的分布及原因分析[10-12],异味物质的检测技术[13-14]及水体异味的防治措施[15-16]等方面,开展室内模拟实验,分析水体中氮磷含量对藻类生长及产生异味物质影响的研究鲜有报道.本文通过研究在氮限制和磷限制条件下,藻细胞密度、叶绿素 a的合成以及土嗅素产生量等,探讨氮限制和磷限制对螺旋鱼腥藻生长、土嗅素生成及释放的影响,为更好的预测和控制鱼腥藻水华暴发和预防由此产生的异味事件提供参考.
1 材料与方法
1.1 藻种及培养
本实验所用螺旋鱼腥藻从河北省秦皇岛市洋河水库分离获得,在中国环境科学研究院藻类培养室进行培养.采用 M11培养基[17](mg/L:NaNO3100, K2HPO410, MgSO4·7H2O 75,CaCl2·2H2O 40, Na2CO320, Na2EDTA·2H2O 0.1),在温度 26℃,光照强度 2500lx、光暗比 12h:12h的条件下培养.
1.2 培养实验
本实验在10L的玻璃瓶中分为2组进行,分别为缺氮条件和缺磷条件,每组设置两个平行.在每个培养瓶中加入8L M11培养基和200mL的洋河水库底泥滤液,其中氮限制控制氮的浓度为1/10M11培养基,则氮的浓度为 1.647mg/L(N:P=0.93);而磷限制则控制磷的浓度为 1/10M11培养基,则磷的浓度为 0.178mg/L(N:P=92.53),然后用高压灭菌锅在121℃下灭菌30min.
藻种在接种前分别在缺氮和缺磷的M11培养基中进行3d的饥饿培养.在无菌条件下接种至10L玻璃瓶中,接种量为 5×103cells/mL,培养时曝气量为2.5L/min.藻细胞密度和叶绿素a每5d取样进行分析,异形胞和土嗅素含量每3d取样进行分析.
1.3 测定方法
藻细胞密度和异形胞用浮游植物计数板在光学显微镜下测定,每个样品计数3次.土嗅素采取固相微萃取(美国 Supelco公司)与 HP7890/5975气相色谱-质联用仪(美国Agilent公司)进行测定[18].用玻璃纤维滤膜(Whatman GF-C)对藻液进行过滤后测定胞外土嗅素,用未过滤的藻液测定土嗅素总量.胞内土嗅素含量为土嗅素总量减去胞外土嗅素含量.叶绿素a采用玻璃研磨器,丙酮提取,分光光度法测定[19].总氮和溶解性总氮采用过硫酸钾氧化,紫外分光光度法测定[20];总磷和溶解性总磷采用过硫酸钾氧化,钼锑抗分光光度法测定[21].
2 结果
2.1 螺旋鱼腥藻的生长特征
螺旋鱼腥藻在磷限制条件下的生长受到抑制,生长迟缓,而在氮限制条件下迅速进入一个相对较快的生长期(如图 1所示).磷氮限制条件下最大藻细胞密度分别为 5.48×104,2.26×105cells/mL,后者是前者的4倍.
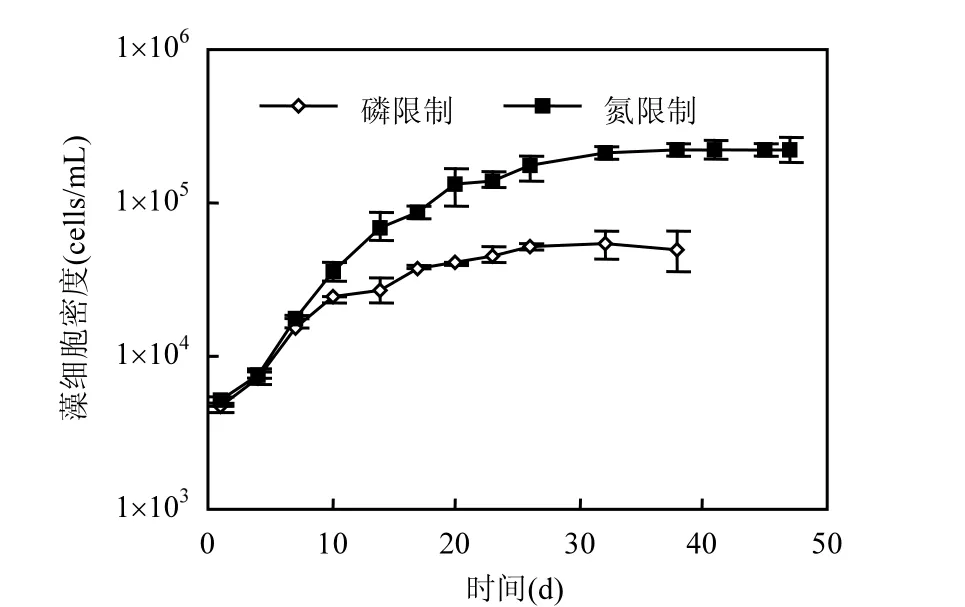
图1 螺旋鱼腥藻的生长曲线Fig.1 Growth curves of Anabaena sp.population

图2 氮限制条件下异形胞形成的百分比Fig.2 Ratios of heterocyst under nitrogen-limited condition
螺旋鱼腥藻在磷限制下几乎不生成异形胞,在氮限制下则极易生成异形胞.在螺旋鱼腥藻培养到第20d后异形胞形成比例为3.5%~4.4%(如图2所示).
2.2 土嗅素生成量的变化趋势
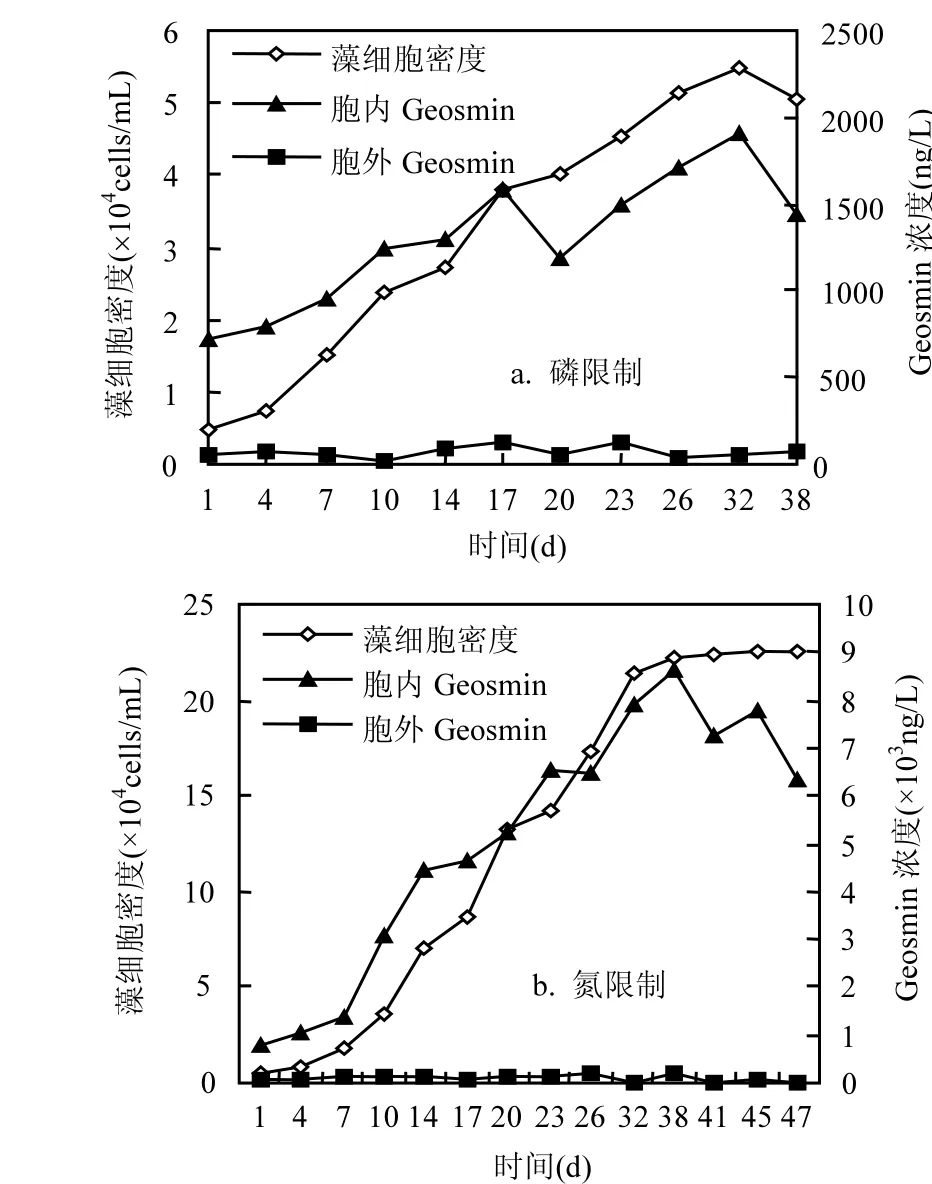
图3 磷氮限制条件下土嗅素浓度的变化趋势Fig.3 Varietion of geosmin concentration under phosphoruslimited condition and nitrogen-limited condition
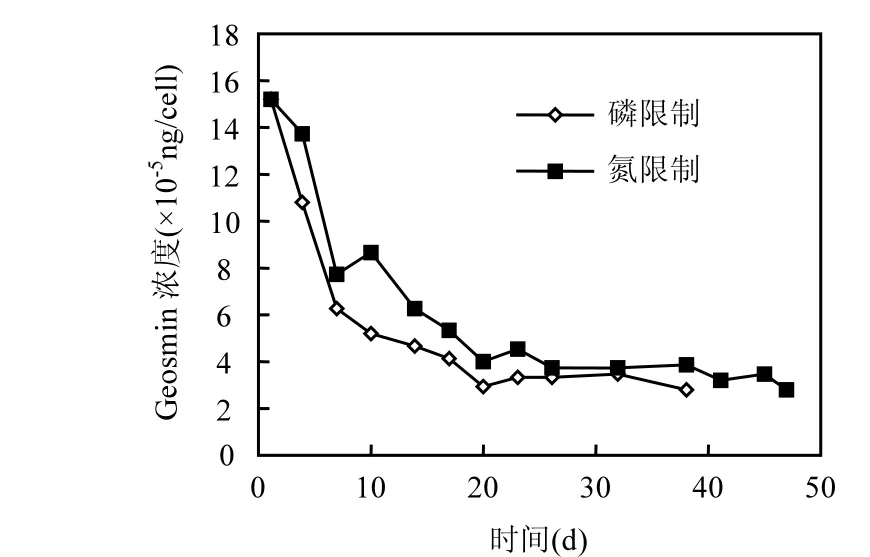
图4 单位细胞所含土嗅素浓度的变化Fig.4 Varietion of geosmin concentration in unit cell
在螺旋鱼腥藻的整个生长过程中,其胞内土嗅素的含量都远远大于胞外(图3).在磷限制条件下,土嗅素的最高浓度为 1.91×103ng/L;而在氮限制条件下,土嗅素的最高浓度为8.64× 103ng/L,远远高于前者.胞内土嗅素的浓度变化与藻细胞密度的变化趋势基本一致.
在磷限制和氮限制2种培养条件下(图4),单位细胞内土嗅素的浓度在培养的前 20d内都处于急速下降的趋势,之后开始趋于平缓,分别维持在 3.18×10-5,3.68×10-5ng/cell左右.
2.3 叶绿素a的含量及与土嗅素含量的关系
螺旋鱼腥藻单位细胞生成的叶绿素 a含量的变化趋势(图 5)表明,在磷限制条件下,每细胞所含叶绿素 a的浓度在培养的前 7d急速下降,之后基本维持在 1.89×10-3ng/cell;而在氮限制条件下,每细胞所含叶绿素 a浓度的下降趋势并不明显,维持在3.67×10-3ng/cell左右.在氮限制条件下,鱼腥藻更易形成叶绿素 a,在磷限制条件下,鱼腥藻形成叶绿素 a的过程受到抑制,其值远低于氮限制条件下叶绿素a的量.
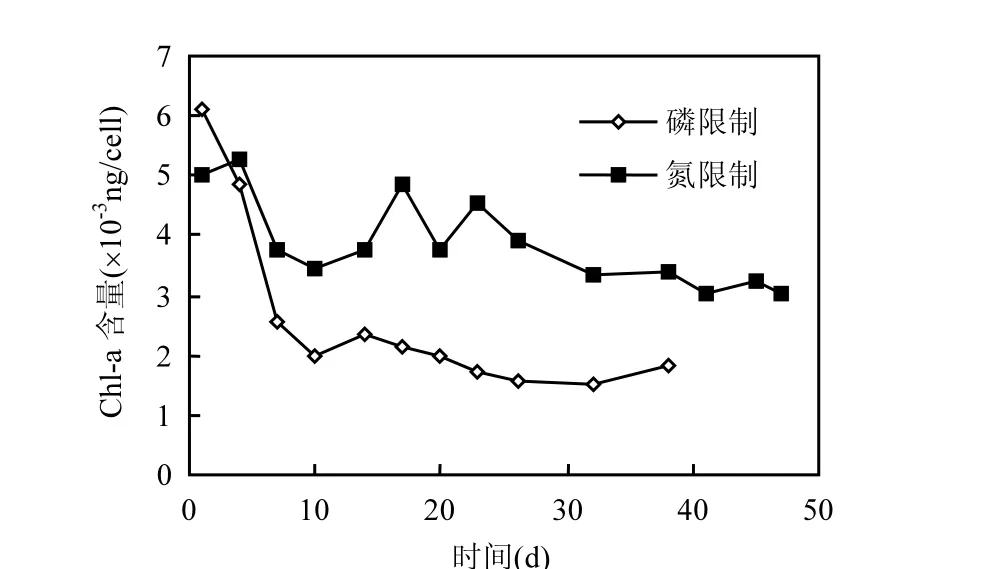
图5 单位细胞所含叶绿素a浓度的变化趋势Fig.5 Varietion of chl a concentration in unit cell

图6 单位细胞分泌土嗅素与叶绿素质量比的变化趋势Fig.6 Varietion of geosmin/Chl a ratio in unit cell
鱼腥藻单位细胞产生的土嗅素与叶绿素 a的质量比(geosmin/chl a)在磷限制条件下要高于氮限制条件下(图6).
2.4 培养过程中营养盐的变化
在磷限制条件下,随着藻细胞的生长,藻液中的溶解性总磷(DTP)逐渐降低(由 0.13mg/L降为0.02mg/L)(图 7).在氮限制条件下,鱼腥藻首先利用培养基中的氮源,藻液中的总氮(TN)和溶解性总氮(DTN)都有所下降(图 7),当培养基中氮源不能满足鱼腥藻生长需要时,鱼腥藻开始生成异形胞,并进行固氮作用.所以随着藻细胞密度的增加,藻液中总氮(TN)的浓度有所提高.

图7 磷限制下水体中磷的变化趋势和氮限制下水体中氮的变化趋势Fig.7 Varietion of phosphorus content in water column under phosphorus-limited condition and varietion of nitrogen content in water column under nitrogenlimited condition
3 讨论
在磷限制和氮限制条件下,鱼腥藻的生长情况不同.Rashash等[22]研究鱼腥藻时,发现其藻细胞密度在低磷情况下比在低氮情况下明显减少.这主要是由于螺旋鱼腥藻为固氮蓝藻,当其处在缺氮条件下时,鱼腥藻会形成具有固氮作用的异形胞,异形胞可以直接固定大气中的N2(分子态),形成藻细胞可以利用的氮素化合物,从而使其生长并不受到很大影响.在本研究中,在氮限制条件下,异形胞形成比率约为 3.8%,螺旋鱼腥藻生长未受到明显影响.在磷限制条件下,螺旋鱼腥藻几乎不生成异形胞且生长受到抑制;所以可以通过控制排入水体中磷的含量,使水体处于磷限制,更能有效避免鱼腥藻过度生长.
在生成土嗅素方面,磷限制条件下单位细胞土嗅素的生成量比氮限制条件下的生成量低约15%.Wu等[23]研究鱼腥藻发现鱼腥藻中的异形胞比其他细胞产生更多的土嗅素,本研究中螺旋鱼腥藻在氮限制条件下更易产生异形胞,推测由异形胞产生的土嗅素是螺旋鱼腥藻单位细胞土嗅素的生成量在氮限制条件下高于磷限制条件下的主要原因.
不论是氮限制还是磷限制条件下,螺旋鱼腥藻胞内土嗅素的含量都远远大于胞外土嗅素的含量,这说明螺旋鱼腥藻在整个生长过程中,其生成的土嗅素大部分都保留在细胞内,只有很少一部分释放到了水体.刘妍娟等[24]在研究螺旋鱼腥藻土嗅素的产生和分布规律时报道螺旋鱼腥藻的胞内土嗅素占总土嗅素的85%-95%,说明土嗅素在螺旋鱼腥藻生长过程中主要分布在藻细胞内部;Jüttner等[25]研究表明在藻细胞内生长旺盛期(约前 4d),细胞内异味化合物浓度不断增加,98%左右的异味化合物存在于细胞内,随着细胞的衰老(第4d后),细胞内异味化合物浓度开始下降,而培养液中的异味化合物的浓度却不断增加;Rashash等[22]研究得出,在生长的初期,鱼腥藻产生的土嗅素大部分保留在了细胞里,在 20d之后,细胞内和水体中的土嗅素比例相当;Rosen等[26]研究揭示鱼腥藻细胞的死亡导致了细胞内土嗅素向介质中的释放.本研究中在营养盐限制条件下,螺旋鱼腥藻的生长受到抑制,未达到衰败期,故仍处于生成的土嗅素保留在细胞内的阶段.基于上述情况,在预防水体中发生螺旋鱼腥藻引起的嗅味问题时,可以通过过滤去除水体中的过量的藻类,从而减小发生水体的嗅味问题几率.
4 结论
4.1 螺旋鱼腥藻在磷限制下生长受到限制,几乎不生成异形胞;在氮限制下生长未受到明显影响,平均生成 3.8%异形胞.在磷限制条件下,螺旋鱼腥藻产生土嗅素的最高浓度为 1.91×103ng/L;在氮限制条件下,土嗅素的最高浓度为 8.64×103ng/L.
4.2 不论是氮限制还是磷限制,螺旋鱼腥藻在整个生长过程中,其生成的土嗅素大部分都保留在细胞内,只有很少部分(0.2%~10.4%)释放到了水体.
4.3 鱼腥藻单位细胞产生的土嗅素与叶绿素 a的质量比(geosmin/chl a)在磷限制条件下要高于氮限制条件下.
[1]Farlow W G.Relation of certain forms of algae to disagreeable tastes and odors [J].Science, 1883,2:333-336.
[2]李 林.淡水水体中藻源异味化合物的分布、动态变化与降解研究 [D].武汉:中国科学研究院水生生物研究所, 2005.
[3]Izaguirre G, Hwang C J, Krasner S W, et al.Geosmin and 2-methylisoborneol from cyanobacteria In three water supply systems [J].Appl.Environ.Microbiol., 1982,43:708-714.
[4]Li L, Wan N, Gan N Q, et al.Annual dynamics and origins of the odorous compounds in the pilot experimental area of Lake Dianchi [J].China.Wat.Sci.Tech., 2007,55(5):43-50.
[5]Izaguirre G, Taylor W D.Geosmin and MIB events in a new reservoir in southern California.[J].Wat.Sci.Tech., 2007,55(5):9-14.
[6]Zhang T, Li L, Song L, et al.Effects of temperature and light on the growth and geosmin production of Lyngbya kuetzingii(Cyanophyta) [J].Journal of Applied Phycology, 2009,21(3):279-285.
[7]Tsuchiya Y, Matsumoto A.Characterization of Oscillatoria F.Granulata producing 2-Methylisoborneol and geosmin [J].Wat.Sci.Tech., 1999,40(6):245-250.
[8]Ismail M K, Sadoun K K.Environmental and nutritional factors affecting geosmin synthesis by Anabaena sp [J].Water Research,2001,35(5):1209-1218
[9]Rashash D M C, Dietrich A M, Hoehn R C, et al.The influence of growth conditions on odor-compound production by two chrysophytes and two cyanobacteria [J].Chemical Ecology and Biology, 1995,31(11):165-172.
[10]邓绪伟,陶 敏,张 路,等.洞庭湖水体异味物质及其藻类和水质的关系 [J].环境科学研究, 2013,26(1):16-21.
[11]李 林,万 能,甘南琴,等武汉大莲花湖异味化合物日变化及其相关因子分析 [J].水生生物学报, 200731(1):112-117.
[12]齐 敏,孙小雪,邓绪伟,等太湖中不同形态异味物质含量、相互关系与其环境因子关系的探讨 [J].湖泊科学, 2012,26(4):1040-1047.
[13]黎 雯,徐 盈,吴文忠,等.水体中异味化合物定量测定的一种有效方法 [J].分析测试技术与仪器, 1998,4(2):84-90.
[14]李 林,宋立荣,甘南琴,等.顶空固相微萃取-气相色谱-质谱测定水中异味化合物 [J].分析化学, 2005,33(8):1058-1062.
[15]刘 欣,何 进,喻子牛.微生物产生的土腥味化合物及其清除方法 [J].中国生物工程杂志, 2005,25(8):35-38.
[16]郭烽武,武周虎,姚 杰,等.水的异味去除技术研究进展 [J].青岛建筑工程学院院报, 2005,26(1):55-58
[17]Kuwabara K.Temperature effect on growth characteristics and competition between cyanobacteria Microcystis sp.and Oscillator sp.: a experimental study using lake simulator [R].日本:第九回世界湖沼会议, 2002.
[18]梁存珍,王东升,桑义敏,等.饮用水中土霉味物质测定方法的优化 [J].中国给水排水, 2007,23(10):76-78.
[19]金相灿,屠清瑛.湖泊富营养化调查规范 [M].北京:中国环境科学出版社, 1990.
[20]GB/T 11894-198 水质-总氮的测定-碱性过硫酸钾消解紫外分光光度法 [S].
[21]GB/T 11893-1989 水质-总磷的测定-钼锑抗分光光度法 [S].
[22]Rashash D M C.The influence of growth conditions on odor-compound production by two chrysophytes and two cyanobacteria [J].Water.Sci.Tech., 1995,31(11):165-172.
[23]Wu J T.Variation of geosmin content in Anabaena cells and its relation to nitrogen utilization [J].Arch.Microbiol., 1991,157:66-69.
[24]刘妍娟,储昭升,金相灿,等.螺旋鱼腥藻土嗅素的产生和分布规律 [J].中国环境科, 2009,29(10):1082-1085.
[25]Jüttner F.Biochemistry of biogenic off flavour compounds in surface waters [J].Water Science Technol., 1988,20(8/9):107-116.
[26]Rosen B H, MacLeod B W, Simpson M R.Accumulation and release of geosmin during the growth phases of Anabaena circinalls (Kutz.) Raven horst [J].Water Science and Technology,1992,25(2):185-190.
