生物炭催化过硫酸盐脱色偶氮染料金橙Ⅱ
2014-08-02AlbertoBentoCharrua
刘 娜,王 柳,邱 华,Alberto Bento Charrua,王 航,王 锐
吉林大学环境与资源学院,长春 130021
生物炭催化过硫酸盐脱色偶氮染料金橙Ⅱ
刘 娜,王 柳,邱 华,Alberto Bento Charrua,王 航,王 锐
吉林大学环境与资源学院,长春 130021
生物炭作为一种廉价易得的材料,在土壤修复等各方面的功能已引起广泛关注,但其催化作用却鲜有研究。首次对生物炭(biochar-BC)催化过硫酸盐(Na2S2O8-PS)使偶氮染料金橙Ⅱ(AO7)脱色的可行性进行研究,对影响催化体系脱色效率的因素(包括pH、生物炭质量浓度和PS/AO7摩尔比)进行探讨,同时研究了生物炭的重复利用效果及前后性质变化。结果表明:PS/BC体系明显比单独的PS体系脱色效果好;两个反应体系都遵循一级反应动力学;PS/BC体系反应的最适pH接近中性;生物炭质量浓度越大,脱色效果越好;PS/AO7摩尔比越大,脱色效果越好,但是催化效果却没有相应的改善;生物炭重复利用后对AO7仍然有脱色效果;BC的孔大多位于层状结构表面,且为小孔,重复使用后,表面孔会堵塞;除了灰分和氧元素外,其他元素(C、N、H、S)含量都有一定程度的减小;BC表面官能团种类很多,主要有C=O、C=C、C-O、C-H,芳香族C=C和C-H以及-OH官能团;BC重复使用后-OH峰会消失。综上述,生物炭可以催化过硫酸盐对偶氮染料AO7进行脱色,原理是BC表面的-OH官能团与PS反应生成硫酸根自由基去除AO7。
生物炭; 过硫酸盐; 偶氮染料; 金橙Ⅱ
0 前言
当今,染料被广泛应用于纺织、绘画、印刷、塑料和化妆品等行业,但在其生产和应用过程中会排放大量印染废水,其中的有机污染物含量高、水质变化剧烈,严重危害环境[1]。在众多商业染料中,偶氮染料数量最多且最重要,可占到50%[2-3]。大多数偶氮染料具有偶氮键,因此有难生物降解和潜在致癌的特点,排入水中会引起严重的生态环境问题。又因为偶氮染料污染的废水不仅色度高、化学需氧量大、总固体含量高,而且水体呈明显碱性,所以该种废水的处理问题引起广泛的关注[2-4]。
传统处理印染废水的方法有结合高氯酸氧化混凝/絮凝、膜过滤和生物氧化等,然而,这些方法的处理结果很难满足排放标准,且具有污泥产量高、膜污染严重、生物不稳定和效率低等诸多不利的因素[5-6]。因此,如何低能高效降解印染废水成为现在研究的重点[2]。
高级氧化处理技术(advanced oxidation processes, AOPs)是一种通过生成高活性自由基,从而高效无选择性地降解及矿化大部分有机或无机污染物的新技术[7-8]。污水处理常见的AOPs有光催化降解、芬顿氧化[9]、臭氧氧化、超临界流体氧化和活化过硫酸盐氧化。活化过硫酸盐氧化是一种新兴的处理有机污染物的高级氧化方法,目前主要用于原位化学氧化将地下水或土壤中污染物转化为少害或无害的化学物质[10]。过硫酸盐(persulfate, PS)激活后可以产生具有更高氧化电势(E0=2.6 eV)的硫酸根自由基(SO4·-)[11],其激活方式通常有热[12-15]、紫外线[16-17]、基质、过渡金属[18-22]、土壤矿物[23-24]和辐射[25-26]。许多研究[27-29]证实热、金属、光可以诱导过硫酸盐产生自由基。有研究[30]提出阴离子、中性有机分子和亲核基团也可以氧化产生硫酸根自由基。自由基一旦生成,可以与任何氧化剂包括有机污染物进行反应。在酸性条件下,可通过以下反应生成SO4·-:
任何pH条件下,通过下述反应,硫酸根自由基可以生成羟基自由(·OH),提高降解效果[27]。
特别是在pH为中性时,硫酸根自由基与羟基自由基相比有更高的标准还原电势,所以此时它对有机化合物有更高的处理能力[31]。活性炭(AC)是一种良好的吸附剂、催化剂和催化剂载体。有学者[32-33]报道活性炭与过氧化氢联合氧化可以去除多种有机污染物,甚至是一些无法生物降解的物质。过硫酸盐与过氧化氢有类似的结构,它同样可以和活性炭结合氧化降解污染物。近年来,研究[34-35]认为活性炭有一种含氧官能团,因此可以作为催化剂催化过硫酸盐。反应机制[34-35]为

(4)
(5)
生物炭(biochar, BC)是一种富含碳的产品,制作过程是将生物质如木材、肥料或树叶在缺氧或者无氧的密闭容器中加热裂解[36]。生物炭属于黑炭,可分为木炭、竹炭、秸秆木炭、稻草杆炭、谷壳炭和动物废物炭。目前仍没有一个固定的标准来区分生物炭和其他类似的碳质材料。近年来,生物炭在土壤改良中的作用已被证实。与此同时,它在减少温室气体和污染环境修复等其他方面的应用也广泛引起关注。研究人员发现,生物炭对重金属和有机物有较好的吸附作用[37-39]。但至今生物炭在作为催化剂方面的应用研究较少。
笔者对生物炭催化过硫酸盐脱色偶氮染料进行了研究,以金橙Ⅱ(AO7)作为目标污染物,研究了生物炭对AO7的吸附作用及pH对吸附过程的影响、生物炭催化过硫酸盐使AO7脱色的可行性及影响因素等,以期发现一种新型的高级氧化活化方式,对偶氮染料废水具有廉价高效的处理效果。
1 实验材料与方法
1.1 材料
过硫酸钠、金橙Ⅱ购于国药化学试剂有限公司。松木生物炭是将条状松木在马弗炉中采用厌氧热解方式烧制而成,热解条件为450 ℃灼烧2 h,然后研磨过筛得到0.40~0.45 mm的颗粒状生物炭,记为BC0。
1.2 方法
1.2.1 吸附
吸附过程会对催化产生影响,所以为了研究生物炭的催化作用,需要对生物炭的吸附作用进行研究。首先在100 mL 0.057 mmol/L的金橙Ⅱ溶液中加入一定量的生物炭(质量浓度分别为1.0,2.5,5.0,7.5,10.0 g/L);然后将锥形瓶置于恒温振荡器中在30 ℃下以150 r/min震荡,定时取样测定金橙Ⅱ的浓度及pH变化。
pH是吸附过程中一个至关重要的因素,因此对不同pH条件下生物炭的吸附情况也进行了研究。方法为控制金橙Ⅱ浓度为0.057 mmol/L,生物炭质量浓度为5.0 g/L,初始pH分别为2.54、3.53、4.55、6.09、8.44和10.55。实验条件及测样指标同上述吸附条件。所有的实验均进行3次,文中所用数据为3次平均值。
1.2.2 过硫酸钠催化
在200 mL 0.057 mmol/L的金橙Ⅱ溶液中加入一定量的生物炭(质量浓度为5.0 g/L)和过硫酸钠(nPS/nAO7为100/1),同时加入仅有生物炭和仅有过硫酸钠的溶液作为空白对比。反应条件为:30℃,150 r/min,初始pH为6.15;分别在6、12、24、36、48 h取样10 mL,用0.45 μm无机滤膜过滤后测定滤液AO7浓度。
研究BC催化PS脱色AO7的影响因素时,除影响因素外,其他反应条件若未注明均与上相同。
1.2.3 重复利用情况
将1.2.2中BC0与PS反应的溶液过滤,留下BC0在105 ℃烘干24 h,即得到BC1;同样烘干BC1及BC2与PS反应溶液过滤后留下的生物炭,即得到BC2和BC3。由此得到生物炭的重复利用结果。
1.2.4 分析方法
AO7测定方法为分光光度法,测定波长为 484 nm,使用仪器为紫外分光光度计(mini-1240,岛津,日本)。pH值用pH计(UB-7,AA,中国)测定。生物炭的零电点pH值(pHpzc)测定方法为:先配制pH分别为2.5、3.5、4.5、5.5、6.5、7.5、8.5、9.5、10.5的水溶液,同时加入0.1 g生物炭,置于恒温振荡器中震荡2 h后取出,过滤,测定滤液的pH值;然后以溶液初始pH为横轴,初始pH和最终pH为纵轴绘图,两条直线的交点处值即为生物炭的pHpzc。生物炭的表面形态通过扫描电镜(SEM,JSM-6700F,JEOL,日本)测试,C、H、N、S元素质量分数用元素分析仪(Vario Micro V2.0.12,Elementar,德国)测定。灰分质量分数测试方法为通过生物炭于马弗炉中在750 ℃下灼烧4 h的质量损失计算。O元素质量分数通过质量守恒定律计算得到。表面官能团通过傅里叶红外光谱(FTIR,Thero 6700分光光度计,Nicolet,美国)测定。
2 结果与讨论
2.1 生物炭吸附AO7溶液
不同质量浓度生物炭对AO7的吸附结果如图1所示。结果显示:随着生物炭质量浓度的增大,吸附效果会相应增强,吸附平衡时的pH也会相应增大。因为AO7溶液是一种酸性染料,所以这表明BC表面有一些可以反应使溶液pH增大的物质。
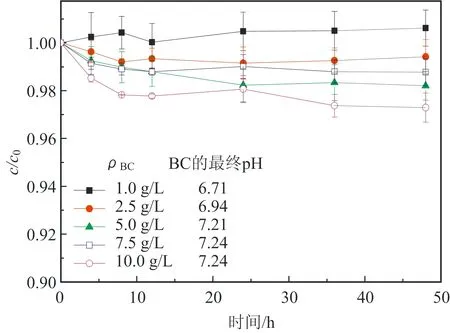
初始pH为6.09;c0.AO7的初始浓度为0.057 mmol/L;c.定时取样时AO7的浓度。图1 不同质量浓度BC对AO7的吸附效果及其吸附过程pH变化Fig.1 Influence of biochar concentration and pH on the adsorption effect of AO7
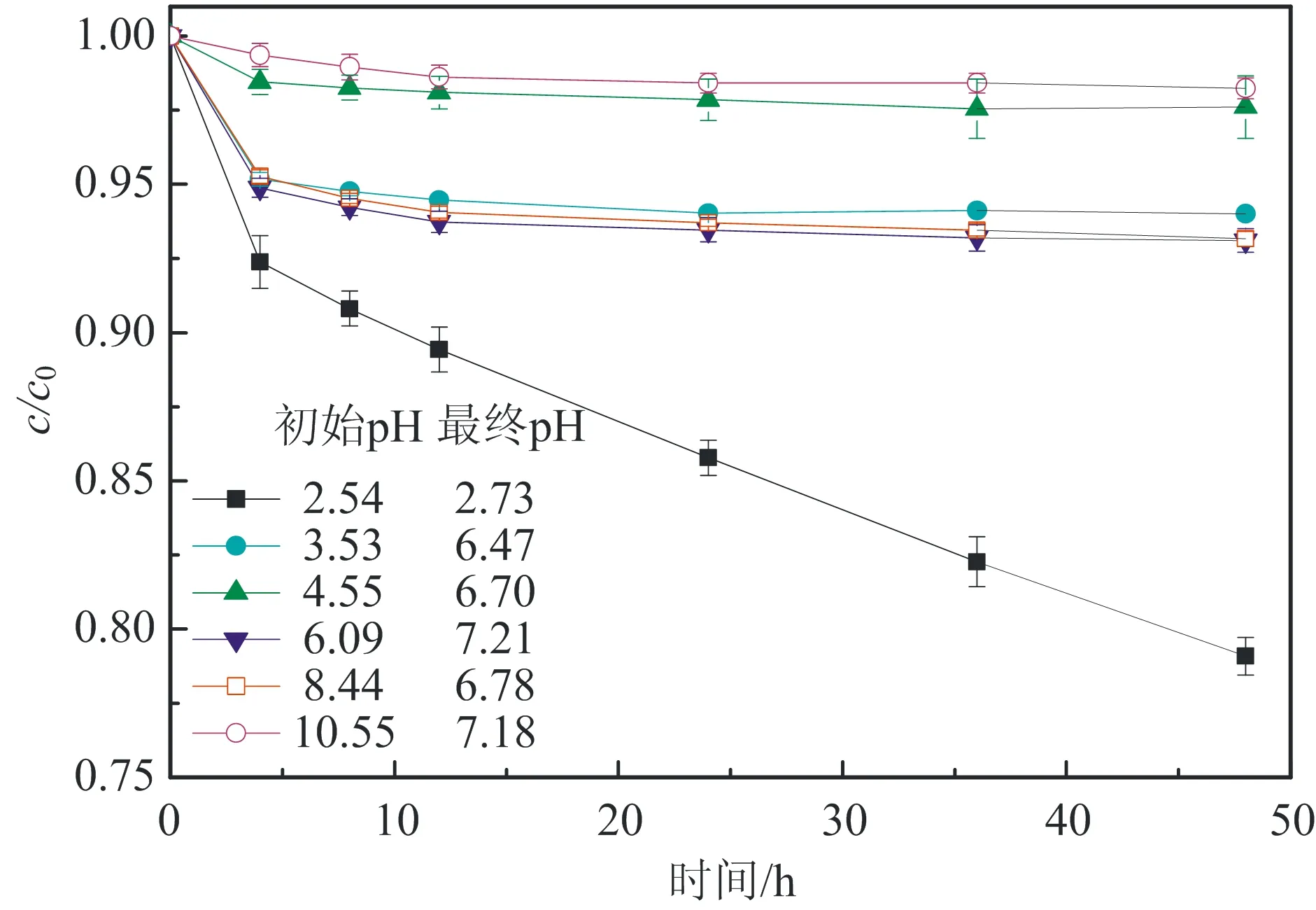
ρBC为5.0 g/L。图2 不同初始pH条件下BC对AO7的吸附效果及其吸附后最终pHFig.2 Adsorption effect of AO7 by biochar and the final pH at different initial pHs
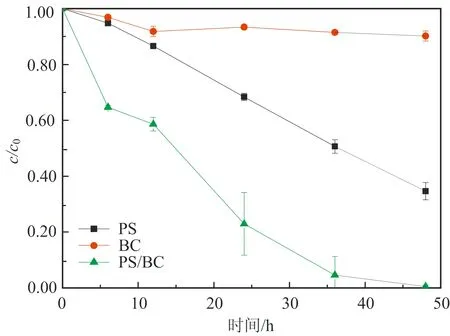
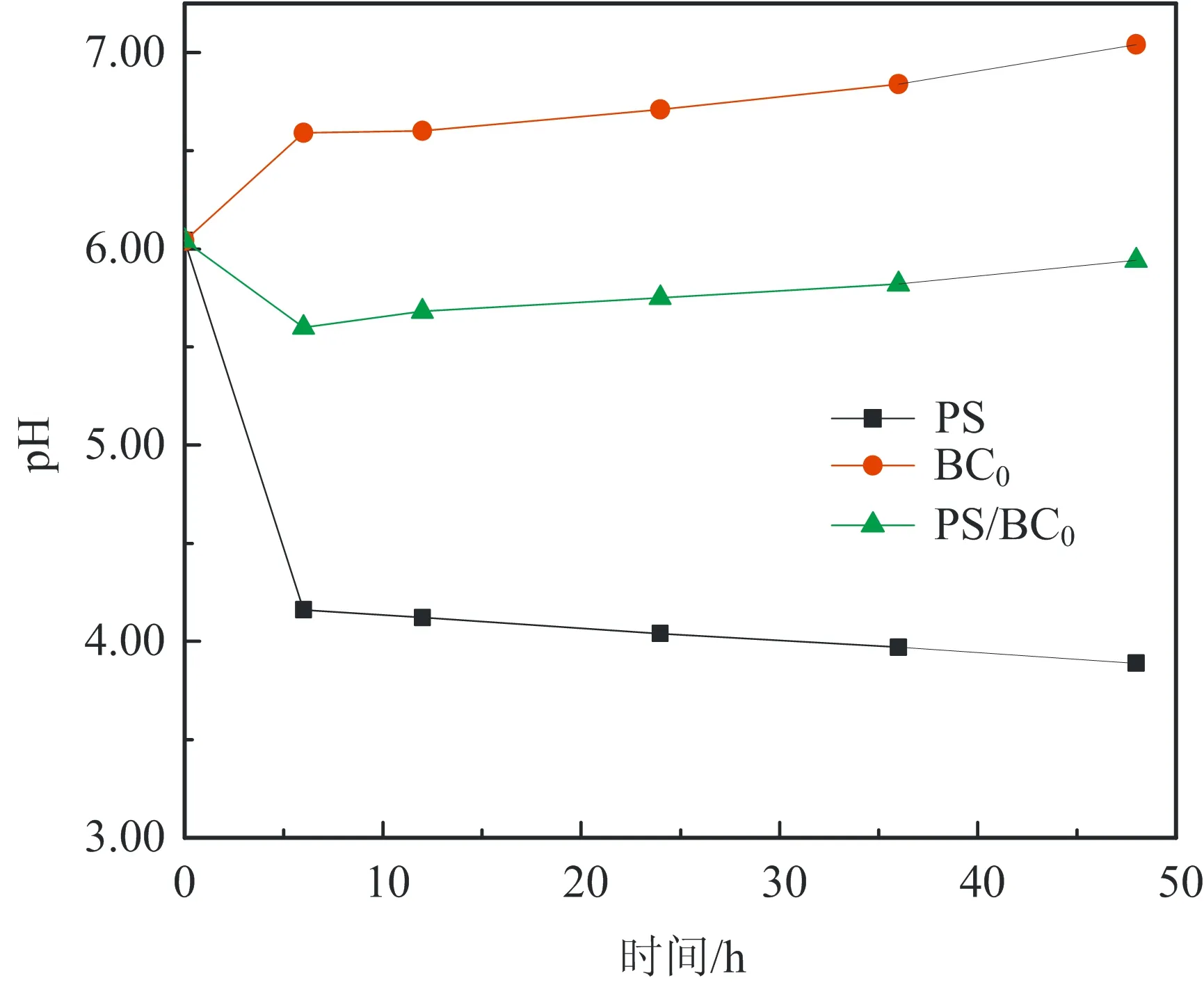
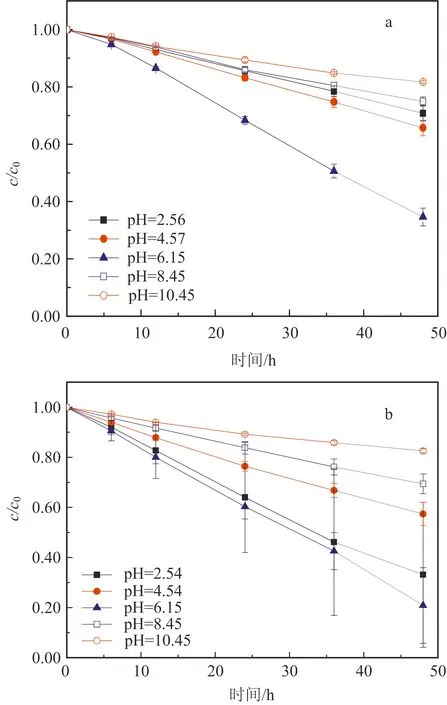
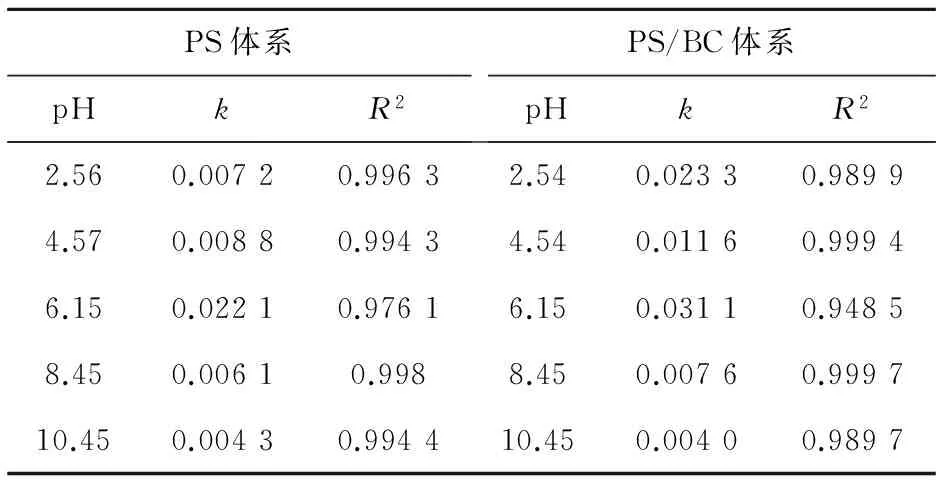
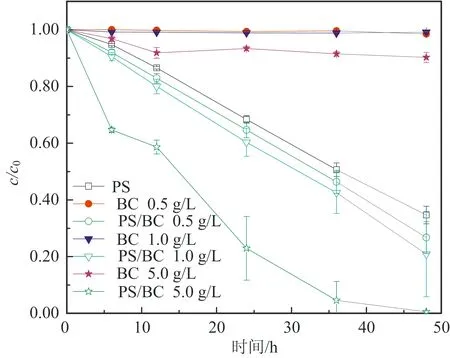
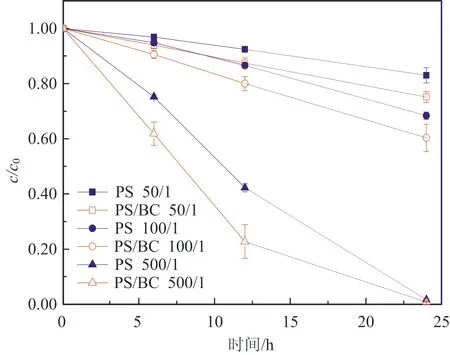
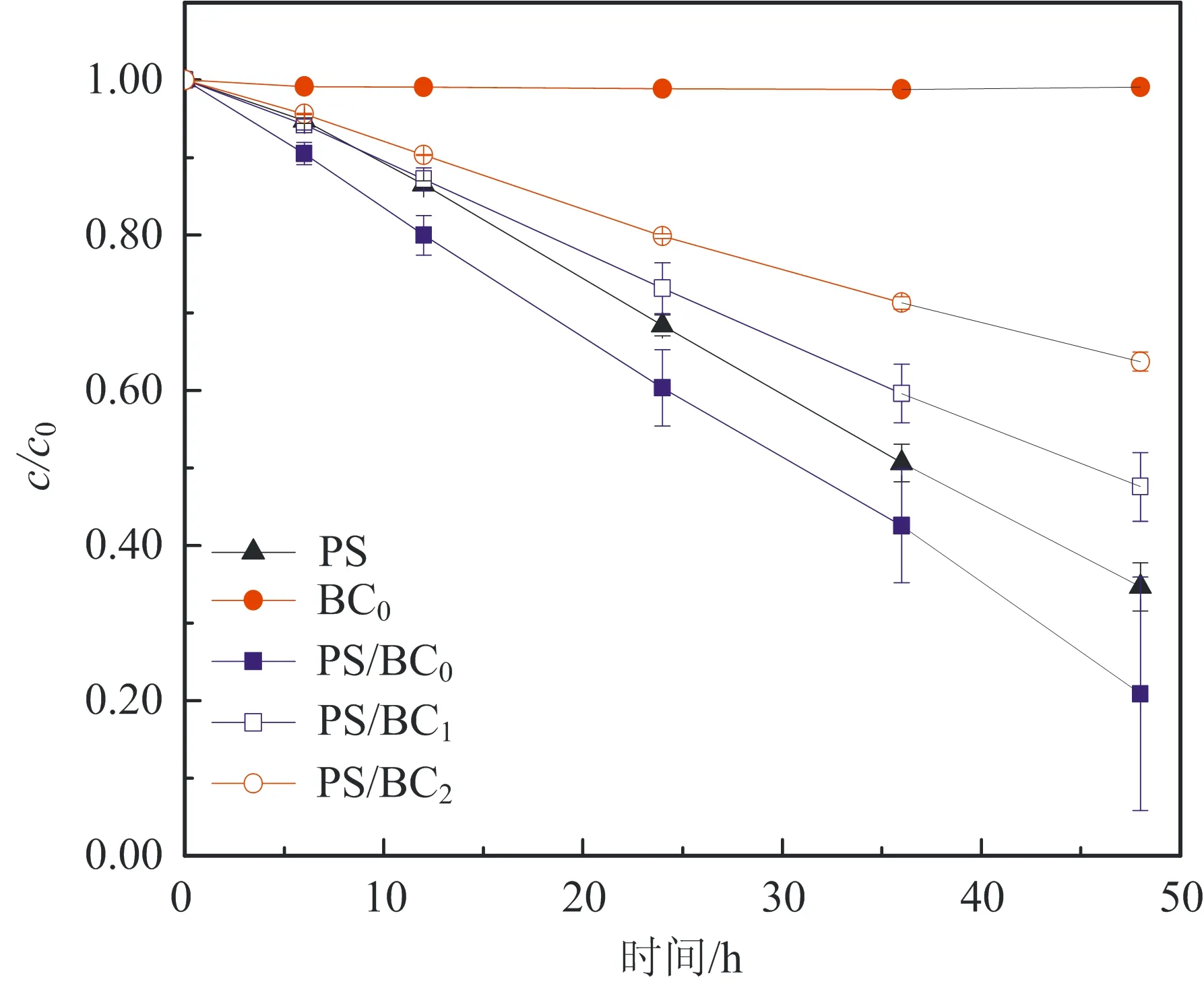
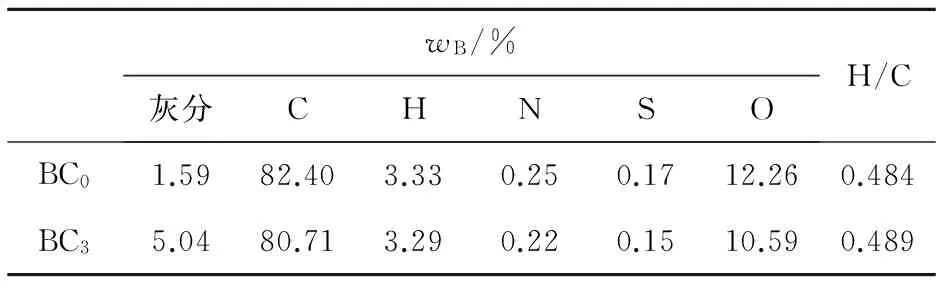
图2为不同初始pH对BC吸附效果的影响:在酸性条件下,随着pH值的增大,吸附效果会有一定的波动;在碱性条件下,随着pH值的增大,吸附效果逐渐减弱。当溶液初始pH为10.55时,BC对AO7几乎没有吸附;而当pH为2.54时,BC对AO7 48 h的吸附去除效率为20%。出现这种情况的原因可能与pHpzc有关。因为当溶液pH (6) 或 BC-OH0+AO7-→BC- AO7+OH-。 (7) 结合图1和上述吸附机制,推测溶液pH上升的原因是酸性条件可中和吸附过程中产生的OH-,所以吸附效果更好。 2.2 BC催化PS可行性研究 图3显示了不同体系(包括单独PS、单独BC、PS/BC体系)对AO7的脱色效果。结果很明显,三个体系对AO7 48 h的脱色顺序从大到小为PS/BC体系(99.5%)、单独PS体系(65.5%)、单独BC体系(9.8%)。单独的BC和PS体系对AO7的脱色效果都不够好,而PS/BC体系的脱色效率则非常可观。结果表明BC可以催化PS使偶氮染料AO7脱色。 对单独PS和PS/BC催化体系反应数据进行反应动力学模拟,二者都遵循一级反应动力学。这表明两个体系的反应物浓度随时间按指数规律下降,且反应物消耗一半的时间与消耗剩余反应物的时间相等。计算得知,单独PS和PS/BC体系的一级动力学反应常数k分别为0.022 1和0.105 6 h-1,R2分别为0.976 1和0.942 4(R为相关系数)。这也和图3中的结果一致。研究[2,32,42]也表明AC与H2O2或PS体系的反应遵循一级动力学。 ρBC为5.0 g/L;nPS/nAO7为100/1。图3 不同体系对AO7脱色效果及其反应动力学Fig.3 Decoloration effect of AO7 by different systems and their reaction kinetics 在PS催化反应中,pH是一个至关重要的因素,因此催化过程中溶液的pH变化也需要研究。如图4所示,不同的反应过程中pH值的变化有很大的区别:一方面,随着吸附反应的进行,溶液的pH值升高至接近中性,这个结果与上述吸附研究一致;另一方面,随着催化反应的进行,溶液的pH值会急剧地下降。单独PS体系的溶液pH降至低于4.0,而PS/BC体系在后续的反应中会有一定回升。Rachel[28]研究发现,热活化PS氧化脱氯过程中,当SO4·-与水发生反应时,由于质子的生成溶液的最终pH值会降低;同时,在BC吸附AO7的过程中,溶液的pH值会有一定程度的增大。因此吸附与催化的共同作用导致PS/BC体系的pH值有一定回升。然而也有研究(如Liang等[27])认为任何情况下SO4·-与水的反应并不明显。 ρBC为5.0 g/L;nPS/nAO7为100/1。图4 不同体系反应pH变化Fig.4 Change of pH in the reaction by different systems 2.3 PS/BC体系脱色AO7过程中的影响因素 笔者研究了pH、生物炭质量浓度、PS/AO7摩尔比和BC的重复利用对PS/BC体系使偶氮染料废水AO7脱色的影响。 2.3.1 pH的影响 a.单独PS体系;b. PS/BC体系。ρBC为1.0 g/L;nPS/nAO7为100/1。图5 不同初始pH条件对AO7的脱色效果Fig.5 Decoloration effect at different initial pHs Table 1 Eaction kinetics constants and correlation coefficient of both systems PS体系pHkR2PS/BC体系pHkR22.560.00720.99632.540.02330.98994.570.00880.99434.540.01160.99946.150.02210.97616.150.03110.94858.450.00610.9988.450.00760.999710.450.00430.994410.450.00400.9897 2.3.2 生物炭质量浓度的影响 如图6所示,随着生物炭质量浓度的增大,单独BC的吸附作用和PS/BC体系的催化作用都能更好地去除AO7。对吸附过程来说,BC质量浓度达到5.0 g/L时,吸附去除率仅为10.0%;对氧化过程来说,当BC质量浓度为5.0 g/L时,PS/BC体系36 h对AO7的去除率已经接近100.0%。通过对比BC质量浓度为0.5 g/L时PS/BC体系和单独PS体系对AO7的去除效率(分别为73.2%和65.4%),可以得出结论:BC可以催化过硫酸盐发生氧化反应。 nPS/nAO7为100/1。图例中数值为ρBC。图6 不同BC质量浓度下两个体系对AO7的去除效果Fig.6 Removal effect of AO7 by both systems at different BC dosages 2.3.3 PS/AO7摩尔比影响 ρBC为1.0 g/L。图例中比值为nPS/nAO7。图7 nPS/nAO7对反应体系的影响Fig.7 Influence of nPS/nAO7 to the reaction system 2.4 BC重复利用 2.4.1 BC重复利用后对PS的催化效果 生物炭重复利用前后催化PS对AO7的脱色效果如图8所示。对PS/BC体系来说,BC重复利用后对AO7的脱色效率明显下降了:初次使用时脱色效率为79.1%;使用一次后为52.4%;使用两次后为39.3%。当BC重复利用一次后催化PS对AO7的脱色效果已经不如单独PS体系。Yang等[2]研究用AC催化PS降解AO7,AC重复使用后对AO7仍然有很高的脱色效率。分析原因可能是AC经过一系列的活化过程,孔及表面充分扩大,从而反应更快,而本文中的BC只是简单的灼烧。但是,这也可以为资源化利用生物质废弃物提供一定的依据。 ρBC0、ρBC1、ρBC2为1.0 g/L。nPS/nAO7为100/1。图8 BC重复利用后PS/BC体系对AO7的去除Fig.8 AO7 removal by PS/BC after BC was reused 2.4.2 BC重复利用后性质 图9为BC重复利用前后的SEM图。由图9可知: BC的结构为层状,在很大程度上保留了原材料的形态;在孔的数量和深度方面,BC的孔大都位于层状结构的表面,且多数是小孔;对比BC0--BC1--BC2--BC3可以发现BC重复利用一次(BC1)后孔的数量和大小基本上没有什么变化,但是使用3次(BC3)后,层状结构上的孔明显地都堵塞了,这可能是BC重复使用后催化效果剧减的主要原因。 图9 BC重复使用前后的SEM图Fig.9 SEM of BC before and after being reused 表2中,对比BC0和BC3的元素质量分数可知,BC重复使用后除了灰分和氧元素外,其他元素(C、N、H、S)的质量分数都有一定程度的减小。这个结果与研究[43]中木质生物炭的元素质量分数基本一致。H质量分数主要与有机质有关,因此H/C摩尔比可以代表其炭化程度[44]。文中松木生物炭的H/C值与其他研究中AC的相比相对较高,这表明材料含有更多的原始有机质。原因可能是松木生物炭的热解温度为450 ℃,相对较低,不足以炭化所有的有机质。 表2 BC0和BC3的元素质量分数对比 由图10可以看出,BC的表面官能团种类很多。在800~2 000 cm-1范围内主要有C=O,C=C,C-O,C-H,芳香族C=C和C-H。这与文献[43]中结果基本一致,且其在3 400 cm-1处有很宽的吸收峰,代表有大量的-OH官能团。对比其使用前后的红外光谱图,不同点是与BC0相比,BC1、BC2及BC3在3 400 cm-1处的吸收峰很小,几乎没有。 图10 BC重复利用前后红外谱图变化Fig.10 Infrared spectrogram change of BC before and after being reused 1)生物炭不仅能够吸附AO7,而且能够催化PS去除AO7。但是生物炭的吸附能力很弱, pH降低有利于BC的吸附作用。而PS/BC体系间明显存在着协同作用,可以有效地使偶氮染料AO7脱色。 2)PS/BC体系遵循一级反应动力学,反应最佳pH为中性;BC质量浓度越大、PS浓度越大,脱色效率越高; BC重复利用后脱色效率明显降低,原因可能是BC层状结构上的孔发生明显的堵塞和BC表面的-OH官能团的红外吸收峰的消失。 3)由一种廉价易得的生物质原材料----松木,制备得到的BC可以像活性炭一样催化PS对AO7进行脱色,其原理推测为BC表面的-OH官能团与PS反应生成的自由基去除AO7。 吉林大学(教育部)地下水资源与环境重点实验室的老师和同学们在本研究的样品收集和实验过程中提供了必要的设备,给予了很大的支持,在此表示感谢。 [1] 谭明, 邹东雷, 赵晓波. 铁屑粉煤灰微电解法预处理印染废水的研究[J]. 吉林大学学报:地球科学版, 2004, 34(增刊): 122-125. Tan Ming, Zou Donglei, Zhao Xiaobo. A Study of Ironscurf and Ash Micro-Electrolysis Used in Pretreating Dye-Stuff Waste Water[J]. Journal of Jilin University:Earth Science Edition, 2004, 34(Sup.): 122-125. [2] Yang S Y, Yang X, Shao X T, et al. Activated Carbon Catalyzed Persulfate Oxidation of Azo Dye Acid Orange 7 at Ambient Temperature[J]. Journal of Hazardous Materials, 2011, 186(1): 659-666. [3] Lu X J, Yang B, Chen J H, et al. Treatment of Wastewater Containing Azo Dye Reactive Brilliant Red X-3B Using Sequential Ozonation and Upflow Biological Aerated Filter Process[J]. Journal of Hazardous Materials, 2009, 161(1): 241-245. [4] Van der Zee F P, Villaverde S. Combined Anaerobic-Aerobic Treatment of Azo Dyes:A Short Review of Bioreactor Studies[J]. Water Research, 2005, 39(8): 1425-1440. [5] Keiichi T, Kanjana P, Teruaki H. Photocatalytic Degradation of Commercial Azo Dyes[J]. Water Research, 2000, 34(1): 327-333. [6] 周丹丹,赵文元,王君,等. 流化床混凝装置中多级速度梯度的建立及其对混凝反应的影响[J]. 吉林大学学报:地球科学版, 2012, 42(6): 1896-1902. Zhou Dandan, Zhao Wenyuan, Wang Jun, et al. Set-up Method of Multi-Velocity Gradient in a Fluidized Flocculation Bed and Characterization of Its Impact on Flocculation Reaction[J]. Journal of Jilin University:Earth Science Edition, 2012, 42(6): 1896-1902. [7] Gimeno O, Carbajo M, Beltran F J, et al. Phenol and Substituted Phenols AOPs Remediation[J]. Journal of Hazardous Materials, 2005, 119(1/2/3): 99-108. [8] Yan J C, Lei M, Zhu L H, et al. Degradation of Sulfamonomethoxine with Fe3O4Magnetic Nanoparticles as Heterogeneous Activator of Persulfate[J]. Journal of Hazardous Materials, 2011, 186(2/3): 1398-1404. [9] 邹东雷,王红艳,杨金玲,等.Fenton试剂氧化-微电解-接触氧化法处理丙烯腈废水实验研究[J]. 吉林大学学报:地球科学版, 2007, 37(4): 793-797. Zou Donglei, Wang Hongyan, Yang Jinling, et al. Study on the Treatment of Acrylonitrile Wastewater by Fenton Reagent,Micro-Electrolysis and Biological Contact Oxidation Process[J]. Journal of Jilin University :Earth Science Edition, 2007, 37(4): 793-797. [10] Yang S Y, Wang P, Yang X, et al. A Novel Advanced Oxidation Process to Degrade Organic Pollutants in Wastewater: Microwave-Activated Persulfate Oxidation[J]. Journal of Environmental Sciences, 2009, 21(9): 1175-1180. [11] Liu C S, Shih K, Sun C X, et al. Oxidative Degradation of Propachlor by Ferrous and Copper Ion Activated Persulfate[J]. Science of Total Environment, 2012, 416: 507-512. [12] Oh S Y, Kim H W, Park J M, et al. Oxidation of Polyvinyl Alcohol by Persulfate Activated with Heat, Fe2+,and Zero-Valent Iron[J].Journal of Hazardous Materials, 2009, 168(1): 346-351. [13] Huang K C, Couttenye R A, Hoag G E. Kinetics of Heat-Assisted Persulfate Oxidation of Methyl Tert-Butyl Ether (MTBE)[J]. Chemosphere, 2002, 49: 413-420. [14] Xie X F, Zhang Y Q, Huang W L, et al. Degradation Kinetics and Mechanism of Aniline by Heat-Assisted Persulfate Oxidation[J]. Journal of Environmental Sciences, 2012, 24(5): 821-826. [15] Huang K C, Zhao Z Q, Hoag G E, et al. Degradation of Volatile Organic Compounds with Thermally Activated Persulfate Oxidation[J]. Chemosphere, 2005, 61(4): 551-560. [16] Lin Y T, Liang C J, Chen J H. Feasibility Study of Ultraviolet Activated Persulfate Oxidation of Phenol[J]. Chemosphere, 2011, 82(8): 1168-1172. [17] Li S X, Hu W. Decolourization of Acid Chrome Blue K by Persulfate[J]. Procedia Environmental Sciences, 2011, 10: 1078-1084. [18] Oh S Y, Kang S G, Chiu P C. Degradation of 2,4-Dinitrotoluene by Persulfate Activated with Zero-Valent Iron[J]. Science of Total Environment, 2010, 408(16): 3464-3468. [19] Oh S Y, Kang S G, Kim D W, et al. Degradation of 2,4-Dinitrotoluene by Persulfate Activated with Iron Sulfides[J]. Chemical Engineering Journal, 2011, 172(2/3): 641-646. [20] Do S H, Kwon Y J, Kong S H. Effect of Metal Oxides on the Reactivity of Persulfate/Fe(II) in the Remediation of Diesel-Contaminated Soil and Sand[J]. Journal of Hazardous Materials, 2010, 182(1/2/3): 933-936. [21] Xu X R, Li X Z. Degradation of Azo Dye Orange G in Aqueous Solutions by Persulfate with Ferrous Ion[J]. Separation and Purification Technology, 2010, 72(1): 105-111. [22] Li S X, Wei D, Mak N K, et al. Degradation of Diphenylamine by Persulfate: Performance Optimization,Kinetics and Mechanism[J]. Journal of Hazardous Materials, 2009, 164(1): 26-31. [23] Teel A L, Ahmad M, Watts R J. Persulfate Activation by Naturally Occurring Trace Minerals[J]. Journal of Hazardous Materials, 2011, 196: 153-159. [24] Ahmad M, Teel A L, Watts R J. Persulfate Activation by Subsurface Minerals[J]. Journal of Contaminant Hydrology, 2010, 115(1/2/3/4): 34-45. [25] Roshani B, Leitner N K. Effect of Persulfate on the Oxidation of Benzotriazole and Humic Acid by E-Beam Irradiation[J]. Journal of Hazardous Materials, 2011, 190(1/2/3): 403-408. [26] Lee Y C, Lo S L, Chiueh P T, et al. Efficient Decomposition of Perfluorocarboxylic Acids in Aqueous Solution Using Microwave-Induced Persulfate[J]. Water Research, 2009, 43(11): 2811-2816. [27] Liang C J, Wang Z S, Bruell C J. Influence of pH on Persulfate Oxidation of TCE at Ambient Temperatures[J]. Chemosphere, 2007, 66(1): 106-113. [28] Waldemer R H, Tratnyek P G, Johnson R L, et al. Oxidation of Chlorinated Ethenes by Heat-Activated Persulfate Kinetics and Products[J]. Environmental Science and Technology, 2007, 41(3): 1010-1015. [29] Hori H, Yamamoto A, Hayakawa E, et al. Efficent Decomposition of Environnentally Persistent Perfluorocarboxylic Acids by Use of Persulfate as a Photochemical Oxidant[J]. Environment Science Technology, 2005, 39(7): 2383-2388. [30] Minisci F, Citterio A. Electron-Transfer Processes:Peroxydisulfate, a Useful and Versatile Reagent in Organic Chemistry[J]. Accounts of Chemical Research, 1983, 16(1): 27-32. [31] Anipsitakis G P, Dionysiou D D. Radical Generation by the Interaction of Transition Metals with Common Oxidants[J]. Environmental Science and Technology, 2004, 38(13): 3705-3712. [32] Kurniawan T A, Lo W H. Removal of Refractory Compounds from Stabilized Landfill Leachate Using an Integrated H2O2Oxidation and Granular Activated Carbon (GAC) Adsorption Treatment[J]. Water Research, 2009, 43(16): 4079-4091. [33] Ince N H, Apikyan I G. Conbination of Activated Carbon Adsorption with Light-Enhanced Chemical Oxidation via Hydrogen Peroxide[J]. Water Research, 2000, 34(17): 4169-4176. [34] Liang C J, Lin Y T, Shih W H. Treatment of Trichloroethylene by Adsorption and Persulfate Oxidation in Batch Studies[J]. Industrial & Engineering Chemistry Research, 2009, 48(18): 8373-8380. [35] 杨鑫,杨世迎,王雷雷,等. 活性炭催化过二硫酸盐降解水中AO7[J]. 环境科学,2011,32(7):1960-1966. Yang Xin, Yang Shiying, Wang Leilei, et al. Activated Carbon Catalyzed Persulfate Oxidation of Azo Dye Acid Orange 7 in Aqueous Solution[J]. Environmental Science, 2011, 32(7): 1960-1966. [36] Lehmann J, Joseph S. Biochar for Environmental Management[M]. London: Earthscan,2009. [37] Chen B L, Zhou D D, Zhu L Z. Transitional Adsorption and Partition of Nonpolar and Polar Aromatic Contaminants by Biochars of Pine Needles with Different Pyrolytic Temperatures [J]. Environment Science Technology, 2008, 42(14): 5137-5143. [38] Cao X D, Ma L N, Gao B, et al. Dairy-Manure Derived Biochar Effectively Sorbs Lead and Atrazine[J]. Environment Science Technology, 2009, 43(9): 3285-3291. [39] Liu Z G, Zhang F S. Removal of Lead from Water Using Biochars Prepared from Hydrothermal Liquefaction of Biomass[J]. Journal of Hazardous Materials, 2009, 167(1/2/3): 933-939. [40] Reymond J P, Kolenda F. Estimation of the Point of Zero Charge of Simple and Mixed Oxides by Mass Titration[J]. Power Technology, 1999, 103(1): 30-36. [41] Weng C H, Lin Y T, Chen Y J, et al. Spent Green Tea Leaves for Decolourisation of Raw Textile Industry Wastewater[J]. Coloration Technology, 2013, 129(4): 298-304. [42] Georgi A, Kopinke F D. Interaction of Adsorption and Catalytic Reactions in Water Decontamination Processes[J]. Applied Catalysis B: Environmental, 2005, 58(1/2): 9-18. [43] Keiluweit M,Nico P S,Johnson M G,et al.Dynamic Molecular Structure of Plant Biomass-Derived Black Carbon (Biochar)[J]. Environment Science Technology, 2010, 44(4): 1247-1253. [44] Chun Y, Sheng G Y, Chiou C T, et al. Compositions and Sorptive Properties of Crop Residues-Derived Chars[J]. Environmental Science and Technology, 2004, 38(17): 4649-4655. Biochar Catalyzed Persulfate Decoloration of Azo Dye Acid Orange 7 Liu Na, Wang Liu, Qiu Hua, Alberto Bento Charrua, Wang Hang, Wang Rui College of Environment and Resources, Jilin University, Changchun 130021, China As a kind of inexpensive material-biochar, the function of soil restoration and other aspects has caused wide public concern, but its catalytic role has been studied rarely. The feasibility of persulfate (PS) catalyzed by biochar(BC) to decolor an azo dye (acid orange (AO7)) was studied. Some factors influencing the decolorizing efficiency of PS/BC system were evaluated, including pH, concentration of biochar and PS/AO7 mole ratio. What’s more, the recycle effect and characteristics of biochar were studied.Results showed that the decolorizing effect of the PS/BC system was obviously better than the only PS system. The decoloration of AO7 by both reaction systems followed first order reaction kinetics. The optimum pH of PS/BC system was near-neutral. The higher the biochar concentration, the better the decolorizing effect was. Similar trend was observed for the PS/AO7 mole ratio, whereas the catalytic effect did not increase accordingly. The reused biochar could still decolor AO7. The BC holes were mostly located on the surface of the layered structure, and most of them were blocked after repeated use. Excluding ash and oxygen, content of elements (C, N, H, S) reduced at a certain degree. Many different surface functional groups of BC were mainly C=O, C=C, C-O, C-H, aromatic C=C and C-H and -OH. The absorption peak of -OH disappeared after repeated use. All the above, pine biochar could catalize persulfate to decolorize azo dye -AO7, and the principle was that, the sulfate free radical which was produced by the reaction of -OH function group on the surface of biochar and persulfate could remove AO7. biochar; persulfate; azo dye; acid orange 7 10.13278/j.cnki.jjuese.201406209. 2014-04-25 国家自然科学基金项目(41072170);吉林省科技厅应用基础研究项目(20030550) 刘娜(1976--),女,教授,博士生导师,主要从事环境生物技术方面的研究,E-mail:liuna@jlu.edu.cn。 10.13278/j.cnki.jjuese.201406209 X506 A 刘娜,王柳,邱华,等.生物炭催化过硫酸盐脱色偶氮染料金橙Ⅱ.吉林大学学报:地球科学版,2014,44(6):2000-2009. Liu Na , Wang Liu , Qiu Hua, et al.Biochar Catalyzed Persulfate Decoloration of Azo Dye Acid Orange 7.Journal of Jilin University:Earth Science Edition,2014,44(6):2000-2009.doi:10.13278/j.cnki.jjuese.201406209.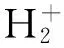
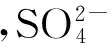
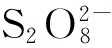


3 结论
