不同树种叶片非结构性碳水化合物季节动态比较1)
2014-08-02王文娜李俊楠王会仁谷加存
王文娜 李俊楠 王会仁 谷加存
(东北林业大学,哈尔滨,150040)
不同树种叶片非结构性碳水化合物季节动态比较1)
王文娜 李俊楠 王会仁 谷加存
(东北林业大学,哈尔滨,150040)
以红皮云杉(Piceakoraiensis)、落叶松(Larixgmelinii)、黄波椤(Phellodendronamurense)和水曲柳(Fraxinusmandshurica)人工纯林为研究对象,于生长季每月初测定其当年生叶和1年生叶(红皮云杉)可溶性糖、淀粉和总非结构性碳水化合物质量分数,研究树种和叶龄对叶片非结构性碳水化合物及其组分的影响。结果表明:红皮云杉与其他树种非结构性碳水化合物及其组分的季节动态有明显的不同。各树种不同月份叶片可溶性糖波动均较大(1.0%~95.5%),但是除红皮云杉外,其余树种淀粉变化相对较小(2.7%~30.5%);叶片总非结构性碳水化合物质量分数与淀粉的季节动态相似,黄波椤叶片总非结构性碳水化合物与可溶性糖和淀粉相关性均不显著,而其他树种和叶龄叶片与淀粉显著正相关;树种对叶片总非结构性碳水化合物、可溶性糖和淀粉质量分数影响均显著,月份仅对可溶性糖质量分数影响显著(P=0.017),树种和月份的交互作用对可溶性糖和淀粉影响显著;不同叶龄红皮云杉叶片非结构性碳水化合物及其组分季节动态有明显差异,其中除10月份外1年生叶可溶性糖质量分数均高于当年生叶。
可溶性糖;淀粉;当年生叶;1年生叶;温带森林
Soluble sugar; Starch; Current-year leaf; One-year-old leaf; Temperate forest
非结构性碳水化合物,包括可溶性糖,即葡萄糖、果糖、蔗糖、果聚糖等,以及淀粉都是参与植物生命代谢的重要物质[1]。非结构性碳水化合物,在植株体内的代谢很大程度上影响着植物的生长及其对环境的响应[2-4]。叶片是植物主要的光合器官,是碳水化合物的源[5]。当整株植物处于充足的碳水化合物供应水平时,叶片中存在非结构性碳水化合物的积累,从而导致光合作用的下调;相反,当碳水化合物需求超过供应时,叶片中的非结构性碳水化合物水平降低,并伴随着叶片光合速率的提高[6]。因此,叶片非结构性碳水化合物对树木生理状况和资源供应敏感,能够很好地指示树木的生理状态和碳供应水平。
树种自身遗传特性、生长阶段、经营措施、环境因子等均对树木叶片非结构性碳水化合物水平有重要的影响[7-9]。例如,Hoch等[10]研究发现,3种常绿树种中淀粉,总非结构性碳水化合物(Total nonstructural carbohydrate,可溶性糖和淀粉质量分数之和)的季节动态与其余7个落叶树种叶片存在明显不同的季节格局。于丽敏等[5]的研究显示,7月中旬蒙古栎和落叶松中可溶性糖质量分数显著小于红松,而淀粉和总非结构性碳水化合物则没有显著的差异。显然,树木叶片非结构性碳水化合物动态与树种(或生活型)和取样季节可能有重要的联系,但是不同气候区水分和热量的季节分布存在明显差异,因此,以往研究结果是否具有普遍性需要在更广泛的范围内进行检验,以便更全面地认识树木非结构性碳水化合物的季节动态和种间变异规律。为此,本文选择东北帽儿山地区常见的4个树种为研究对象,即常绿针叶:红皮云杉(Piceakoraiensis);落叶针叶:落叶松(Larixgmelinii);落叶阔叶:水曲柳(Fraxinusmandshurica)和黄波椤(Phellodendronamurense),以叶片为研究材料,通过一个生长季对每月初可溶性糖、淀粉和总非结构性碳水化合物质量分数的连续测定,试图解决:1)可溶性糖、淀粉和总非结构性碳水化合物质量分数是否存在明显的种间差异;2)不同树种(生活型)叶片非结构性碳水化合物及其组分质量分数的季节动态如何;对于红皮云杉,叶片年龄如何影响其季节动态。同时明确影响非结构性碳水化合物季节动态的潜在因素。这些结果将为了解不同树种的生长动态、生理状况和潜在机制提供重要的理论依据。
1 研究区概况
研究地点位于黑龙江省尚志市,东北林业大学帽儿山林场尖砬沟森林培育实验站(127°30′~127°34′E,45°21′~45°25′N)。该地区属温带大陆性季风气候,平均海拔300 m,坡度为10°~15°;属于长白山系张广才岭西北坡,小岭余脉,为松嫩平原向张广才岭过渡的低山丘陵区。年平均气温2.8 ℃,1月平均温度-23 ℃,7月平均气温20.9 ℃。年平均降水量723 mm,年平均蒸发量1 094 mm。无霜期120~140 d,≥10 ℃的积温2 526 ℃。研究林分位于山坡中部(海拔300~400 m),土壤为暗棕壤,平均土层厚度在40~50 cm。
2 研究方法
2.1 叶片样品的采集
选择彼此毗邻的红皮云杉、落叶松、黄波椤、水曲柳人工纯林为取样林分(林分面积>5 hm2),林分为1986年栽植,株行距为1.5 m×2.0 m,2007年秋季林分平均胸径分别为:(7.0±0.6)、(12.3±0.1)、(5.0±0.1)、(9.8±0.7)cm。于2010年生长季的6—10月初,随机取3株优势木作为样株,用高枝剪取树冠阳面中上部枝条及叶片样品。每次随机取3株优势木作为样株,在树冠阳面中上部剪取叶片,每个样株至少包括3个枝条上的叶片样品,手工摘掉后混匀。因为云杉针叶为多年生,因此将其针叶区分为当年生叶和1年生叶进行比较研究,根据针叶所处枝条位置和针叶的颜色,将位于分支末端,浅黄色枝条上着生的嫩绿针叶作为当年生叶;末端枝条以上的第一轮分枝,黄或深黄色枝条上着生的深绿色针叶作为1年生叶。叶片样品先放入封口袋并带回实验室置于微波炉中杀青(高火2 min)[11],然后将叶片样品进行冻干(48 h)、粉碎,粉碎后样品用于测定可溶性糖、淀粉以及总非结构性碳水化合物质量分数。
2.2 非结构性碳水化合物的测定
称取约40 mg已粉碎的叶片样品,用改进的酚—硫酸法分两步分别测定叶片的可溶性糖和淀粉质量分数,可溶性糖和淀粉质量分数之和作为叶片总非结构性碳水化合物质量分数[12]。
2.3 数据处理
本研究中每次取样单元为样株(n=3),计算平均数和标准误差。采用多重比较(LSD检验)分析不同树种叶片可溶性糖、淀粉与总非结构性碳水化合物浓度的差异,显著性水平设定为α=0.05;采用双因素方差分析检验树种和取样时间对可溶性糖、淀粉与总非结构性碳水化合物质量分数的影响(其中不包括红皮云杉6月数据,因为其他树种该月份未取样);采用线性回归的方法,考察总非结构性碳水化合物与可溶性糖、淀粉的相关性。统计分析在SPSS17.0 for Windows(SPSS,USA)中完成;采用SigmaPlot 10.0软件作图。
3 结果与分析
3.1 不同树种叶片可溶性糖和淀粉的季节动态
树木组织中可溶性糖和淀粉季节变化的格局,在一定程度上能够表征树木的活力和代谢水平[13]。树种间可溶性糖和淀粉最明显的差异体现在云杉与其余3个树种之间,虽然4树种叶片可溶性糖质量分数均具有明显季节动态,但是除红皮云杉以外其余树种淀粉质量分数季节动态并不明显(图1)。各树种叶片可溶性糖质量分数波动值为8.2~50.1 mg·g-1;淀粉波动值为45.9~173.0 mg·g-1。除红皮云杉当年生叶可溶性糖以外,其他树种叶片和红皮云杉1年生叶可溶性糖质量分数季节变化规律性相似,均在7月至8月上升(相对变化值1.0%~55.6%),8月达到高峰,9月开始下降直至10月(4.3%~59.8%);而红皮云杉当年生叶片可溶性糖从6月份开始持续降低,但在9—10月间迅速增加(95.5%)(图1A)。6—10月期间,除红皮云杉以外的树种叶片淀粉质量分数的季节波动幅度较小,6—7月红皮云杉当年生叶淀粉质量分数增加(相对变化值52.3%),而1年生叶淀粉质量分数降低(相对变化值57.5%);9—10月红皮云杉当年生叶淀粉质量分数下降10.4%,其他叶片均呈上升趋势(2.7%~30.5%)(图1B)。笔者结果与Wong等[13]研究一致,糖槭(Acersaccharum)叶片淀粉质量分数在6—7月降低,可溶性糖质量分数则增加。这可能是因为树木生长旺期大量的光合产物向树体其他生长部位运输,而没有能够以淀粉形式储存。落叶松和其他落叶阔叶树种叶片9—10月可溶性糖质量分数的普遍下降(除红皮云杉当年生叶),可能是生长季末期光合作用减弱所致;而红皮云杉当年生叶片可溶性糖迅速增加(此时1年生叶迅速降低),可能在于可溶性糖质量分数的增加,有助于提高红皮云杉当年生针叶对冬季低温胁迫的抵抗能力[6],同时可能也存在1年生叶可溶性糖向当年生叶的转移,但是这需要进一步的研究,如采用同位素标记方法。总体上,各树种叶片可溶性糖和淀粉质量分数的季节变化大致呈相反的趋势。于丽敏等[5]针对东北地区落叶松(Larixgmelinii)、红松(Pinuskoraiensis)和蒙古栎(Quercusmongolica)的研究也发现,叶片中可溶性糖和淀粉相对质量分数呈现出显著的互补关系。这也说明叶片中可溶性糖和淀粉之间的相互转化在不同树种之间可能是较为普遍的。
3.2 不同树种总非结构性碳水化合物季节动态
红皮云杉当年生和1年生针叶,总非结构性碳水化合物质量分数分别在7月和6月具有高峰,而其他树种高峰值出现在随后月份。总体上,7月份以后,除红皮云杉在6月具有高峰以外,各树种总非结构性碳水化合物质量分数的季节波动较小,与淀粉季节动态相似(图1B,表1)。Hoch等[10]也发现6—11月温带常绿和落叶树种叶片,总非结构性碳水化合物质量分数变化格局较相似。回归分析表明,总非结构性碳水化合物质量分数的变化,受可溶性糖和淀粉影响程度不同,黄波椤叶片总非结构性碳水化合物质量分数与可溶性糖和淀粉的相关性均不显著,前者能够解释总非结构性碳水化合物变异的33%,后者为32%;相反,其余树种和叶片类型变异主要受淀粉的影响,淀粉能够解释总非结构性碳水化合物变异的42%~99%(表2),这些结果也说明为什么总非结构性碳水化合物与淀粉的季节动态接近。淀粉对总非结构性碳水化合物季节动态的普遍影响,可能是因为淀粉质量分数高于可溶性糖,前者占总非结构性碳水化合物质量分数比例较大(56.9%~90.1%),所以淀粉质量分数很大程度上决定了总非结构性碳水化合物的季节变化;而黄波椤可溶性糖和淀粉季节变化均较弱,所以两者对总非结构性碳水化合物的影响均不显著。

A.可溶性糖质量分数B.淀粉质量分数

不同小写字母表示树种(叶龄)间差异显著(P<0.05)。
注:“—”为没有当期数据;表中数据为平均值±标准误;同列不同小写字母表示树种间差异显著。

表2 不同树种(叶龄)叶片总非结构性碳水化合物与可溶性糖和淀粉的相关性
3.3 不同叶龄云杉针叶非结构性碳水化合物季节动态的差异
本研究的另一重要发现是,红皮云杉1年生和当年生叶片非结构性碳水化合物动态存在明显差异(图1和表1)。红皮云杉1年生叶片可溶性糖除10月份以外,均高于当年生叶片;而1年生叶片淀粉从6—7月急剧下降(相对变化值57.5%),当年生叶片淀粉和1年生叶片可溶性糖明显的增加(相对变化值52.3%和1.4%)(图1)。为了树木节约运输成本,非结构性碳水化合物的活化和运输常常发生在两个距离最近的源和汇[6]。因此,我们推测红皮云杉1年生叶片淀粉的迅速降低,一方面是为了供给自身对碳水化合物的需求,因为此时其可溶性糖在缓慢地增加;另一方面,此时当年生叶片处于叶面积构建期,因此,其构建也消耗了1年生叶片部分淀粉。
3.4 树种和月份对非结构性碳水化合物质量分数的影响
双因素方差分析表明,树种对总非结构性碳水化合物及其组分均有显著影响(P<0.05,表3),而月份(取样时间)仅对可溶性糖有显著影响(P<0.01,表3)。6月、7月份树种间总非结构性碳水化合物质量分数差异较大(变异系数35.6%~36.7%),之后月份树种差异较小(变异系数14.8%~20.9%)。相比较,树种间可溶性糖和淀粉质量分数差异较大,变异系数分别为18.1%~53.5%和9.1%~56.1%。黄波椤的总非结构性碳水化合物及其组分质量分数均高于水曲柳,红皮云杉总非结构性碳水化合物及其组分质量分数高于落叶松(除红皮云杉当年生叶的可溶性糖外)。于丽敏等[5]也发现常绿针叶树种红松叶片总非结构性碳水化合物质量分数高于落叶针叶树种落叶松,与本研究相一致。此外,相同生活型树种总非结构性碳水化合物变化也有一定的规律性,两个阔叶树种的总非结构性碳水化合物及其组分的季节动态相似,针叶树中红皮云杉当年生叶和落叶松针叶可溶性糖在7月至10月具有相似的动态。因此,为更科学的评价树种间差异,应该尽可能地涵盖更多的树种生活型。
表3 树种和取样月份对叶片可溶性糖、淀粉和总非结构性碳水化合物的双因素方差分析
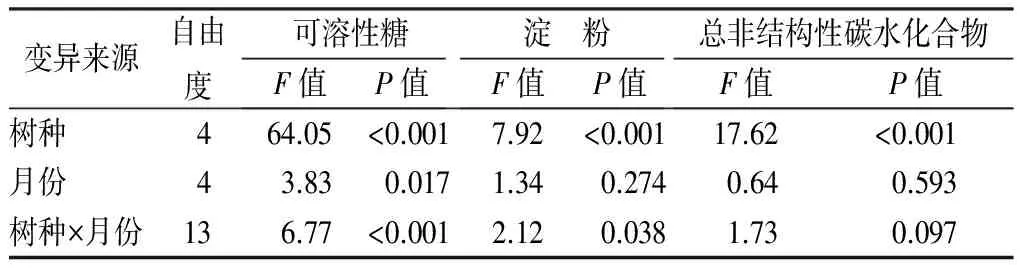
变异来源自由度可溶性糖F值P值淀 粉F值P值总非结构性碳水化合物F值P值树种464.05<0.0017.92<0.00117.62<0.001月份43.830.0171.340.2740.640.593树种×月份136.77<0.0012.120.0381.730.097
4结论
本研究中4树种叶片可溶性糖质量分数具有明显的季节动态,与之相比,淀粉季节动态并不明显(红皮云杉除外)。红皮云杉不同年龄的叶片非结构性碳水化合物及其组分的季节变化也存在差异,1年生叶和当年生叶间在夏季可能存在一定的物质交换过程。黄波椤的总非结构性碳水化合物质量分数变化与可溶性糖和淀粉的相关性均不显著,而其他树种季节变化主要由淀粉引起。树种对叶片总非结构性碳水化合物及其组分的质量分数均有显著影响,而取样月份仅显著影响可溶性糖质量分数,树种和月份的交互作用对可溶性糖和淀粉影响显著。相同生活型的树种非结构性碳水化合物及其组分有相似的季节动态。这些结果显示,叶片非结构性碳水化合物及其组分季节动态有明显的种间差异,反映了树木当期的生长动态和生理水平,但叶龄和生活型对其动态也有影响。
[1] 潘庆民,韩兴国,白永飞,等.植物非结构性贮藏碳水化合物的生理生态学研究进展[J].植物学通报,2002,19(1):30-38.
[2] Koch K E. Carbohydrate-modulated gene expression in plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1996,47:509-540.
[3] Vanden E W, Laere A V, Roover J D. Effect of nitrogen concentration on fructan and fructan metabolizing enzymes in young chicory plants (Cichoriumintybus)[J]. Physiologia plantarum,1999,105(1):1399-3054.
[4] Loewe A, Einig W, Shi L, et al. Mycorrhiza formation and elevated CO2both increase the capacity for sucrose synthesis in source leaves of spruce and aspen[J]. New Phytologist,2000,145(3):565-574.
[5] 于丽敏,王传宽,王兴昌.三种温带树种非结构性碳水化合物的分配[J].植物生态学报,2011,35(12):1245-1255.
[6] Kozlowski T T. Carbohydrate Sources and Sinks in Woody Plants[J]. The Botanical Review,1992,58(2):107-222.
[7] Litton C M, Ryan M G, Knight D H. Effects of tree density and stand age on carbon allocation patterns in postfire lodgepole pine[J]. Ecological Applications,2004,14(2):460-475.
[8] 平晓燕,周广胜,孙敬松.植物光合产物分配及其影响因子研究进展[J].植物生态学报,2010,34(1):100-111.
[9] Rachmilevitch S, Huang B, Lambers H. Assimilation and allocation of carbon and nitrogen of thermal and nonthermal Agrostis species in response to high soil temperature[J]. New Phytologist,2006,170(3):479-490.
[10] Hoch G, Richter A, Körner C. Non-structural carbon compounds in temperate forest trees[J]. Plant Cell & Environment,2003,26(7):1067-1081.
[11] Popp M, Lied W, Meyer A J, et al. Sample preservation for determination of organic compounds: microwave versus freeze-drying[J]. Journal of Experimental Botany,1996,47(17):1469-1473.
[12] Guo D L, Mitchell R J, Hendricks J J. Fine root branch orders respond differentially to carbon source-sink manipulations in a longleaf pine forest[J]. Oecologia,2004,140(3):450-457.
[13] Wong B L, Baggett K L, Rye A H, et al. Seasonal patterns of reserve and soluble carbohydrates in mature sugar maple (Acersaccharum)[J]. Canadian Journal of Botany,2003,81:780-788.
1) 中央高校基本科研业务费(DL12CA06);国家自然科学基金项目(31100470)。
王文娜,女,1989年3 月生,东北林业大学林学院,硕士研究生。
谷加存,东北林业大学林学院,讲师。E-mail:gjchun001@163.com。
2013年10月20日。
S718.43
Seasonal Dynamics of Leaf Nonstructural Carbohydrate Content in Four Temperate Tree Species/Wang Wenna, Li Junnan, Wang Huiren, Gu Jiacun(Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University.-2014,42(4).-46~49,108
责任编辑:潘 华。
To determine the effect of tree species and leaf age on the seasonal dynamics of leaf soluble sugar, starch and total nonstructural carbohydrate, we quantified nonstructural carbohydrate and its component concentrations monthly of current-year leaf (needle) ofPiceakoraiensis,Larixgmelinii,Fraxinusmandshurica,Phellodendronamurense, and one-year-old needle ofP.koraiensisin pure plantation during one growing season. There is large discrepancy in the seasonal pattern of nonstructural carbohydrate betweenP.koraiensisand other tree species. There is large variation in monthly soluble sugar content (1.0%-95.5%), but small in starch content (2.7%-30.5%) except forP.koraiensis. The seasonal dynamic of the total nonstructural carbohydrate content across tree species is similar to starch. Total leaf nonstructural carbohydrate content has no correlation with soluble sugar and starch inP.amurense(P>0.05), but positive correlation with starch in the other tree species (P<0.05). By two-way ANOVA, tree species significantly affects the contents of total nonstructural carbohydrate, soluble sugar and starch (P<0.05), but sampling time only significantly influences the soluble sugar content (P=0.017), and their interaction has markedly influence on soluble sugar and starch concentration (P<0.05). There is distinct difference in the seasonal dynamics of nonstructural carbohydrate and its components between current-year and one-year-old needle ofP.koraiensis, and one-year-old needle always has larger soluble sugar content than that in current-year needle except in October.
