梅花PmICE1基因的克隆及低温条件下的表达1)
2014-08-02张启翔郝瑞杰徐宗大杨炜茹
曹 宁 张启翔 郝瑞杰 徐宗大 王 涛 杨炜茹
(北京林业大学,北京,100083) (国家花卉工程技术研究中心)(北京林业大学) (花卉种质创新与分子育种北京市重点实验室(北京林业大学))
梅花PmICE1基因的克隆及低温条件下的表达1)
曹 宁 张启翔 郝瑞杰 徐宗大 王 涛 杨炜茹
(北京林业大学,北京,100083) (国家花卉工程技术研究中心)(北京林业大学) (花卉种质创新与分子育种北京市重点实验室(北京林业大学))
以梅花(Prunusmume)品种‘三轮玉蝶’为试材,根据苹果(Malusdomestica)MdCIbHLH1基因序列在梅花基因组数据库中搜索同源序列并设计引物,通过PCR、RT-PCR获得ICE1基因的DNA、cDNA全长序列。cDNA全长1 626 bp,含有完整的开放阅读框,编码541个氨基酸,基因编码区上存在3个内含子和4个外显子,含有bHLH区、富S区、核定位信号区(NLS)和转膜区。ExSAPy在线预测编码蛋白呈亲水性,亚细胞定位预测目的蛋白位于细胞核(98%)。BLAST分析结果表明,其cDNA序列及推导的氨基酸序列均与苹果、茶(Camelliasinensis)、甜杨(Populussuaveolens)、枳(Poncirustrifoliata)等物种的ICE1具有较高同源性,推断克隆到的cDNA可能是梅花ICE1基因,命名为PmICE1。实时荧光定量分析结果表明,在4 ℃低温胁迫下,PmICE1基因表达量随胁迫时间的延长呈上升趋势,16 h时达到峰值,说明该基因在低温胁迫下呈上调表达。
梅花;ICE1转录因子基因;抗寒性;实时荧光定量PCR
Prunusmume;ICE1 transcription factor gene; Cold resistance; Relative real-time PCR
梅花(PrunusmumeSiebold & Zucc)是中国传统名花,自然分布在长江及淮河流域[1]。由于梅花抗寒性较差,抗寒育种一直是梅花育种的重要方向[2]。目前,在梅花抗寒育种方面已有较多研究,但多为通过引种对现有资源加以利用,很难有效地提高梅花的抗寒能力[3]。研究梅花的低温响应机制,了解梅花抗寒的分子机理,并以此为基础进行分子育种是从根本上解决梅花耐寒问题、使梅花栽培范围向北推广的重要手段。
众多研究表明,植物的抗寒性是由多基因控制的数量性状,低温响应受复杂的网络调控[4],因此可调控多个抗寒基因表达的转录因子(TFs)已成为抗寒研究的热点[5]。其中转录因子ICE1(Inducer of CBF3 expression 1)可特异地结合到CBF3启动子的MYC作用元件(CANNTG)上,并诱导CBF/DREB1等下游抗寒基因的转录表达[6-7]。Chinnusamy等[6]发现拟南芥ICE1突变体耐寒力明显下降,进一步研究表明ICE1基因在拟南芥低温胁迫应答中起着关键性的作用[7]。从苹果(Malusdomestica)、枳(Poncirustrifoliata)、赤桉(Eucalyptuscamaldulensis)、菊花(Chrysanthemumgrandiflorum)中分离出的ICE1类似基因MdICE1[8]、MdCIbHLH1[9]、PtrICE1[10]、EcaICE1[11]、CdICE1[12]都证明转录因子ICE1能有效地提高植株的抗寒能力。此外,将拟南芥ICE1基因导入尤力克柠檬[133]、大花蕙兰[14]、烟草[15]、番茄[16]等物种中,也均获得了抗寒性明显提高的转基因植株。
本研究以梅花品种‘三轮玉蝶’为试验材料,通过RT-PCR克隆到梅花中的第一个ICE1基因,并对该基因进行生物信息学分析及表达模式探讨,以期为梅花低温应答的分子机理研究提供理论依据,并为梅花抗寒育种奠定分子基础。
1 材料与方法
试验材料为北京林业大学鹫峰基地的梅花品种‘三轮玉蝶’,于2012年4月采集生长状况良好、长势一致且着生叶片的枝条,经培养箱4 ℃低温处理后,采集叶片液氮速冻在冰箱中-80 ℃备用。
1.1 DNA、RNA的提取及cDNA合成
采用天根公司快速DNA提取检测试剂盒、百泰克公司通用植物总RNA提取试剂盒(离心柱型)提取梅花叶片DNA、总RNA,1%的琼脂糖凝胶电泳检测RNA完整性。反转录参照TIANScript RT Kit(天根)说明书进行。将DNA、cDNA放置于-20 ℃保存,用于基因克隆。
1.2PmICE1基因的克隆
选择苹果MdCIbHLH1转录因子基因的序列(GenBank ID:EF495202.1)为模板,根据课题组梅花全基因组测序的结果[17],本地Blast获取同源性高达83%的梅花基因序列全长。
在预测序列开放阅读框(ORF)两侧设计特异引物,上游引物:5’-GGAGATCTAGAGAAAATGCTGCCT-3’(下划线为BglⅡ酶切位点),下游引物:5’-GGTAACCGCAATCTATATCAAGCC-3’(下划线为BstEⅡ酶切位点)。以梅花叶片DNA、cDNA为模板,进行PCR、RT-PCR扩增,反应体系为:2×PCR Mix(TaKaRa)12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板1 μL,ddH2O补足25 μL。扩增程序:94 ℃,预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸90 s,共35个循环;最后72 ℃延伸10 min。PCR、RT-PCR产物采用琼脂糖凝胶电泳检测,使用Promega Gel extraction kit DNA凝胶回收试剂盒回收RT-PCR产物。将回收的目的片段连接在pGEM-T Easy载体上,连接产物转化大肠杆菌Top10,挑取阳性克隆送往擎科生物技术有限公司测序。
1.3 序列的生物信息学分析
利用NCBI上的Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)、ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)和Ban-kit服务器(http://www.ncbi.nlm.nih.gov/BankIt/)进行核酸和氨基酸同源序列搜索、保守域预测、开放阅读框预测和序列在线提交。用EXPASy的ProtParam在线程序(http://web.expasy.org/protparam/)分析蛋白的分子量、理论等电点以及疏水性等。用WoLF PSORT(http://psort.hgc.jp/form.html)对PmICE1进行亚细胞定位。利用DNAMAN软件比对保守域。MEGA 5.0软件构建系统发育树,采用Neighbor-joining(NJ)算法的Complete deletion模式建树,Bootstrap值取1 000。
1.4PmICE1、PmCBF1基因实时荧光定量PCR表达
以4 ℃低温胁迫处理0.5、1、4、6、8、12、16、24、48、72、96、134 h的梅花叶片的cDNA为模板进行实时荧光定量PCR分析,以未低温处理材料为对照。
使用Primer 5.0软件对PmICE1、梅花PmCBF1基因[18]、内参EF1α基因[19]设计特异引物(见表1)。提取样品总RNA,并用核酸定量仪(Thermo NanoDrop 2000)测定RNA浓度,分别以3 μg总RNA为模板反转录成cDNA第一链备用。将cDNA进行10倍梯度稀释(1∶1,1∶10,1∶100,1∶1 000,1∶10 000),并作为模板进行荧光定量PCR,获得标准曲线,选择稀释10倍的cDNA模板浓度。反应在Thermo实时定量PCR仪上进行,方法参照荧光定量试剂盒SYBR PrimeScriptTM RT-PCR Kit(TaKaRa)说明书进行。
荧光定量PCR扩增体系为:cDNA模板2 μL,SYBR Premix Ex TaqTM10 μL,上、下游特异引物(10 μmol/L)各0.4 μL,补ddH2O至20 μL。扩增程序采用两步法:95 ℃预变性30 s;95 ℃变性5 s,65 ℃复性30 s,共40个循环。每个样品设3次反应重复,分别设置水对照和总RNA对照。利用PikoReal Software以及Excel进行数据分析。目的基因相对表达量=2-ΔΔCT,其中ΔCT(对照)=CT(PmICE1,对照)-CT(EF1α,对照),ΔCT(胁迫)=CT(PmICE1,胁迫)-CT(EF1α,胁迫),ΔΔCT=ΔCT(胁迫)-ΔCT(对照)[20]。
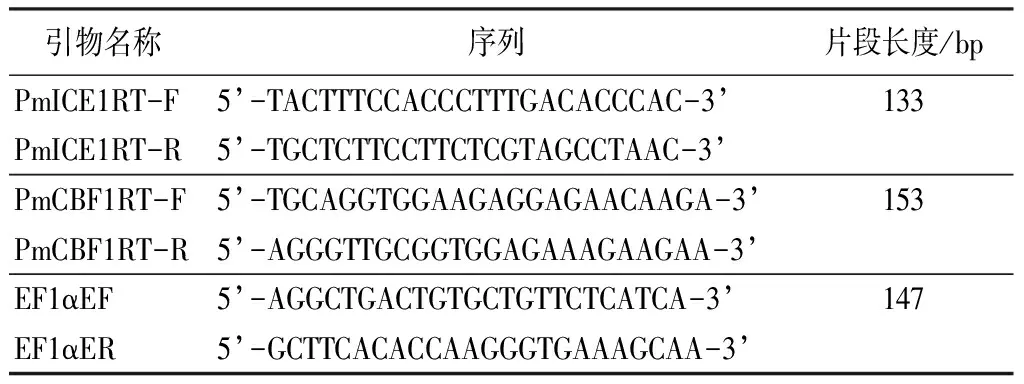
表1 引物序列
2 结果与分析
2.1PmICE1基因的获得及序列分析
用特异性引物分别以梅花DNA、cDNA为模板进行PCR扩增,获得全长2 782和1 626 bp(图1)的片段,与基因组序列完全一致。Blast比对发现,在PmICE1基因编码区存在3个内含子和4个外显子,外显子长度分别为1 143、228、171和84 bp(图2)。与苹果(MdCIbHLH1)、拟南芥(AtICE1、AtICE2)等物种的ICE1基因的结构具有一致性[4]。
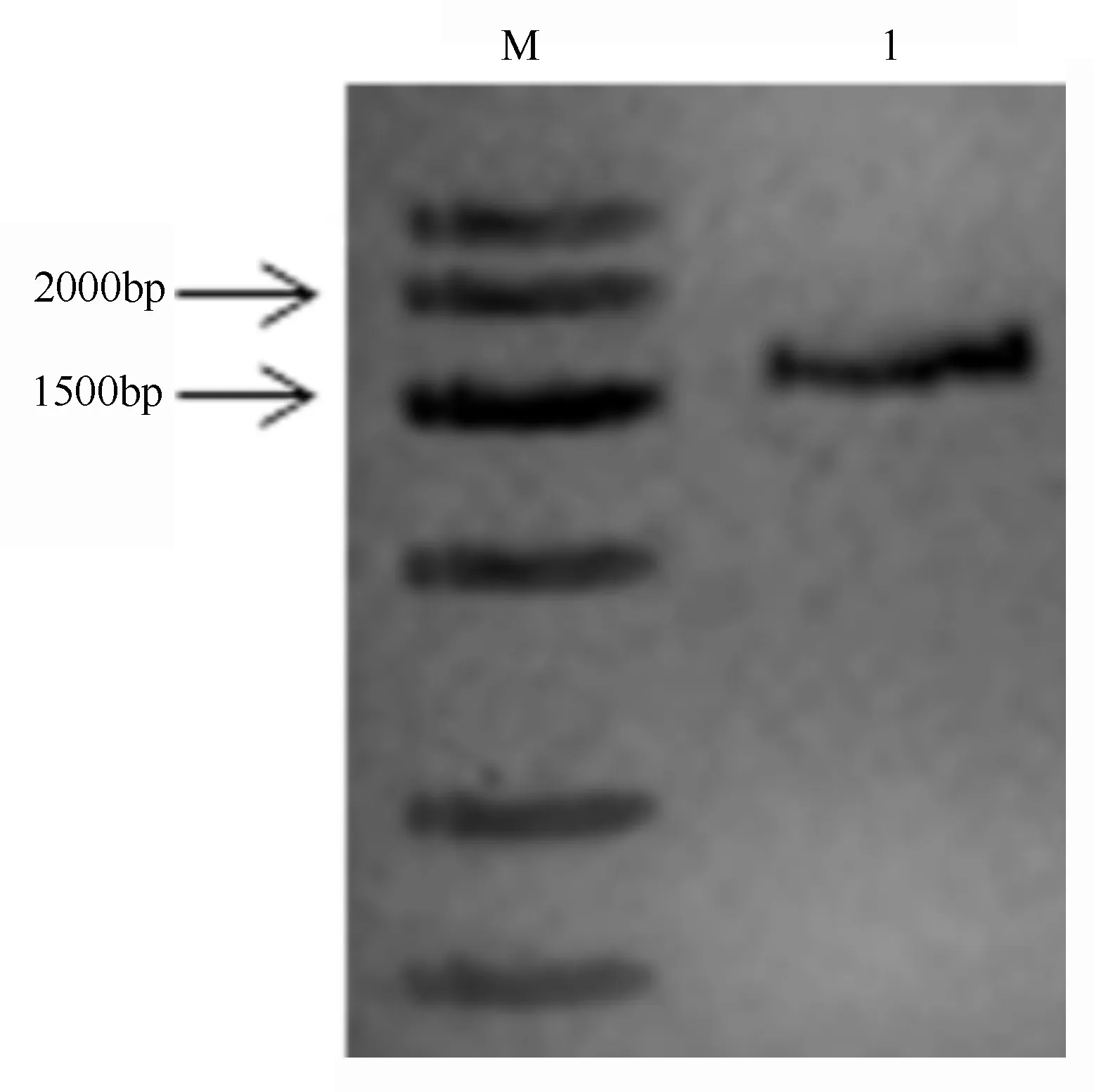
M为Marker(天根Marker Ⅶ);1为cDNA RT-PCR。
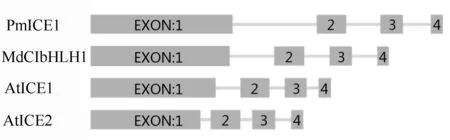
图2 PmICE1,MdCIbHLH1与AtICEs的基因组结构
目的基因PmICE1的cDNA具有一个完整编码框,可编码541个氨基酸。使用ExSAPy在线Prot-Param分析预测出该基因编码的蛋白分子量为58.96 kD,等电点pI为5.381。编码的氨基酸序列中,Leu含量最高(11.76%),Ser含量其次(10.67%),Gly含量居第三(8.82%),含量最低的是Trp(0.55%)。PmICE1的氨基酸根据其侧链的性质分为疏水氨基酸(34.19%)和亲水氨基酸(65.81%),说明编码的ICE1蛋白为亲水性蛋白,这与甜杨、赤桉等抗寒转录因子ICE1蛋白非常相似[12]。另外,PmICE1序列中含有8个Cys,分别位于第35、99、144、185、444、474、502和516位氨基酸,彼此间隔较近,表明PmICE1可能含有二硫键,这对维持稳定结构及顺利行使功能具有重要的意义。
用WoLF PSORT对PmICE1蛋白进行亚细胞定位,结果显示PmICE1蛋白有98%的几率被定位于细胞核。ART数据库Smart分析表明,PmICE1含有富S区、核定位信号(NLS)区和转膜区(图3),表明PmICE1可能为转录因子,通过NLS区和转膜区的作用进入细胞核调控基因的表达。
2.2 PmICE1蛋白分析
Blast结果表明,梅花PmICE1与拟南芥ICE1蛋白质序列的同源性为49%,与苹果MdCIbHLH1蛋白序列同源性高达83%。使用MEGA5.0将PmICE1推测蛋白质与已发表物种的ICE1蛋白序列作系统进化树(图4),蛋白聚类分析表明,物种间的聚类基本符合物种的演化规律。
多重比对结果显示,梅花与拟南芥、芥菜以及苹果ICE1蛋白质序列在C端高度保守,是一个包含60个氨基酸残基的Helix-Loop-Helix保守区(图5)。
2.3 梅花PmICE1基因低温诱导表达
在低温胁迫过程中,梅花PmICE1基因的表达有一定程度的上调,处理4 h后,PmICE1基因表达量大幅上升,16 h时达到最大值后逐渐下降。梅花CBF基因PmCBF1[18]在低温处理后8 h表达量大幅上升,16 h时达到最大值,随后下降(表2)。说明PmICE1、PmCBF1基因的表达均受低温胁迫的诱导,可能在梅花低温胁迫过程中起作用,且PmCBF1表达较PmICE1滞后。

表2 低温胁迫下PmICE1和PmCBF1基因的相对表达量
注:表中数据为平均值±标准差。
3 结论与讨论
植物抗寒性属多基因控制的数量性状,单个功能性蛋白基因的超表达,较难提高植物抗寒性。抗寒功能性蛋白的启动子上往往含有相同的转录因子调控元件,一个转录因子的超表达可激活多个CORs基因的表达,有效提高植物的抗寒性[21]。低温胁迫下,比较拟南芥野生种和ICE1突变体在基因组转录水平上的变化,约1/3的冷调节基因受到影响[7]。作为ICE1-CBF-COR通路的上游启动因子,ICE1基因的表达会触发下游多种基因的表达,从而提高植物的抗寒能力。此外,ICE1基因只有在低温胁迫下才会激活CBF/DREB途径,诱导抗寒基因的表达,包括物质代谢和生长发育的相关基因,从而增强植物对低温环境的抵抗能力[6],这一机制可有效减少植株的能量损失,从而保证植物正常的生长发育。

PmICE1的始终密码子、富S区、NLS区和转膜区分别用下划线+黑体、下划线、阴影、阴影+下划线表示。
本研究以苹果基因MdCIbHLH1为模板,采用同源克隆的方法,从梅花中分离出第一个梅花ICE1(PmICE1)基因。该基因与拟南芥的AtICE1[6]、AtICE2[22]及苹果MdCIbHLH1[9]基因组结构相似,均含有4个外显子和3个内含子,且外显子氨基酸的数量由多到少顺序:外显子1>外显子2>外显子3>外显子4,说明PmICE1基因与拟南芥ICEs类基因的基因组结构高度相似。同时可发现,梅花和苹果ICE1基因的氨基酸数量明显多于拟南芥,这可能是由于木本生物拥有更复杂的调控方式。
序列比对结果显示,PmICE1与苹果和茶树、甜杨、枳等物种的ICE1具有较高的同源性,尤其在bHLH保守功能域,同源性在90%以上,该区域对于DNA结合至关重要[23],进一步说明PmICE1可能是ICE1在梅花中的同源基因。
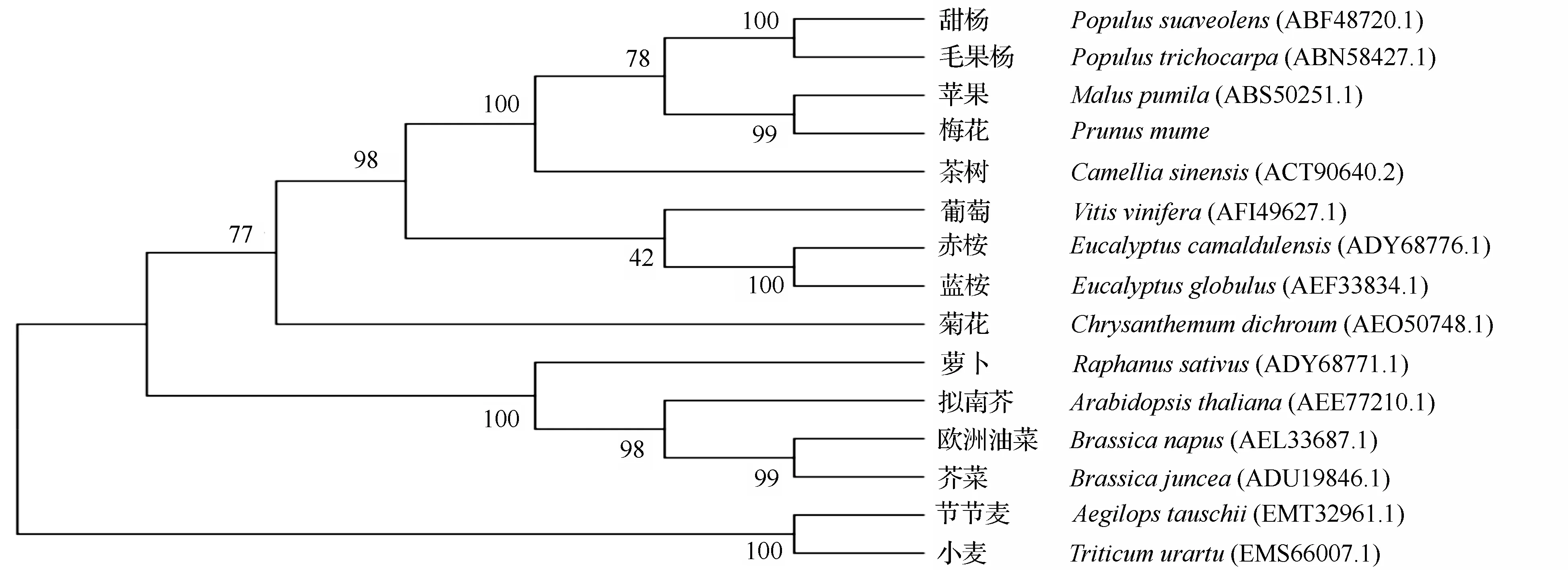
节点上的数值表示Bootstrap验证中基于1 000次重复该节点可信度的百分比。

图5 PmICE1与其他ICE1转录因子的bHLH区域高度保守
PmICE1基因在低温胁迫下的表达分析表明,该基因受低温胁迫的诱导,为其是低温胁迫转录因子提供了证据。已有研究表明,在转录调控中,上游基因的表达水平变化早于下游基因,如拟南芥中CBFs在冷处理条件下的诱导表达早于CORs[7]。本研究发现PmCBF1基因在低温胁迫下表达量的变化趋势与前人研究结果[18]完全一致,PmICE1基因在低温胁迫条件下的诱导表达早于PmCBF1基因,说明PmICE1基因在低温胁迫条件下激活了PmCBF1基因的表达。
本研究证明了梅花中存在有PmICE1基因,基于PmICE1基因在低温条件下的表达明显上调,我们推测在梅花中可能存在ICE1抗寒机制,但对于PmICE1基因的抗寒分子机理还有待于进一步的研究。
[1] 陈俊愉.中国梅花[M].海口:中国海南出版社,1996.
[2] 刘晓倩,张启翔.国内梅花资源与育种研究进展[J].山东林业科技,2008,38(2):63-65.
[3] 李庆卫,吴君,陈俊愉,等.乌鲁木齐抗寒梅花品种区域试验初报[J].北京林业大学学报,2012,34(2):50-51.
[4] Warren G J. Cold stress: manipulating freezing tolerance in plants[J]. Current Biology,1998,15(8):514-516.
[5] 李瑞梅,惠杜娟,刘姣,等.植物抗寒转录因子CBF和ICE研究进展[J].广东农业科学,2012,48(23):132-138.
[6] Chinnusamy V, Ohta M, Kanrar S, et al. ICE1: a regulator of cold-induced transcription and freezing tolerance in Arabidopsis[J]. Genes & Development,2003,17(8):1043-1054.
[7] Lee B H, Henderson D A, Zhu J K. The arabidopsis cold-responsive transcription and its regulation by ICE1[J]. Plant Cell,2005,17(11):3155-3175.
[8] 赵玲玲.苹果MdSAMMDC2和MdICE1基因的功能鉴定以及抗逆性研究[D].泰安:山东农业大学,2007.
[9] Feng Xiaoming, Zhao Qiang, Zhao Lingling, et al. The cold-induced basic helix-loop-helix transcription factor gene MdCIbHLH1 encodes an ICE-like protein in apple[J]. BMC Plant Biology,2012,12:1186-1193.
[10] 刘德春.枳PtrICE1、PtrHOS1和PtrLOS2基因克隆及PtrICE1遗传转化研究[D].武汉:华中农业大学,2010.
[11] Lin Yuanzhen, Zheng Huiquan, Zhang Qian, et al. Functional profiling of EcaICE1 transcription factoer gene from Eucalyptus camaldulensis involved in cold response in tobacco plants[J]. Journal of Plant Biochemistry and Biotechnology,2013,22:187-192.
[12] Chen Lin, Chen Yu, Jiang Jiafu, et al. The constitutive expression ofChrysanthemumdichrumICE1 in Chrysanthemum grandiflorum improves the level of low temperature, salinity and drought tolerance[J]. Plant Cell Reports,2012,31(9):1747-1758.
[13] Huang J Q, Sun Z H.Agrobacteriummediated transfer of arabidopsis ICE1 gene into lemon[J]. Agricultural Sciences in China,2005,4(9):714-720.
[14] 张瑜,向殿军,殷奎德.农杆菌介导的大花蕙兰转ICE1基因[J].中国农学通报,2008,25(12):40-43.
[15] 郑银英,崔百明,常明进,等.转拟南芥ICE1基因增强烟草抗寒性的研究[J].西北植物学报,2009,29(1):75-79.
[16] 张玉,蒋欣梅,于锡宏.ICE1基因表达载体的构建及对番茄的转化[J].中国蔬菜,2010,30(18):27-33.
[17] Zhang Q X, Chen W B, Sun L D, et al. The genome ofPrunusmume[J]. Nature Communacations,2012,3(2):1-8.
[18] 张杰,张启翔,杨炜茹.梅花CBF转录因子的克隆及表达[J].西北植物学报,2012,32(8):1505-1510.
[19] Dube A, Bisaillon M, Perreault J P. Identification of proteins fromPrunuspersicathat interact with peach latent mosaic viroid[J]. Journal Of Virology,2009,83(23):12057-12067.
[20] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,2001,25(4):402-408.
[21] 向殿军,殷奎德,满丽莉,等.萝卜低温胁迫转录因子的克隆及遗传转化[J].西北植物学报,2011,31(10):1933-1941.
[22] Fursova O V, Pogorelko G V, Tarasov V A. Identification of ICE2, a gene involved in cold acclimation which determines freezing tolerance inArabidopsisthaliana[J]. Gene,2009,429(1/2):98-103.
[23] Carretero Paulet L, Galstyan A, Roig Villanova I, et al. Genome-wide classification and evolutionary analysis of the bHLH family of transcription factors inArabidopsis,Poplar, rice, moss, and algae[J]. Plant Physiol,2010,153(3):1398-1412.
1) 国家“863”计划项目(2011AA100207、2013AA102607)。
曹宁,女,1989年1月生,北京林业大学园林学院,硕士研究生。
张启翔,国家花卉工程技术研究中心,教授。E-mail:zqxbjfu@126.com。
2013年11月8日。
S685.17
Molecular Cloning and Expression Analysis of Cold-Resistant Transcription FactorPmICE1 fromPrunusmume/Cao Ning(Beijing Forestry University, Beijing 100083, P. R. China); Zhang Qixiang(National Engineering Research Center for Floriculture); Hao Ruijie, Xu Zongda, Wang Tao(Beijing Forestry University); Yang Weiru(Beijing Key Laboratory of Ornamental Plants Germplasm Innovation and Molecular Breeding, Beijing Forestry University)//Journal of Northeast Forestry University.-2014,42(4).-21~25
责任编辑:潘 华。
A putative sequence of ICE1 gene was identified in the genome database ofPrunumumeaccording to the ICE1 transcription factor of Apple (Malusdomestica)MdCIbHLH1 gene.ICE1 gene was isolated fromPrunusmume‘San Lun Yu Die’ by PCR and RT-PCR. A 1 626-bp cDNA clone was obtained including a putatively entire open reading frame (ORF) and encodes a protein of 541 amino acids. The coding regions of the gene include three introns and four exons. The predicted PmICE1 protein contains a typical bHLH domain, a serine-rich region (S-rich), a nuclear localization signal (NLS), a transmembrane domain, N-glycosylation and kinase phosphorylation sites. ExSAPy online predictive coding protein is hydrophilic. The possibility of location in the nucleus is 98% according to the subcellular localization prediction. By bioinformatics analysis, the cDNA is highly homologous to ICE1 fromMalusdomestica,Camelliasinensis,PoncirustrifoliataandPopulussuaveolens, and the cloned sequence may be a new member ofICE1 gene inPrunusmume. By relative real-time PCR experiment, the expression ofPmICE1 gene increases at 4 ℃ at beginning and achieves the highest after 16 hours. Therefore,PmICE1 increases under low temperature stress.
