I-107欧美杨对不同强度干旱胁迫的形态与生理响应1)
2014-08-02井大炜邢尚军马海林杜振宇刘方春马丙尧
井大炜 邢尚军 马海林 杜振宇 刘方春 马丙尧
(德州学院,德州,253023) (山东省林业科学研究院)
I-107欧美杨对不同强度干旱胁迫的形态与生理响应1)
井大炜 邢尚军 马海林 杜振宇 刘方春 马丙尧
(德州学院,德州,253023) (山东省林业科学研究院)
为了探讨杨树苗对干旱胁迫的适应能力,通过盆栽试验,研究了不同干旱胁迫处理对杨树苗生长、生物量分配、光合色素以及内源激素的影响。结果表明:在中度和重度胁迫下,杨树苗的基径、株高、叶片数和总叶面积均显著低于对照,而在轻度胁迫下的基径和株高与对照差异不显著。随着胁迫强度的增加,叶、茎和根的干质量、胁迫指数和总干质量逐渐降低,而根/冠比显著升高;叶的分配指数逐渐降低,根的逐渐升高。叶绿素(Chla、Chlb和Chl(a+b))及类胡萝卜素(Car)均随着干旱胁迫增强而呈减小趋势,但Chla/Chlb和Chl/ Car的变化趋势相反。生长素、赤霉素和玉米素随着胁迫强度的加剧逐渐降低,而脱落酸先升高后降低。综合分析认为,杨树苗在轻度水分胁迫下具有较强的形态和生理适应性,而在中度和重度胁迫下明显减弱。
杨树;干旱胁迫;生物量分配;光合色素;内源激素
当前正在发生的全球环境变化已经、并将继续引起全球水热格局的重新分布,从而将对全球植物产生严重影响[1]。干旱是我国面临的重要的生态问题,所导致的经济损失巨大。据统计,我国干旱、半干旱地区约占国土面积的50%[2]。因此,植物对干旱的生理生态适应机制一直都是植物生理生态学的热点问题之一。在水分胁迫下,植物的生理、形态和结构等各方面均受到影响,而研究它们的变化规律对于揭示其抗旱能力和抗旱机理具有重要意义[3]。
杨树是北方平原与沙区营造防护林和用材林的主要树种,品种繁多,栽培面积大,在生态环境治理和解决木材短缺方面均占有重要地位。但是,在没有灌溉条件的干旱、半干旱地区,杨树生长受到了严重的抑制,从而限制了这种优良树种的经济和生态效益的发挥[4]。随着近年来对杨树研究的日益深入,其在干旱条件下的耗水特性和水分利用效率[5]、光合作用及叶绿素荧光特性[6]等均已被报道,但是关于杨树在水分胁迫下的生物量积累和分配以及内源激素变化规律的研究却鲜有报道。幼苗是树木存活和更新的重要阶段,幼苗的耐旱性可能对森林植被的恢复和重建起着重要的作用[7]。为此,文中通过盆栽试验,以1年生I-107欧美杨为对象,设置4个水分梯度,研究杨树苗的形态结构、生物量积累和分配、叶绿素以及内源激素对不同水分胁迫的响应,探寻杨树苗对干旱胁迫的适应机制。为了解杨树最适土壤水分条件和合理指导林业抚育提供科学依据。
1 材料与方法
试验地点设在山东省林业科学研究院试验苗圃,供试土壤为潮土,土壤速效氮、速效磷、速效钾质量分数分别为27.96、26.52、79.00 mg·kg-1,有机质质量分数为6.83 g·kg-1。所用化肥为尿素、过磷酸钙和氯化钾,用量分别为7.72、16.17、6.57 g。杨树扦插苗品种为I-107欧美杨,接穗长15~16 cm,茎粗2 cm,质量25~27 g。试验用盆为购自市场的塑料盆,盆高20 cm,宽30 cm。于2011年4月13日盆栽试验时,将肥料与土壤充分混匀后装盆,每盆装土10.5 kg,进行正常栽培管理。
2011年6月19日进行水分胁迫,每盆充分灌溉,使土壤含水量一致,停止灌溉后等土壤自然落干进行干旱胁迫,测定的田间持水量为32.65%。试验共设4个土壤水分处理:正常水分(对照,CK),为田间持水量的65%~75%;轻度干旱胁迫(LS),为田间持水量的55%~65%;中度干旱胁迫(MS),为田间持水量的45%~55%;重度干旱胁迫(SS),为田间持水量的35%~45%。每处理5盆,每盆1株。
用称质量法控制土壤含水量,使之保持相应的土壤湿度,每天早晚称质量两次,补充当天失去的水分,使各处理保持设定的含水量。在试验中,为防止自然降雨对处理的影响,搭建了塑料拱棚。在一般情况下,棚膜收起,以保证四周通风,使生长环境除降水外,与自然环境接近。降水时,放下棚膜。在胁迫120 d后,把每处理的5株幼苗,分根、茎、叶分别取样;并将每株幼苗顶端往下第5至第8片完全舒展并且成熟的功能叶放入冰壶中,迅速带回实验室进行光合色素和内源激素的测定。
生长、生物量积累及分配:株高和地径分别用游标卡尺和卷尺测定;利用叶面积仪扫描的方法获得叶面积;在80 ℃下将根、茎、叶烘干至恒质量并分别称量;比叶面积(SL,A)=叶面积/叶片质量;株高胁迫指数=胁迫处理株高/对照处理株高;干物质量胁迫指数(WS,I)=胁迫处理器官干物质量/对照处理器官干物质量;分配指数=植株器官干物质量/植株总干质量[8]。
光合色素:取0.1 g新鲜叶片剪碎混匀,用80%的丙酮在低温、黑暗条件下浸泡至叶片完全变白。浸提液过滤、定容后用UV-265型紫外可见分光光度计在波长646、663和470 nm下比色,分别测定叶绿素a(Chla)、叶绿素b(Chlb)和类胡萝卜素(Car)的吸光值,计算Chla、Chlb、Car质量分数以及Chla/Chlb和Chl/Car的值[9]。
内源激素测定:采用高效液相色谱法,使用美国Agilent HP 1100 series型液相色谱仪,紫外检测波长254 nm,过C18柱(250 mm×4.6 mm),流动相为V(甲醇)∶V(水,其中含0.5%醋酸)=45∶55,进样量20 μL,流速1 mL·min-1。外标法定量[10]。
采用SPSS 17.0统计软件进行数据统计,用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)比较不同处理组数据的差异(P<0.05)。
2 结果与分析
2.1 干旱胁迫对杨树苗生长特征的影响
表1显示不同强度干旱胁迫下杨树苗的生长参数及其变化特点。可以看出,轻度胁迫下的基径、株高和株高胁迫指数与对照差异不显著,但叶片数、总叶面积和比叶面积却显著低于对照;同对照相比,中度和重度胁迫显著降低了杨树苗的基径、株高、株高胁迫指数、叶片数和总叶面积,而比叶面积与对照无显著差异。可见,随着胁迫强度的加剧,除比叶面积外,杨树苗的其他生长参数值均逐渐降低,分别在重度胁迫下达到最小值,其中,叶片数和总叶面积的下降幅度最大,相对于对照分别降低了67.50%和75.17%。
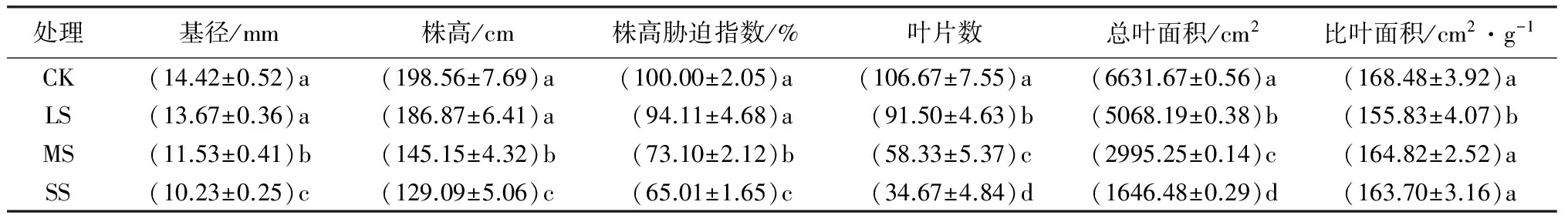
表1 不同干旱胁迫下杨树苗的生长特征
注:表中数据为平均值±标准差;同列不同小写字母表示处理间差异显著(P<0.05)。
2.2 干旱胁迫对杨树苗干物质积累与分配的影响
如表2所示,3种水分胁迫下各器官的干物质量均受到了不同程度的抑制作用。其中,轻度胁迫下各器官的干质量与对照差异不显著,而在中度和重度胁迫下均显著低于对照。在对照、轻度和中度胁迫下,不同器官之间的干质量变化规律由大到小的顺序是:茎、叶、根;而在重度胁迫下,由于叶片有明显的干枯脱落现象,使干质量小于根。随着胁迫强度的增加,叶片的WS,I下降最快,其次是茎,最慢的是根,即各器官的WS,I由大到小的顺序是:根、茎、叶;总干质量呈现显著降低的趋势,而根/冠比呈显著升高的趋势。与对照相比,在轻度、中度和重度胁迫下的总干质量分别降低了15.39%、45.64%、62.65%,而根/冠比分别增加了13.13%、45.10%、80.42%。
由表3可见,不同强度干旱胁迫下杨树苗的生物量在叶、茎和根中的分配发生了明显的变化。随着干旱胁迫强度的增加,叶片的分配指数逐渐降低,茎的分配指数变化较小,而根的分配指数呈逐渐升高的趋势。方差分析表明,轻度胁迫下的叶、茎和根的分配指数与对照差异不显著;在中度和重度胁迫下,叶和根的分配指数与对照相比差异显著,而茎的分配指数与对照差异不显著。
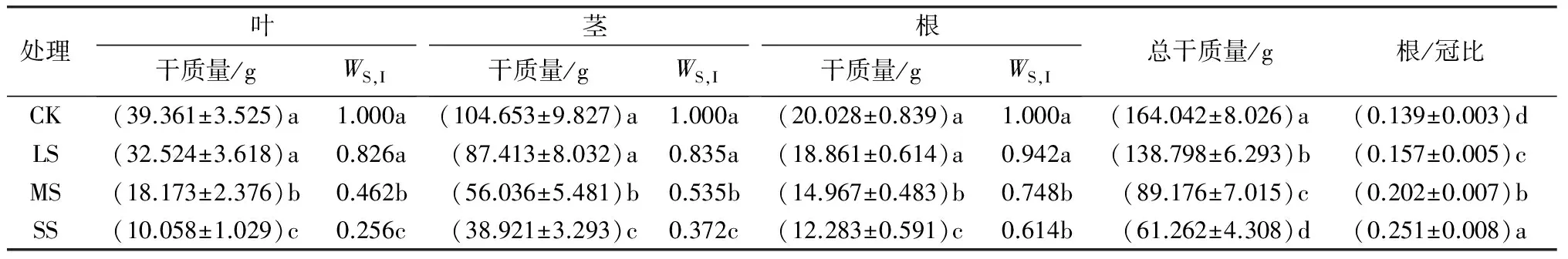
表2 不同干旱胁迫下杨树苗植株各器官干物质量、胁迫指数及根冠比
注:表中干质量数据为平均值±标准差;同列不同小写字母表示处理间差异显著(P<0.05)。
2.3 干旱胁迫对杨树苗叶片光合色素的影响
由表4可见,杨树苗叶片中Chla、Chlb、Chl和Car的质量分数在不同干旱胁迫下表现出相似的变化规律,都随着干旱胁迫加强呈降低趋势。方差分析表明,Chla、Chlb和Chl在轻度胁迫下与对照差异不显著,而在中度和重度胁迫下均显著低于对照;Car质量分数在不同胁迫强度下均达显著差异。Chla、Chlb、Chl和Car的质量分数均在重度胁迫下达到最低值,同对照相比,分别降低了52.84%、68.54%、58.11%和69.44%。相反,Chla/Chlb和Chl/Car随着干旱胁迫强度的加剧呈升高趋势,中度和重度胁迫下的Chla/Chlb和Chl/Car均显著高于对照,而轻度胁迫下与对照无显著差异。

表3 不同干旱胁迫下杨树苗植株各器官的分配指数
注:表中数据为平均值±标准差;同列不同小写字母表示处理间差异显著(P<0.05)。
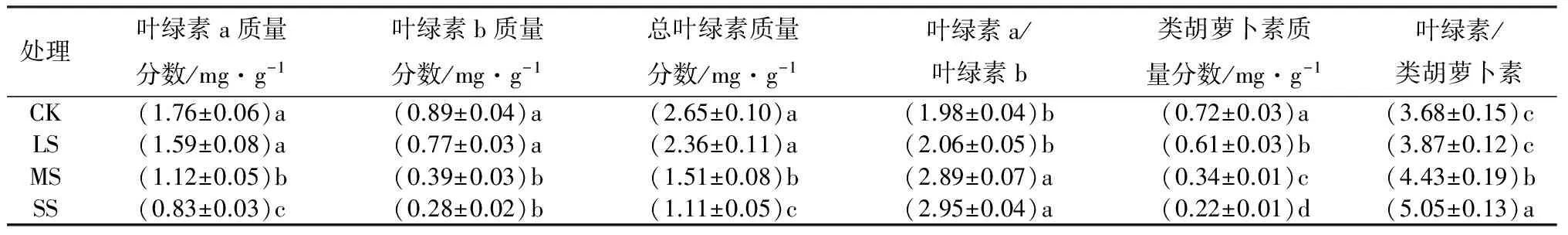
表4 不同干旱胁迫下杨树苗叶片的光合色素质量分数
注:表中数据为平均值±标准差;同列不同小写字母表示处理间差异显著(P<0.05)。
2.4 干旱胁迫对杨树苗叶片内源激素的影响
从表5可见,生长素、赤霉素和玉米素的质量分数随着胁迫强度的增加逐渐降低,分别在重度胁迫下达到最低值,同对照相比,分别下降了79.45%、46.14%、73.56%。脱落酸质量分数随着胁迫强度的增加呈先升高后降低的变化趋势,在轻度胁迫下达到最大值,比对照增加了142.11%;而在中度和重度胁迫下开始下降。方差分析表明,生长素和赤霉素在轻度胁迫下与对照差异不显著,而在中度和重度胁迫下均显著低于对照;玉米素和脱落酸在3种水分胁迫下与对照均达显著差异。
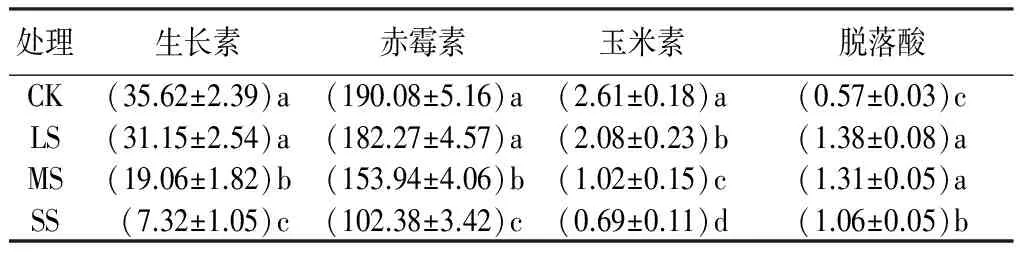
表5 不同干旱胁迫下杨树苗叶片中内源激素的质量分数 μg·g-1
注:表中数据为平均值±标准差;同列不同小写字母表示处理间差异显著(P<0.05)。
3 结论与讨论
叶片特征变化直接影响光合作用的效率和净光合产量。由于叶片是水分消耗的重要器官,其在干旱胁迫条件下的变化是维持植物体内水分平衡的重要表现。本项研究结果中,干旱胁迫降低了杨树苗的叶片数、总叶面积和叶片生物量,这与干旱条件下大部分植物的反应基本一致[11-12]。这主要是因为植物可通过降低叶片数和减小叶面积来降低植物的蒸腾速率,以维持体内水分的相对充足[13]。在轻度水分胁迫下,杨树苗的比叶面积显著低于对照,而比叶面积的降低表明干旱胁迫条件下叶片厚度的增加,可增加水分在叶片中的传导距离,减少体内水分损失[14]。郑淑霞等[15]在油松和刺槐中的研究表明,比叶面积的降低与水分利用效率的提高和叶片的保护存在着一定的联系。可见,比叶面积降低是杨树苗适应轻度水分胁迫的一种表现。在中度和重度胁迫下的比叶面积与对照差异不显著,这是不是杨树苗对中度和重度水分胁迫的一种适应性反应呢,还有待于进一步的研究。另外,本试验中杨树苗的基径、株高和株高胁迫指数在轻度胁迫下与对照无显著差异,而在中度和重度胁迫下均显著低于对照,这表明杨树苗在中度和重度胁迫下生长所受的抑制作用较大。
多数研究认为,植物通过增加地下生物量分配,提高根/冠比值来适应土壤干旱[16];也有研究认为,根/冠比值随土壤水分胁迫的加剧呈现先降后升或先升后降的趋势[17]。本研究发现,在轻度胁迫下,根的干物质量下降速度小于叶片,使根/冠比显著高于对照。这说明轻度干旱对杨树苗地上生物量的抑制程度要大于对地下生物量的抑制。干旱促使杨树苗干物质分配发生了改变,优先供应根系生长,产生更加协调的根冠关系以加强对土壤水分的利用,这是杨树苗抵抗轻度干旱逆境的一种适应性机制。同对照相比,在中度和重度胁迫下的根/冠比的增加幅度更大。但是通过进一步分析发现,中度和重度胁迫下的根生物量相比对照有显著的降低,同时伴随有部分叶片的干枯脱落,使叶片的数量、干物质量、胁迫指数和分配指数均明显的下降,在重度胁迫下尤为严重。可见,根/冠比的增大并不代表植物根量同比例增大,更不能说明植物耐旱能力提高。本试验中,由于叶片的干枯脱落现象,导致叶片干物质量的下降速度明显快于根系,从而就出现了根/冠比增加而耐旱能力提高的假象。
干旱胁迫条件下,植物体叶绿素质量分数的变化指示植物对水分胁迫的敏感性,并直接影响光合产量[11]。但关于干早胁迫下叶绿素质量分数的变化有不同结论。有研究认为,水分胁迫条件下,叶绿素质量分数提高10%~25%[18];也有研究认为,在干旱条件下叶绿素质量分数明显下降[19]。本试验表明,在中度和重度胁迫下,同对照相比,杨树苗的Chla、Chlb和Chl的质量分数均显著下降,可能的原因有两个:一是干旱胁迫直接导致叶绿素的降解;二是干旱胁迫造成植株对营养元素的吸收困难,而引起缺素症状,表现为叶绿素质量分数降低,叶片黄化等[20]。另外,Chla/Chlb的值随着水分胁迫加剧逐渐增大,表明Chlb比Chla更容易受到干旱的伤害。
Car既是光合色素,又是内源抗氧化剂,它可以耗散过剩光能,清除活性氧,从而防止膜脂过氧化,保护光合机构。本试验中,Car质量分数随着胁迫程度的增加而显著降低,表明Car的抗氧化能力在逐渐减弱。本试验还发现,Chl/Car在中度和重度胁迫下明显升高,而Chl/Car能反映植物光能吸收和光保护的关系,其值高低与植物耐受逆境的能力有关[21]。Chl/Car的显著升高说明Car的下降幅度大于Chl,可能是由于杨树苗在中度和重度胁迫下的光合结构遭到了较严重的破坏所致。
生长素、赤霉素、玉米素是植物体内促进植物生长发育的激素,因此,受到干旱胁迫时,这类激素的质量分数会发生变化,以协调植株的生理活动,适应环境的变化[22]。本试验中,内源生长素质量分数在轻度胁迫下与对照无显著差异,而在中度和重度胁迫下显著低于对照。这可能是因为生长素是由植物顶端组织和生长的叶片合成的,当杨树苗遭遇较严重的干旱胁迫时,叶片生长受到了明显的抑制,导致合成生长素部位的减少,而生长素与生长组织之间存在着一个互动的平衡反馈关系。随着胁迫强度的增加,赤霉素和玉米素质量分数也表现出相似的变化规律。
脱落酸主要是由根产生的,它是一种对植物生长、发育、抗逆性、气孔运动和基因表达等都有重要调节功能的植物激素,有研究表明,在水分亏缺时,脱落酸的一个重要生理功能就是促进离子流出保卫细胞从而降低保卫细胞膨压,诱导气孔关闭,降低水分损耗,增加植物在干旱条件下的保水能力[23]。本试验研究发现,与对照相比,脱落酸质量分数在轻度胁迫下增加的幅度最大,这表明杨树苗在轻度水分胁迫下具有较强的保水能力,抵御干旱能力较强;在中度和重度胁迫下,脱落酸的质量分数并没有继续升高,反而有所下降。这可能是由于随着胁迫强度的加剧,杨树苗的部分根系受损或坏死,根生物量下降所致。这也说明杨树苗在中度和重度水分胁迫下的抵抗能力是很有限的。
[1] 王云龙,许振柱,周广胜.水分胁迫对羊草光合产物分配及其气体交换特征的影响[J].植物生态学报,2004,28(6):803-809.
[2] 王宇超,王得祥,彭少兵,等.干旱胁迫对木本滨藜生理特性的影响.林业科学,2010,46(1):61-67.
[3] Meyer W S, Walker S. Leaflet orientation in water stressed soybeans[J]. Agronomy Journal,1981,73:1071-1074.
[4] 侯庆春,韩蕊莲.黄土高原植被建设中的有关问题[J].水土保持通报,2000,20(2):53-56.
[5] 杨建伟,梁宗锁,韩蕊莲,等.不同干旱土壤条件下杨树的耗水规律及水分利用效率研究[J].植物生态学报,2004,28(5):630-636.
[6] 付士磊,周永斌,何兴元,等.干旱胁迫对杨树光合生理指标的影响[J].应用生态学报,2006,17(11):2016-2019.
[7] 徐飞,郭卫华,徐伟红,等.刺槐幼苗形态、生物量分配和光合特性对水分胁迫的响应[J].北京林业大学学报,2010,32(1):24-30.
[8] 李国龙,吴海霞,温丽,等.甜菜苗期抗旱鉴定指标筛选及其综合评价[J].干旱地区农业研究,2011,29(4):69-74.
[9] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000,134-137.
[10] 张敬敏,邢尚军,桑茂鹏,等.不同水分下腐殖酸对杨树生理生化特性和生长的影响[J].水土保持学报,2010,24(6):200-203.
[11] Wu Fangzong, Bao Wukai, Li Fanlu, et al. Effects of water stress and nitrogen supply on leaf gas exchange and fluorescence parameters ofSophoradavidiiseedlings[J]. Photosynthetica,2008,46(1):40-48.
[12] Yin Chunying, Berninger F, Li Chunyang. Photosynthetic responses ofPopulusprzewalskisubjected to drought stress[J]. Photosynthetica,2006,44(1):62-68.
[13] 靳甜甜,刘国华,胡婵娟,等.黄土高原常见造林树种光合蒸腾特征[J].生态学报,2008,28(11):5758-5765.
[14] Vitousek P M, Aplet G, Turner D, et al. The Mauna loa environmental matrix: foliar and soil nutrients[J]. Oecologia,1992,89(3):372-382.
[15] 郑淑霞,上官周平.黄土高原油松和刺槐叶片光合生理适应性比较[J].应用生态学报,2007,18(1):216-221.
[16] 李树华,许兴,米海莉,等.水分胁迫对牛心朴子植株生长及渗透调节物质积累的影响[J].西北植物学报,2003,23(4):592-597.
[17] 王云龙,许振柱,周广胜.水分胁迫对羊草光合产物分配及其气体交换特征的影响[J].植物生态学报,2004,28(6):803-809.
[18] 邵瑞鑫,上官周平.外源一氧化氮供体SNP对受旱小麦光合色素含量和PSⅡ光能利用能力的影响[J].作物学报,2008,34(5):818-822.
[19] 高三基,罗俊,陈如凯,等.甘蔗品种抗旱性光合生理指标及其综合评价[J].作物学报,2002,28(1):94-98.
[20] Smimoff N, Colombe S V. Drought influences the activity of enzymes of the chloroplast peroxide scavenging system[J]. Journal of Experimental Botany,1988,39(8):1097-1108.
[21] 米海莉,许兴,李树华,等.水分胁迫对牛心朴子、甘草叶片色素、可溶性糖、淀粉含量及碳氮比的影响[J].西北植物学报,2004,24(10):1816-1821.
[22] 李岩,潘海春,李德全.土壤干旱条件下玉米叶片内源激素含量及光和作用特点[J].植物生理学报,2000,26(4):302-305.
[23] Rock C D, Ng P P F. DominantWiltymutants ofZeamays (poaceae) are not in abscisic acid perception or metabolism[J]. Am J Bot,1999,86(12):1796-1800.
Morphological and Physiological Responses ofPopulus×euramericanacv. ‘Neva’ to Water Stress/
Jing Dawei(Dezhou University, Dezhou 253023, P. R. China); Xing Shangjun, Ma Hailin, Du Zhenyu, Liu Fangchun, Ma Bingyao(Shandong Forestry Academy)//Journal of Northeast Forestry University.-2014,42(1).-10~13,56
Poplar; Water stress; Biomass partitioning; Photosynthetic pigment; Endogenous hormone
井大炜,男,1982年1月生,德州学院,博士研究生 。
邢尚军,山东省林业科学研究院,研究员。E-mail:xingsj-126@126.com。
2013年4月13。
S792.11; Q945.78
1) 山东省农业重大应用技术创新课题、山东省科技发展计划专项(2010GSF10621)。
责任编辑:任 俐。
For assessing the ability of water stress about poplar seedlings, a pot experiment was conducted to investigate the effects of water stress on growth, biomass production and partitioning, photosynthetic pigment and endogenous hormone of one-year-old poplar seedlings. The poplar seedlings are influenced under different water stress conditions. Compared to the control, the basal diameter, height, leaf number and total leaf decrease significantly under either moderate or severe stress, while the basal diameter and height have no significant differences with the control under light stress. With the increasing extent of water stress, the dry weight, water stress index (WSI) and total dry weight decrease gradually, however, the root/shoot (R/S) increases significantly. The partitioning index of leaf decreases, but that of root increases gradually. The contents of chlorophyll a (Chla), chlorophyll b (Chlb), chlorophyll (a+b) and carotenoid (Car) decrease significantly, but the ratio of Chla/b and Chl/Car have an inverse trend with the increasing intensity of water stress. IAA, GA and ZT contents decrease consistently, while ABA content has the trend of first up and then down with the increasing extent of water stress. Therefore, the poplar seedlings have strong morphological and physiological adaptations under light water stress, but would be weakened significantly under both moderate and severe water stress.
