大花三色堇热激蛋白70(HSP70)基因片段的分离1)
2014-07-27黄伶俐杜晓华穆金艳陈宏志刘会超
黄伶俐 杜晓华 穆金艳 陈宏志 刘会超
(河南科技学院,新乡,453003)
大花三色堇热激蛋白70(HSP70)基因片段的分离1)
黄伶俐 杜晓华 穆金艳 陈宏志 刘会超
(河南科技学院,新乡,453003)
为了获得三色堇耐热性相关的基因HSP70基因,根据GenBank上登录的拟南芥、陆地棉等HSP70基因序列设计引物,用同源克隆法分离出大花三色堇HAR的HSP70基因片段,并进行测序与比对。结果表明:克隆得到基因片段,长度为882 bp,其序列与已公布的几种植物HSP70的编码区相似率平均为85.1%,上游引物含于基因片段中。初步证明此基因片段为三色堇HSP70基因片段。
大花三色堇;HSP70基因;基因克隆;序列分析
Journal of Northeast Forestry University.-2014,42(7).-105~107
In order to obtain the heat resistance gene HSP70 ofViola×wittrockiana, the primers were designed based on the sequence of the HSP70 gene sequences ofArabidopsisthaliana,Gossypiumhirsutumand other plants in GenBank. The HSP70 gene fragment of pansy HAR were cloned by homology cloning and the fragment was sequenced. The length of gene fragment of HAR were 882 bp, the gene sequence shared 85.1% similar rate with the CDS of HSP70, and the forward primer was included in the fragment. The results provided evidence that the gene fragment were the HSP70 of pansy HAR.
KeywordsViola×wittrockiana; HSP70gene; Gene cloning; Sequence similarity
大花三色堇(Viola×wittrockiana),又名蝴蝶花、猫脸花和鬼脸花等,其品种繁多且色彩鲜艳,花期长且耐寒,有“花坛皇后”的美誉,是我国重要的花坛和盆栽花卉,在我国广泛栽培[1]。一般大花三色堇品种不耐高温,在华北地区超过35 ℃,植株生长不良并逐渐死亡。HAR为近年本课题组发现的特有耐热三色堇种质。
虽然植物的抗热性是受多基因控制的复杂性状,但近年在植物体中发现的热激蛋白(Heat Shock Proteins,HSPs)被证明与植物的抗热性成正相关,在生物抵御热胁迫中发挥着重要作用[2-4]。热激蛋白是生物体在外界温度突然升高5~10 ℃时(热激)迅速合成的一种特有蛋白。根据对昆虫、鸟类、鱼类、哺乳类、植物以及细菌、酵母等多种生物的研究发现,热应激是生物体遭受胁迫时,正常蛋白的合成受阻,而一系列HSP合成的过程[5]。其中,HSP70作为分子伴侣能阻止热伤害的变性蛋白聚集,并帮助其恢复到正常构象。生物体自身耐受性获得的速度与HSP积累速率呈正相关;耐受性的降低与HSP的降解同步[2,6-8]。热激蛋白的合成受控于特定的基因,目前已从拟南芥、陆地棉等植物分离到了编码该蛋白的基因。三色堇耐热种质HAR是否含有HSP70基因,其HSP70基因有什么特点,是值得探索的问题。为此,本研究试图从耐热三色堇种质HAR中分离出HSP70基因,并进行序列分析,为揭示三色堇耐热分子机理积累资料。
1 材料与方法
大花三色堇品种HAR,由河南科技学院三色堇育种实验室提供,该材料从荷兰Buzzy种选育所得,耐热性好能越夏,花期4—6月份,花色为紫红色。
主要试剂:PCR引物合成(上海生工生物工程公司),柱式植物RNAout Kit(北京天恩泽公司),Quantscript RT Kit(天根Tiangen公司),Taq DNA Polymerase(天根Tiangen公司),Gel Extraction Kit(Omega公司)。
总RNA的提取及第一链cDNA的合成:以育苗室培育4个月的HAR植株作为试验株,于生化培养箱内40 ℃热激20、35、50、60 min(恢复10 min),按照柱式植物RNAout Kit试剂盒说明书的步骤分别取幼叶提取总RNA,用琼脂糖凝胶电泳检测RNA的纯度。
按照Quantscript RT Kit试剂盒说明书的反转录程序进行第一链cDNA的合成,获得第一链cDNA。
HSP70基因片段的获得:将拟南芥、陆地棉、蓖麻等几种植物中已公布的HSP70序列进行比对,以同源性最高的一段CDS编码区设计一对引物,上游引物:GTT ACA GTT CCT GCT TAT TTC,下游引物:TAG ACC TGG ATC AGT ACA CC。此对引物的解链温度Tm值为56 ℃,预计扩增产物为905 bp。
按照Taqase说明书设置HSP70基因片段的PCR扩增的反应条件,由梯度PCR试验得出此对引物最佳退火温度为50.3 ℃。HSP70基因片段的PCR产物进行电泳检测,目标片段长度为900 bp左右,认定为目的片段,将100 μl PCR扩增产物进行电泳,按照Gel Extraction Kit说明书步骤进行胶回收,获得40 μL纯化产物,纯化产物5 μl用于电泳检测,目的条带清晰。直接将回收产物送至上海生工进行测序。
大花三色堇HSP70基因片段的同源性:利用DNAStar软件对所测序列进行比对分析,将模板编码区序列在Editseq功能中保存为seq格式,样本测序后本身为seq保存格式,便于比对时插入比对框;在序列比对软件中将2个需要比对的序列通过输入序列添加进比对框,点击Align进行相似性比对。并将大花三色堇HSP70基因片段序列在NCBI数据库中BLAST比对功能区中与GenBank中已有的HSP70序列进行相似性比对,输出结果要求为高度相似序列。一些相似性比较低而不在结果中显现的则在DNAStar的序列比对功能区进行比对操作。
2 结果与分析
2.1 HSP70基因片段的获得
植物RNAout Kit提取HAR的总RNA,电泳检测(图1),RNA 18 s和28 s两条带清晰明亮,虽有少量DNA残留,但不影响PCR扩增;根据已登录的几种植物的HSP70基因序列,用DNAStar软件比对出100%相似的一段编码区,以此段序列设计引物,并以HAR的总RNA为模板经过反转录获得cDNA,再以cDNA为模板通过PCR扩增获得长度约为900bp的DNA片段(图2)。

M.DL-2000标记;1、2.RNA提取物。
2.2 HSP70基因片段序列分析
利用DNAStar分析软件对HSP70基因片段序列进行分析可知,HSP70基因片段总长882 bp,将其与设计引物所选取得编码区序列进行比对,从281—878 bp处有598 bp碱基的相似率为85.1%;上游引物存在于一条链的854—876 bp处,引物21 bp的相似率为95.2%,证明所获片段是由目的引物分离得到。由于三色堇与参考植物亲缘关系较远,85.1%的相似率基本确定为该基因片段为三色堇HAR的HSP70基因片段。

M.DL-2000标记;1.HSP70PCR产物;2.空白对照。
2.3 大花三色堇HSP70基因片段与不同物种的相似性
通过NCBI数据库中BLAST比对以及DNAStar中的序列比对软件所得的结果可知,不同植物之间HSP70基因相似率很高:三色堇HSP70基因与所比对的序列期望值(E值)都为0,表明与所比较的基因序列完全匹配;三色堇HSP70基因片段与烟草、陆地棉、南瓜、亚洲水稻、拟南芥和湖北海棠等达到86%以上的相似率,且能达到80%以上相似率的全为植物HSP70基因,而非植物类的常见物种如老鼠、果蝇、酵母菌和白色念珠菌的HSP70基因与三色堇HSP70基因相似率比较低(表1),说明HSP70基因在不同物种的进化中根据环境和自身适应性而有所变化,但总体而言,HSP70基因在植物中相当保守。
表1 三色堇HAR HSP70基因片段与不同物种HSP70基因编码区序列相似性
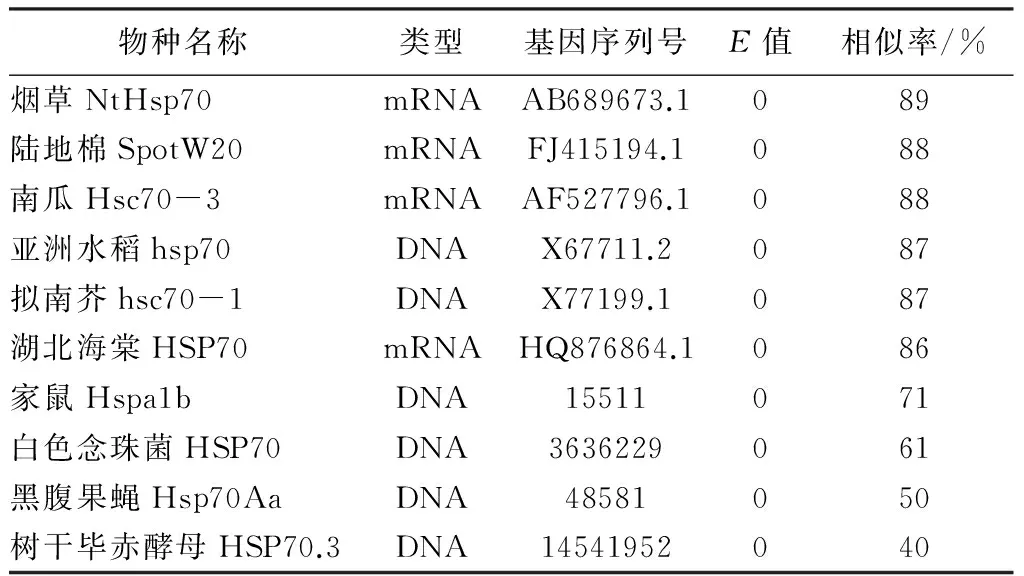
物种名称类型基因序列号E值相似率/%烟草NtHsp70mRNAAB689673.1089陆地棉SpotW20mRNAFJ415194.1088南瓜Hsc70-3mRNAAF527796.1088亚洲水稻hsp70DNAX67711.2087拟南芥hsc70-1DNAX77199.1087湖北海棠HSP70mRNAHQ876864.1086家鼠Hspa1bDNA15511071白色念珠菌HSP70DNA3636229061黑腹果蝇Hsp70AaDNA48581050树干毕赤酵母HSP70.3DNA14541952040
3 结论与讨论
HSP70在生物体内分布极为广泛,存在于古生菌、真核细菌和真核生物等几乎所有的生物体中[9],也是目前研究的最为深入的一种热激蛋白。起主要作用的HSP多由核基因编码成蛋白质,并分布在细胞的不同部位如细胞质、线粒体、叶绿体和内质网。基于各个亚细胞器的结构不同及其调控反应的不同,编码各个HSP70的基因就有所不同,各种HSP70蛋白之间存在着差异[10],拟南芥有HSP70-4和hsp70T-2两个变体,玉米有hsp70-1和hsp70-4两个变体,小麦有hsp70和Tahsp70d两个功能相似性伴侣。生物体内,HSP的诱导极其快速和显著,其对生物体的保护作用是多种分子伴侣蛋白网络式协同作用的结果。各种HSP在保护细胞免受外界胁迫的过程中相辅相成,有时甚至达到叠加效应。HSP70与其他分子伴侣协同参与抗胁迫一系列机制中的膜及蛋白的修复与保护和自由基及有毒化合物的清除[4]等反应。HSP70基因在一种保守蛋白热激转录因子(Heat Shock Factor,HSF)的调控下,根据胁迫情况的差异编码相应功能的HSP70,表达的HSP70帮助恢复和保持细胞内稳态,从而保护整个植株[11]。
HSP70基因已经从拟南芥、水稻、玉米和芍药等多种植物中分离出来并且加以分析,HSP70基因一般5’端有100 bp左右的非翻译区,3’端有200 bp的非翻译区,中间的开放阅读框(Open-Reading Frame,ORF)包含大约2 000 bp碱基用于编码HSP70蛋白[12-14]。植物的ORF框分为两类,一类含有内含子,如玉米、牵牛花等的ORF框;而另一类则无内含子,如大豆、胡萝卜等的ORF框[15]。在HSP70基因的ORF上游通常存在基因调控区,包含多个热激元件(Heat Shock Elements,HSEs),还有一些类似HSE的元件,其功能是与热激因子(HSF)结合调控热激蛋白基因的表达[16]。目前,三色堇关于分子方面的研究比较少,只涉及一些小分子,HSP70方面尚未有基因序列在Genbank中登陆,鉴于HSP70的高度保守性,本研究从拟南芥、陆地棉等植物的HSP70入手,利用同源序列克隆法,以植物同源HSP70基因保守区为模板,设计特异引物,通过PCR技术克隆出三色堇片段,其长度为882 bp,序列分析显示其序列与作为模板的拟南芥HSP70-4的部分序列的相似率为85.1%。NCBI数据库中的Blast功能软件比对显示其与烟草的NtHSP70mRNA相似率为89%,与陆地棉、南瓜的mRNA相似率为88%,与家鼠的DNA相似性为71%,与果蝇的DNA相似性为50%,经过相似性比较可知不同物种之间HSP70基因有所差异,且亲缘关系越远差异越大。尽管在进化过程中存在着诸多如亚细胞器调控过程的变化或者一个简单独立的生化反应发生变异导致HSP70基因有所变异,总体而言,植物中HSP70基因保持着高度的稳定性。根据HSP70基因序列的特点以及碱基的相似率等初步判定所得基因片段为三色堇HSP70基因片段,该基因片段的获得为后续的克隆三色堇HSP70的全长和分析其生物学功能的研究奠定了基础。
[1] 张其生,包满珠,卢兴霞,等.大花三色堇育种研究进展[J].植物学报,2010,45(1):128-133.
[2] Denlinger D L, Yocum G D. Physiology of heat sensitivity//[M]Hallman G J, Denlinger D L et al. Thermal sensitivity in insects and application in integrated pest management[M]. Colorado: Westview Press, Boulder,1998:55-95.
[3] Feder M E, Hofmann G E. Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology[J]. Annual Review of Physiology,1999,61(2):43-82.
[4] Wang Wangxia, Vinocur B, Altman A. Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance[J]. Planta,2003,218(1):1-14.
[5] Roberts J K, Key J L. Isolation and characterization of a soybean hsp70 gene[J]. Plant Molecular Biology,1991,16(4):671-683.
[6] Sørensen J G, Michalak P, Justesen J, et al. Expression of the heat-shock protein HSP70 in Drosophila buzzatii lines selected for thermal resistance[J]. Hereditas,1999,131(2):155-164.
[7] Chen K Y, Chen Z C. Heat shock proteins of thermophilic and thermotolerant fungi from Taiwan[J]. Botanical Bulletin of Academia Sinica,2004,45(3):247-257.
[8] 李俊杰,桑润滋,田树军,等.热激蛋白在动物应激中的应用[J].家畜生态,2004,25(3):44-46.
[9] Boorstein W R, Craig E A. Molecular evolution of the HSP70 multigene family[J]. Mol Evol,1994,38(1):1-17.
[10] Pegoraro C, Mertz L M, Maia L C, et al. Importance of heat shock proteins in maize[J]. Journal of Crop Science and Biotechnology,2011,14(2):85-95.
[11] Zhu Yan, Wang Zhi, Jing Yanjun, et al. Ectopic over-expression of BhHsf1, a heat shock factor from the resurrection plant Boea hygrometrica, leads to increased thermotolerance and retarded growth in transgenicArabidopsisand tobacco[J]. Plant Molecular Biology,2009,71(4-5):451-467.
[12] Bates E M, Vergne P, Dumas C. Analysis of the cytosolic hsp70 gene family inZeamays[J]. Plant Molecular Biology,1994,25(5):909-916.
[13] Bettencourt B R, Feder M E. Rapid concerted evolution via gene conversion at the drosophila hsp70 genes[J]. Journal of Molecular Evolution,2002,54(5):569-586.
[14] Fu Wandong, Li Shuai, Yao Jianting, et al. Molecular cloning and analysis of a cytosolic Hsp70 gene fromEnteromorphaprolifera(Ulvophyceae, Chlorophyta)[J]. Plant Molecular Biology Reporter,2010,28(3):430-437.
[15] Lin Xiaoying, Chern Maw-shenq, Zimmerman J L. Cloning and characterization of a carrot hsp70 gene[J]. Plant Molecular Biology,1991,17(6):1245-1249.
[16] Christians E E M, Renard J P. Developmental control of heat shock and chaperone gene expression[J]. Cmls Cell mol life sci,1997,53(2):168-178.
Cloning of Gene Fragment of HSP70 inViola×wittrockiana/
Huang Lingli, Du Xiaohua, Mu Jinyan, Chen Hongzhi, Liu Huichao(Henan Institute of Science and Technology, Xinxiang 453003, P. R. China)//
黄伶俐,女,1987年9月生,河南科技学院园艺园林学院,硕士研究生。
刘会超 ,河南科技学院园艺园林学院,教授。E-mail:huichaoliu2012@163.com。
2013年11月25日。
Q343.1+1
1) 河南省科技攻关项目(132102110119)、河南省科学技术研究项目(13B210009)。
责任编辑:任 俐。
