不同品种苹果果皮和果肉中总三萜含量的测定
2014-07-26李志华宋晓凯赵艳敏刘岱琳
李志华,宋晓凯,赵艳敏,刘岱琳,*
(1.中国矿业大学,江苏徐州221116;2.中国人民武装警察部队后勤学院,天津300162)
苹果中的营养功能因子主要为多酚和三萜类成分[1]。近年来对于苹果中的多酚类成分的分离及其抗氧化、心脑血管的保护作用等多种功效研究较为深入[2-3],而苹果中的三萜类成分研究相对较少。目前在苹果中已经发现的三萜类化合物有熊果酸,齐墩果酸,蔷薇酸,马斯里酸,科罗索酸等,而熊果酸为苹果中总三萜的主要成分[4-6]。苹果中的总三萜有抗癌、抗菌、抗病毒和抗炎等功能[7-9],目前未见对苹果中总三萜类成分的含量分析研究。为了全面评价苹果中的营养成分,比较苹果不同部位中三萜类成分的分布,本文采用紫外-可见分光光度法,对不同品种苹果果皮、果肉中总三萜的含量进行了研究。研究结果为苹果中总三萜营养成分的综合开发利用提供依据。
1 材料与方法
1.1 材料
国产青苹果、进口青苹果、黄元帅苹果、红蛇苹果、青蛇苹果、嘎啦苹果、栖霞苹果、姬娜苹果、花牛苹果、沂蒙山苹果、红富士苹果、西域皇妃苹果均为市售产品。
1.2 试剂与仪器
熊果酸对照品、香草醛、无水乙醇、冰乙酸、高氯酸均为分析纯;TU-1901双光束紫外-可见分光光度计:北京普析通用仪器有限公司;ModulyoD冻干机:赛默飞世尔;FA1204B电子天平:上海精科;HH-2数字显示恒温水浴锅:常州市国华仪器有限公司;FW100高速万能粉碎机:天津泰斯特仪器有限公司。
1.3 方法
1.3.1 对照品溶液的制备
准确称取一定量的熊果酸,置于25 mL棕色容量瓶中,加95%乙醇定容,得0.105 mg/mL的熊果酸对照品溶液。
1.3.2 样品溶液的制备
将苹果洗净、剥皮(厚约1 mm~2 mm),果肉切片,之后快速称量果肉、果皮的重量(鲜果重),在切片程中为防止酶促褐变将苹果浸泡在3%柠檬酸溶液中,经冷冻干燥后分别称重(干果重),后用粉碎机粉碎至100目,真空包装,放于0℃~4℃冰箱中备用。分别称取不同品种苹果果皮、果肉干粉5 g,精密称定,置于100 mL容量瓶中,加入80 mL 95%乙醇加热回流提取2 h,冷却至室温后用95%乙醇定容至100 mL,摇匀后精确移取10 mL溶液于100 mL容量瓶中,定容即得样品溶液。
1.3.3 最佳测定波长的选择
取熊果酸对照品溶液0.6 mL和红富士苹果果肉样品溶液0.2 mL,置于具塞试管中,水浴上蒸干后加入0.3 mL 5%香草醛-冰乙酸溶液和1.00 mL高氯酸,于60℃水浴加热15min后移入冰水浴中冷却,再加入5.0 mL冰乙酸,摇匀后置于室温,15 min后用分光光度计在400 nm~800 nm波长范围内扫描,确定其最大检测波长。
1.3.4 显色条件的选择
5%香草醛-冰乙酸溶液用量的选择:取熊果酸对照品溶液0.6 mL 6份,水浴蒸干后分别加5%香草醛-冰乙酸溶液 0.1、0.2、0.3、0.4、0.5、0.6 mL,后各加高氯酸1.0 mL,于60℃水浴加热15 min后移入冰水浴中冷却,再加入5.0 mL冰乙酸,摇匀后置于室温,15 min后于最大吸收波长处测定吸光度,以确定5%香草醛-冰乙酸的最佳用量。
高氯酸用量的选择:取熊果酸对照品液0.6 mL 6份,水浴蒸干后分别加5%香草醛-冰乙酸溶液0.3 mL,再分别加高氯酸 0.7、0.8、0.9、1.0、1.1、1.2 mL,于60℃水浴加热15 min后移入冰水浴中冷却,再加入5.0 mL冰乙酸,摇匀后置于室温,15 min后于最大吸收波长处测定其吸光度,以确定高氯酸的最佳用量。
水浴温度的选择:取熊果酸对照品溶液0.6 mL 6份,水浴蒸干后加5%香草醛-冰乙酸溶液0.3 mL、高氯酸 1.0 mL,分别在 40、50、60、70、80、90 ℃水浴中反应15 min,后移入冰水浴中冷却,再加入5.0 mL冰乙酸,摇匀后置于室温,15 min后于最大吸收波长处测定其吸光度,以确定最佳水浴温度。
水浴时间的选择:取熊果酸对照品液0.6 mL6份,水浴蒸干后加5%香草醛-冰乙酸溶液0.3 mL、高氯酸1.0mL,于 60℃水浴中分别加热 5、10、15、20、25、30min,冰水浴中冷却后加入5.0 mL冰乙酸,摇匀后置于室温,15 min后于最大吸收波长处测定其吸光度,以确定最佳水浴时间。
1.3.5 标准曲线的绘制
精密吸取熊果酸对照品溶液 0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL,置于具塞试管中,水浴蒸干后分别加入0.3 mL 5%香草醛-冰乙酸溶液和1.00 mL高氯酸,于60℃水浴加热15 min后移入冰水浴中冷却,再加入5.0 mL冰乙酸,摇匀后置于室温,15 min后用分光光度计在最佳检测波长下测定样品溶液的吸光度,以熊果酸量(μg)为横坐标,吸光度为纵坐标绘制标准曲线。
1.3.6 总三萜含量的测定
分别吸取上述制备的不同品种苹果的总三萜试样溶液0.2 mL,置于具塞试管中,水浴蒸干后加入0.3 mL 5%香草醛-冰乙酸溶液和1.00 mL高氯酸,于60℃水浴加热15 min后移入冰水浴中冷却,再加入5.0 mL冰乙酸,摇匀后置于室温,15 min后用分光光度计在最佳检测波长下测定样品溶液的吸光度[10]。根据测得的吸光度和标准曲线回归方程,计算样品中的总三萜含量(以熊果酸计)。
1.3.7 分析方法的评价
精密度实验:精密量取红富士果肉样品溶液5份,每份0.2 mL,按照优化条件显色后测定吸光度,计算结果的相对标准偏差,评价该方法的精密度。
稳定性实验:精密吸取红富士果肉样品溶液0.2mL,按照优化条件,显色后分别在0~60 min内测定其吸光度,计算结果的相对标准偏差,评价该试验方法的稳定性。
重现性实验:称取相同质量的红富士果肉干粉5份,按1.3.2项下方法制备样品溶液,分别取样品溶液0.2 mL,按1.3.6项下方法进行测定,计算结果的相对标准偏差,评价该方法的重现性。
加样回收率实验:在苹果三萜的样品液中分别加入不同量的熊果酸标准溶液,分别测定其吸光度,计算总三萜的含量,并计算其回收率。
2 结果与分析
2.1 最佳检测波长的选择
按照1.3.3的方法对熊果酸对照品溶液与红富士苹果样品液在400 nm~800 nm波长范围内进行全波长扫描,结果如图1、图2所示。

图1 熊果酸对照品溶液显色后全波长扫描谱Fig.1 The wavelength scanogram of ursolic acid after colorable reaction

图2 红富士苹果样品液加显色剂显色后全波长扫描谱Fig.2 The wavelength scanogram of fuji apple sample after colorable reaction
由图可见,熊果酸对照品溶液和样品溶液,经过显色反应后,最大吸收峰均在550 nm左右,因此以550 nm作为最佳检测波长。
2.2 显色条件的选择
按照1.3.4的方法对5%香草醛-冰乙酸用量进行优化,结果表明,随着香草醛-冰乙酸溶液的增加,吸光度增大,增加到0.3 mL后吸光度开始减小,故选择0.3 mL作为最佳用量。
对高氯酸用量的优化结果表明,随着高氯酸用量的增加,吸光度先升高后略有下降,当加入量为1.0 mL时吸光度最大,故选择1.0 mL作为最佳用量。
对水浴温度的优化结果表明,随着温度升高,吸光度相应增大;但水浴温度超过60℃时,空白液开始变色,故选择水浴温度为60℃。
对水浴时间的优化结果表明,随水浴时间延长,吸光度增大,15 min以后吸光度基本不变,故选择水浴反应时间为15 min。
2.3 标准曲线的绘制
以熊果酸量(μg)为横坐标,吸光度为纵坐标作图,结果图3所示。

图3 熊果酸标准曲线Fig.3 Standard curve of ursolic acid
由图3可知,熊果酸线性回归方程为:y=0.007x-0.035(R2=0.999 3),R2=0.999 3,结果表明熊果酸量在21 mg~126 mg范围内与吸光度线性关系良好。
2.4 分析方法的评价
精密量度实验:对红富士果肉样品5份溶液显色后进行吸光度测定,结果其吸光度值的RSD为0.87%,表明该测定方法具有良好的精密度,达到了样品分析要求。
稳定性实验:对红富士果肉样品溶液显色后分别在0~60 min内进行测定,结果显示在15 min~40 min内吸光度值稳定,RSD为1.13%和1.76%;表明该方法在显色后15 min~40 min内完成较为适宜。
重现性实验:对5份由红富士果肉制备的样品溶液显色后进行测定,计算总三萜的含量,其含量的RSD为1.23%,表明该方法具有良好的重现性。
加样回收率实验见表1。

表1 加标回收率实验结果Table 1 Average recovery for ursolic acid in sample spiked and the RSD
由表1可知,5次加标回收试验的最低回收率为97.4%,最高回收率为103.78%,平均回收率为100.32%,其相对标准偏差RSD为2.99%。表明该方法准确可靠,此法可用来对苹果样品溶液进行总三萜含量检测。
2.5 样品测定
取不同品种苹果制备的样品溶液,按1.3.5项下方法测定吸光度,每份试样溶液平行测定3次,由标准曲线和冻干苹果质量,计算冻干苹果果皮和果肉中总三萜的含量(以熊果酸计,mg/g),结果见表2。

表2 不同品种苹果中总三萜含量Table 2 Total triterpenoids contents of diferent apple varieties
2.6 新鲜苹果果皮和果肉中总三萜的含量
由冻干苹果中的总三萜含量与冻干苹果和新鲜苹果的质量比,即可求得新鲜苹果中总三萜的含量,结果见表3(Df:冻干果肉占新鲜果肉的比重;Ds:冻干果皮占新鲜果皮的比重)。
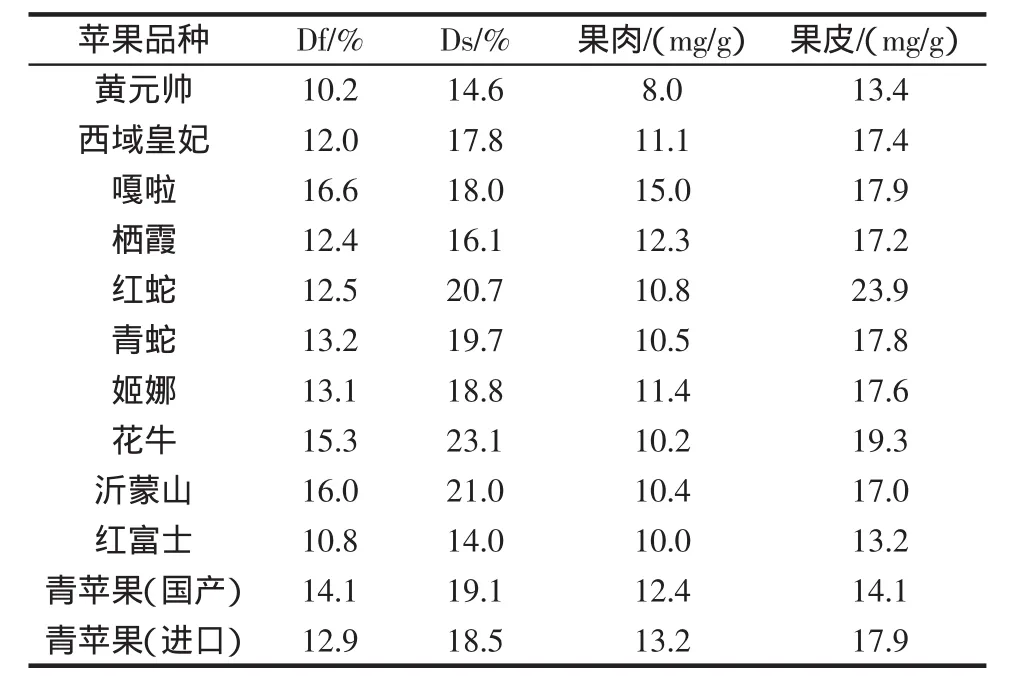
表3 不同苹果品种鲜果中总三萜含量Table 3 Total triterpenoids contents of diferent apple varieties in fresh apple
3 结论
1)采用分光光度法,以熊果酸为对照品,5%香草醛-冰醋酸-高氯酸为显色反应体系测定不同品种苹果中总三萜的含量。在5%香草醛-冰醋酸用量0.3 mL、高氯酸1 mL、60℃反应时间15 min,检测波长为550 nm的条件下,熊果酸量在21 mg~126 mg范围内与吸光度存在较好的线性关系。
按照优化的显色条件测得加样回收平均回收率为100.32%(RSD为2.99%)。该总三萜含量的检测方法具有操作简单、稳定性好、精密度高、准确可靠等优点,可用于苹果中总三萜含量的测定。
2)测定结果显示同种苹果的果肉和果皮其总三萜的含量差异较大,不同品种苹果果皮和果肉中的总三萜含量也存在显著差异。苹果果皮中总三萜含量高于果肉中总三萜的含量,本课题组前期测定了不同品种苹果中多酚的含量[11],其研究结果也说明苹果果皮中多酚物质含量较高。这些研究结果都充分说明对于苹果,尽管果皮量小,但是其所含功能营养成分却不容忽视。
3)不同品种苹果果皮的总三萜含量为13.2 mg/g~23.9mg/g,苹果果肉的总三萜含量为8.0mg/g~15.0mg/g。不同品种苹果中总三萜含量差异较为明显,其中以红蛇果皮中总三萜含量最高,而黄元帅、红富士和国产青苹果果皮中含量较低;苹果果肉中总三萜的含量以嘎啦最高,黄元帅最低。从原料的资源和可获得性等角度综合分析,嘎啦苹果可以作为总三萜类功能性营养成分开发利用的优选品种。
[1]Clarissa Gerhauser.Cancer chemopreventive potential of apples,apple juice,and apple components[J].Planta Med,2008,74(13):1608-1624
[2]Eberhardt M V,Lee C Y,Liu R H,et al.Antioxidant activity of fresh apples[J].Nature,2000,405(29):903-904
[3]Sun J,Chu Y F,Wu X Z,et al.Antioxidant and antiproliferative activities of common fruits[J].J Agric Food Chem,2002,50(25):7449-7454
[4]Anna Szakiel,Cezary Paczkowski,Flora Pensec,et al.Fruit cuticular waxes as a source of biologically active triterpenoids[J].Phytochem Rev,2012,11(2):263-284
[5]Tony K,McGhie,Sébastien Hudault,et al.Apple Peels,from Seven Cultivars,Have Lipase-Inhibitory Activity and Contain Numerous Ursenoic Acids As Identified by LC-ESI-QTOF-HRMS[J].J Agric Food Chem,2012,60(1):482-491
[6]Sebastian Jäger,Holger Trojan,Thomas Kopp,et al.Pentacyclic Triterpene Distribution in Various Plants-Rich Sources for a New Group of Multi-Potent Plant Extracts[J].Molecules,2009,14(6):2016-2031
[7]Dolores Mueller,Sven Triebel,Olga Rudakovski,et al.Influence of triterpenoids present in apple peel on inflammatory gene expression associated with inflammatory bowel disease (IBD)[J].Food chemistry,2013,139(3):339-346
[8]He X J,Liu R H.Triterpenoids isolated from apple peels may be responsible for their anticancer activity[J].J Agric Food Chem,2007,55(11):4366-4370
[9]He X J,Wang Y H,Hu H,et al.In Vitro and in Vivo Antimammary Tumor Activities and Mechanisms of the Apple Total Triterpenoids[J].J Agric Food Chem,2012,60(37):9430-9436
[10]李菁,曾荣华,陈文俊,等.灵芝孢子油的总三萜测定研究及HPLC鉴别[J].中药材,2011,34(10):1621-1625
[11]王皎,高颖,赵燕敏,等.测定不同品种苹果果皮和果肉中总多酚的含量[J].食品研究与开发,2013,34(20):84-86
