表面活性剂对离子液体预处理纤维素的影响
2014-07-24冯圆圆李强季更生唐玉斌李天程
冯圆圆,李强,2,3,季更生,唐玉斌,李天程
(1 江苏科技大学生物与化学工程学院,江苏 镇江212018;2 中国农业科学院蚕业研究所附属蚕药厂,江苏 镇江 212018; 3 南京大学化学化工学院,江苏 南京210093)
纤维素是地球上最丰富的天然可再生资源,它的开发与利用对解决能源危机具有重要意义。但纤维素材料的结晶度[1]较高,形成了降解纤维素的强大障碍。溶剂预处理[2]技术是目前破坏纤维素复合物的最有效手段之一,目前研究得较多的纤维素溶剂主要有N-甲基吗啉-N-氧化物溶剂体系、碱溶液等,通过碱化使得纤维素结构发生改变[3-5],从而更利于纤维素材料的应用。但这些溶剂存在着不稳定、有毒害、不易回收等缺点,因此有必要研发绿色环保的溶剂。
近年的研究表明,离子液体对纤维素材料有较好的溶解和处理能力[6],可以有效地提高纤维素的酶解产率[7]。然而离子液体处理纤维素材料后的洗涤过程,会导致纤维素的重结晶,从而影响了酶解率的提高。表面活性剂可以降低离子液体的张力,有望提高纤维素酶解产率,目前很少有关于利用离子液体与表面活性剂耦合处理纤维素材料的研究[8-9]。为此作者选择之前工作中报道的具有良好生物兼容性的磷酸酯类离子液体[10],将此离子液体与表面活性剂耦合使用,研究表面活性剂对纤维素材料改性的影响,为纤维素材料的应用提供有力的数据支持。
1 实验方法与步骤
1.1 主要原料与仪器
1-甲基咪唑、磷酸三甲酯,纯度≥98%,上海晶纯生化科技股份有限公司;微晶纤维素,上海晶纯生化科技股份有限公司;纤维素酶(10000U/g),上海晶纯生化科技有限公司;十二烷基硫酸钠(SDS)、聚乙二醇4000(PEG4000)、曲拉通X-100(X-100)、气溶胶OT(AOT),国药集团化学试剂有限公司。[MEIM][DMP]通过已报道工艺[11]合成。
DF-Ⅱ集热式磁力加热搅拌器,上海比朗仪器有限公司;紫外-分光光度计UV759S,上海精科;电热恒温鼓风干燥箱DHG-9101-ISA 型,上海三发科学仪器有限公司;傅里叶变换红外光谱仪,TENSOR27,德国布鲁克光谱仪器公司;X 射线衍射仪,X′TRA,瑞士ARL 公司。
1.2 纤维素的预处理和再生
在100mL 的三口烧瓶中分别加入6g 的[MEIM][DMP]和0.2g 微晶纤维素及1%的表面活性剂(X-100、PEG4000、AOT、SDS),置于磁力搅拌器上,在130℃的温度下进行预处理2h,处理结束后,向烧瓶中加入沉淀剂蒸馏水,此时出现沉淀,将混合液进行离心-洗涤-离心,洗涤3~4 次,保留每次离心后的上层液体,以进行回收再利用。最后将得到的样品沉淀物置于60℃的烘箱中干燥,烘干后研磨成粉末保存,留至下一步的酶解。
再生纤维素酶解的总体积为3mL,再生纤维素浓度为7mg/mL,缓冲液为50mmol/L,pH 值4.8的柠檬酸-柠檬酸钠缓冲液,添加200U/g(U 是指在50℃,pH 值5.0 条件下,每分钟每克酶粉催化纤维素水解生产的葡萄糖量[12])底物的纤维素酶,每个设3 组平行试验,在50℃的摇床中进行酶水解反应,每间隔一段时间取一定量样品,用DNS 法测定还原糖含量。
1.3 表面活性剂对纤维素的改性
在100mL 的三口烧瓶中分别加入6g 的[MEIM][DMP]和0.2g 微晶纤维素置于磁力搅拌器上,在130℃的温度下进行预处理2h,处理结束后,向烧瓶中加入沉淀剂蒸馏水,此时出现沉淀,将混合液进行离心-洗涤-离心,洗涤3~4 次,最后一次洗涤时,在每份样品中加入1%的不同表面活性剂,搅拌均匀后,离心干燥,并研磨成粉末,用于红外光谱和X 射线衍射的测定,考察处理后的纤维素的结构变化。
2 结果与讨论
2.1 纤维素的预处理及酶解
纤维素预处理的目的是促进酶解,可以通过酶解时糖的产率来对预处理溶剂中的表面活性剂进行评估。
从图1 中可以看出,离子液体处理后的纤维素的产糖率均明显高于未处理的纤维素。在酶解48h时,未处理的纤维素及[MEIM][DMP]、[MEIM][DMP]/PEG4000、[MEIM][DMP]/X-100、[MEIM][DMP]/AOT、[MEIM][DMP]/SDS 处理的纤维素的产 糖 浓 度 分 别 为 2.20mg/mL 、 3.68mg/mL 、
3.92mg/mL、3.72mg/mL、3.56mg/mL、3.06mg/mL。其中,[MEIM][DMP]/PEG4000 处理的纤维素产糖量最高,其产糖率比未处理的纤维素高78.2%,比未加表面活性剂处理的再生纤维素高6.5%,可见PEG4000 有利于进一步提高纤维素酶解率。
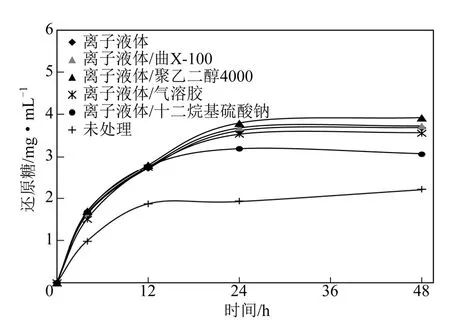
图1 [MEIM][DMP]/表面活性剂预处理微晶纤维素后的酶解时间进程
2.2 表面活性剂对纤维素结构改性的影响
2.2.1 处理前后微晶纤维素的红外光谱分析
对不同方式处理后的纤维素进行了红外光谱分析。图2 为[MEIM][DMP]处理后水洗、[MEIM][DMP]处理后加PEG4000 洗涤以及未处理的纤维素的红外光谱对照图。而图3 则为经不同表面活性剂洗涤后的再生纤维素的红外光谱对照图。由图2、图3可见,3400cm-1、 2900cm-1和1060cm-1处的吸收峰分别对应纤维素分子中非结晶区—OH 键的伸缩振动、—CH 键伸缩振动和C—O 变形振动峰[13]。郭元强等[14]通过研究聚乙二醇和纤素共混物的相容性及形态结构时发现纤维素与聚乙二醇具有很好的相容性,且共聚物的结晶度也明显降低。梁学海等[15]在研究聚乙二醇/纤维素共混物的晶体变化时发现聚乙二醇与纤维素之间可以形成较强的氢键。由图2 可知,与通过[MEIM][DMP]处理后水洗的纤维素相比,加入PEG4000 洗涤的纤维素红外光谱图谱中出现了PEG4000 分子的特征峰(1103cm-1处为C—O—C 振动峰),说明有PEG4000 分子与纤维素分子链接,形成较强的氢键,阻止了离子液体处理后水洗过程中的再生纤维素重结晶过程,使得纤维素结晶度降低,从而使酶解产率有所提高。因此PEG4000 提高酶解产率是通过阻碍再生纤维素重结晶过程实现的。

图2 不同处理方式下的微晶纤维素的红外光谱图

图3 不同表面活性剂对纤维素改性的红外光谱图
根据以上红外光谱图,可以计算出两条红外透过率的比率:①α1437cm-1/α899cm-1,表示结晶度指数或者侧枝结构指数(LOI);②α1378cm-1/α2900cm-1,表示总结晶指数(TCI)[16]。LOI 和TCI 数值越高表示结晶度越高及侧枝数越多。再生纤维素结晶指数的红外比率如表1 所示。显然经过离子液体[MEIM][DMP]处理后的纤维素的结晶度明显小于未处理的纤维素。其中经过PEG4000 洗涤的纤维素的结晶指数LOI 和TCI 最小(分别为0.9039 和0.8907),表明经过PEG4000 洗涤后的纤维素结晶度降低,这与上述分析结果相符。

表1 再生纤维素的结晶指数的红外比率
2.2.2 纤维素的X 射线衍射分析
经离子液体处理后由不同表面活性剂洗涤后的微晶纤维素的X 射线衍射谱图见图4。由图4 可知,未处理的微晶纤维素衍射峰形尖锐且强度高,在衍射角14.96°、16.12°、22.58°和34.45°分别出现衍射峰,为纤维素Ⅰ型结晶结构,分别对应晶胞(101)、(101-)、(002)和(040)晶面,其中14.96°和22.58°的衍射峰强度能反应纤维素分子中氢键的作用强度。由图4 中曲线可知,经过离子液体处理后得到的再生纤维素部分氢键断裂,结晶区域几乎消失,得到的几乎是无定形纤维素。表明微晶纤维素的峰形由典型的纤维素双峰变成基本平坦的无定形区,这也为纤维素酶组分中的内切酶提供更多更好的作用位点,加快了酶解速率[12]。因此表面活性剂的加入并未破坏这种再生纤维素的无定形结构。
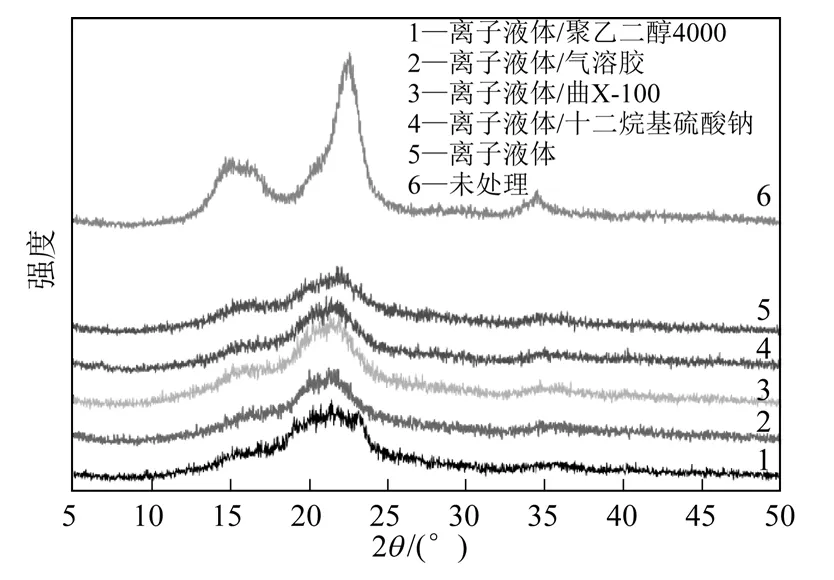
图4 处理前后微晶纤维素的X 射线衍射谱图
3 结 论
(1)利用离子液体[MEIM][DMP]与不同表面活性剂耦合处理纤维素,筛选到较好的表面活性剂PEG4000,有助于提高酶解产率。
(2)在预处理条件为T=130 ℃,t=2h,PEG4000/[MEIM][DMP]=0.01(质量比),得到的再生纤维素酶解48h 时还原糖产率比未处理的纤维素高78.2%,比单纯离子液体处理的产糖率高6.5%。
(3)通过红外光谱图及X 射线衍射分析,有PEG4000 分子插入到纤维素分子中。纤维素与PEG4000 之间形成氢键,从而阻止了再生纤维素洗涤过程中的重结晶过程,使得再生纤维素结晶度降低,提高了纤维素的酶解产率。本工作的结果为研究纤维素重结晶过程和表面活性剂参与纤维素处理提供了理论依据。
[1] Heinze T , Liebert T. Unconventional methods in cellulose functionalization[J].Progress in Polym Science,2001,26:1689-1762.
[2] Rubin E M.Genomics of cellulosic biofuels[J]. Nature,2008,45:841-845.
[3] Oudiani A E,Chaabouni Y,Msahli S. Crystal transition from cellulose Ⅰ to cellulose Ⅱ in NaOH treated Agave americana L.fibre[J].Carbohydrate Polymers,2011,86(3):1221-1229.
[4] Masahisa W,Masakazu I,Ken T.Enzymatic hydrolysis of celluloseⅠ is greatly accelerated via its conversion to the cellulose Ⅱhydrate form[J]. Polymer Degradation and Stability,2010,95:543-548.
[5] Kayoko K,Satoshi K,Eiji T.Crystal transition from Na-cellulose IV to cellulose Ⅱ monitored using synchrotron X-ray diffraction[J].Carbohydrate Polymers,2011,83:483-488.
[6] Supratim D,Bradley H,Joshua I P,et al. Ionic liquid tolerant hyperthermophilic cellulases for biomass pretreatment and hydrolysis[J].Green Chemistry,2010,12:338-345.
[7] Zhao H,Cecil L J,Gary A B,et al.Regenerating cellulose from ionic liquids for an accelerated enzymatic hydrolysis[J]. Journal of Biotechnology,2009,139:47-54.
[8] Tohru Inoue,Yuka Higuchi,Takeshi Misono. Differential scanning calorimetric study of nonionic surfactant mixtures with a room temperature ionic liquid , bmimBF4[J]. Journal of Colloid and Interface Science,2009,338:308-311.
[9] Tohru Inoue,Kazuaki Kawashima,Yuji Miyagawa. Aggregation behavior of nonionic surfactants in ionic liquid mixtures[J]. Journal of Colloid and Interface Science,2011,363:295-300.
[10] Li Q,Jiang X L,He Y C,et al.Evaluation of the biocompatibile ionic liquid 1-methyl-3-methylimidazolium dimethylphosphite pretreatment of corn cob for improved saccharification[J]. Applied Microbiology and Biotechnology,2010,87:117-126.
[11] Nie Y,Li C,Sun A,et al.Extractive desulfurization of gasoline using imidazolium-based phosphoric ionic liquids[J]. Energy and Fuels,2006,20:2083-2087.
[12] 陈建军,杨清香,王栋,等. 不同生长阶段平菇漆酶、纤维素酶活性研究[J]. 西北农业学报,2007,16(1):87-89.
[13] 巩桂芬. 用于制备还原糖的植物纤维素的预处理方法研究[D]. 哈尔滨:哈尔滨工业大学,2010.
[14] 郭元强,梁学海. 纤维素/聚乙二醇共混物的相容性及形态结构研究[J]. 纤维素科学与技术,1999,7(1):9-14.
[15] Liang X H,Guo Y Q,Gu L Z,et al.Crystalline-Amorphous phase transition of a poly (ethylene glycol)/cellulose blend[J].Macromolecules,1995,28:6551-6555.
[16] 李强,何玉财,徐鑫,等. 离子液体系中原位酶解高效糖化玉米秸秆[J]. 化工进展,2010,29(5):958-962.
