太阳能热化学储能研究进展
2014-07-24吴娟龙新峰
吴娟,龙新峰
(华南理工大学化学与化工学院,广东 广州510640)
随着工业的不断发展,人类对电力的需求越来越大。目前的电力资源主要依赖于煤、石油、天然气等化石能源,以燃煤为主的电力生产会引起两方面的问题:首先,煤炭、石油和天然气等化石燃料的供应日趋紧张;其次,化石燃料的燃烧向大气排放大量具有负面效应的CO2、CO 及SOx、NOx、颗粒物(PM)等环境污染物,给环境与生态保护带来巨大危害。太阳能是由太阳内部连续不断的核聚变反应过程所产生的能量,年辐射量高达5.7×1022J,相当于1.9×1012吨标准煤。现在太阳能的大规模利用是用来发电,现在已应用的包括太阳能热发电和光伏发电。太阳能发电由于具有费用低、来源广、不污染环境以及不需远距离输送等优点而受到人们的广泛关注。大力开发利用太阳能,将会改变我国能源短缺和不合理的能源结构,使能源供应多样化,研究、开发太阳能热力发电系统已成为当今能源动力领域的研究热点。
然而,由于太阳能具有间歇性、低密度和不稳定性、难以持续供应的缺点,纯太阳能热发电的广泛应用目前仍有许多问题需要解决,其中如何实现太阳能高效、大规模的储存,保证太阳能一天持续供给是太阳能热发电技术的关键。在太阳能热发电中,高温储热的作用是调节负荷、降低设备容量和投资成本,进一步提高太阳能资源利用效率和设备可用率,提高热电系统的可靠性和经济性。根据储热机理的不同,高温储能可以分为显热储热、潜热储热和化学反应热储热3 种方式。
1 高温热能储存技术
1.1 显热储能
显热储热指通过储能介质温度的变化来实现储能过程,可分为固体显热储热、液体显热储热以及液-固联合显热储热3 种。高温混凝土由于单位储热量成本低而成为太阳能热发电系统中代表性的显热储热介质,但同时也存在着热导率低的缺陷,在使用中需要添加一些高热导率的组分,如石墨等,或优化储能系统的结构设计来提高储热系统的传热性能。液态储热材料主要有水、油、高温熔盐。LUZ公司建立的大型槽式抛物面聚焦太阳能发电系统SEGSⅠ即采用矿物油作为传热介质和储能材料,但是此矿物油储能系统成本高且易燃易爆。在后来的设计中选用高温熔盐作为储热介质,但在实际应用中为了得到适宜的温度、熔点、储能密度及降低单位储能成本,通常会将几种无机盐混合共晶形成混合熔盐,如美国Solar Two 以及西班牙Solar Tres电站均利用Solar Salt(40%KNO3-60%NaNO3)作为储热材料[1-2]。此储能系统应用在槽式太阳能发电系统中仍需解决两个问题:①开发研究出性能优良包括高熔化焓、腐蚀性小且成本低的储热材料;②提高高温熔盐的热导率,研究发现使用添加剂如泡沫金属、膨胀石墨以及纳米材料能有效改善储热系统的传热性能[3-4]。液-固联合显热储热结合了固体、液体显热储热的优势,成为目前显热储热的重要研究方向,James 等[5]研究发现采用液-固联合显热储热方式的斜温层单罐的投资成本约为双罐熔融盐储热系统的65%。显热储热在目前的太阳能热发电中是技术最成熟、应用的最多的储热方式,但是采用显热储热方式还存在储能密度低、储能时间短、温度波动范围大及储能系统规模过于庞大等缺点。
1.2 潜热储热
潜热储能又称相变储能,主要是通过储热材料发生相变时吸收或释放热量来进行能量的存储与释放。现阶段的研究主要集中在固液相变储能材料,较显热储热相比,相变储热材料(PCM)一般具有储热密度大、相变温区窄等优点,可显著降低储能系统的尺寸。1993年德国太阳能及氢能研究中心共同提出PCM/显热储热材料/PCM 的混合储热方法,储热容量高达200MWh。2004年,欧洲的DISTOR项目就采用NaNO3和KNO3的混合熔盐为直接蒸汽发电槽式系统设计完善的相变储热系统[6]。
现阶段主要研究的高温相变储热材料主要有高温熔盐、金属以及合金。高温熔盐作为储热材料应用于太阳能热发电系统目前只在显热储热方式中得到一定规模的应用。金属相变材料由于具有储能密度大、循环稳定性好以及良好的传热性能等特点,在中、高温相变储能的应用中具有极大的优势,其中铝基合金由于具有适宜的相变温度以及相对低的腐蚀性,成为太阳能热发电系统中高温相变储热材料的研究焦点[7]。但目前对于合金相变材料的热物性变化如热导率的研究还很不充分,且金属合金在高温下的液态强腐蚀性都极大地限制了金属合金在高温相变储热领域的应用。相变材料的选择或开发以及换热器的设计都是实现高温相变储能在太阳能热发电系统的难点,因此目前相变储热技术在太阳能热发电系统中仍处于试验阶段[8]。
1.3 热化学储能
1.4 3 种热能储存方式的比较
不管选择何种热能储存方式,要从以下方面来进行考虑:储能密度、储能温度、储能周期、材料运输的可能性、储能方法成熟与否以及相关技术的复杂性。表1 是几种储能方式对比,对比其他储热方式,热化学储能具有以下的优势:①储能密度分别是潜热储热和显热储热的5 倍和10 倍;②热化学储能在环境温度下可实现长期无热损;③适合长距离运输。这些特性为太阳能的高效转换、储存及传输提供了一种极具前景的方法,并能使太阳能得到24h 的连续供给,特别适用于电厂峰谷负荷调节,并于尖峰发电时释放出热能,推动汽轮机发电。
2 热化学储能式太阳能热发电的技术经济性分析
图1 是一个10MW 氨基热化学储能式太阳能热电站概念系统设计图,整个系统由太阳能集热部分、氨分解器、氨合成器以及朗肯动力循环装置组成[9]。该10MW 太阳能热力发电厂采用两种比较常见的集热方法:①400 台400m2的抛物面碟片集热器阵列布置;②2800 套150m2的延伸金属膜定日镜按圆形布置在两个塔周围。针对上述的两种不同的集热方式,提出两种氨分解反应器,包括直接太阳辐射腔式接收器-多管反应器以及普通的管束反应器。氨合成反应器采用日产量为2000t 的氨合成转换器,该反应器能充分利用所释放的热能,来生产压力为10MPa、430~450℃的过热蒸汽。
对该10MW 太阳能热电站进行技术经济分析表明:一个10MW 氨基储能式碟式太阳能热力电厂所需总投入为180.5 亿澳元,太阳能集热部分占据了整个太阳能电厂总投资的42%。在折扣率为7%的情况下,可使发电成本降到0.25 澳元/(kW·h),且随着该技术的成熟和工业化生产,发电成本可进一步下降至0.2~0.15 澳元/(kW·h),所有费用都以1997年的澳元(AUD)计。
3 各种热化学储能体系的研究概况
目前已经研究过七十多种热化学反应,在选择合适的热化学反应用于化学储能时要考虑一下的条件[11]:①储热反应发生在1000℃以下;②释热反应发生在500℃以上;③反应焓大,产物的摩尔体积小;④反应完全可逆,无副反应,循环性能好;⑤反应储热、释热速率快;⑥反应物成本低,无毒,无腐蚀性;⑦反应条件温和,不需高压或高真空操作。表2 列举了几种典型的应用前景的热化学储能体系。
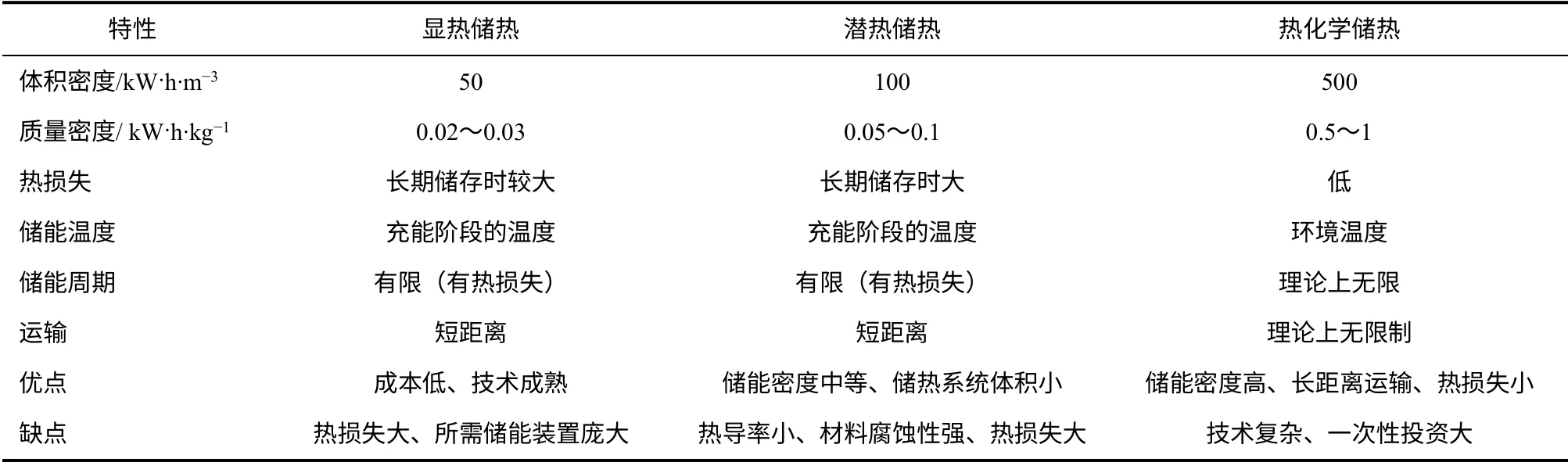
表1 几种储热方式的比较[10]
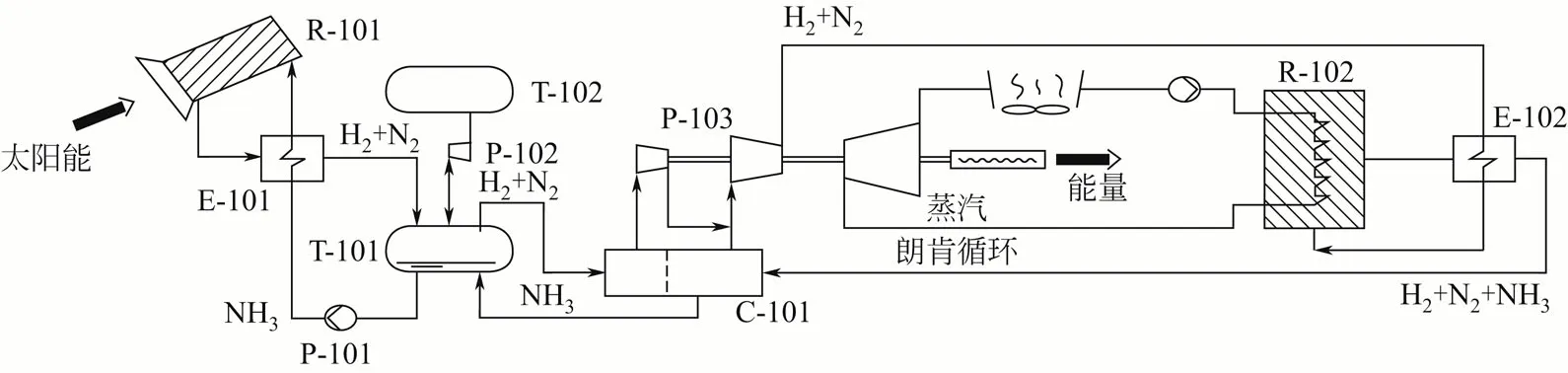
图1 采用闭环氨基热化学储能式太阳能热电站概念系统设计
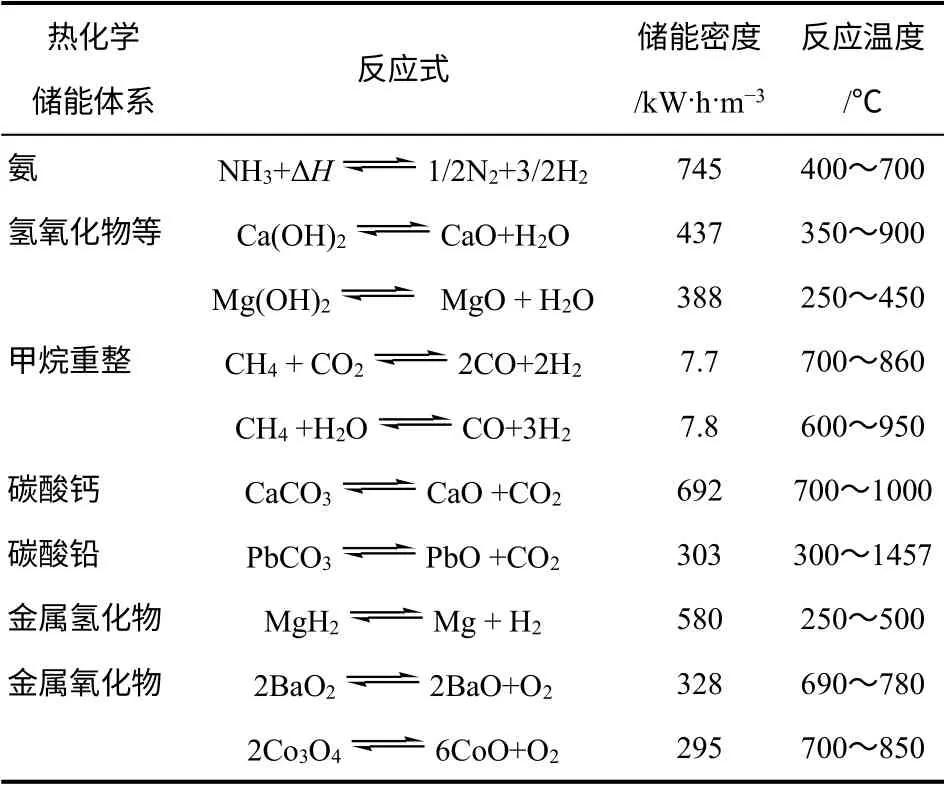
表2 常见的热化学储能体系的性能与反应温度[12]
3.1 无机氢氧化物的热分解
目前研究较多的是Ca(OH)2/CaO 体系,其次是Mg(OH)2/MgO 体系。该体系的热化学反应列于式(1)和式(2),Ca(OH)2/CaO 体系能量储/释循环如图2 所示。
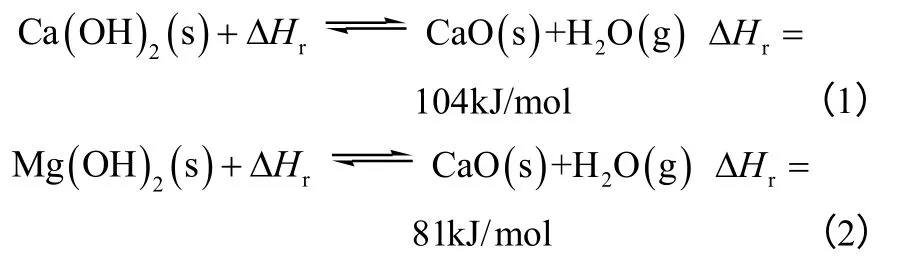
Ca(OH)2脱水反应温度较高,适用储存高温热能,反应产物CaO 能在常温下长期保存。且Ca(OH)2/CaO 体系的储能密度很大、热能的储/释速度快,稳定安全、无毒、价格低廉、便于处理。
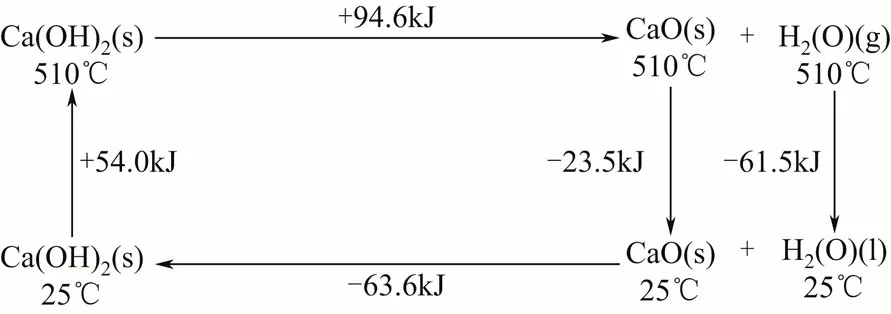
图2 Ca(OH)2/CaO 储能体系的能量储/释循环过程
美国LUZ 公司从20 世纪80年代就开始了热化学储能领域的研究开发工作,采用CaO/Ca(OH)2体系对一个净热容量为925MW·h 的储能系统进行理论分析,发现其80MW 的太阳能热电站能在白天8h 蓄热,正午前后4h 满负荷发电。此外,Ca(OH)2/CaO、Mg(OH)2/MgO 等无机氢氧化物储/释能体系在热能储存[13-14]、预热发动机[15]以及化学热泵[16]上的应用研究也引起了广泛研究。
表3 列举了无机氢氧化物储能的优缺点。反应物集聚和烧结所造成的反应物床层传热性能差以及反应物的活性低是采用无机氢氧化物储能必须解决的一个问题。其中一个比较有效的解决办法是向反应物中添加石墨基体。日本的Kato 等[17-18]分别制备了膨胀石墨、Mg(OH)2的复合物EM 以及膨胀石墨、Mg(OH)2、CaCl2的复合物EMC,并研究了Mg(OH)2、EM 以及EMC 在水合及脱水过程中的热力学性能,实验发现添加膨胀石墨能有效地提高反应物脱水及水合活性,同时也极大地提高了反应物的传热性能。另外,氢氧化钙的腐蚀性及循环寿命问题都是热化学储能实际应用中要考虑的。
3.2 碳酸化合物的分解
碳酸化合物热分解的一般形式如式(3)。
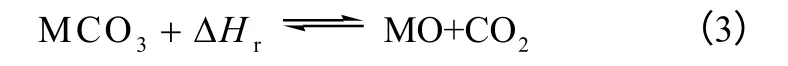
式中,M 表示某种金属。对于太阳能储热研究,目前只对CaCO3/CaO 体系、PbCO3/PbO 体系有比较详细的研究,基本反应过程如式(4)和式(5)。


表3 无机氢氧化物储能的优缺点
其中,CaCO3/CaO 体系由于储能密度高(3.26GJ/m3)、无副反应及原料CaCO3来源丰富而被认为在高温储热的应用上具有广阔的前景。Kato 等[19]探究了CaO/CO2反应用于化学热泵的反应活性,发现当压力为0.4MPa 时,储能密度可达到800~900kJ/kg,且平衡时CaO 床层的热输出温度可达到998℃。此外,CaCO3煅烧反应器的设计也引起了广泛的研究。Meier 等[20]采用塔式太阳能热发电的集热方式,设计了一个10MW 的太阳能回转窑反应器用于CaCO3/CaO 的煅烧反应,反应器的效率能达到20%,经过一百多个小时的运行操作后性能仍然十分稳定。
然而,CO2的储存问题是CaCO3/CaO 储能系统中必须要解决的一个关键问题。Kyaw 等[21]提出了3种CO2的储存系统:①作为压缩气体;②生成其他的碳酸盐;③采用合适的吸附剂如活性炭或沸石来吸收,结果发现当压力为1MPa,温度为300℃时,单位质量的沸石13X 能够吸收2%~3%的CO2,因此沸石13X 可以作为CaCO3/CaO 储能系统中CO2的吸附剂。Kato 等[22]也提出了一个CaO/PbO/CO2复合系统来储存CO2。表4 列举了碳酸盐分解反应用于热化学储能的优缺点,提高碳酸化合物分解过程中反应物的活性以及选择有效的方法来解决CO2的储存问题是下一步的研究重点。
3.3 甲烷二氧化碳重整
CH4/CO2重整反应不仅能够有效减少CO2的释放,还能够提供一种高效的可再生资源(如太阳能)储存及输送的方法。甲烷-二氧化碳重整整体反应如式(6)、式(7)。
主反应

副反应

CO2/CH4催化重整反应条件为温度605~905℃,压力在0.1~0.7MPa,CO2/CH4的摩尔比在0.8~1.2。Edwards 等[23]指出了该重整反应在热能储存利用上的巨大前景,他们采用技术经济分析方法来评价在一个净输出为100MW 的发电厂中,开环和闭环CO2/CH4催化重整过程的能源效率,研究发现闭环系统(太阳能/朗肯循环电厂)的能源效率达到33.6%,而开环系统(太阳能/燃气轮机联合循环)的能源效率达到44.6%。
由于CH4/CO2重整过程中有副反应发生,因此选择合适的催化剂来提高反应物的活性剂反应的选择性十分重要。Kodama 等[24-25]将金属氧化物还原和甲烷催化重整相结合,他们发现WO3和V2O5对甲烷重整具有很高的活性和选择性,后来他们又发现在氙弧灯光的照射下,镍催化剂对CH4/CO2重整具有良好的催化性能和选择性,如Ni/α-Al2O3在模拟太阳光的照射下,甲烷的转化率超过90%,且有16%的入射光以化学能的形式储存。Gokon 等[26]也证实了FeO 是甲烷二氧化碳重整将太阳能转化成化学能中非常有效的催化剂。
3.4 金属氢化物的分解
金属氢化物的储热原理是利用某些金属或合金具有吸收氢的能力,在适当的温度和压力下,发生吸氢反应生成氢化物,同时放出大量的热量;反之,金属氢化物在减压、加热的条件下会受热分解,放出储存的氢气。氢化镁由于具有较高的储能密度(0.85kW·h/kg MgH2)和良好的可逆性成为热化学储能中比较有前景的储能材料。氢化镁储能的反应原理如式(8)。
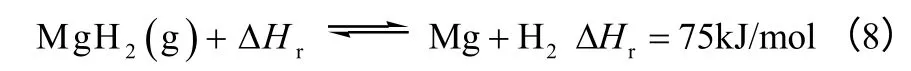
然而,氢气和镁的反应相当迟缓,因此并不能应用在实际储能中。除了提高反应温度,选择合适的催化剂提高反应速率也十分重要[27]。Bogdanovic等[28]对镍掺杂和没有镍掺杂的Mg/MgH2材料用于储能、储氢的对比研究,发现镍掺杂的Mg/MgH2即使在中温中压下也有比较好的氢化速率及循环稳定性。
Mg/MgH2体系由于具有良好的可逆性、无副产物以及反应体系易分离等优点,在化学热泵、太阳能利用及储氢、储能领域具有广阔的应用前景。但H2的储存问题、反应需要掺杂镍或铁催化剂、操作压力高(50~100bar,1bar=105Pa)及反应物易烧结,这些都极大地限制了Mg/MgH2体系在热化学储能领域的研究应用。

表4 碳酸盐分解储能的优缺点
3.5 氨基热化学储能
氨基太阳能热化学储能机理如式(9)。
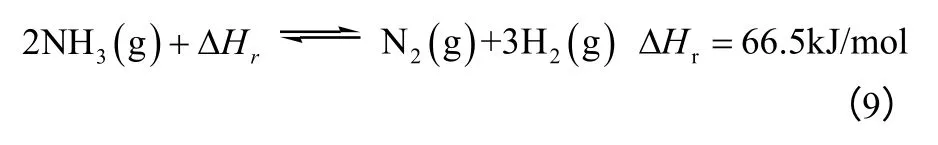
这个反应发生的条件是温度400~700℃,压力10~30bar,且正、逆反应都需要催化剂,常用的氨合成催化剂是“KM1”,常用的氨分解催化剂是“DNK-2R”。
氨基聚光式太阳能发电系统最早是由澳大利亚国立大学的Carden 等[29]在1974年提出的。Lovegrove 等[10,30-33]对闭式氨基太阳能热化学储能系统(图3)及采用该储能系统的太阳能热力发电进行了近四十年的持续研究,研究领域涉及㶲分析、反应器模型、碟形抛物面集热器特性、系统模型、控制方法、热交换、经济分析等方面。
氨基热化学储能相比其他的储能方式具有很多的优点,如成熟的合成氨工业为氨基热化学储能的研究提供丰富的研究资料;氨在环境条件下为液体,容易实现和产物的分开储存;储能体系无副反应发生。但是NH3/N2/H2系统用于热化学储能仍然有一些问题需要解决,如H2和N2的长期安全储存问题;反应必须使用催化剂,增大成本;反应的操作压力过高;正、逆反应的不完全转化等。氨基热化学储能系统下一步的研究方向是储能系统的中试放大研究、储能反应器的设计及热能储、释过程温度分布的优化。
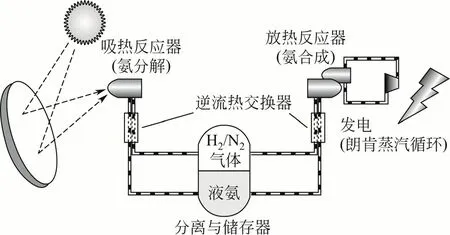
图3 采用氨基热化学储能系统的太阳能热发电系统
3.6 氧化还原反应
由于具有较大的储能密度和较高的操作温度,可逆的氧化还原反应是实现热化学储能比较有前景的方法之一,尤其是空气既能作为传热流体,又能作为反应物,这既简化了储能系统,又节约了操作成本。这些反应通常都发生在600~1000℃,特别适用于高温热能储存。
Bowery 等[34]在1978年探究了BaO/BaO2系统用于高温热能储存的可行性,结果发现储能密度高达2.9GJ/m3BaO。其他热化学储能体系如Fe2O3、Co3O4、Mn2O3、Mn3O4等也引起了广泛的探究,结果发现其中Co3O4具有最好的动力学性能,且经过30 次循环后Co3O4没有发现明显的降解,储能反应中反应物的平均转化率是40%~50%,反应的储能密度为95kW·h/m3[35-36]。
然而Co3O4的极毒性和高成本限制了Co3O4/CoO 系统用于热化学储能,研究发现向Co3O4中添加一些廉价的、低毒性的金属氧化物能够在一定程度上改善这种缺陷。Carrillo 等[37]发现掺杂了少量Mn2O3的Co3O4中较纯Co3O4具有更好的循环稳定性。Block 等[38]也提出了一个Co3O4/Fe2O3复合系统用于热化学储能,结果发现较纯Co3O4和纯Fe2O3,Co3O4/Fe2O3混合物的微观结构稳定性以及反应的可逆性都有很大的提高。
表5 总结了BaO/BaO2系统以及Co3O4/CoO 系统用于热化学储能的优点及缺点。
4 总结与展望
世界范围内的能源日趋紧张与环境污染问题以及我国目前的能源结构调整策略为热化学储能的应用带来了很大的契机。热化学储能以自身具有的特殊功能,在大规模千兆瓦级电力调峰、太阳能热力发电、工业和民用废热和余热的回收利用等领域具有广泛的应用前景。
目前,热化学储能方法仅仅处在小试研究阶段,还没有建成大规模的热电站,在实际应用中还存在着许多技术问题:如反应条件苛刻,不易实现;储能体系寿命短;储能材料对设备的腐蚀性大;产物不能长期储存;一次性投资大及效率低。为真正实现热化学储能从单纯的理论研究到实际应用,未来的研究热点应主要集中在以下几个方面:

表5 金属氧化物分解用于热化学储能的优缺点
(1)选择合适的储能体系,包括反应可逆性好、腐蚀性小、无副反应、适宜的操作条件;
(2)储能、释能反应器和热交换器设计,高温热化学储能系统能量储、释过程研究;
(3)热化学储能系统能量储、释循环的稳态和动态特性及其建模;
(4)储能系统㶲流结构模型和反应物物料流到能量流转换过程的理论与模型;
(5)热化学储能式太阳能发电的中试放大研究及整个发电系统的技术经济分析。
[1] Herrmann U,Kearney D W. Survey of thermal energy storage for parabolic trough power plants[J].J.Sol.Energy Eng.,2002,124(2):145-152.
[2] Dunn R I,Hearps P J,Wright M N.Molten-salt power towers:Newly commercial concentrating solar storage[J].Proceedings of the IEEE,2012,100(2):504-515.
[3] Acem Z,Lopez J,Palomo E.KNO3/NaNO3graphite materials for thermal energy storage at high temperature:Part I. Elaboration methods and thermal properties[J].Appl.Therm.Eng.,2010,30(13):1580-1585.
[4] Shin D Y,Banerjee D. Enhancement of specific heat capacity of high-temperature silica-nanofluids synthesized in alkali chloride salt eutectics for solar thermal-energy storage applications[J]. Int. J. Heat Mass Transfer,2011,54(5-6):1064-1070.
[5] James E P,Steven K S,Kolb W J,et al.Development of a molten-salt thermocline thermal storage system for parabolic through plants[J]. J.Sol.Energy Eng.,2002,124:153-159.
[6] 杨小平,杨晓西,丁静,等. 太阳能高温热发电储热技术研究进展[J]. 热能动力工程,2011,26(1):1-6.
[7] 程晓敏,何高,吴兴文. 铝基合金储热材料在太阳能热发电中的应用及研究进展[J]. 材料导报,2010,17:139-143.
[8] 左远志,丁静,杨晓西. 蓄热技术在聚焦式太阳能热发电系统中的应用现状[J]. 化工进展,2006,25(9):995-1000.
[9] Abedin A H,Rosen M A. A critical review of thermochemical energy storage systems[J]. The Open Renewable Energy Journal,2011(4):42-46.
[10] Luzzi A,Lovegrove K,Filippi E,et al.Techno-economic analysis of a 10MW solar thermal power plant using ammonia-based thermochemical energy storage[J]. Sol.Energy,1999,66(2):91-101.
[11] Wentworth W E,Chen E.Simple thermal decomposition reactions for storage of solar thermal energy[J]. Sol. Energy,1976,18(3):205-214.
[12] Herrmann U. Survey of thermal energy storage for parabolic trough power plants[J].J.Sol.Energy Eng.,2002,124(2):145-152.
[13] Schaube F,Wörner A,Tamme R.High temperature thermochemical heat storage for concentrated solar power using gas-solid reactions[J].J.Sol.Energy Eng.,2011,133(3):1-7.
[14] Schmidt M,Szczukowski C,Roßkopf C,et al.Experimental results of a 10kW high temperature thermochemical storage reactor based on calcium hydroxide[J].Appl.Therm.Eng.,2014,62(2):553-559.
[15] Darkwa K. Thermochemical energy storage in inorganic oxides:An experimental evaluation[J].Appl.Therm.Eng.,1998,18(6):387-400.
[16] Ogura H,Yasuda S,Otsubo Y,et al. Continuous operation of a chemicals heat pump[J].Asia-Pac.J.Chem.Eng.,2007,2:118-123.
[17] Kim S T,Ryu J,Kato Y. Reactivity enhancement of chemical materials used in packed bed reactor of chemical heat pump[J].Prog.Nucl.Energy,2011,53(7):1027-1033.
[18] Zamengo M,Ryu J,Kato Y. Thermochemical performance of magnesium hydroxide-expanded graphite pellets for chemical heat pump[J].Appl.Therm.Eng.,2014,64(1-2):339-347.
[19] Kato Y,Yamada M,Kanie T,et al.Calcium oxide/carbon dioxide reactivity in a packed bed reactor of a chemical heat pump for high-temperature gas reactors[J].Nucl.Eng.Des.,2001,210(1-3):1-8.
[20] Meier A,Bonaldi E,Cella G M,et al. Design and experimental investigation of a horizontal rotary reactor for the solar thermal production of lime[J].Energy,2004,29(5-6):811-821.
[21] Kyaw K,Shibata T,Watanabe F,et al.Applicability of zeolite for CO2storage in a CaO-CO2high temperature energy storage system[J].Energy Convers.Manage.,1997,38(10-13):1025-1033.
[22] Kato Y,Watanabe Y,Yoshizawa Y.Application of inorganic/carbon dioxide reaction system to a chemical heat pump[C]//Proceedings of the 31st Intersociety Energy Conversion Conference,Washington D C,1996,2:763-768.
[23] Edwards J H,Do K T,Maitra A M.The use of solar-based CO2/CH4reforming for reducing green house effect gas emissions during the generation of electricity and process heat[J]. Energy Convers.Manage.,1996,37(6-8):1339-44.
[24] Kodama T,Ohtake H,Matsumoto S,et al.Thermochemical methane reforming using a reactive WO3/W redox system[J]. Energy,2000,25:411-425.
[25] Kodama T,Koyanagi T,Shimizu T,et al.CO2reforming of methane in a molten carbonate salt bath for use in solar thermochemical processes[J].Energy&Fuels,2001,15(1):60-65
[26] Gokon N,Oku Y,Kaneko H,et al.Methane reforming with CO in molten salt using FeO catalyst[J].Sol.Energy,2002,72(3):243-250.
[27] Bellemare J,Huot J. Hydrogen storage properties of cold rolled magnesium hydrides with oxides catalysts[J]. J. Alloys Compd.,2012,512(1):33-38.
[28] Bogdanovic B,Hofmannb H,Neuya A,et al. Ni-doped versus undoped Mg-MgH2materials for high temperature heat or hydrogen storage[J].J.Alloys Compd.,1999,292(1-2):57-71.
[29] Carden P. Energy corradiation using the reversible ammonia reaction[J].Sol.Energy,1977,19(4):365-378.
[30] Kreetz H,Lovegrove K.Theoretical analysis and experimental results of a 1kWchem ammonia synthesis reactor for a solar thermochemical energy storage system[J].Sol.Energy,1999,67(4-6):287-296.
[31] Lovegrove K,Luzzi A,Mccann M,et al. Exergy analysis of ammonia-based solar thermochemical power system[J]. Sol.Energy,1999,66(2):103-115.
[32] Lovegrove K,Luzzi A,Soldiani I,et al.Developing ammonia based thermochemical energy storage for dish power plants[J]. Sol.Energy,2004,76(1-3):331-337.
[33] Lovegrove K,Burgess G,Pye J.A new 500m2paraboloidal dish solar concentrator[J].Sol.Energy,2011,85:620-626.
[34] Bowery R G,Justen J.Energy storage using the reversible oxidation of barium oxide[J].Sol.Energy,1978,21(6):523-525.
[35] Wong B,Brown L,Schaube F. Oxide based thermochemical heat storage[C]//16th Solar PACES International Symposium,Perpignan,France,2010.
[36] Neises M,Tescari S,Oliveira L de,et al.Solar-heated rotary kiln for thermochemical energy storage[J]. Sol. Energy,2012,86(10):3040-3048.
[37] Carrillo A J,Moya J,Bayón A,et al.Thermochemical energy storage at high temperature via redox cycles of Mn and Co oxides:Pure oxides versus mixed ones[J]. Sol. Energy Mater. Sol. Cells,2014,123:47-57.
[38] Block T,Knoblauch N,Schmücker M.The cobalt-oxide/iron-oxide binary system for use as high temperature thermochemical energy storage material[J].Thermochim.Acta,2014,577:25-32.
