内皮素-1在均匀流中构象改变的分子动力学模拟
2014-07-18黄庆生肖天霞魏彦杰
黄庆生 肖天霞 张 键 魏彦杰
(中国科学院深圳先进技术研究院 深圳 518055)
内皮素-1在均匀流中构象改变的分子动力学模拟
黄庆生 肖天霞 张 键 魏彦杰
(中国科学院深圳先进技术研究院 深圳 518055)
内皮素 ET-1(Endothelin-1)与其受体 ETA(Endothelin-A)和 ETB(Endothelin-B)的相互作用控制血管紧张度,维持血压,与心血管疾病关系密切。ET-1 与血管内皮的 ETB结合介导血管舒张,而与血管平滑肌的 ETA和 ETB结合则引起血管收缩。ET-1 只有在存在正常血流的体内实验才表现出明显的舒张活性,且其结构具有柔性,故推测血流的剪切应力可能控制了它的构象,进而调控它与 ETB的结合。文章利用流动分子动力学计算机模拟方法,研究了均匀流中质心受约束的内皮素 ET-1 的构象。实验结果观察到该分子的羧基端往氨基端靠近,整个分子变得紧凑。这个发现对研究 ET-1 与 ETB的相互作用和设计基于 ET-1 的心血管药物将会有一定的指导意义。
内皮素-1;内皮素 B 受体;均匀流;分子动力学模拟
1 引 言
血流对其中的生物分子施加推力和剪应力,这种作用近年来已被证实能够改变生物分子的构象,从而调控多种生理过程[1,2]。血压的维持依赖于血管壁平滑肌细胞的收缩和舒张,而平滑肌受到内皮素-1(Endothelin-1,ET-1)系统的高效调节[3]。然而,在有关血压维持的研究中,还没有对血流调控血压的分子结构机制的充分阐述。目前仅知道血流动力学通过对 ET-1 表达和分泌的调控影响血压,并且涉及到 ET-1 的活性尚有一些相互矛盾的数据没有得到合理解释。这种现状不利于对高血压和动脉粥样硬化等心血管疾病机理的研究,也阻碍了药物的理性设计和临床应用[4]。
ET-1 是一个长度为 21 个氨基酸的肽(图1(a)),最早从血管内皮细胞的条件培养液中分离得到[5]。ET-1 直接作用于内皮素 A 受体(Endothelin-A,ETA)可引起平滑肌强烈收缩[6],但血液中 ET-1 的主要生理作用是通过内皮素 B受体(Endothelin-B,ETB)引起血管舒张,这可能是对血压的一种反馈控制机制[7-9]。血流有若干种机制对内皮素系统进行调控,包括对 ET-1 的合成和分泌调节[10-13],对内皮素转化酶(Endothelin Converting Enzyme)表达的调节[14],及对 Weilbel-Palade 小体胞吐作用的控制[15-17],这些机制能够在不同的时间和空间范围改变 ET-1 的浓度。实验表明血流可能调控血液中 ET-1 和内皮上的 ETB结合进而调控血压。首先,在生理条件下血浆中的ET-1 并不表现其对血管收缩的特异作用[15]。而且在生理条件下占主导地位的是血管中的 ET-1 和内皮细胞上的 ETB结合引起的动脉舒张,这是因为 ETA拮抗剂 BQ123 引起的前臂动脉舒张可以通过抑制 NO 合成或同时注射 ETB拮抗剂 BQ788 抵消[18]。外源性的 ETB激动剂 S6c 和 BQ3020 在冠状动脉和乳内动脉的离体实验中表现出的也是舒张效应和收缩效应的相互抵消[19]。这些实验虽然受到一些因素干扰,但却都表明了血流、ET-1 和ETB同时存在时血管舒张的事实。另外,临床研究表明高血压和其他一些心血管疾病的病因是病变改变了血流的动力学性质[20],使得血液中 ET-1的舒张活性无法表现,结果其收缩活性占主导地位而引起病情恶化[21-23]。
蛋白质分子的结构决定了其结合功能,血流的影响可能通过对 ET-1 构象的精确调控达到。ET-1 羧基端的 6 个残基形成构象多变的尾部(图1(a)),用 X 射线晶体衍射方法测得的是不太规整的 α 螺旋[24],而用核磁共振方法测得的水溶液中的结构则是无规卷曲[25-27],Tyr13 是该蛋白的疏水中心[28]。我们推测具有柔性结构的羧基端的构象受到血流调控。
目前 ET-1 静态结构的研究已较为充分,包括静态结构的实验测定和多种条件下的分子动力学模拟、蒙特卡洛模拟等[29-33]。但 ET-1 对血管紧张度的调节活性在体内外实验的差异表明血流可能调节了 ET-1 的活性。故要研究血流对 ET-1的调控,必须研究 ET-1 的动态结构。分子动力学模拟能够捕捉原子级别的动态相互作用[34],而流动分子动力学(Flow Molecular Dynamics,Flow MD)模拟则用显式溶剂化的分子动力学研究流体力学,通过对水分子施加外力实现对水流的模拟[35,36]。对于血流调控生物大分子构象的现象,该技术是揭示其中力学机制的有力工具。
本文应用流动分子动力学模拟均匀流的环境,研究 ET-1 在水流中的构象改变,进一步探讨动态环境中生物大分子的构象变化及其对药物设计的启发。
2 材料与方法
2.1 计算机模拟方法
本文使用 VMD 软件及其插件 PSFGEN 构建模拟体系,完成对分子模型的操控,并使用NAMD2 软件进行分子动力学模拟。
已经发表的 ET-1 的静态结构有若干个,本文采用其中的两个作为模拟的初始构象,由蛋白质数据库(Protein Data Bank,PDB)取得,其 ID分别为 1EDN 和 1V6R(图 1(a))。1EDN 系由 X射线晶体衍射方法得到;1V6R 系由 ET-1 水溶液的核磁共振谱解出。
模拟体系采用 8.7 nm×4.7 nm×4.7 nm 的水框,其边界用周期性边界条件处理,水框中心附近放置 ET-1,体系中加入一定数目的钠离子、氯离子模拟生理盐水并维持电中性(图 1(b))。

图 1 ET-1 的结构和模拟体系Fig. 1. Structure of ET-1 and the simulation system
作为准备阶段的模拟,首先对水框和离子进行 1 万步的能量最小化,其次对除 ET-1 的肽骨架之外的原子(包括水框和离子)进行 1 万步的能量最小化,然后对所有原子进行 2 万步的能量最小化。接下来的阶段进行 2 ns 的平衡,采用朗之万动力学控制温度和压强,其中前 1 ns 固定Cys11 的 Cα原子(该原子处于 ET-1 质心附近),后 1 ns 用 SMD 的方法约束整个 ET-1,使其质心固定在模拟体系中心。分别包含 1EDN 和 1V6R作为初始构象的两个模拟体系各自独立进行能量最小化和平衡后, 开始进行生产性阶段的模拟,每个体系再平行地运行自由分子动力学和流动分子动力学,模拟时长均为 20 ns,最后共得到 4条模拟轨迹。其中,自由分子动力学对分子不作任何操控,也不控制体系的温度和压强,意在观察 ET-1 构象的发展趋势。
流动分子动力学通过操控水分子形成水流,观察水流冲刷对 ET-1 构象的影响。具体地说,对体系在 x 轴负方向一侧、厚度为 0.3 nm 水层中的每个水分子中的氧原子施加指向 x 轴正方向、大小为 5.0 pN 的驱动力,使水定向运动;并且对体系中所有水分子中的氧原子按朗之万动力学施加阻尼力(阻尼系数 γ=0.1 ps—1),将温度控制在310 K。在模拟开始不久(1 ns 以内),体系中就可以形成指向 x 轴正方向、流速为 36 nm/ns 的均匀定常流。
2.2 数据分析和可视化
文中使用 VMD 显示模拟结果并提取数据,用 R 软件分析结果。
3 结 果
3.1 ET-1 在两种模拟中的构象变化
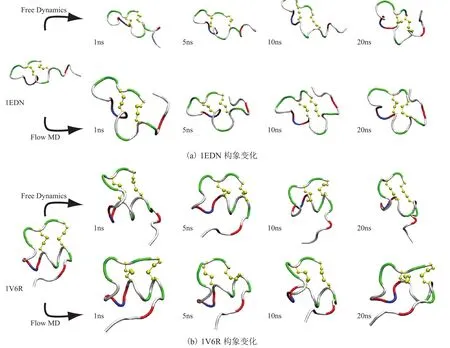
图 2 模拟中 ET-1 的构象变化Fig. 2. Conformational changes of ET-1 in simulation
内皮素 ET-1 是一个长度为 21 个氨基酸的肽,分别用 X 射线晶体衍射方法[24]和核磁共振方法测得的结构[25-27]显示,其羧基端 6 个残基形成构象多变的尾部(图 1(a))。为了避免初始构象引起的偏倚,对这两个代表性的结构平行地进行了模拟(图 2)。其中,图 2(a)、2(b)分别是初始构象为 1EDN 和 1V6R 的 ET-1 在自由动力学模拟(Free Dynamics)和流动分子动力学(Flow MD)中的代表性构象(时间为 1 ns、5 ns、10 ns和 20 ns)。而管状模型代表 ET-1 骨架,其颜色白色、绿色、红色和蓝色分别代表疏水、亲水、碱性和酸性残基,黄色的球棍模型代表两个二硫键。自由动力学模拟的结果显示,初始构象引起的偏倚对前 5 ns 的影响较大,其羧基端的变化幅度较大,起始于 1EDN 的模拟很快便变得不同于初始构象。起始于 1V6R 的模拟虽然大体上维持了初始构象,但这更可能是由于 1V6R 是水溶液中测得的结构,自由动力学说明了 ET-1 在静态水溶液中的结构应该是接近于 1V6R 的。
在流动分子动力学模拟中,ET-1 的构象变化在模拟的开端同样比较剧烈,随后会形成紧凑且相对稳定的结构。虽然水流向体系中引入了能量,但朗之万动力学令引入的能量耗散,并且控制了温度,ET-1 的构象变化并不比在自由动力学中更活跃。相反,由于水流的冲刷,ET-1 适应了这种环境后,一定程度上还受到了约束,因此其构象处于紧张的稳定中。

图 3 ET-1 结构参数的改变以及相应参数在自由动力学和流动分子动力学模拟中的比较Fig. 3. Evolution and comparison of structural parameters of ET-1 in free dynamics and in flow MD simulation
3.2 ET-1 构象变化的定量分析和比较
分子的回转半径(Radius of Gyration,Rgyr)表述了分子的几何尺寸,可度量结构的松散程度。图 3 为 ET-1 结构参数的改变以及相应参数在自由动力学(Free Dynamics)和流动分子动力学(Flow MD)模拟中的比较结果。其中,图 3(a)为初始构象 1EDN 的 ET-1 回转半径 Rgyr的演化;(b)为初始构象 1V6R 的 ET-1 回转半径 Rgyr的演化;(c)为回转半径 Rgyr模拟全程平均值和变化范围的比较;(d)为初始构象 1EDN 的 ET-1 的溶剂可达表面积(Solvent-Accessible Surface Area,Ssolv)的演化;(e)为初始构象 1V6R 的 ET-1 的溶剂可达表面积 Ssolv的演化;(f)为溶剂可达表面积Ssolv模拟全程平均值和变化范围的比较。在流动分子动力学模拟中,ET-1 的回转半径 Rgyr在模拟的前 5 ns 很快由较高的值(1EDN 的 1 nm 和 1V6R的 0.85 nm)降低到 0.8 nm 左右,之后虽有起伏,但基本维持在这个值(图 3(a)、3(b))。而在自由动力学中,回转半径 Rgyr的起伏范围较大,尤其是起始于 1EDN 的模拟,围绕在 0.9 nm 左右波动;而起始于 1V6R 的模拟其回转半径则围绕0.85 nm 左右波动,偶尔可以达到大于初始构象的值。回转半径模拟全程的最大值、平均值和最小值都显示了在流动分子动力学模拟中小于自由动力学的趋势(图 3(c))。上述趋势对于平均值比较明显,可能是由于初始构象引起的偏倚对最大值和最小值的比较有较大干扰。
蛋白分子的溶剂可达表面积 Ssolv定量刻画分子的折叠情况,较大的溶剂可达表面积意味着分子处于解折叠状态。而对于有铰链区的分子,则可用来描述铰链的开关状态。对于模拟中 ET-1来说,当羧基端靠近氨基端时,其溶剂可达表面积将取得较小值。

图 4 模拟中 ET-1 的羧基端 16 至 21 号残基的结构参数在自由动力学和流动分子动力学模拟中的比较Fig. 4. Comparison of structural parameters of residues 16 to 21 of ET-1 C-terminal in free dynamics and in flow MD simulation
在模拟中,ET-1 的溶剂可达表面积 Ssolv有类似回转半径 Rgyr的趋势,不过溶剂可达表面积 Ssolv的变化较为平稳,波动较小。除了起始于 1V6R的自由动力学之外,其他的模拟在前 5 ns 中,溶剂可达表面积 Ssolv都很快由较高的值(1EDN 的 26 nm2和 1V6R 的 25 nm2)降低下来(图 3(d)、3(e))。其中,在流动分子动力学中,溶剂可达表面积 Ssolv可以在 5 ns 时降低至 22 nm2左右(图3(d)、3(e)),之后还有继续降低的趋势。而在自由动力学模拟中,基本上都是围绕 24 nm2上下波动。同回转半径 Rgyr一样,溶剂可达表面积Ssolv在模拟全程的最大值、平均值和最小值显示了在流动分子动力学模拟中小于自由动力学的趋势(图 3(f)),尤其是对于平均值的比较。
3.3 水流对 ET-1 羧基端构象的影响
在流动分子动力学模拟的前期(前 5 ns),水流的动力使得 ET-1 羧基端有更大的活动范围;而在 ET-1 的构象适应于水流之后,羧基端形成靠近氨基端的构象,趋于稳定。
为揭示这种趋势,将 ET-1 的核心区(第 1 至15 号残基)与模拟的初始构象对齐后,比较其羧基端(第 16 至 21 号残基)肽链骨架与初始构象时的均方根距离(Root-Mean-Square Distance,RMSD),结果见图 4。其中,图 4(a)为初始构象 1EDN 的 ET-1 的羧基端所有原子与初始构象的均方根距离 RMSD 的演化;(b)为初始构象1V6R 的 ET-1 的羧基端所有原子与初始构象的均方根距离 RMSD 的演化;(c)为羧基端 6 个 Cα原子在模拟的后 10 ns 的均方根涨落(Root-Mean-Square Fluctuation,RMSF),图示为这 6 个原子的平均值,误差棒表示 6 个原子中的最大值和最小值;(d)为初始构象 1EDN 的 ET-1 中第 21 号残基与第 1 号残基的质心间距离的演化;(e)为初始构象 1V6R 的 ET-1 中第 21 号残基与第 1 号残基的质心间距离的演化;(f)为第 21 号残基与第 1 号残基的质心间距离在模拟全程平均值和变化范围的比较。图 4(a)和 4(b)显示,在前 5 ns中,流动分子动力学构象的 RMSD 大于自由动力学中的构象,之后趋于平稳,在最后 10 ns 中变得小于自由动力学中的构象。该部位 Cα原子的均方根涨落 RMSF 同样表现出这种趋势。后10 ns RMSF 很小,与自由动力学中形成明显对照(图 4(c))。流动分子动力学和自由动力学的这种差异在初始构象为 1EDN 的模拟中更为明显(图4(a)、4(c))。
在两个流动分子动力学模拟中,ET-1 羧基端都往核心区(第 1 至 15 号残基)接近。在初始构象为 1V6R 的模拟中,羧基端逐渐偏离其初始构象,往氨基端(Cys1)靠拢;在初始构象为 1EDN的模拟中,ET-1 羧基端的类 α 螺旋逐渐破坏,His16 成为铰链,允许羧基端摆动,先转变为类似 1V6R 的构象,最后形成羧基端和氨基端相互贴近的构象(图 4(d)、4(e)、4(f))。
4 讨 论
ET-1 的受体有两个:内皮素 A 受体(ETA)和内皮素 B 受体(ETB)[6,37]。在心血管系统中,ETA在血管平滑肌细胞和心肌细胞表达水平高,介导血管收缩[6],从而维持生理条件下的血流动力学参数[38]。ETB高表达于内皮细胞[39],在平滑肌细胞、巨噬细胞和血小板也有表达。内皮细胞的 ETB激活后引起一氧化氮和前列环素等血管舒张剂的合成和分泌[40,41],血管舒张剂随后作用于平滑肌细胞引起血管舒张[42]。ETB结合ET-1 后内吞,将 ET-1 清理出循环系统[43]。在平滑肌细胞上也有少量 ETB表达,功能与 ETA相似,可能还会与 ETA形成二聚体或多聚体[4],介导收缩活性。不过,平滑肌上的 ETB的收缩效应很小[44,45]。实验表明,ETB敲除的小鼠会发展为高血压[7],而人类接受 ETB阻断剂后血压也会升高[8]。显然,ETA和 ETB构成微妙的平衡,维持循环系统的正常功能。更进一步地,ET-1 的杂合子基因敲除小鼠的表现型是血压升高而非降低[9],表明虽然 ET-1 对平滑肌有强烈的收缩活性,但血液中 ET-1 的主要生理作用是引起血管舒张,作为一种反馈机制中的一环控制血压。
血流有若干种机制对内皮素系统进行调控[10-17],虽然还没有直接针对 ET-1 和 ETB结合机制的研究,但实验数据可能支撑血流调控血液中 ET-1 和内皮上的 ETB结合的结论。血浆中的ET-1 浓度较低,维持在 1~10 pmol/L[46]。虽然浓度很低,但体外实验表明这个浓度足以引起血管强烈收缩[19],然而在生理条件下血浆中的 ET-1并不具有对血管收缩的特异作用[15]。在人体注射 ETA拮抗剂 BQ123 引起前臂动脉舒张,如果抑制 NO 合成或者同时注射 ETB拮抗剂 BQ788 则这种舒张会减弱,表明生理条件下前臂动脉的舒张依赖于内皮细胞上 ETB和血管中 ET-1 的持续性结合[18]。与此对照,外源性的 ETB激动剂 S6c和 BQ3020 在冠状动脉和乳内动脉的离体实验中都表现出舒张效应和收缩效应的相互抵消[19]。另有一个研究表明,外源性的 ETB激动剂 S6c 和BQ3020 在离体的肠系膜动脉不引起收缩,不过同一研究中也观察到剥离内皮后 S6c 不引起收缩,因此其数据被解释成相关受体的表达受到微妙的调控[47]。这些实验,不管是体内实验还是体外实验,干扰因素都非常多,实验结果看似有矛盾之处。然而,对这些矛盾的分析却表明了血流存在时 ETB才能表现出明显的舒张活性,并且暗示了血流无法调控外源的激动剂,但却能够促进ET-1 与 ETB的结合。临床研究也表明,高血压和其他一些心血管疾病的病因是 ETB和 ET-1 的比例失衡[21],或病变改变了血流的动力学性质[20],因而 ET-1 无法表现其舒张活性,反而表现其收缩活性引起病情恶化[21-23]。血流的影响可能是解释ET-1 矛盾行为的关键。
本文中进行的模拟表明,ET-1 的羧基端也许可以感受血液的动力学参数。虽然由于不同方法测得的结构迥异,羧基端的构象不稳定性很早就受到了关注[29-33],然而该区域的不稳定性一直没有和其与受体结合的活性联系起来。羧基端的 6 个残基决定了 ET-1 与 ETB的结合[48],并且ETB的肽类激动剂和拮抗剂基本上具有和 ET-1相似的羧基端序列,而氨基端则差别较大[4,49](图1(a))。因此,可以推测,ET-1 与 ETB结合的活性可以通过羧基端被调控,这 6 个残基可能构成一个构象开关。与 ET-1 羧基端的结构相对照,其氨基端 15 个残基折叠成紧致的块状,有两个二硫键维持其稳定性,考虑到氨基端介导与 ETA的结合,该反应主要发生在内皮下组织的静态环境中,因此与氨基端的刚性结构相对应[50]。由于ET-1 和两个受体结合导致截然相反的生理活性,如果 ET-1 羧基端的构象灵活性能得到确认,那就表明可能改造已有的肽类激动剂和拮抗剂,考虑用药部位的血流特性,更有针对性地设计药物,控制其对受体的亲和力。
血管中靠近壁面处是剪切流,剪切流场的效应可以分解为拉伸和旋转,柔软的肽链在剪切流中可以被拉长或缠绕,取决于其长轴与速度梯度的夹角的瞬时值[51]。本文使用计算机模拟出均匀流,在其中 ET-1 受到水流的冲刷,可以体现剪切流的拉伸效应。在模拟中,ET-1 的重心被约束在原点,允许其自由翻转,这部分地模拟了剪切流的翻转效应。模拟的结果表明,ET-1 的回转半径有所缩小。在真正的剪切流中,肽链可能会更容易缠绕而变得紧凑。
5 结 语
本文使用流动分子动力学计算机模拟的方法研究了均匀流中,重心受约束的内皮素 ET-1 的构象变化。模拟结果显示该分子的羧基端往氨基端靠近,整个分子变得紧凑。这个发现对研究ET-1 与 ETB的相互作用和设计基于 ET-1 的心血管药物将会有一定的指导意义。
致 谢
本研究受广州超级计算中心先导系统和中国科学院深圳超算中心支持。本研究使用的软件 VMD 和 NAMD 由美国伊利诺伊大学 Urbana-Champaign 分校的 Beckman 先进科学技术研究所的理论和计算生物物理学小组开发。
[1] Ridger V, Krams R, Carpi A, et al. Hemodynamic parameters regulating vascular inflammation and atherosclerosis: a brief update [J]. Biomedicine & Pharmacotherapy, 2008, 62(8): 536-540.
[2] Furie B, Furie BC. Mechanisms of thrombus formation [J]. New England Journal of Medicine, 2008, 359(9): 938-949.
[3] Rautureau Y, Schiffrin EL. Endothelin in hypertension: an update [J]. Current Opinion in Nephrology and Hypertension, 2012, 21(2): 128-136.
[4] Mazzuca MQ, Khalil RA. Vascular endothelin receptor type B: structure, function and dysregulation in vascular disease [J]. Biochemical Pharmacology, 2012, 84(2): 147-162.
[5] Yanagisawa M, Kurihara H, Kimura S, et al. A novel potent vasoconstrictor peptide produced by vascular endothelial cells [J]. Nature, 1988, 332(6163): 411-415.
[6] Arai H, Hori S, Aramori I, et al. Cloning and expression of a cDNA encoding an endothelin receptor [J]. Nature, 1990, 348(6303): 730-732.
[7] Ohuchi T, Kuwaki T, Ling GY, et al. Elevation of blood pressure by genetic and pharmacological disruption of the ETB receptor in mice [J]. American Journal of Physiology, 1999, 276(4 Pt 2): R1071-1077.
[8] Strachan FE, Spratt JC, Wilkinson IB, et al. Systemic blockade of the endothelin-B receptor increases peripheral vascular resistance in healthy men [J]. Hypertension, 1999, 33(1 Pt 2): 581-585.
[9] Kurihara Y, Kurihara H, Suzuki H, et al. Elevated blood pressure and craniofacial abnormalities in mice deficient in endothelin-1 [J]. Nature, 1994, 368(6473): 703-710.
[10] Kuchan MJ, Frangos JA. Shear stress regulatesendothelin-1 release via protein kinase C and cGMP in cultured endothelial cells [J]. American Journal of Physiology, 1993, 264(1 Pt 2): H150-156.
[11] Malek AM, Zhang J, Jiang J, et al. Endothelin-1 gene suppression by shear stress: pharmacological evaluation of the role of tyrosine kinase, intracellular calcium, cytoskeleton, and mechanosensitive channels [J]. Journal of Molecular and Cellular Cardiology, 1999, 31(2): 387-399.
[12] 王贵学, 罗向东, 欧阳克清, 等. 剪切应力对毛细血管内皮细胞代谢的影响 [J]. 生物物理学报, 1999, 15(1): 179-186.
[13] 刘波, 周瑾, 刘艳春, 等. 低切应力作用下体外培养动脉的内皮素表达 [J]. 生物物理学报, 2005, 21(3): 200-204.
[14] Masatsugu K, Itoh H, Chun TH, et al. Physiologic shear stress suppresses endothelin-converting enzyme-1 expression in vascular endothelial cells [J]. Journal of Cardiovascular Pharmacology, 1998, 31 (Suppl 1): S42-45.
[15] Khimji AK, Rockey DC. Endothelin-biology and disease [J]. Cellular Signalling, 2010, 22(11): 1615-1625.
[16] van Mourik JA, Romani de Wit T, Voorberg J. Biogenesis and exocytosis of Weibel-Palade bodies [J]. Histochemistry and Cell Biology, 2002, 117(2): 113-122.
[17] Fyhrquist F, Saijonmaa O, Metsarinne K, et al. Raised plasma endothelin-I concentration following cold pressor test [J]. Biochemical and Biophysical Research Communications, 1990, 169(1): 217-221.
[18] Verhaar MC, Strachan FE, Newby DE, et al. Endothelin-A receptor antagonist-mediated vasodilatation is attenuated by inhibition of nitric oxide synthesis and by endothelin-B receptor blockade [J]. Circulation, 1998, 97(8): 752-756.
[19] Davenport AP. International Union of Pharmacology. XXIX. Update on endothelin receptor nomenclature [J]. Pharmacological Reviews, 2002, 54(2): 219-226.
[20] 孙安强, 邓小燕. 冠状动脉支架血流动力学中的几个问题 [J]. 生物物理学报, 2011, 27(08): 669-675.
[21] Schneider MP, Boesen EI, Pollock DM. Contrasting actions of endothelin ET(A) and ET(B) receptors in cardiovascular disease [J]. Annual Review of Pharmacology and Toxicology, 2007, 47: 731-759.
[22] King JM, Srivastava KD, Stefano GB, et al. Human monocyte adhesion is modulated by endothelin B receptor-coupled nitric oxide release [J]. Journal of Immunology, 1997, 158(2): 880-886.
[23] Barst RJ, Langleben D, Frost A, et al. Sitaxsentan therapy for pulmonary arterial hypertension [J]. American Journal of Respiratory and Critical Care Medicine, 2004, 169(4): 441-447.
[24] Janes RW, Peapus DH, Wallace BA. The crystal structure of human endothelin [J]. Nature Structural Biology, 1994, 1(5): 311-319.
[25] Takashima H, Mimura N, Ohkubo T, et al. Distributed computing and NMR constraint-based high-resolution structure determination: applied for bioactive Peptide endothelin-1 to determine C-terminal folding [J]. Journal of the American Chemical Society, 2004, 126(14): 4504-4505.
[26] Krystek SR Jr., Bassolino DA, Novotny J, et al. Conformation of endothelin in aqueous ethylene glycol determined by 1H-NMR and molecular dynamics simulations [J]. FEBS Letters, 1991, 281(1-2): 212-218.
[27] Andersen NH, Chen CP, Marschner TM, et al. Conformational isomerism of endothelin in acidic aqueous media: a quantitative NOESY analysis [J]. Biochemistry, 1992, 31(5): 1280-1295.
[28] Takashima H, Tamaoki H, Teno N, et al. Hydrophobic core around tyrosine for human endothelin-1 investigated by photochemically induced dynamic nuclear polarization nuclear magnetic resonance and matrix-assisted laser desorption ionization time-of-flight mass spectrometry [J]. Biochemistry, 2004, 43(44): 13932-13936.
[29] Weaver DF, Kim S, Gross PM. Theoretical conformational analyses of endothelin-1 in vacuum, aqueous, and lipid environments [J]. Journal of Cardiovascular Pharmacology, 1993, 22(Suppl 8): S374-376.
[30] Doherty AM, Cody WL, Leitz NL, et al. Structureactivity studies of the C-terminal region of the endothelins and the sarafotoxins [J]. Journal of Cardiovascular Pharmacology, 1991, 17 (Suppl 7): S59-61.
[31] Kimura S, Kasuya Y, Sawamura T, et al. Structureactivity relationships of endothelin: importance of the C-terminal moiety [J]. Biochemical and Biophysical Research Communications, 1988, 156(3): 1182-1186.
[32] Hewage CM, Jiang L, Parkinson JA, et al. Solution structure determination of endothelin-1 in methanol/ water by NMR and molecular modelling methods [J]. Journal of Peptide Science, 1997, 3(6): 415-428.
[33] Kuroda M, Yamazaki K, Taga T. Conformation of the C-terminus of endothelin-1 in aqueous solution studied by Monte-Carlo simulation [J]. FEBS Letters, 1994, 355(3): 263-266.
[34] Fischer S, Olsen KW, Nam K, et al. Unsuspected pathway of the allosteric transition in hemoglobin [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(14): 5608-5613.
[35] Szymczak P, Cieplak M. Hydrodynamic effects in proteins [J]. Journal of Physics: Condensed Matter, 2011, 23(3): 033102.
[36] Lou J, Zhu C. Flow induces loop-to-beta-hairpin transition on the beta-switch of platelet glycoprotein Ib alpha [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(37): 13847-13852.
[37] Sakurai T, Yanagisawa M, Takuwa Y, et al. Cloning of a cDNA encoding a non-isopeptide-selective subtype of the endothelin receptor [J]. Nature, 1990, 348(6303): 732-735.
[38] Russell FD, Davenport AP. Secretory pathways in endothelin synthesis [J]. British Journal of Pharmacology, 1999, 126(2): 391-398.
[39] Hosoda K, Nakao K, Hiroshi A, et al. Cloning and expression of human endothelin-1 receptor cDNA [J]. FEBS Letters, 1991, 287(1-2): 23-26.
[40] Liu S, Premont RT, Kontos CD, et al. Endothelin-1 activates endothelial cell nitric-oxide synthase via heterotrimeric G-protein betagamma subunit signaling to protein jinase B/Akt [J]. Journal of Biological Chemistry, 2003, 278(50): 49929-49935.
[41] Herrera M, Hong NJ, Ortiz PA, et al. Endothelin-1 inhibits thick ascending limb transport via Aktstimulated nitric oxide production [J]. Journal of Biological Chemistry, 2009, 284(3): 1454-1460.
[42] Ito M, Nakano T, Erdodi F, et al. Myosin phosphatase: structure, regulation and function [J]. Molecular and Cellular Biochemistry, 2004, 259(1-2): 197-209.
[43] Oksche A, Boese G, Horstmeyer A, et al. Late endosomal/lysosomal targeting and lack of recycling of the ligand-occupied endothelin B receptor [J]. Molecular Pharmacology, 2000, 57(6): 1104-1113.
[44] Davenport AP, O'Reilly G, Kuc RE. Endothelin ETA and ETB mRNA and receptors expressed by smooth muscle in the human vasculature: majority of the ETA sub-type [J]. British Journal of Pharmacology, 1995, 114(6): 1110-1116.
[45] Dimitrijevic I, Edvinsson ML, Chen Q, et al. Increased expression of vascular endothelin type B and angiotensin type 1 receptors in patients with ischemic heart disease [J]. BMC Cardiovascular Disorders, 2009, 9: 40.
[46] Haynes WG, Webb DJ. Contribution of endogenous generation of endothelin-1 to basal vascular tone [J]. Lancet, 1994, 344(8926): 852-854.
[47] Adner M, Geary GG, Edvinsson L. Appearance of contractile endothelin-B receptors in rat mesenteric arterial segments following organ culture [J]. Acta Physiologica Scandinavica, 1998, 163(2): 121-129.
[48] Mihara S, Fujimoto M. Non-isopeptide-selective endothelin receptors in human Girardi heart cells [J]. Life Sciences, 1992, 50(3): 219-226.
[49] Mourier G, Hajj M, Cordier F, et al. Pharmacological and structural characterization of long-sarafotoxins, a new family of endothelinlike peptides: role of the C-terminus extension [J]. Biochimie, 2012, 94(2): 461-470.
[50] Compeer MG, Suylen DP, Hackeng TM, et al. Endothelin-1 and -2: two amino acids matter [J]. Life Sciences, 2012, 91(13-14): 607-612.
[51] Smith DE, Babcock HP, Chu S. Single-polymer dynamics in steady shear flow [J]. Science, 1999, 283(5408): 1724-1727.
Molecular Dynamics Simulation of Endothelin-1 Conformational Changes within Uniform Flow
HUANG Qingsheng XIAO Tianxia ZHANG Jian WEI Yanjie
( Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, China )
Interactions of ET-1 (Endothelin-1) with its receptors ETA(Endothelin-A) and ETB(Endothelin-B) regulate the vascular tone, maintain the blood pressure, and are closely related to cardiovascular diseases. Binding of ET-1 with ETBin the vascular endothelium induces vasodilation, while binding with ETAand ETBin vascular smooth muscle results in vasoconstriction. Because ET-1 only induces vasodilation in vivo when the blood flow is present, we speculate that the shear stress of the blood flow may control the conformation of ET-1 through its structural flexibility, thus regulate its binding with ETB. By flow molecular dynamics simulation, the conformational changes of ET-1 in uniform flow were studied with its center of mass constrained. It is found that the C-terminal of ET-1 gets closer to the N-terminal in the simulation, resulting in a compact structure. This finding may provide guidance for the study on the interaction between ET-1 and ETBand the design of ET-1-based cardiovascular drugs.
endothelin-1; endothelin B receptor; uniform flow; molecular dynamics simulation
TG 156
A
2014-01-01
国家自然科学基金项目(31100850);深圳杰出青年基金项目(SW201110059);国家自然科学基金项目(11204342);深圳市科技创新委员会项目(JCYJ20120615140912201);深圳市孔雀计划项目(KQCX20130628112914299)。
黄庆生,博士,助理研究员,研究方向为生物大分子的结构模拟、计算机辅助药物设计和生物信息学;肖天霞,硕士,研究方向为生物信息学 ;张键(通讯作者),博士,研究员,研究方向为生殖与内分泌学,E-mail:jian.zhang@siat.ac.cn;魏彦杰 (通讯作者),博士,副研究员,研究方向为蛋白质结构预测、生物信息学和高性能计算,E-mail:yj.wei@siat.ac.cn。
