用于高灵敏可视化检测松材线虫的闭管等温扩增法
2014-07-18马雪萍成思佳武海萍宋沁馨邹秉杰周国华1
马雪萍, 成思佳, 武海萍, 宋沁馨,3, 邹秉杰,3, 周国华1,,3
(1.南京医科大学 基础医学院,江苏 南京 210009;2.华东医学生物技术研究所,江苏 南京 210002;3.南京军区南京总医院 药理科,江苏 南京 210002)
用于高灵敏可视化检测松材线虫的闭管等温扩增法
马雪萍1,2,3, 成思佳2, 武海萍2, 宋沁馨2,3, 邹秉杰2,3, 周国华1,2,3
(1.南京医科大学 基础医学院,江苏 南京 210009;2.华东医学生物技术研究所,江苏 南京 210002;3.南京军区南京总医院 药理科,江苏 南京 210002)
建立了一种基于环介导等温核酸扩增技术(LAMP)的松材线虫高灵敏可视化闭管检测方法。针对松材线虫核糖体DNA的序列保守区域设计LAMP引物,通过优化LAMP体系中的Mg2+、甜菜碱浓度和反应温度等因素,建立了环介导等温扩增法;并结合蜡封反应管对产物进行检测,检测结果可直接通过肉眼观察SYBR Green I 荧光显色进行判定。结果表明,本方法可检测到低至10拷贝/管的松材线虫核酸片段,可对单条线虫进行检测,并且具有很高的特异性,能区分检测松材线虫与拟松材线虫。由于整个反应恒温进行,无需热循环仪;闭管检测极大地降低了扩增产物交叉污染的风险;检测速度快,整个检测过程只需40 min,为松材线虫的现场快速筛检提供了一种简便、高灵敏、高特异的工具。
松材线虫;环介导等温扩增;闭管反应;高灵敏度;可视化检测
松材线虫(Bursaphelenchusxylophilus)病又称为松树萎蔫病,由松材线虫感染松树所致,被称为松树的癌症,是世界上极具危险性的检疫性植物病害。该病主要通过人为调运带疫的苗木、松木制品等进行远距离传播,且致病力强、传播快,一旦感染,治理难度大[1]。我国每年由松材线虫病而造成的直接经济损失达25亿元,间接经济损失达250亿元[2]。因此,建立一种高灵敏、快速、简便的松材线虫检测方法极为重要。传统检测松材线虫的方法是基于显微镜的形态学诊断法。低致病性拟松材线虫(Bursaphelenchusmucronatus)与高致病性松材线虫形态相似,《中华人民共和国出入境检验检疫行业标准》(SN/T 2017-2007)规定通过尾部是否有尾尖突来区分这2种线虫。然而有些松材线虫雌虫尾部也有尾尖突,这就增加了镜检的难度[3-4],导致对松材线虫的检测常出现错检和漏检的现象。拟松材线虫和松材线虫在核糖体DNA(Ribosomal DNA,rDNA)的内转录间隔区(Internal Transcribed Space,ITS)存在30~40碱基的差异,采用核酸检测方法可以从核酸序列上对松材线虫和拟松材线虫进行鉴定,确保了检测的准确性,弥补了形态学检测的缺陷。目前常用的核酸检测法有基于PCR的随机扩增多态性DNA标记(Random Amplified Polymorphic DNA,RAPD)、限制性内切酶片段长度多态性(Restriction Fragment Length Polymorphism,RFLP)、单链构象多态性检测技术(Single-Strand Conformation Polymorphism,SSCP)和实时荧光PCR(Real-time PCR,RT-PCR)等[5-7]。虽然这些方法具有较高的准确性,但依然存在缺陷,如灵敏度不够高,操作繁琐,需要热循环仪,大多需要开管检测易造成污染等。因此,需建立一种快速、高灵敏、低成本、无污染、操作简便的松材线虫检测方法。环介导等温核酸扩增技术(Loop-mediated isothermal amplification,LAMP)[8-10]依赖于能够识别靶序列上6个特异区域的引物和一种具有链置换特性的DNA聚合酶,在等温条件下可高效、快速、特异地扩增靶序列[11]。反应结果可以检测扩增副产物焦磷酸镁沉淀形成的浊度。但浊度仪价格昂贵,增加了检测成本,并且传统LAMP法检测对象是扩增副产物焦磷酸镁沉淀,易造成非特异性检测结果。而采用开管盖加荧光染料的方法虽可进行肉眼判断[12],但却易产生气溶胶污染,造成假阳性结果[13]。Kikuchi等[3]虽然已采用LAMP法对松材线虫进行检测,然而仍存在以下不足:①产物分析采用了SYBR Green I荧光染料显色法和FITC-LFD试纸法,均需开管盖,极易造成污染。目前国内大多数实验室不能严格分区[14],Kikuchi等的方法在国内大多数实验室特别是基层的松材线虫监测部门不宜推广。②Kikuchi等的方法反应试剂采用的是日本荣研化学公司的环介导等温扩增试剂盒,每管反应成本在100元左右,不适合大批样本的筛查。基于此,本课题组建立了一种基于微晶蜡的闭管LAMP技术,用微晶蜡将SYBR Green I染料密封于管底,在LAMP扩增时微晶蜡呈固态,染料与扩增体系分离互不干扰,待扩增结束后将温度升高,微晶蜡融化,染料与扩增产物接触,即可对扩增产物进行检测。该技术具备灵敏度高、特异性好、操作简便的优点,并解决了传统LAMP易污染的问题。本文成功地将这种闭管LAMP技术用于松材线虫的检测,在恒定温度下可对松材线虫进行无污染闭管LAMP扩增,最低可检测到10个松材线虫的DNA分子,并可对单条线虫进行检测。本方法不仅灵敏度高,而且特异性好,能明显分辨形态学难以区分的松材线虫和拟松材线虫,为松材线虫病的监测和监管提供了一种有力工具。
1 材料与方法
1.1材料
1.1.1 样本 松材线虫及拟松材线虫样本由南京农业大学植物保护学院赠予;松材线虫病木样本由南京生兴生物技术有限公司提供;含松材线虫特异基因片段质粒由英潍捷基(上海)公司合成。
1.1.3 仪器 EDC-810型基因扩增仪(东胜创新生物科技有限公司),DNA Engine Opticon 2实时荧光PCR仪(美国Bio-Rad公司),CKX31-C11BF 倒置显微镜(日本Olumpus株式会社), PolyScience 9105低温水浴箱(美国PolyScience公司),Syngene GeneGenius全自动凝胶成像系统(美国Syngene公司)。
1.2方法
1.2.1 线虫基因组DNA的提取 取线虫木屑样本或线虫虫体的水悬液8 μL,加10 μL 的WLB裂解液(二硫苏糖醇2.5 mmol/L,1.125%吐温-20,氯化钾125 mmol/L,Tris-HCl 25 mmol/L,氯化镁3.75 mmol/L,pH 8.3)和2 μL 的蛋白酶K(1 mg/mL)溶液,迅速将混合液置于-70 ℃冰箱速冻20 min,取出将冰块捣碎;65 ℃孵育60 min,95 ℃孵育10 min,使虫体裂解DNA释放;13 000×g离心3 min,上清即为线虫DNA。
1.2.2 扩增引物的设计 本实验将松材线虫与拟松材线虫的核酸序列进行比对[15-16],选择序列相对保守的基因区作为扩增靶点(松材线虫序列GenBank登录号:JF317229.1,拟松材线虫序列GenBank登录号:JQ729988.1)。利用在线引物设计软件Primer Explorer version 4来设计松材线虫LAMP扩增引物,并从中挑选特异性好、扩增效率高的引物组作为本检测方法的LAMP扩增引物。将外引物F3-B.x和B3-B.x作为松材线虫PCR扩增引物,并在拟松材线虫扩增靶点上选择与松材线虫扩增区域相似的序列设计PCR扩增引物F-B.m和R-B.m。其中,F3-B.x和F-B.m序列一致,B3-B.x和R-B.m仅有2个碱基的不同。所有引物由英潍捷基(上海)公司合成,具体引物名称及序列见表1。

表1 松材线虫和拟松材线虫的扩增引物序列
注:B.x为松材线虫扩增引物,B.m为拟松材线虫扩增引物
1.2.3 线虫PCR扩增体系及反应条件 50 μL PCR扩增体系包括:10×buffer 5 μL,MgCl22 mmol/L,dNTP 200 μmol/L,上下游引物各0.4 μmol/L,DNA模板2 μL,Taq酶1.25 U,加水补充至50 μL。PCR反应条件:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环扩增;72 ℃延伸5 min。
1.2.4 松材线虫LAMP反应体系 25 μL LAMP扩增松材线虫体系包括:10 mmol/L氯化钾,10 mmol/L硫酸铵,8 mmol/L硫酸镁,20 mmol/L Tris-HCl(pH 8.8),0.1%(V/V))吐温-20,0.1 g/L牛血清白蛋白,8 mmol/L甜菜碱,1.4 mmol/L dNTPs,8 UBstDNA聚合酶;F3-B.x和B3-B.x终浓度为0.2 μmol/L,FIP-B.x和BIP-B.x终浓度为1.6 μmol/L,LF-B.x终浓度为0.2 μmol/L;1 μL松材线虫DNA提取物。
1.2.5 松材线虫LAMP反应条件的正交优化 本实验对影响LAMP扩增的3个主要因素Mg2+浓度、甜菜碱浓度和反应温度,采用SPSS Statistics设计了三因素三水平的L9(33)正交优化试验(见表2)。每个反应除Mg2+浓度、甜菜碱浓度和反应温度分别采用表2所示条件,体系中其他成分均不变。以EVA Green作为荧光染料,采用实时荧光PCR仪对LAMP扩增产物进行实时检测,程序如下:60 ℃(62 ℃或64 ℃)反应2 h,每2 min读板1次。采用编号6中的条件,以去离子水代替模板作为空白对照。

表2 LAMP反应条件L9(33)正交优化实验
1.2.6 LAMP产物的蜡封管检测法 采用文献报道的蜡封反应管对松材线虫进行可视化闭管检测[17]。首先在PCR管中加入2 μL 400 μmol/L SYBR Green I溶液,称取5 mg微晶蜡固体(熔点78 ℃左右)置于管底,加热至80 ℃使蜡熔化,取出于室温冷却至蜡凝固,此时SYBR Green I染料被固体微晶蜡封存于管底。在固体蜡上层加入LAMP反应液,进行恒温反应,待反应结束后于80 ℃加热10 min使酶失活;由于微晶蜡熔点在78 ℃左右,所以此时微晶蜡也随即融化,振荡PCR管,使下层的SYBR Green I染料与上层的反应液混合并显色;日光灯下阳性呈绿色,阴性呈橙色,紫外灯下阳性发出绿色荧光,阴性无荧光。
2 结果与分析
2.1松材线虫LAMP反应条件的优化
书中故事和青春或憧憬已无什么关系,也并非浪漫愉悦。呈现更多的是成年人的阴影、考验、损伤、辗转反侧、困顿冲突及难以言尽之处。人与时间并行,渐渐看清心灵的复杂褶皱和层次。也只有历经世事之后,理解力才能够穿透表象抵达本质,并试图给予一切宽谅。写到《春宴》,内心清朗。这并非指它是属性清朗的作品,相反,它代表的是一条于黑暗中穿行的道路,黑暗本身是它的内容,且这黑暗部分也是容易引起误解以至不悦或不适的。人在对苦痛和阴影有所承当有所体悟之后,才能真正理解其所映衬的那一道纯净自若的光。
Mg2+浓度、甜菜碱浓度和反应温度是影响LAMP反应的3个主要因素,本实验采用SPSS Statistics设计了三因素三水平的L9(33)正交优化试验。为了直观地得到实时反应的结果,采用实时荧光PCR仪对LAMP扩增产物进行实时检测。结果如图1所示,a为各反应条件下,荧光值随反应时间的变化,即产物量的变化;将仪器的荧光检测阈值设置为0.052,阴性对照的荧光值始终低于阈值;b为不同条件下荧光值达到阈值所需的时间。结果表明8号反应条件下产物积累最快,荧光值达到阈值所需时间最短,只需40 min即可达到平台期,积累大量扩增产物。因此,选择Mg2+浓度为8 mmol/L、甜菜碱浓度为8 mmol/L、温度为62 ℃作为松材线虫LAMP检测的最优反应条件。

图1 松材线虫LAMP反应条件正交优化试验结果
2.2LAMP闭管检测松材线虫方法的灵敏度
为了测定本方法的灵敏度,采用闭管LAMP检测法对不同浓度的合,质粒分子进行检测。首先,将合成的质粒梯度稀释成4 000、400、40、10和4个拷贝/管,各取1 μL加入含有LAMP反应液的蜡封反应管中62 ℃恒温反应40 min,然后加热到80 ℃ 10 min终止反应,微晶蜡融化。震荡离心冷却后,在日光或紫外灯下观察结果,如图2所示。10个拷贝及以上的合成质粒DNA分子的闭管LAMP产物在日光灯下呈绿色(图2b中右侧4管),在紫外灯下发绿色荧光(图2c中右侧4管);10个拷贝以下的合成质粒DNA分子的闭管LAMP产物及阴性对照在日光灯下呈橙色(图2b中左侧2管),在紫外灯下无荧光(图2c中左侧2管)。以琼脂糖凝胶电泳法对图2中b和c的反应结果进行验证,结果如图2a所示,表明10个拷贝及以上合成质粒DNA分子的闭管LAMP产物经电泳后呈阶梯状条带(图2a中右侧4个泳道),低于10个拷贝合成质粒DNA分子的闭管LAMP产物及阴性对照经电泳无条带(图2a中左侧2个泳道)。因此,采用闭管LAMP法能检测低至10个拷贝的合成质粒DNA分子,并能实现无需开管肉眼直接观察检测结果。
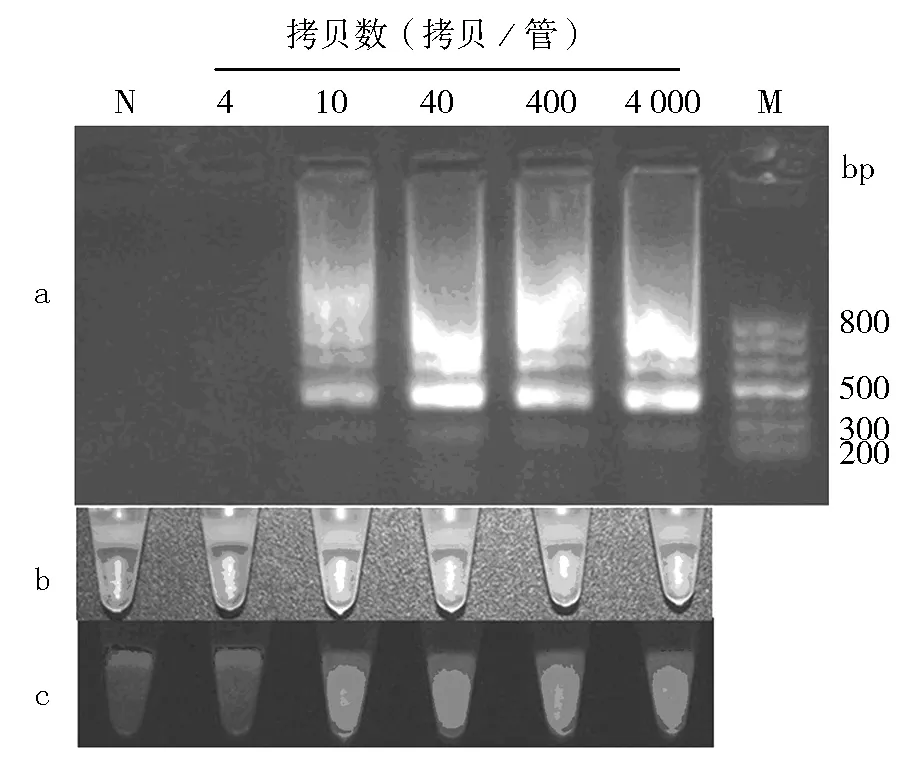
图2 不同拷贝数(4~4 000)松材线虫合成质粒的LAMP检测结果Fig.2 LAMP detection images of different copies (from 4 to 4 000) of B. xylophilus plasmid DNA
a:闭管LAMP产物琼脂糖凝胶电泳检测结果;b:蜡封管中LAMP产物在日光灯下的结果;c:蜡封管中LAMP产物在紫外灯下的结果
a: the electrophorogram of LAMP amplicons;b: the LAMP amplicons with SYBR I in wax-sealed tube irradiated by daylight;c: the LAMP amplicons with SYBR I in wax-sealed tube irradiated by UV light
然而,实际样本可能只含有单条松材线虫,为了验证所建立方法的灵敏度对实际样本的适用性,本文采用所建立的LAMP闭管检测松材线虫法对单条松材线虫进行了检测。显微镜下挑取单条线虫,对其进行DNA提取,得到20 μL线虫DNA提取液,从中吸取1 μL进行LAMP闭管检测,同时以4 000拷贝/管的合成质粒DNA分子为对照。结果如图3所示,单条线虫DNA分子和合成质粒DNA分子的闭管LAMP产物在日光下呈绿色(图3a中右侧2管),在紫外灯下发绿色荧光(图3b中右侧2管);阴性对照在日光灯下呈橙色(图3a中左侧1管),在紫外灯下无荧光(图3b中左侧1管)。表明LAMP闭管检测法检测单条线虫的结果与质粒DNA分子一致,呈阳性。因此,本文建立的松材线虫闭管LAMP检测法可以成功检测单条线虫的1/20,灵敏度足以满足实际样本的检测。

图3 LAMP闭管检测单条松材线虫结果
a:蜡封管中LAMP产物在日光灯下的结果;b:蜡封管中LAMP产物在紫外灯下的结果
a: LAMP amplicons with SYBR I in wax-sealed tube irradiated by daylight; b:LAMP amplicons with SYBR I in wax-sealed tube irradiated by UV light
2.3LAMP闭管检测松材线虫方法的特异性
拟松材线虫与松材线虫无论在形态上还是基因序列上都极为相似[4]。常规镜检是通过尾部是否有尾尖突来区分松材线虫和拟松材线虫,然而这样的判断对观察者的要求较高,且容易导致主观判断失误。因此,本文以拟松材线虫为比较对象来验证本方法的特异性。通过将松材线虫和拟松材线虫的基因序列进行比对,根据两者在rDNA ITS区的基因差异,设计松材线虫基因特异性LAMP引物,达到松材线虫能被检测到而拟松材线虫不被检测到的目的。
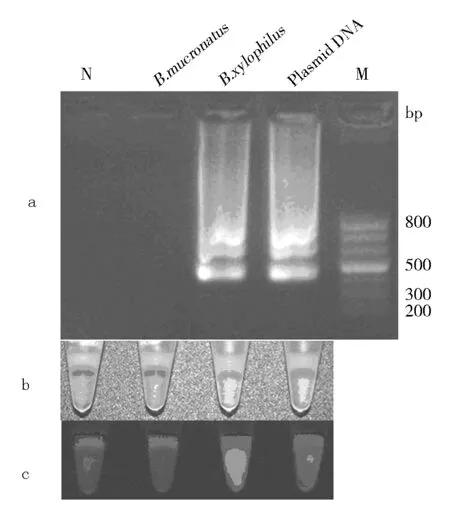
图4 LAMP闭管检测松材线虫与拟松材线虫结果Fig.4 The closed-tube LAMP detection results of Bursaphelenchus xylophilus and Bursaphelenchus mucronatus
a:LAMP产物琼脂糖凝胶电泳结果;b:蜡封管中LAMP产物在日光灯下的结果;c:蜡封管中LAMP产物在紫外灯下的结果
a: the electrophorogram of LAMP amplicons; b: the LAMP amplicons with SYBR I in wax-sealed tube irradiated by daylight; c: the LAMP amplicons with SYBR I in wax-sealed tube irradiated by UV light
首先对已知的松材线虫和拟松材线虫虫体样本进行DNA提取,再采用本文建立的闭管LAMP法对两者进行检测,结果如图4所示,提取的松材线虫虫体样本DNA分子与合成的松材线虫质粒DNA分子的闭管LAMP产物在日光灯下呈绿色(图4b中右侧2管),在紫外灯下发绿色荧光(图4c中右侧2管),为阳性结果;提取的拟松材线虫虫体样本DNA分子与阴性对照的闭管LAMP产物在日光灯下呈橙色(图4b中左侧2管),在紫外灯下不发荧光(图4c中左侧2管),为阴性结果。采用琼脂糖凝胶电泳法对结果进行验证,如图4a所示,提取的松材线虫虫体样本DNA分子与合成的松材线虫质粒DNA分子的闭管LAMP产物经电泳后呈阶梯状条带,提取的拟松材线虫虫体样本DNA分子与阴性对照的闭管LAMP产物均无条带。因此,本文建立的闭管LAMP检测法特异性高,能够区分检测松材线虫和拟松材线虫。
然而,实际样本可能还感染其他线虫,为了验证所建立方法在这样的高背景下是否能成功检测松材线虫,本文采用所建立的LAMP法对不同比例的松材线虫和拟松材线虫核酸片段进行了检测。首先,提取松材线虫和拟松材线虫虫体样本DNA,以此为模板分别进行PCR扩增,扩增产物经BioSpin PCR纯化试剂盒纯化后,以紫外分光光度法测定其浓度,经梯度稀释后制备不同浓度比(松材线虫∶拟松材线虫浓度比为1∶1、1∶10、1∶100、1∶1 000、1∶10 000)的检测模板,其中松材线虫浓度固定为103拷贝/μL,相应的拟松材线虫浓度分别为103、104、105、106和107拷贝/μL。采用本文建立的LAMP法分别检测以上混合模板,同时以103拷贝/μL的松材线虫模板为阳性对照,107拷贝/μL的拟松材线虫模板和水为阴性对照。

图5 LAMP闭管检测不同比例的松材线虫与拟松材线虫混合模板的结果Fig.5 The closed-tube LAMP detection results of different proportions of Bursaphelenchus xylophilus and Bursaphelenchus mucronatus mixed templates
a:蜡封管中LAMP产物在日光灯下的结果;b:蜡封管中LAMP产物在紫外灯下的结果
a: the LAMP amplicons with SYBR I in wax-sealed tube irradiated by daylight; b: the LAMP amplicons with SYBR I in wax-sealed tube irradiated by UV light
检测结果如图5所示,表明不同比例的松材线虫和拟松材线虫混合模板、103拷贝/μL松材线虫模板的LAMP扩增产物,在日光灯下呈绿色(图5a),在紫外灯下发绿色荧光(图5b);而107拷贝/μL的拟松材线虫模板的LAMP扩增产物结果与阴性对照一致,即在日光灯下呈橙色(图5a),在紫外灯下无荧光(图5b)。因此,本文所建立的LAMP闭管检测松材线虫法特异性高,即使实际样本中混合其他线虫,也不影响松材线虫的检测。
2.4实际样本的检测
采用本文建立的LAMP闭管检测松材线虫的方法,对经过显微镜镜检的16例松木样本的DNA提取物进行LAMP闭管检测。检测结果如图6a和b所示,其中1、4、5、6、8、13、14、15号样本经LAMP闭管检测后,产物在日光灯下呈绿色(图6a中样本编号所对应检测管),在紫外灯下发绿色荧光(图6b中样本编号所对应检测管),表明1、4、5、6、8、13、14、15号样本为阳性样本;而2、3、7、9、10、11、12、16号样本检测结果与阴性对照一致,产物在日光灯下呈橙色(图6a中样本编号所对应检测管),在紫外灯下不发荧光(图6b中样本编号所对应检测管),表明为阴性。该结果与镜检结果完全一致,表明本文建立的方法准确性高,能够用于实际样本的检测。
为了进一步验证方法的可靠性,从上述16个样本(8个为松材线虫,8个为拟松材线虫)中随机取虫体样本混合制备成5个新的未知样本(从S1到S5)。取样方法:S1由第2、4、8号样本混合而成,S2由第5、11号样本混合而成,S3由第1、9、13、15号样本混合而成,S4由第7、10号样本混合而成,S5由第3、6、12、14号样本混合而成。这5个模拟混合样本的闭管LAMP检测结果如图6c和d所示,其中S1、S2、S3、S5的LAMP产物在日光灯下呈绿色(图6c中混合样本编号所对应检测管),在紫外灯下发绿色荧光(图6d),表明样本S1、S2、S3、S5为阳性;而样本S4与阴性对照的检测结果一致,表明S4为阴性。事实上,样本S1中的4和8号样本为阳性,该样本的检测结果应为阳性。同理,由于第1、5、6、13、14、15为阳性样本,模拟混合样本S2、S3、S5中含有上述样本,检测结果也应为阳性;而第7和10号样本为阴性样本,所以样本S4的检测结果应为阴性。因此,本文建立的方法准确、可靠,进一步说明了能够将其应用于松材线虫实际样本的检测。
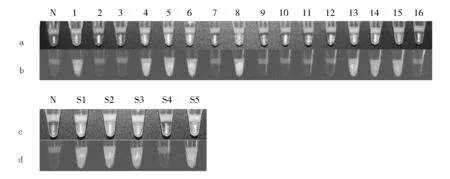
图6 16例松木样本DNA提取物及双盲混合样本的LAMP闭管检测结果
a:蜡封管中1~16号样本LAMP产物在日光灯下的结果;b:蜡封管中1~16号样本LAMP产物在紫外灯下的结果;c:蜡封管中S1~S5号混合样本LAMP产物在日光灯下的结果;d:蜡封管中S1~S5号混合样本LAMP产物在紫外灯下的结果
a: the LAMP amplicons of 1~16 specimens with SYBR I in wax-sealed tube irradiated by daylight; b: the LAMP amplicons of 1~16 specimens with SYBR I in wax-sealed tube irradiated by UV light; c:the LAMP amplicons of S1~S5 mixed specimens with SYBR I in wax-sealed tube irradiated by daylight; d: the LAMP amplicons of S1~S5 mixed specimens with SYBR I in wax-sealed tube irradiated by UV light
3 讨 论
本文建立了一种LAMP闭管检测松材线虫的方法。该方法灵敏度高,可检测低至10个拷贝的DNA分子;特异性好,可区分检测形态及核酸序列都非常相似的松材线虫和拟松材线虫;检测时间短,可在40 min内实现对松材线虫的检测。与传统的形态学检测法相比,本方法检测松材线虫无需对虫体进行分离培养,直接采用病木木屑样本的水悬液,即可进行DNA的提取,操作简便、快速。与基于PCR的方法相比,优点表现在:①本方法检测过程恒温进行,无需热循环装置;②采用温度敏感的微晶蜡将显色用荧光染料SYBR Green I密封于反应管底部,扩增反应结束后通过升温的方式使扩增产物发生显色反应,无需开管进行检测,因此避免了污染;③在日光灯或紫外灯下,通过肉眼观测颜色变化就能分辨阳性和阴性,实现了可视化检测,无需昂贵的检测仪器,极大地降低了检测成本。因此,本文建立的LAMP闭管检测松材线虫的方法,非常适合于产地检疫、调运检疫等以松材线虫为主要检疫对象的部门使用。
[1] Okland B, Skarpaas O, Schroeder M, et al. Is eradication of the pinewood nematode (Bursaphelenchusxylophilus) likely An evaluation of current contingency plans[J].Risk Anal,2010,30(9):1424-1439.
[2] 范军祥,黄焕华,钱明惠. 松材线虫病的诊断方法探讨[J].广东林业科技,2008,24(5):4.
[3] Kikuchi T, Aikawa T, Oeda Y, et al. A rapid and precise diagnostic method for detecting the Pinewood nematodeBursaphelenchusxylophilusby loop-mediated isothermal amplification[J].Phytopathology,2009,99(12):1365-1369.
[4] Sultana T, Han H,Park J. Comparison of complete mitochondrial genomes of pine wilt nematodeBursaphelenchusxylophilusandBursaphelenchusmucronatus(Nematoda: Aphelenchoidea) and development of a molecular tool for species identification[J].Gene,2013,520(1):39-46.
[5] Cao AX, Liu XZ, Zhu SF, et al. Detection of the Pinewood Nematode,Bursaphelenchusxylophilus, Using a Real-Time Polymerase Chain Reaction Assay[J].Phytopathology,2005,95(5):566-571.
[6] Aikawa T, Kikuchi T,Kosaka H. Demonstration of interbreeding between virulent and avirulent populations ofBursaphelenchusxylophilus(Nematoda: Aphelenchoididae) by PCR-RFLP method[J].Applied entomology and zoology,2003,38(4):565-569.
[7] Vieira P, Burgermeister W, Mota M, et al. Lack of Genetic Variation ofBursaphelenchusxylophilusin Portugal Revealed by RAPD-PCR Analyses[J].J Nematol,2007,39(2):118-126.
[8] Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):E63.
[9] Tomita N, Mori Y, Kanda H, et al. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products[J].Nat Protoc,2008,3(5):877-882.
[10]Mori Y and Notomi T. Loop-mediated isothermal amplification (LAMP): a rapid, accurate, and cost-effective diagnostic method for infectious diseases[J].Journal of infection and chemotherapy,2009,15(2):62-69.
[11]Liang C, Chu Y, Cheng S, et al. Multiplex loop-mediated isothermal amplification detection by sequence-based barcodes coupled with nicking endonuclease-mediated pyrosequencing[J].Anal Chem,2012,84(8):3758-3763.
[12]Iwamoto T, Sonobe T ,Hayashi K. Loop-mediated isothermal amplification for direct detection of Mycobacterium tuberculosis complex,M.avium, andM.intracellularein sputum samples[J].Journal of clinical microbiology,2003,41(6):2616-2622.
[13]Cheng SJ, Chen ZY, Chu YN, et al. Sensitive detection of influenza A (H1N1) virus by isothermal amplification in a single tube[J].Chinese Journal of Analytical Chemistry,2011,39(3): 335-340.
[14]秦文韬,王忠跃,张昊.环介导恒温扩增技术在植物病原物检测中的应用[J].中国农业科学导报,2013,15(3):169-174.
[15]Santos CS, Pinheiro M, Silva AI, et al. Searching for resistance genes toBursaphelenchusxylophilususing high throughput screening[J].BMC Genomics,2012,13:599.
[16]Cardoso JM, Fonseca L,Abrantes I. Genetic diversity of ITS sequences ofBursaphelenchusxylophilus[J].Genet Mol Res,2012,11(4):4508-4515.
[17]Liang C, Cheng S, Chu Y, et al. A Closed-Tube Detection of Loop-Mediated Isothermal Amplification (LAMP) Products Using a Wax-Sealed Fluorescent Intercalator[J].Journal of Nanoscience and Nanotechnology,2013,13(6):3999-4005.
AClosed-TubeIsothermalAmplificationMethodforHighlySensitive&VisualizedDetectionofPineWoodNematode(Bursaphelenchusxylophilus)
MA Xue-ping1,2,3, CHENG Si-jia2, WU Hai-ping2, SONG Qin-xin2,3, ZOU Bing-jie2,3, ZHOU Guo-hua1,2,3
(1.Schl.ofBasicMed.Sci.,NanjingMed.Uni.,Nanjing, 210009; 2.HuadongRes.Inst.forMed. &Biotechnics,Nanjing, 210002; 3.Dept.ofPharm.,NanjingGen.Hosp.ofNanjingMil.Command,Nanjing210002)
A visualized closed-tube loop-mediated isothermal amplification (LAMP) assay with high sensitivity method to detect pine wood nematode (Bursaphelenchusxylophilus) was established. LAMP primers were designed aiming at the conservative domain of ribosomal DNA sequence ofB.xylophilusthrough an optimization of LAMP reaction conditions such as concentration of Mg2+, betaine, and reaction temperature etc and established the LAMP method. The results of determination was observed through naked eyes by judging color changes of fluorescent coloration SYBR Green I of the product sealed with wax at the bottom of the detection tube. The results indicated that the sensitivity of the proposed method was as low as 10 copies of genomic DNA fragment ofB.xylophilus, and it was sensitive enough to detect a single nematode. The method had a very high specificity, and could easily distinguishB.xylophilusfromB.mucronatus. Because the whole reaction was carried out in constant temperature, no thermal cycler was needed. The closed-tube LAMP reaction greatly decreased the risk of cross-contamination from amplified products. The assay was very fast, it needed only 40 minutes for the whole detection process. Therefore, the established method provided a simple, highly sensitive and highly specific tool for rapid screening of pine wood nematode on the site.
pine wood nematode (Bursaphelenchusxylophilus); loop-mediated isothermal amplification; closed-tube reaction; high sensitivity; visualized detection
国家重大科技专项(2013zx10004103);国家科技转基因生物新品种培育重大专项(2011ZX08012-005);国家自然科学基金青年科学基金(21005088)
马雪萍 女,硕士研究生。研究方向为分子遗传学。Tel: 025-80860196, E-mail: maxueping1130@126.com
* 通讯作者。男,研究员,博士。研究方向为分子遗传学。Tel: 025-80860196, E-mail: ghzhou@nju.edu.cn
2013-12-04;
2013-12-16
Q939.95;S432.4+5
A
1005-7021(2014)04-0007-08
10.3969/j.issn.1005-7021.2014.04.002