呼吸道合胞病毒感染诱导BALB/c鼠固有免疫细胞分泌IL-33
2014-07-18戚菲菲王锐莹刘北星
戚菲菲, 王锐莹, 刘 静, 曾 胜, 刘北星*
(1.中国医科大学 基础医学院免疫学教研室,辽宁 沈阳 110001;2.中国医科大学96期10班,辽宁 沈阳 110001)
呼吸道合胞病毒感染诱导BALB/c鼠固有免疫细胞分泌IL-33
戚菲菲1, 王锐莹2, 刘 静1, 曾 胜1, 刘北星1*
(1.中国医科大学 基础医学院免疫学教研室,辽宁 沈阳 110001;2.中国医科大学96期10班,辽宁 沈阳 110001)
IL-33是新发现的细胞因子,在病毒感染所诱发的气道炎症反应中发挥重要作用。研究发现感染呼吸道合胞病毒的BALB/c鼠肺组织内IL-33水平明显升高。但RSV感染后分泌IL-33的免疫细胞类型,尤其是感染早期分泌IL-33的固有免疫细胞类型目前尚不清楚。通过分离培养BALB/c鼠肺泡巨噬细胞及树突状细胞,采用ELISA及实时荧光定量PCR法检测上述固有免疫细胞RSV感染后IL-33分泌水平的变化。结果显示,RSV感染72 h后BALB/c鼠肺泡巨噬细胞IL-33mRNA水平明显升高,而树突状细胞RSV感染24 h后IL-33mRNA水平开始上升,48 h达峰值。研究证实RSV感染诱导BALB/c鼠固有免疫细胞分泌IL-33,进而介导感染后炎症的发生发展。
呼吸道合胞病毒;IL-33;肺泡巨噬细胞;树突状细胞
IL-33是2005年发现的IL-1家族细胞因子[1]。相对其在淋巴结、脾脏、肾脏等组织的低水平表达[2],IL-33在呼吸道及消化道等与外界接触的黏膜系统中具有较高的表达水平。在这类组织中,IL-33与其他细胞因子如IL-25、胸腺基质淋巴蛋白等一起调控免疫应答[3]。目前IL-33的作用模式尚不十分清楚。有学者推测IL-33前体需经特定酶裂解后,方能变成具有活性的细胞因子释放至细胞外,之后与靶细胞膜上的受体结合,影响下游信号转导通路,或转位到靶细胞核作为DNA结合因子发挥作用。IL-33是参与调控Th2型免疫应答的细胞因子。在体外实验中,IL-33可刺激Th2细胞分泌Th2型细胞因子IL-5和IL-13。接受重组IL-33刺激的小鼠,其肺、食道及肠黏膜组织中出现明显的病理变化,包括嗜酸细胞及单核细胞浸润、黏液分泌增加、上皮细胞增生等。而这些变化在IL-13基因敲除鼠中并未观察到,提示IL-33通过诱导IL-13的产生介导组织病理[4]。此外,IL-33亦可活化肥大细胞、嗜酸和嗜碱粒细胞、NKT细胞等,诱导其分泌Th2型细胞因子,在炎症、哮喘、自身免疫性疾病以及心脑血管疾病的发生发展中发挥关键作用[5]。体内多种细胞分泌IL-33[6]。除上皮细胞、平滑肌细胞、成纤维细胞、神经胶质细胞等这类非免疫细胞外,巨噬细胞、树突状细胞、肥大细胞等亦可在某些刺激因素作用下分泌IL-33。Ya-Jen[7]等报道流感病毒感染鼠肺泡巨噬细胞IL-33 mRNA表达水平升高。我们前期研究也发现呼吸道合胞病毒(respiratory syncytial virus, RSV)经鼻感染BALB/c鼠后,其肺组织IL-33水平升高明显。呼吸道合胞病毒是儿科急性下呼吸道感染及院内感染的重要病原体[8],RSV感染不仅导致婴幼儿严重毛细支气管炎,而且与哮喘的发生发展密切相关[9-10]。推测呼吸道合胞病毒感染BALB/c鼠后,通过诱导多种细胞产生IL-33这一炎性调控因子,活化Th2型免疫细胞,促使其分泌Th2型细胞因子,如IL-5、IL-13,进而导致患儿RSV感染后的哮喘样临床症状。迄今为止,尚无文献报道RSV感染诱导何种细胞分泌IL-33。尤其在感染早期,固有免疫细胞是否为IL-33的来源细胞尚不明确。本研究通过分离纯化BLAB/c鼠肺泡巨噬细胞以及树突状细胞,并通过相应传代细胞系的进一步验证,旨在证实RSV感染发生时固有免疫细胞中产生IL-33的细胞类型,为研究IL-33的作用模式以及开发针对IL-33的靶向治疗提供实验佐证。
1 材料与方法
1.1材料
1.1.1 实验动物 6~8周龄雌性BALB/c鼠,购自辽宁本溪长生生物技术有限公司,在中国医科大学实验动物中心SPF级动物饲养室内常规饲养。
1.1.2 细胞株 人喉癌上皮细胞系Hep-2及小鼠树突状细胞系DC2.4为本实验室保存细胞株,用含10% FCS的RPMI-1640常规传代培养。小鼠单核巨噬细胞系RAW264.7,购自中国科学院细胞库,用含10% FCS的DMEM常规传代培养。
1.1.3 病毒 人类呼吸道合胞病毒A2型(RSV A2),Hep-2细胞增殖病毒,30%蔗糖超速离心法分离病毒粒子,-80 ℃冰箱保存。病毒滴度用组织细胞半数感染量50%(50% tissue culture infections dose, TCID50)表示。
1.1.4 试剂 重组鼠粒细胞-巨噬细胞集落刺激因子(rmGM-CSF)和重组鼠白细胞介素4(rmIL-4)购自Peprotech公司。RNA提取试剂盒、逆转录试剂盒和荧光实时定量PCR试剂盒购自TaKaRa公司。小鼠IL-33 ELISA检测试剂盒购自eBioscience公司。
1.2方法
1.2.1 骨髓来源树突状细胞的诱导培养 颈椎脱臼法处死小鼠,无菌状态下取出股骨,剪刀剪掉骨两端,用1 mL注射器吸取RPMI-1640培养液刺入骨髓腔反复冲洗,收集细胞悬液,红细胞裂解液溶解红细胞后,用10% FCS RPMI-1640培养液悬浮骨髓单核细胞,调整细胞浓度为1×106/mL。接种细胞于24孔培养板,每孔1×106个细胞。加入细胞因子GM-CSF 20 ng/mL、IL-4 10 ng/mL,37 ℃、5% CO2培养,隔日半量换液并补足细胞因子。培养至第7天,收获半悬浮及疏松贴壁的树突状细胞。
1.2.2 肺泡巨噬细胞的收集及纯化 颈椎脱臼法处死小鼠,分离气管。用含1 mL PBS的注射器反复冲洗肺泡3次,收集肺泡灌洗液,1 200 r/min离心5 min,弃上清。用2 mL 10% FCS RPMI-1640重悬细胞,将其加入直径35 mm培养皿中,37 ℃、5% CO2静置2 h,收集贴壁巨噬细胞。
1.2.3 RSV病毒感染 用10% FCS RPMI-1640培养液调整肺泡巨噬细胞及树突状细胞浓度为1×106/mL,加1 mL细胞悬液于24孔板中,并以不同感染复数感染RSV病毒,37 ℃、5% CO2孵箱培养。在感染后不同时间点收集细胞培养上清,ELISA法检测培养上清中IL-33蛋白水平;同时提取细胞RNA,Real-time RT PCR法检测细胞IL-33mRNA表达。
1.2.4 实时荧光定量PCR 利用TRIzol试剂盒提取细胞总RNA,Superscript II逆转录试剂盒合成cDNA。按照SYBRPremixExTaqTMⅡ试剂盒说明,在IL-33引物作用下进行实时荧光定量PCR扩增(ABI 7500),共40个循环。
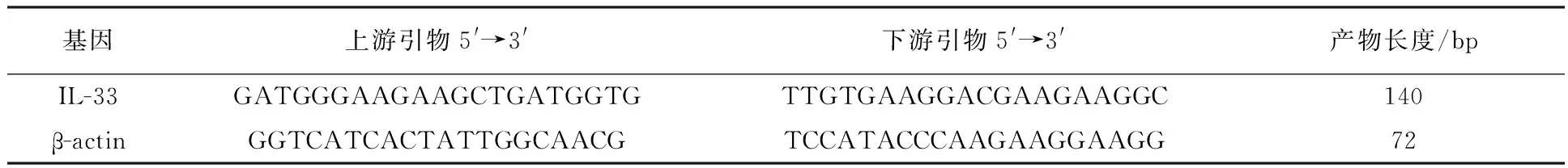
表1 引物序列及产物的长度
1.2.5 ELISA检测 依据细胞因子检测试剂盒的操作步骤,检测感染RSV的肺泡巨噬细胞及树突状细胞培养上清中IL-33蛋白含量。试剂盒IL-33最低检测浓度为25 pg/mL。
1.2.6 统计学分析 所有数据采用SPSS13.0软件进行统计学分析。实验结果以均值±标准差(X±S)表示。组间差异采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果与分析
2.1不同RSV感染剂量诱导细胞产生IL-33水平不同
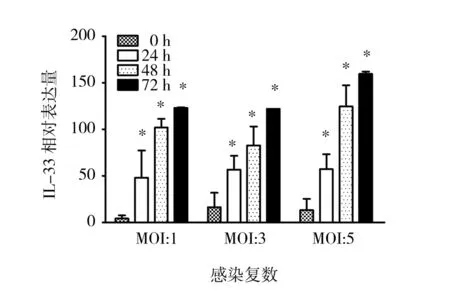
图1 不同RSV感染复数对小鼠巨噬细胞IL-33mRNA转录水平的影响Fig.1 Infection with RSV at a different multiplicity of infection influences the expression of IL-33 mRNA in the cells of RAW246.7
*P<0.05, **P<0.01, ***P<0.001,下图同
为获得最佳的RSV感染量,分别用感染复数为1、3、5的病毒粒子感染小鼠巨噬细胞系RAW264.7。结果发现3种感染复数均能提高RAW264.7细胞IL-33mRNA转录水平。在感染后24和48 h,3种感染复数增强IL-33mRNA表达的效果无明显差异。但在感染后72 h,感染复数5的RSV感染所诱导的IL-33mRNA的增加最为明显(图1)。由此,采用了感染复数为5的RSV感染剂量进行以下实验。
2.2RSV感染增强BALB/c鼠肺泡巨噬细胞及树突状细胞IL-33mRNA的表达
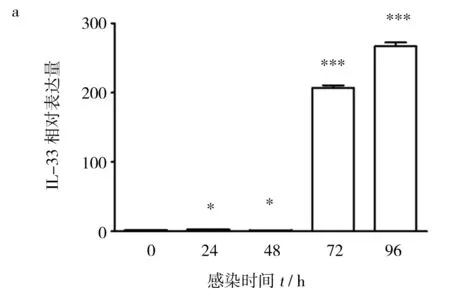
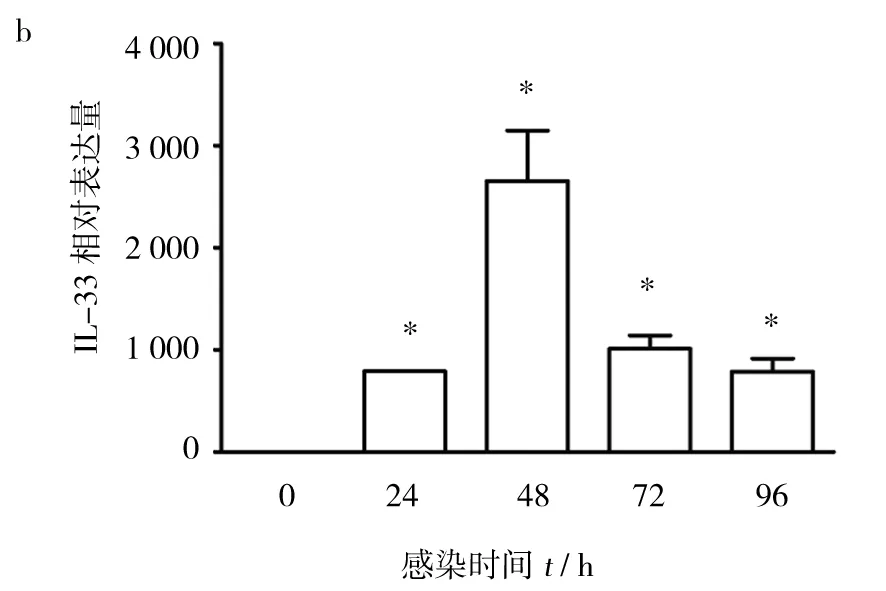
图2 RSV感染增加BALB/c鼠肺泡巨噬细胞(a)和树突状细胞(b)IL-33 mRNA的表达Fig.2 Infection with RSV increases the expression of IL-33 mRNA in the alveolar macrophage(a) and dendritic cells(b) from normal BALB/c mice
提取BALB/c鼠肺泡巨噬细胞和树突状细胞,实时荧光定量PCR法检测RSV感染后不同时间点的IL-33mRNA表达。结果显示,RSV感染后24及48 h,小鼠肺泡巨噬细胞IL-33mRNA水平略有升高。感染72 h IL-33mRNA转录水平显著升高。在RSV感染96 h后,肺泡巨噬细胞IL-33mRNA水平依然维持在高位(图2a)。与肺泡巨噬细胞不同,骨髓来源的树突状细胞感染RSV 24 h即可检测到高水平的IL-33mRNA的表达。感染48 h后,IL-33mRNA转录水平达峰值,之后略有下降,但与对照相比仍有显著差异(图2b)。实验结果提示,在RSV感染发生过程中BALB/c鼠肺泡巨噬细胞和树突状细胞是重要的IL-33来源细胞。
2.3RSV感染对小鼠RAW264.7及DC2.4细胞系IL-33mRNA表达的影响
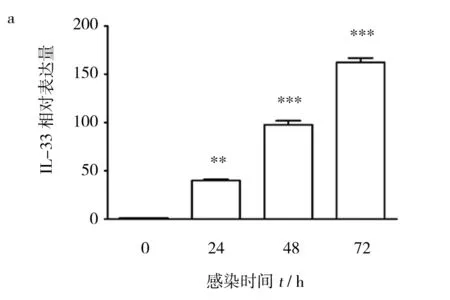

图3 SV感染对小鼠巨噬细胞系RAW264.7(a)和树突状细胞系DC2.4(b)IL-33mRNA表达水平的影响的表达Fig.3 RSV infection affects the expression of IL-33 mRNA in the cells of RAW264.7(a) and DC2.4(b)
为进一步证实BALB/c鼠肺泡巨噬细胞和树突状细胞是RSV感染时IL-33的来源细胞,用RSV感染小鼠巨噬细胞系RAW264.7和树突状细胞系DC2.4,并用实时荧光定量PCR法检测其IL-33mRNA表达水平的变化。结果发现RSV感染RAW264.7细胞24 h,IL-33mRNA水平开始升高,感染72 h后IL-33mRNA转录达到较高水平(图3a)。与此略有不同,RSV感染树突状细胞系DC2.4 24 h,细胞内IL-33mRNA转录水平达峰值,之后开始下降,感染72 h后基本降至正常水平(图3b)。
2.4RSV感染对固有免疫细胞IL-33分泌水平的影响
为进一步明确RSV感染诱导机体固有免疫细胞分泌IL-33,将分离纯化的BALB/c鼠肺泡巨噬细胞和树突状细胞体外感染RSV后,用ELISA法检测感染细胞培养上清中IL-33蛋白含量。结果显示,所有实验组和对照组的感染细胞培养上清中IL-33含量均在ELISA试剂盒检测水平以下。
3 讨 论
IL-33作为核因子,在组织细胞损伤时释放到胞外成为一种免疫系统的危险信号[11]。分泌到胞外的IL-33通过与细胞膜表面的IL-33受体ST2的结合,活化靶细胞,诱导其分泌效应因子,调节免疫应答[1]。体内多种细胞组成性或在某些因素刺激下合成并分泌IL-33。有文献报道IL-1β和TNF-α诱导肺成纤维细胞及支气管平滑肌细胞高水平表达IL-33mRNA[2,6]。Carriere等[12]则在发炎的人扁桃体的血管中、Crohn病患者的肠道中、类风湿关节炎患者的关节滑膜中检测到IL-33,提示IL-33的存在与多种组织的炎症状态相关。
呼吸道病毒感染导致气道炎症反应。其中呼吸道合胞病毒是引起婴幼儿肺炎和毛细支气管炎的主要病原体。我们前期研究发现,RSV感染早期小鼠肺组织悬液中IL-33水平明显升高。利用单克隆抗体阻断IL-33减轻感染鼠肺炎症,提示IL-33在介导RSV感染诱发的气道炎症反应方面发挥关键作用(结果待发表)。但迄今为止尚不清楚何种免疫细胞在RSV感染过程中合成并分泌IL-33。本研究针对感染早期的固有免疫细胞,探讨RSV感染后BALB/c鼠肺组织细胞中产生IL-33的固有免疫细胞类型。发现RSV感染明显增加小鼠肺泡巨噬细胞和树突状细胞IL-33mRNA转录水平,提示肺泡巨噬细胞和树突状细胞是RSV感染鼠体内IL-33的重要来源细胞。这一推断通过体外细胞系RSV感染实验进一步得到证实。已有文献报道流感病毒感染后小鼠肺组织内IL-33水平的升高不仅是肺上皮细胞感染的结果,也是肺泡巨噬细胞活化后高水平合成并分泌IL-33的结果[13]。推测RSV感染后导致固有免疫细胞IL-33mRNA表达升高,由此提高了感染鼠肺组织内IL-33水平。产生的IL-33通过旁分泌和自分泌方式,与表达IL-33受体的Th2细胞、肥大细胞、嗜酸和嗜碱细胞、NKT细胞等相互作用,激活NF-κB或MAPK信号转导途径,诱导这些细胞分泌Th2型细胞因子IL-5、IL-4、IL-13等,从而调控机体免疫应答[1]。本研究首次证明了呼吸道合胞病毒感染诱导BALB/c鼠肺组织巨噬细胞及树突状细胞高水平表达IL-33mRNA,由此扩大或增强了RSV感染引发的炎症应答。
然而,尽管研究发现RSV感染增强BALB/c鼠肺泡巨噬细胞和树突状细胞IL-33mRNA的表达,但并没有在感染细胞的培养上清中检测到IL-33蛋白,推测有以下原因:①本实验使用的IL-33 ELISA检测试剂盒的最低检测浓度为25 pg/mL。而感染细胞培养上清中IL-33浓度较低,故常规ELISA检测方法可能难以达到理想的检测效果。有文献报道,利用细胞为基础的ELISA检测方法,可以有效提高细胞因子检测敏感度[14]。②肺泡巨噬细胞和树突状细胞均表达IL-33的受体ST2。细胞经感染刺激后释放的IL-33可能直接与细胞表面的跨膜受体ST2结合,导致上清中IL-33浓度过少。③IL-33作为核因子存在于细胞内。只有在细胞破损时IL-33才被释放至胞外。在本实验体系中,感染细胞培养96 h后仍有相当一部分细胞存活,可能也是导致培养上清中IL-33含量低的原因之一。
本研究利用实时荧光定量PCR方法,证实RSV感染过程中,肺泡巨噬细胞和树突状细胞IL-33mRNA转录水平明显提高,提示某些固有免疫细胞可能在RSV感染诱发的气道炎症应答方面发挥一定作用。
[1] Schmitz J, Owyang A, Oldham E, et al. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines[J]. Immunity,2005,23(5):479-490.
[2] Préfontaine D, Lajoie-Kadoch S, Foley S, et al. Increased expression of IL-33 in severe asthma: evidence of expression by airway smooth muscle cells[J]. J Immunol,2009,183(8):5094-5103.
[3] Kim BS, Wojno ED, Artis D. Innate lymphoid cells and allergic inflammation[J]. Curr Opin Immunol, 2013,25(6):738-744.
[4] Kim HY, Chang YJ, Subramanian S, et al. Innate lymphoid cells responding to IL-33 mediate airway hyperreactivity independently of adaptive immunity[J]. J Allergy Clin Immunol,2012,129(1):216-227.
[5] Mirchandani AS, Salmond RJ, Liew FY. Interleukin-33 and the function of innate lymphoid cells[J]. Trends Immunol,2012,33(8):389-396.
[6] Le Goffic R, Arshad MI, RauchM, et al. Infection with influenza virus induces IL-33 in murine lungs[J]. Am J Respir Cell Mol Biol,2011,45(6):1125-1132.
[7] Ya-Jen Chang, Hye Young Kim, Lee A Albacker, et al. Innate lymphoid cells mediate influenza-induced airway hyperreactivity independently of adaptive immunity[J]. Nat Immunol,2013,12(7):631-638.
[8] 刘菊,杨春,唐安芬,等.呼吸道合胞病毒Long株的培养及应用[J].微生物学杂志,2004,24(5):47-49.
[9] Sigurs N, Bjarnason R, Sigurbergsson F, et al. Respiratory syncytial virus bronchiolitis in infancy is an important risk factor for asthma and allergy at age 7[J]. Am J Resp Crit Care Med,2000,161(5):1501-1507.
[10]ML Everard. The relationship between respiratory syncytial virus infections and the development of wheezing and asthma in children[J]. Current Opinion in Allergy and Clinical Immunology,2006,6(1):56-61.
[11]Gadina M, Jefferies CA. IL-33: a sheep in wolf's clothing? [J]. Sci STKE, 2007,390: 31.
[12]Carriere V, Roussel L, Ortega N, et al. IL-33, the IL-1-like cytokine ligand for ST2 receptor, is a chromatin-associated nuclear factor in vivo[J]. Proc Natl Acad Sci USA, 2007,104(1):282-287.
[13]Chang YJ, Kim HY, Albacker LA, et al. Innate lymphoid cells mediate influenza-induced airway hyper-reactivity independently of adaptive immunity[J]. Nat Immunol, 2011,12(7):631-638.
[14]Tung HY, Plunkett B, Huang SK, Zhou Y. Murine Mast Cells Secrete and Respond to Interleukin-33[J]. J Interferon Cytokine Res, 2013,34(3):141-147.
RespiratorySyncytialVirusInfectionInducedExcretionofIL-33inInnateImmuneCellsinBALB/cmice
QI Fei-fei1, WANG Rui-ying2, LIU Jing1, ZENG Sheng1, LIU Bei-xing1
(1.Teach. &Res.Div.ofImmunol.,Schl.ofBasicMed.Sci.,ChinaMed.Uni.,Shenyang110001; 2.Classof96K10B,ChinaMed.Uni.,Shenyang110001)
IL-33 is a newly found cytokine; it plays an important role in virus infection induced airway inflammation reaction. It was found in the study that the level of IL-33 was significantly increased in the lungs of BALB/c mice infected with respiratory syncytial virus (RSV). However, the immune cell types for IL-33 excretion after RSV infection, especially the cell types of the innate immune cells, remain unknown so far. In this study, by isolating and cultivating alveolar macrophages and dendritic cells from BALB/c mice, the change of IL-33 excretion level in innate immune cells after infected with RSV were tested and determined with ELISA and real-time PCR. The results showed that at 72 h after RSV infection, the expression of IL-33 mRNA level in the alveolar macrophages increased significantly. Meanwhile, the expression of IL-33 mRNA level in dendritic cells began to increase 24 h after the infection, and reached to a peak at 48 h after RSV infection. This study has confirmed that RSV infection induced BALB/c mice innate immune cells to excrete IL-33, and proceed to medium-leading the occurrence and development of inflammation after the infection.
respiratory syncytial virus (RSV); IL-33; alveolar macrophages; dendritic cells
国家自然科学基金(81273239/H1005)
戚菲菲 女,硕士研究生。主要从事病毒与哮喘研究。Tel:024-23256666-5346, E-mail:cpqf_sky@163.com
* 通讯作者。女,教授,博士生导师。主要从事病毒与哮喘方面的研究。Tel:024-23256666-5346,E-mail:bxliu@mail.cmu.edu.cn
2013-11-14;
2013-11-23
Q939.47
A
1005-7021(2014)04-0037-05
10.3969/j.issn.1005-7021.2014.04.007
