凝血酶原复合物的临床应用
2014-07-18赵怡雯崔娟红杨丽云综述李艳秋审校
赵怡雯,孙 涛,崔娟红,杨丽云 综述 李艳秋 审校
凝血酶原复合物的临床应用
赵怡雯1,孙 涛1,崔娟红1,杨丽云2综述 李艳秋3审校
凝血酶原复合物;IX因子浓缩物;华法林;创伤;血栓弹性描记法
在过去的20年中,维生素K拮抗药(vitamin K antagonist,VKA)的临床应用逐渐增加,从1993年到2008年增加了300%。VKA能够降低房颤及使用人工心脏瓣膜患者的卒中风险、预防复发性静脉血栓的发生、治疗遗传性凝血障碍[1]。大量临床试验研究结果表明,目前常用的VKA华法林会增加患者的出血风险,每年有1%~3%应用华法林的高危患者发生致命性出血[2]。国际标准化比值(international normalized ratios,INR)大于4将增加颅内出血(intracranial hemorrhage,ICH)的绝对风险。ICH发生后最初20 h内INR持续升高将增加血肿扩大的风险,血肿扩大是导致死亡的独立危险因素[3]。
虽然目前出现了新的口服抗凝药,但VKA仍然是抗凝治疗的一线药物[4]。过去,治疗VKA出血的首选方法是补充维生素K、血液制品或重组因子,目前认为采用凝血因子浓缩物能够更为快速、可靠、持久地逆转致命性出血。
治疗指南推荐凝血酶原复合物(prothrombin complex concentrate,PCC)用于治疗致命性出血,但未提及PCC的最佳用量和疗前INR值对疗效的影响[5]。PCC是由灭活的因子Ⅱ、Ⅸ、Ⅹ和不定量的因子Ⅶ构成的复合物。本综述回顾了PCC应用的相关资料,包括监测技术、PCC对致命性出血的治疗作用以及和其他治疗方法的比较,并总结了目前资料中存在的缺陷。
1 华法林及逆转疗法
华法林通过拮抗维生素K环氧化物还原酶从而抑制维生素K依赖的凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ以及内源性抗凝蛋白C和蛋白S的活化,补充维生素K或外源性凝血因子能够逆转华法林的抗凝作用,最常用的逆转VKA的方法,包括新鲜冷冻血浆(fresh frozen plama,FFP)、活化的重组因子Ⅶ(rFⅦa)和PCC[6]。
1.1 FFP FFP是从血浆中分离得到的一种血液制品,包含所有的凝血因子及纤维蛋白原。多年来,临床上一直应用FFP治疗由VKA引起的凝血障碍性出血。使用FFP的缺点包括:治疗剂量所需的FFP体积大,可能出现输血反应,使用前需要较长时间解冻。每单位FFP大约为250 ml,需要提前1 h解冻,对INR水平已经显著升高的患者显然不适用;另外,由于患者通常需要多个单位FFP,用量有时可能高达2 L[7]。
1.2 rFⅦa 重组人凝血因子Ⅶ能够通过激活外源性凝血途径,促进纤维蛋白形成并降低INR水平来维持机体内环境稳态[8]。rFⅦa不仅用于逆转VKA,还用于治疗外伤、手术引起的凝血障碍、胸外科手术以及ICH。rFⅦa药品说明书推荐用量为35~70 μg/kg,临床研究资料中rFⅦa使用剂量为20~90 μg/kg。由于其凝血作用,rFⅦa增加了动脉血栓(例如心肌梗死、脑梗死)风险[9,10]。
1.3 PCC 与FFP不同,PCC是冻干产品,无需解冻,明显节省了使用前准备时间。所有的PCC均包括凝血因子Ⅱ、Ⅸ、Ⅹ,含或不含凝血因子Ⅶ。根据是否含有凝血因子Ⅶ将PCC分为两类:三因子PCC和四因子PCC。PCC中维生素K依赖的凝血因子浓度是血浆中的25倍。根据凝血因子浓度,2000 ml的FFP相当于1例患者1次输注的PCC剂量。为防止快速集中输入促凝血因子引发血栓形成,PCCs中通常含有抗凝药,例如蛋白C,蛋白S和肝素[6]。
过去,PCC仅用于治疗血友病,近期,PCC的治疗范围扩展到用来逆转VKA引起的出血或出血倾向[11,12]。与FFP相比, PCC降低患者INR水平的作用更加强烈、快速、持久。因此目前认为对于急性出血的患者,PCC与目前治疗药物相比更加经济、有效。随着PCC的广泛应用,合理用药成为一个亟需关注的问题。见表1。
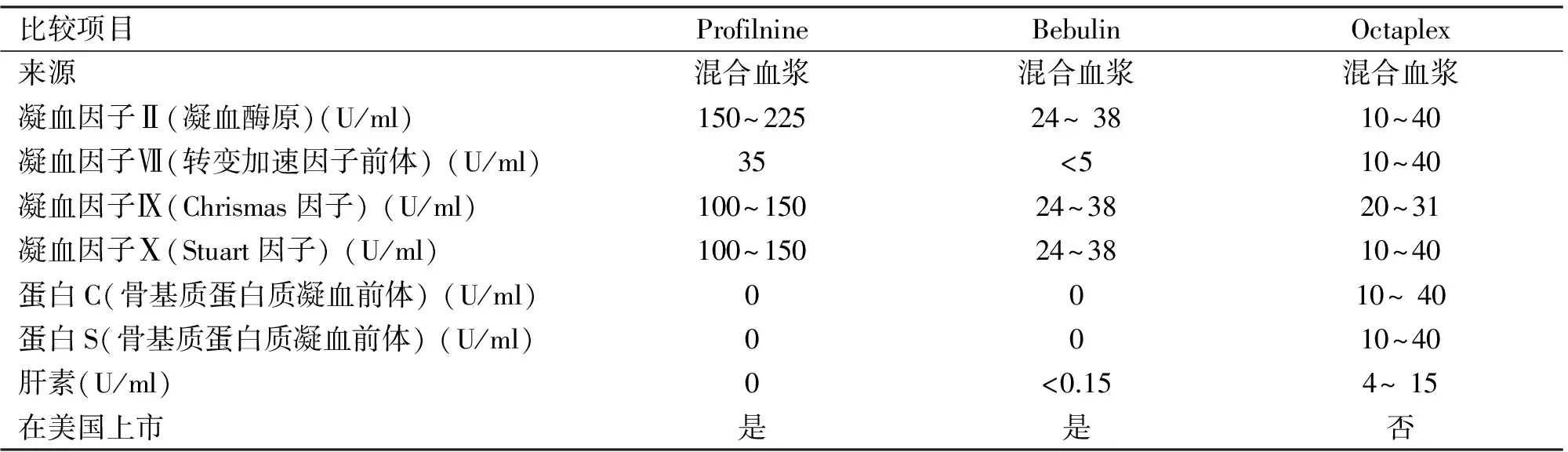
表1 3种品牌PCC产品的比较[13-16]
2 监测手段
2.1 INR 凝血状态可以通过凝血酶原时间(prothrombin time,PT)、INR、部分凝血活酶时间(partial thromboplastin,PTT)来评估。PT和INR通过外源性途径评估凝血所需时间,PTT用于评估内源性途径激活的速度。目前临床上INR已经成为监测抗凝和出血的一项重要参数。INR水平与抑制凝血因子形成的程度密切相关,但与凝血因子缺乏的逆转的相关性却较差[3,13,14]。
患者开始使用VKA治疗时,通过INR进行监测,前提是假设INR达到治疗水平后,因子Ⅱ、Ⅶ、Ⅸ和Ⅹ会出现相应的降低。与此同时,内源性凝血途径也受到相应程度的抑制。这一假设在监测抗凝水平时是有效的,但对于出血患者止血程度的监测缺乏有效性。补充外源性途经的药物,如rFⅦa可能对INR水平有重大影响,但不足以补充内源性凝血途径。因此,INR水平的降低可能与止血无关[3,14]。PCC = prothrombin complex concentrate.上述差异、INR逆转的不确定性以及临床反应,导致医师仍然不知道治疗是应侧重于内源性还是外源性途径,或两者兼顾。尽管存在这些缺点,INR因其有效性及缺乏更好的监测参数,目前仍是主要监测参数[14,15]。
2.2 血栓弹力图 标准凝血模型比简单的凝血级联反应复杂。基于实时功能的监测技术,如血栓弹力图(thromboelastography,TEG)对危重出血患者非常有用。TEG对血液凝固进行实时分析,而不用依靠间接标志物(如INR)。TEG监测器显示的具体参数是基于凝血形成率和形成程度,提供患者特异性凝血动力学指标(表2)。
3 PCC治疗华法林所致出血的最新认识
3.1 三因子PCC 与四因子PCC 三因子PCC已在美国上市;四因子PCC已进入美国以外的市场,如欧洲国家,但目前在这些国家仍处于Ⅲ期临床试验阶段。与含有凝血因子Ⅶ的四因子PCC相比,三因子PCC存在明显不足。虽然没有随机对照临床试验比较这两种PCC产品,但大量文献指出:与四因子PCC相比,三因子PCC降低INR的效果较差,但尚未证实其止血功能差。
Imberti等[17]对46例ICH患者进行了三因子PCC促凝疗效的评估。给药30 min内75%的患者INR下降到1.5以下,其中96%患者INR的降低保持了96 h。分层分析表明,INR下降到1.5以下的概率在INR为2~3.9的37例患者中为89%,在INR为4~6的6例患者中为33%,在INR>6的3例患者中为0%。这一数据表明随着INR的升高,患者对三因子PCC产生耐受[17]。
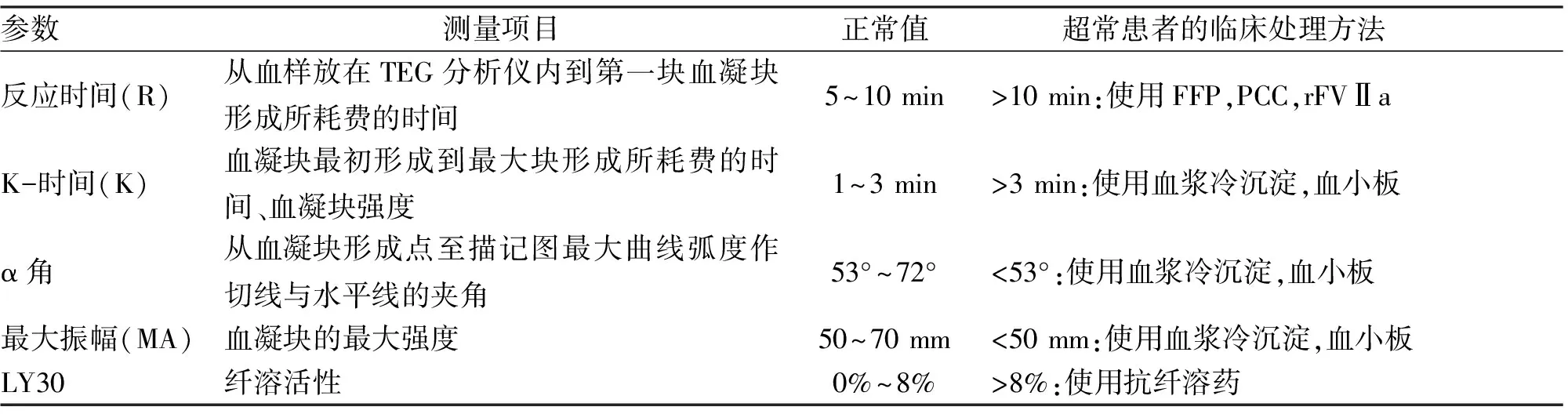
表2 血栓弹力图参数:临床相关的出血患者[16]
Holland等[18]的一项前瞻性试验,评估了使用三因子PCC纠正华法林过量治疗导致的INR超出正常值范围的情况,纠正目标是INR<3。在治疗之前,PCC组平均INR为9,FFP组平均INR为9.4。给予PCC后,55%的患者的INR<3(平均INR4.6),给予FFP组后,62%的患者INR<3(平均INR2.3)。两者之间明显的差异引发了争议。
在文献[17,18]的研究中,治疗前INR值差异显著,分别为3.5和9。这点差异很重要,因为与其他凝血因子不同,凝血因子Ⅶ只需要正常浓度的10%~15%即可保持内环境稳态。对于Ⅶ因子浓度<15%的患者,他们需要补充足够的凝血因子Ⅶ以逆转相关的凝血功能障碍。因此,如何确定紧急出血患者的因子Ⅶ浓度<15%成为一个问题。因为INR准确反映了外源性凝血途径的功能,故总体来讲,INR大致为4~5即表示凝血因子Ⅶ已减少到正常浓度的15%以下[19,20]。因此,治疗前INR>4的患者,如采用三因子PCC治疗则需要补充含因子Ⅶ的产品。Baggs等[4]发表的一项研究进一步支持了以上的结论。此项研究依据INRs对患者进行了分层分析,评价他们对三因子PCC的反应。多数患者由于出血性并发症需要紧急抢救。在三因子PCC治疗效果欠佳的组中,患者平均INR值明显较高(3.5vs2.5,P=0.01)。INR>4的患者仅11%有效,治疗有效率明显小于INR为2~2.9的患者(72%,P=0.01),和INR为3~3.9的患者(58%,P=0.03)。对以上调查结果进行多元逻辑回归分析表明,治疗前INR的高低是INR能否逆转的一个重要因素[4]。
荷兰的研究提供了更多有用的数据,对患者治疗前后因子水平进行了监测,如果患者接受三因子PCC治疗未能达到终点标准,将给他们补充FFP[18]。研究表明,与PCC或FFP单独使用相比, FFP和三因子PCC结合使用能显著提高达到目标INR的比率。补充三因子PCC后,因子Ⅱ、Ⅴ、Ⅸ和Ⅹ水平显著增加,然而,Ⅶ因子水平没有改变。低浓度的因子Ⅶ(2%~5%)最有可能解释INR对三因子药物无反应的原因。补充FFP后患者Ⅶ因子浓度提高到24%,超过15%的阈值。通过提高因子Ⅶ浓度,在校正因子Ⅱ、Ⅶ、Ⅸ和Ⅹ浓度的差异后,93%的患者实现INR逆转的目标。补充前后似乎没有差异,INR值的差异归因Ⅶ因子的存在。这项研究提供了两个重要结果:为患者(尤其是INR值明显升高的患者)补充三因子PCC的同时平均需要两个单位的FFP提供了基础;这种获益最有可能是由于补充了因子Ⅶ的理论得到了支持[18]。
FFP包含凝血因子以外的其他血浆成分,增效的原因可能源于不同的机制,如因子Ⅷ、Ⅷ,von Willebrand因子,或纤维蛋白原的补充。Lankiewicz等[21]评估了在四因子PCC基础上补充FFP用于治疗活动性出血或突发逆转。这项研究包括58例患者,这些患者平均INR为11.7,单独接受四因子PCC或与FFP联合治疗。结果表明INR有类似的降低。与单独使用FFP或联合PCC相比,四因子PCC可能更完全、更快速的逆转INR[3]。这些发现进一步支持因子Ⅶ缺乏理论和在PCC治疗中INR的响应。
基于有限的研究,高成本、不良反应,特别是血栓形成的风险,暂不支持将rFⅦa作为三因子PCC补充Ⅶ因子的潜在来源这种猜想[22]。
总之,四因子与三因子PCC的主要区别是因子Ⅶ的存在。虽然目前INR未必是抗凝逆转最好的替代指标,但却是最有效的参数。INR>4的患者可能对三因子制剂的反应急剧降低。因此,口服抗凝药使得INR>4的患者觉察到因子Ⅶ缺乏需要紧急治疗时,应考虑补充1~2单位FFP。
3.2 PCC给药剂量 PCC治疗危重出血患者最有效的给药方案目前仍未可知。多种因素使得找到单一有效剂量范围变得复杂化。虽然最初用于治疗血友病的推荐剂量为25~50 U/kg,但这个剂量对于VKA治疗的患者可能是过量的,因为他们也不是完全缺乏凝血因子。研究表明,低至9 U/kg的剂量已经足以逆转出血,且INR值升高与需要增加三因子PCC剂量之间可能存在相关性[4,23]。然而,在研究中即使患者INR值显著升高,所给予的最大剂量仍低于血友病中使用的最大剂量50 U/kg[24]。目前,澳大利亚的共识指南仍建议使用25~50 U/kg PCC用于逆转口服抗凝药[25]。尽管美国胸科医师学会推荐只有急性出血患者使用PCC,他们并没有推荐给药方案[5]。尽管存在这些问题,根据INR和患者体重确定给药剂量以降低INR似乎才是最有效的。
Van Aart等[24]运用了根据因子浓度确定的给药方案,然后根据患者体重、实际INR和目标INR调整了给药剂量。患者随机接受固定的剂量为500 U或个体化给药剂量的四因子PCC。这些患者需要逆转超范围的INR,其中大量出血或紧急手术的需要逆转至INR<1.5;需轻微干预或轻微出血的患者目标INR<2.1。固定剂量平均约7 U/kg(5~11 U/kg),个体化给药者剂量为15 U/kg至35 U/kg。89%接受个体化剂量的患者达到了目标INR,而固定剂量者仅43%达到了目标INR(P <0.001),这种差异在给药后5 h仍然存在。根据初始INR水平对患者进行分层分析,INR> 4.5的患者固定剂量治疗明显比个体化剂量疗效差(达到目标INR的比例分别为18.8%和77%)[24]。
与Van Aart研究不同,Yasaka和他的同事[23,24]比较了出血或需要进行侵入性手术患者所需四因子PCC标准化剂量,这些患者的中位INR为2.5。研究发现500 U(6~18 U/kg)和高达1500 U(25~26.8 U/kg)的标准化剂量的逆转程度没有差别;唯一的重大发现是:接受较低剂量(200 U,2.6~5.3 U/kg)的患者逆转成功率低,这表明低剂量可能很难逆转成功。但只有6例患者被随机分到高剂量组(最接近目前推荐的剂量),数量较少不足以显示出疗效差异,因为该研究缺陷严重,无法得出500 U和1500 U效果相似的结论,但是支持假设,即<25 U/kg的剂量对于INR轻度升高者有效[23]。
现有文献一致认为,应该根据患者的体重及现有INR水平进行个体化给药。虽然给药剂量还有待规范,推荐剂量之间也有很大差别,但是目前认为根据体重计算给药剂量可能是最合理的。研究机构可以参考Van Aart的研究,根据现有INR水平和患者体重进行给药剂量标准化,但必须强调的是该研究确定剂量指导方针是针对四因子PCC建立的,因此如果是三因子PCC可能需要高剂量或补充FFP[24]。在没有推荐给药剂量的中心,对于临床相关出血或INR轻微升高(1.5~3.5)的患者,推荐剂量为25 U/kg;INR 3.5~5者给予25~50 U/kg。Holland等[13]的研究表明INR>5的患者可能需要50 U/kg的剂量,一次性给药或分两次给药,并补充FFP,但有较高的血栓形成的风险。目前正在进行预防治疗中血栓形成的Ⅲ期多中心随机对照试验,可能会降低推荐给药量至最低阈值(20 U/kg)以下,与Van Aart的研究中阐明的推荐给药剂量相似[24]。
4 目前对PCC治疗出血性休克的最新认识
PCC也用于外伤性出血的研究,对它的使用仍存在争议,因为其优点有可能成为缺陷。动物模型显示PCC 比rFⅦa止血时间更短(94 min vs. 35 min),凝血酶生成更多[26]。另外对照组动物模型显示,与FFP相比,PCC能更好地纠正PT,止血时间更短,更能有效地止血[27]。一个多中心回顾性临床试验对FFP或TEG引导的四因子PCC结合纤维蛋白原的止血效果进行了评价,阐明了PCC和纤维蛋白原结合使用能够降低同种异体血产品的需求(表3)[28]。尽管这种治疗方法血流动力学状态指标很差,但住院时间明显缩短。

表3 FFP 与PCC+TEG治疗创伤患者结果
虽有上述结果,仍必须指出PCC的缺点。PCC通常因体积小而优越于FFP,然而对于创伤人群可能是有害的,因为经常出现用量不足,患者通常表现为一种高纤溶状态和低纤原血症,这可能会导致出血。与FFP不同,PCC中不含纤维蛋白原,因此PCC给药前需要补充纤维蛋白原(表4)。在创伤中心由于由于解冻和交叉配血导致FFP不能及时使用的情况减少了,因为他们使用了预融储存和基于无线电波的解冻技术。这些措施使得PCC相对于FFP的优势不复存在。由于缺少抗凝血酶,外伤患者血栓形成的风险明显高于VKA引起出血的患者,因此,尽管最佳给药方案待定,但这些外伤患者可能仅需要很小的剂量。目前临床数据支持FFP用于创伤患者,并能够降低死亡率。外伤患者使用PCC未见报道[29,30]。

表4 使用FFP和PCC治疗创伤前后凝血因子浓度和纤维蛋白原水平的比较
综上所述,PCC已经被确定为一种潜在的用于危重出血患者的治疗药物,但在应用前应将患者差异性、产品有效性以及当前化验结果等因素考虑在内。现有的数据大部分是从VKA引发的出血,特别是ICH得出的,结果显示PCC能够显著快速降低INR,作为医师,必须清楚三因子和四因子PCC产品的差别、可能出现的疗效并了解目前进展、必须知道应该如何处理出血患者,包括给药剂量、是否需要补充适量因子Ⅶ。目前,在没有更多数据支持的情况下仅推荐PCC用于治疗难治性出血,而不作为外伤出血患者的一线治疗。
[1] Huhtakangas J, Tetri S, Juvels S,etal. Effect of increased warfarin use on warfarin-related cerebral hemorrhage: a longitudinal population-based study[J]. Stroke,2011,42:2431-2435.
[2] Chapman S A, Irwin E D, Beal A L,etal. Prothrombin complex concentrate versus standard therapies for INR reversal in trauma patients receiving warfarin[J]. Ann Pharmacother, 2011,45:869-875.
[3] Makris M, Greaves M, Phillips W S,etal. Emergency oral anticoagulation reversal: the relative efficacy of infusions of fresh frozen plasma and clotting factor concentrate on correction of the coagulopathy[J]. ThrombHaemost,1997,77:477-480.
[4] Baggs J H, Patanwala A E, Williams E M. Dosing of 3-factor prothrombin complex concentrate for international normalized ratio reversal[J]. Ann Pharmacother,2012,46:51-56.
[5] Ansell J, Hirsh J, Hylek E,etal. Pharmacology and management of the vitamin K antagonists: American College of Chest Physicians evidence-based clinical practice guidelines[J]. Chest,2008,133:160S.
[6] Bershad E M, Suarez J I. Prothrombin complex concentrates for oral anticoagulant therapy-related intracranial hemorrhage: a review of the literature[J]. Neurocrit Care 2010,12:403-413.
[7] Miller Y, Bachowski G, Benjamin R,etal. Practice guidelines for blood transfusion: a compilation From recent peer-reviewed literature[M]. 2nd edition. Washington, DC: American National Red Cross, 2007:66.
[8] Recombinant activated factor seven (NovoSeven_). Princeton, NJ: Novo Nordisk Pharmaceuticals; 1999.
[9] Hauser C J, Boffard K, Dutton R,etal. Results of the CONTROL trial: efficacy and safety of recombinant activated factor VII in the management of refractory traumatic hemorrhage[J]. J Trauma, 2010,69:489-500.
[10] Mayer S A, Brun N C, Begtrup K,etal. Efficacy and safety of recombinant activated factor VII for acute intracerebralhemorrhage[J]. N Engl J Med, 2008,358:2127-2137.
[11] Bebulin VH (Factor IX Complex) vapor heated [package insert]. Westlake Village, CA: Baxter Healthcare Corporation, 2006,09.
[12] Profilnine SD (Factor IX Complex) [package insert]. Los Angeles, CA: GrifolsBiologicals Inc, 2010,03.
[13] Patanwala A E, Acquisto N M, Erstad B L. Prothrombin complex concentrate for critical bleeding[J]. Ann Pharmacother,2011,45:990-999.
[14] Dager W E. Using prothrombin complex concentrate to rapidly reverse oral anticoagulation effects[J]. Ann Pharmacother ,2011,45: 1016-1020.
[15] PinnerN A, Hurdle A C, Oliphant C.Treatment of warfarin-related intracranial hemorrhage: a comparison of prothrombin complex concentrate and recombinant activated factor VII[J]. World Neurosurg,2010,74:631-635.
[16] Wegner J, Popovsky. Clinical utility of thromboelastography: one size does not fit all[J]. Semin Thromb Hemost,2010,36:699-706.
[17] Imberti D, Barillari G, Biasioli C,etal. Emergency reversal of anticoagulation with a three-factor prothrombin complex concentrate in patients with intracranial haemorrhage[J]. Blood Transfus,2011,9:148-155.
[18] Holland L, Warkentin T E, Refaai M,etal. Suboptimal effect of three-factor prothrombin complex concentrate (Profilnine-SD) in correcting supratherapeutic INR due to warfarin overdose[J]. Transfusion,2009,49:1171-1177.
[19] Butler A C, Tait R C. Management of oral anticoagulation-induced intracranial haemorrhage[J]. Blood Rev,1998,12:35-44.
[20] Markis M, Van Veen J J. Three or four factor prothrombin complex concentrate for emergency anticoagulation reversal[J]. Blood Transfus,2011,9:117-119.
[21] Lankiewicz M W, Hays J, Friedman K D,etal. Urgent reversal of warfarin with prothrombin complex concentrate[J]. J ThrombHaemost,2006,4:967-970.
[22] Sarode R, Matevosyan K, Bhagat R,etal. Rapid warfarin reversal: a 3-factor prothrombin complex concentrate and recombinant factor VIIa cocktail for intracerebral hemorrhage[J]. J Neurosurg,2012,116: 491-497.
[23] Yasaka M, Sakata T, Naritomi H. Optimal dose of prothrombin complex concentrate for acute reversal of oral anticoagulation[J]. Thromb Res,2005,115:455-459.
[24] Van Aart L, Eijkhout H W, Kamphuis J S,etal. Individualized dosing regimen for prothrombin complex concentrate more effective than standard treatment in the reversal of oral anticoagulation therapy: an open, prospective randomized controlled trial[J]. Thromb Res,2006,118:313-320.
[25] Baker R I, Couglin P B, Gallus A S,etal. Warfarin reversal: consensus guidelines, on behalf of the Australasian society of thrombosis and hemostasis[J]. Med J Aust,2004,181:492-497.
[26] Dickneite G, Dorr B, Kaspereit F. Prothrombin complex concentrate versus recombinant factor VIIa for reversal of hemodilutional coagulopathy in a porcine trauma model[J]. J Trauma,2010,68:1151-1157.
[27] Dickneite G, Pragst I. Prothrombin complex concentrate vs fresh frozen plasma for reversal of dilutional coagulopathy in a porcine trauma model[J]. Br J Anaesth,2009,102:345-354.
[28] Schochl H, Neinaber U, Maegele M,etal. Transfusion in trauma: thromboelastography guided coagulation factor concentrate-based therapy versus standard fresh frozen plasma based therapy[J]. Crit Care,2011,15:R83.
[29] Godier A, Susen S, Samama M. Treatment of massive bleeding with prothrombin complex concentrate: argument against[J]. J ThrombHaemost,2010,8:2592-2595.
[30] Tanaka K A, Szlam F. Treatment of massive bleeding with prothrombin complex concentrate: argument for[J]. J ThrombHaemost,2010,8:2589-2591.
(2014-03-12收稿 2014-06-20修回)
(责任编辑 梁秋野)
赵怡雯,本科学历,主管技师,E-mail:zhaoyiwen138@sina.com
100039北京,武警总医院:1.检验科;2.军人病区;3.300162天津,武警后勤学院附属医院检验科
杨丽云,E-mail:yangliyun30@163.com
R9731
