营养不良对仔鼠胰岛素和nestin蛋白水平的影响
2014-07-18袁可陈玉凤张立生
袁可 陈玉凤 张立生
·实验研究·
营养不良对仔鼠胰岛素和nestin蛋白水平的影响
袁可 陈玉凤 张立生
目的连续观察营养不良仔鼠生后血糖、血清胰岛素的水平, 并检测其胰腺组织中insulin(胰岛素)和nestin(巢蛋白)mRNA表达水平, 探讨营养不良在仔鼠胰腺发育过程中的影响。方法用低蛋白饮食法低出生体重仔鼠的模型, 实验组(R组)母鼠在21 d哺乳期继续低蛋白饮食喂养;对照组(C组)母鼠给予正常蛋白饮食喂养。仔鼠出生1、7、14、21 d采血监测血糖和血清胰岛素值;RTPCR检测胰岛素和nestin mRNA水平的表达。结果各时间点:①R组仔鼠体重均低于C组;②血糖和血清胰岛素水平差异无统计学意义(P>0.05);③R组胰腺中胰岛素和nestin mRNA水平均低于C组,差异有统计学意义(P<0.05)。结论宫内营养不良可导致仔鼠低体重, 生后早期其血糖和血清胰岛素水平虽然较对照组相比尚无改变, 但胰腺中胰岛素含量已发生明显的改变, β细胞的再生减少可能是其机制。
营养不良;胰岛素;nestin蛋白
近些年来不断有流行病学资料和动物实验研究表明:出生时体重偏低者在成年后发生糖耐量减低和II型糖尿病的风险显著增加。因此研究胎儿生长与成年期疾病的潜在机制成为围产医学和新生儿学的研究热点。作者连续观察营养不良仔鼠生后血糖、血清胰岛素的水平, 并检测其胰腺组织中insulin和nestin mRNA表达水平, 探讨营养不良在仔鼠胰腺发育过程中的影响。
1 材料与方法
1.1动物模型 使10只健康的三月龄SD雌鼠受孕成功,之后随机分为两组:实验组(R组)自受孕成功后开始10%低蛋白饲料喂养, 并持续喂养至在仔鼠出生后21 d;对照组(C组)自受孕成功后给予正常蛋白饲料喂养。
1.2方法
1.2.1体重、血糖和血清胰岛素测定 各组仔鼠于生后1、7、14、21 d称重后断头取血, 测定血糖, 余血样放射免疫法测血清胰岛素水平。
1.2.2mRNA定量分析 完整分离生后第1、7、14、21天的两组仔鼠的胰腺组织, 提取总RNA, 逆转录合成cDNA。在同一反应体系内PCR扩增cDNA, insulin产物为236 bp;nestin产物为283 bp。内对照GAPDH产物451 bp。将扩增成功的cDNA产物加入琼脂糖凝胶后进行电泳, 再利用凝胶成像分析系统扫描, 获得的不同的OD值, 最后用insulin和nestin与GAPDH 的OD比值, 将insulin和nestin mRNA的表达情况进行半定量分析。
1.3统计学方法 采用SPSS12.0统计学软件对数据进行统计学分析。计量资料以均数±标准差表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05为差异具有统计学意义。
2 结果
随出生日龄的增加:①R组仔鼠的体重和C组仔鼠一样在不断增加, 但在各个时间点均显著低于C组, 差异有统计学意义(P<0.05);②R组仔鼠的空腹血糖和血清胰岛素水平无显著变化, 且与C组比较差异无统计意义(P>0.05);③两组仔鼠的胰腺组织中胰岛素和nestin mRNA表达均逐步增加,在每个时间点, R组的表达量均显著低于C组, 差异有统计学意义(P<0.05)。 Insulin mRNA和nestin mRNA含量呈正相关,在R组两者相关系数r为0.674(P=0.013), C组两者的相关系数r为0.775(P=0.002)。见表1。两组仔鼠第21天时insulin和nestin mRNA电泳结果, 见图1。
图1 两组仔鼠第21天时胰腺insulin 和nestin mRNA
表1两组仔鼠不同时间点体重、insulin 和nestin mRNA的比较n=6)
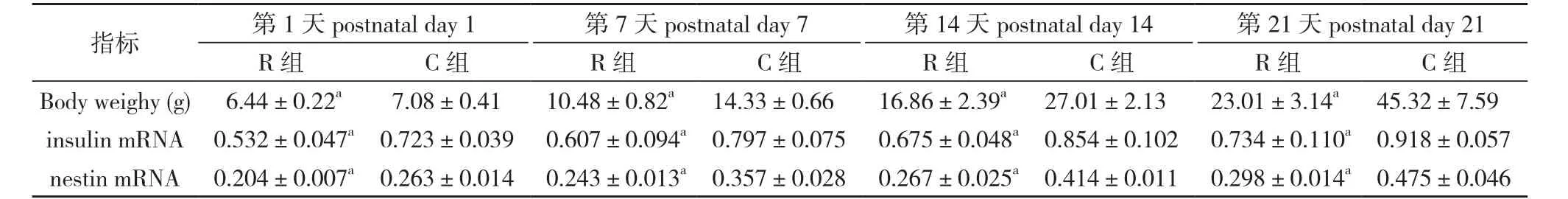
表1两组仔鼠不同时间点体重、insulin 和nestin mRNA的比较n=6)
注:与对照组(C组)比较,aP<0.05
指标第1天 postnatal day 1第7天 postnatal day 7第14天 postnatal day 14第21天 postnatal day 21 R组C组R组C组R组C组R组C组Body weighy (g) 6.44±0.22a7.08±0.4110.48±0.82a14.33±0.6616.86±2.39a27.01±2.1323.01±3.14a45.32±7.59 insulin mRNA0.532±0.047a0.723±0.0390.607±0.094a0.797±0.0750.675±0.048a0.854±0.1020.734±0.110a0.918±0.057 nestin mRNA0.204±0.007a0.263±0.0140.243±0.013a0.357±0.0280.267±0.025a0.414±0.0110.298±0.014a0.475±0.046
3 讨论
针对Pima印地安人的一项流行病学研究发现:出生体重与成年后糖尿病发生率存在U形关系, 即低出生体重者较高出生体重者具有更高的糖尿病发生率(25.0% VS 18.2%)。米杰等[1]的一项针对中国人的流行病学研究也显示出生时的营养不良是其成年期发生II型糖尿病的独立危险因素。关于营养不良与发生成年期疾病的潜在机制, Lucas首先在1998年提出“营养程序化[2]”概念, Wzanne在2001年进一步提出“代谢程序化[3]”概念。他们认为:在出生早期机体会对营养不良产生适应性反应, 导致胰岛的内分泌功能和结构在生命早期即发生潜在的改变, 这种不易觉察的改变将持续至成年期, 最终导致2型糖尿病易患性增加。1999年的一项研究发现低出生体重儿可最早在7岁时检测到糖耐量异常[4]。
围产期发育中的许多器官存在重构(remodeling), 即围生期组织细胞的凋亡、增殖和再生均处于较成年期的高水平,此后至成年期该组织细胞的凋亡、增殖和再生水平显著下降, 其总数量或比例基本确定。Scaglia等[5]实验发现大鼠的胎儿期至生后21 d(相当于人类胎儿至哺乳期)是大鼠胰岛重构的关键时期, 此后胰岛的结构和功能将被“程序化”,将对血糖的自稳态产生终生的影响。本实验动态观察了生后21 d内营养不良组仔鼠血糖和血清胰岛素水平, 显示其尚能保持正常水平, 未出现胰岛素抵抗, 但是胰腺中的胰岛素含量已经出现减少。Nestin是一种在胚胎时期高度表达的中间丝蛋白, 现被公认为是神经干细胞或前体细胞的标志物之一。2000年, Hunziker等[6]首先报道在胰岛中也存在nestin 阳性细胞, 体外实验则发现, nestin阳性的胰腺导管细胞可在体外诱导分化为具有分泌胰岛素功能的β细胞[7]。因此从nestin阳性的内分泌前体细胞到新生β细胞的分化过程是胰岛重构的重要环节。本研究结果显示营养不良组仔鼠的胰腺组织中nestin mRNA含量虽随日龄缓慢上升, 但均显著低于同日龄的对照组, 且与insulin mRNA水平呈正相关。故推测营养不良可能使仔鼠胰腺中内分泌前体细胞数量下降, 从而损害了β细胞的分化, 改变了仔鼠胰岛重构、最终使胰腺中胰岛素含量下降。
新生儿期营养状况对胰腺β细胞的发育至关重要。本研究发现营养不良的仔鼠在生后21 d内, 血糖和血胰岛素水平尚未出现异常, 但其胰腺组织中insulin和nestin mRNA表达量已下降。因此在临床工作中遇到低出生体重新生儿时, 不仅要关注血糖、血清胰岛素水平等血液指标有无异常的表面现象, 更要预见到低出生体重新生儿的胰岛β细胞发育可能已经受损。如果不能及时有效的改善其营养状况, 将可能使得β细胞再生减少, 影响胰岛正常发育, 进而导致其成年期II型糖尿病的发生。因此, 在胎儿、特别是生后早期这个胰岛重构的敏感时期寻求一种有效的方法, 对低出生体重新生儿进行积极有效的早期干预, 将有望改善胰岛重构, 最终达到成年期疾病生后早期防治的目的。
[1] 米杰, 程红, 赵小元, 等.出生重量指数对中年罹患代谢综合征的预测作用.中华预防医学杂志, 2004, 38(4):221-225.
[2] McMillen IC, Edwards LJ, Duffield J, et al.Regulation of leptin synthesis and secretion before birth: implications for the early programming of adult obesity.Reproduction, 2006, 131(3):415-427.
[3] Reusens B, Remacle C.Programming of the endocrine pancreas by the early nutritional environment.Int J Biochem Cell Biol, 2006, 38(5-6): 913-922.
[4] Hoet JJ, Hanson MA.Intrauterine nutrition: Its importance during critical periods for for cardiovascular and endocrine development.J Physiol, 1999, 514(Pt3):617-627.
[5] Scaglia L, Cahill CJ, Findgood DT, et al.Apoptosis participates in the remodeling of the endocring pancreas in the neonatal rat.Endocrinology, 1997, 138(4):1736-1741.
[6] Hunziker E, Stein M.Nestin-expressing cells in the pancreatic islets of langerhans.Biochem Biophys Res Commun, 2000(271):116.
[7] Kim SY, Lee SH, Kim BM, et al.Activation of nestin-positive duct stem (NPDS) cells in pancreas upon neogenic motivation and possible cytodifferentiation into insulin-secreting cells from NPDS cells.Dev Dyn, 2004, 230(1):1-11.
2014-07-24]
266000 青岛市妇女儿童医院新生儿重症监护室(袁可 张立生);新乡市中心医院内分泌科(陈玉凤)
