小檗碱对胰岛β细胞的保护作用及其机制研究
2014-07-18吴惠玲
吴惠玲
(淄博市第一医院内分泌科,山东 淄博 255200)
小檗碱对胰岛β细胞的保护作用及其机制研究
吴惠玲△
(淄博市第一医院内分泌科,山东 淄博 255200)
目的: 探讨小檗碱对胰岛β细胞的保护作用及可能机制。方法: 采用四氧嘧啶(Axn)诱导INS-1胰岛β细胞损伤模型,并以不同浓度的硫酸小檗碱进行干预。将细胞分为对照组(Con组)、损伤组(Axn组)、低剂量小檗碱组(LBer组,小檗碱浓度为15 μmol/L)、中剂量小檗碱组(MBer组,小檗碱浓度为45 μmol/L)及高剂量小檗碱组(HBer组,小檗碱浓度为100 μmol/L)。流式细胞术观察各组细胞凋亡情况,Western blotting免疫印迹法分别观察各组PTEN/PI3K/Akt信号通路、HNF-1α/PDX-1信号通路活化情况以及激活型caspase-3的水平;酶联免疫吸附法(ELISA)观察各组基础胰岛素释放及葡萄糖刺激后胰岛素的释放水平。结果: 与Con组相比,Axn组凋亡率显著升高,但小檗碱干预后凋亡水平显著降低,且呈浓度依赖性。与Con组相比,Axn组PTEN表达水平明显升高,而PI3K/Akt活性被抑制,激活型caspase-3水平显著升高;而小檗碱处理则能逆转上述PTEN通路的促凋亡作用,且显示出浓度依赖性;与Con组相比,Axn组HNF-1α/PDX-1信号通路活性显著下降,但小檗碱处理则能提高该通路活性,表现出浓度依赖性。与Con组相比,Axn组基础及葡萄糖刺激下胰岛素释放水平均显著降低,而小檗碱处理则能显著恢复上述胰岛素释放水平,呈浓度依赖性。结论: 小檗碱对四氧嘧啶损伤的INS-1胰岛β细胞具有保护作用,表现为对其凋亡的抑制与胰岛素分泌功能的恢复,分别与影响细胞内PTEN/PI3K/Akt及HNF-1α/PDX-1信号通路有关。
小檗碱; β细胞; 细胞凋亡; 胰岛素
在世界范围内,糖尿病(diabetes mellitus, DM)是发病率仅次于心血管疾病及肿瘤的第三大非传染性疾病,据世界卫生组织数据统计显示,2010年时全球共有2.58亿糖尿病患者,2012年该数字上升至3.71亿,预计到2030年,全球将会有4.39亿糖尿病患者[1]。作为一种慢性进展性代谢紊乱性疾病,糖尿病的致死及致残率极高,在所有疾病中是仅次于感染性疾病、心血管疾病、恶性肿瘤以及创伤性疾病的第五大致死性病因。糖尿病系各种原因导致的胰岛β细胞损伤及功能障碍引起的胰岛素分泌水平下降引起,因此如何防治β细胞损伤并恢复其正常功能成为糖尿病治疗的关键环节。小檗碱(berberine, Ber)是一种异喹啉类生物碱,主要存在于中药黄连(CoptischinensisFranch.)以及云连(CoptisteetaWall.)等的根茎中[2]。近年来的研究表明小檗碱具有多种生物学活性,如抗炎、抗氧化以及抗增殖等,可影响多种细胞内信号转导通路的活性。目前认为,小檗碱对糖尿病具有一定的治疗作用,但具体机制尚未研究清楚。本研究以四氧嘧啶诱导体外培养的大鼠胰岛β细胞株INS-1损伤模型,用小檗碱干预后观察其对β细胞的保护作用并对其可能机制进行探讨,为小檗碱在糖尿病中的治疗价值提供理论依据。
材 料 和 方 法
1 主要试剂
大鼠胰岛素分泌β细胞株INS-1购自中国典型培养物保藏中心;硫酸Ber、四氧嘧啶(alloxan,Axn)和噻唑蓝(MTT)购自Sigma;Annexin V-FITC流式凋亡检测试剂盒购自BD;第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin ho-molog on chromosome ten,PTEN)、磷脂酰肌醇3-激酶(phosphatidylinsitol 3-kinase,PI3K)、肝脏细胞核因子1α(hepatocyte nuclear factor 1a,HNF-1α)以及胰腺十二指肠同源盒-1(pancreatic and duodenal homeobox 1,PDX-1)抗体均购自Abcam;蛋白激酶B (protein kinase B,Akt)以及磷酸化的Akt(p-Akt)抗体均购自CST;激活型caspase-3(cleaved caspase-3)以及GAPDH抗体购自Santa Cruz;大鼠胰岛素ELISA试剂盒购自R&D。
2 细胞培养、处理及分组
INS-1细胞接种于含有10%胎牛血清(Gibco)以及青霉素-链霉素混合液的RPMI-1640培养基(Gibco)中,在5% CO2、37 ℃以及饱和湿度的培养环境下进行培养,视细胞生长情况每2~3 d进行一次换液,细胞贴壁生长占培养瓶瓶壁的90%左右时,可以1∶2~1∶3的比例进行传代及分瓶培养。
将1×109/L的INS-1细胞悬液分为对照组(Con)、损伤组(Axn)、小檗碱低剂量组(LBer)、小檗碱中剂量组(MBer)以及小檗碱高剂量组(HBer)。Con组进行常规培养;Axn组培养基中加入终浓度为4 mmol/L的四氧嘧啶;LBer组培养基中加入终浓度为4 mmol/L的四氧嘧啶及终浓度为15 μmol/L的硫酸小檗碱溶液;MBer组培养基中加入终浓度为4 mmol/L的四氧嘧啶及终浓度为45 μmol/L的硫酸小檗碱溶液;HBer组培养基中加入终浓度为4 mmol/L的四氧嘧啶及终浓度为100 μmol/L的硫酸小檗碱溶液。上述各组细胞均在5% CO2、37 ℃以及饱和湿度的培养环境下进行72 h的培养。
3 主要实验方法
3.1 MTT比色法测定细胞抑制率 称取0.5 g MTT,溶于100 mL的磷酸盐缓冲液(PBS)中制成浓度为5 g/L的MTT溶液。将上述各组细胞悬液各200 μL接种于96孔板中,每组设6个复孔并设置调零孔及对照孔。在5% CO2、37 ℃以及饱和湿度的培养环境下进行72 h的培养。向每孔中加入20 μL上述MTT溶液并继续培养4 h。弃去孔中培养液终止培养并向每孔中加入150 μL二甲基亚砜(DMSO),低速摇床上充分振荡10 min后在680型酶标仪(Bio-Rad)上读取490 nm处的吸光度(A)值。细胞抑制率为存活细胞数占总细胞数的百分比。
3.2 Annexin V-PI双染流式细胞术凋亡检测 以胰酶在培养皿中对上述各组贴壁细胞进行消化,完全培养液终止消化后以1 000 r/min在室温下离心5 min后弃去上清液,使用预冷的PBS充分洗涤并将各组细胞收集入EP管中。向各管中加入试剂盒中的binding buffer并将细胞悬液浓度调整为1×109/L。分别向各管中加入5 μL的Annexin V并在避光条件下室温反应10 min,向各管中加入5 μL的PI并在避光条件下室温反应5 min。再向各管中加入300 μL的binding buffer后将等量细胞转移入Falcon管在FACScan流式细胞仪(BD)上对细胞凋亡进行检测。
3.3 细胞胰岛素释放的检测 将上述各组培养皿中细胞培养液弃去,以无血清的RPMI-1640培养基洗涤2~3次,加入KRB缓冲液(葡萄糖浓度2.8 mmol/L)培养2 h后收集上清;再向各组培养体系中加入KRB缓冲液(葡萄糖浓度16.7 mmol/L)培养2 h后收集上清。ELISA法对收集的各组上清液中胰岛素含量进行检测,操作步骤严格按照试剂盒说明书进行,最后在680型酶标仪上读取450 nm的A值,并根据标准曲线对胰岛素浓度进行计算。
3.4 Western blotting蛋白免疫印迹实验 将上述各组培养皿中细胞培养液弃去,以预冷的PBS洗涤2~3次后收集各组细胞,以RIPA裂解液(ProMab)进行裂解,并加入终浓度为1 mmol/L的PMSF(Santa Cruz)。4 ℃下以12 500 ×g离心10 min获得的上清即为总蛋白。采用BCA法对上述蛋白浓度进行检测。将各组20 μg总蛋白在SDS-聚丙烯酰胺凝胶中进行垂直电泳后电转印至PVDF膜。5%脱脂牛奶TBST溶液室温下封闭90 min后,分别使用PTEN(1∶2 000)、PI3K(1∶2 000)、Akt(1∶2 000)、p-Akt(1∶1 000)、cleaved caspase-3(1∶1 000)、HNF-1α(1∶1 000)、PDX-1(1∶2 000)以及GAPDH(1∶500)抗体孵育,洗涤后再以辣根过氧化物酶(HRP)标记的Ⅱ抗(1∶2 000)进行孵育。TBST洗涤后以增强型ECL发光试剂盒对免疫印迹进行检测与观察。
4 统计学处理
采用统计学软件SPSS 16.0分析。数据采用均数±标准差(mean±SD)表示,多组间比较采用One-way ANOVA分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1 小檗碱对损伤胰岛β细胞抑制率的影响
经MTT检测发现,与Con组比,四氧嘧啶处理的胰岛β细胞抑制率显著升高;而小檗碱处理则能随小檗碱浓度的升高显著降低细胞抑制率,见图1。
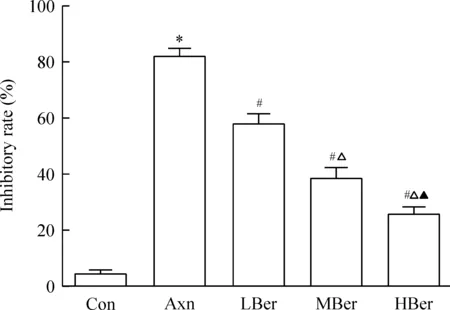
Figure 1.Comparison of the inhibitory rates among different groups. Mean±SD.n=3.*P<0.05vsCon group;##P<0.05vsAxn group;△P<0.05vsLBer group;▲P<0.05vsMBer group.
图1 各组细胞抑制率的比较
2 小檗碱对损伤胰岛β细胞凋亡的影响
经Annexin V-PI双染流式细胞术检测发现,四氧嘧啶处理能够显著促进INS-1细胞凋亡;而在小檗碱处理后,细胞凋亡率随着药物浓度的升高而呈现显著降低,见图2。

Figure 2.Comparison of the apoptotic rates among different groups. Mean±SD.n=3.*P<0.05vsCon group;##P<0.05vsAxn group;△P<0.05vsLBer group;▲P<0.05vsMBer group.
图2 各组细胞凋亡率的比较
3 小檗碱对损伤胰岛β细胞PTEN/PI3K/Akt信号通路的影响
Western blotting法发现,与Con组相比,Axn组PTEN表达水平显著升高,PI3K表达水平及Akt磷酸化水平则显著降低;而与Axn组相比,小檗碱处理的LBer、MBer及HBer组,PTEN表达水平随着浓度升高而下降,同时PI3K表达水平及Akt磷酸化水平则显著升高,见图3。
4 小檗碱对损伤胰岛β细胞cleaved caspase-3水平的影响
与Con组相比,Axn组cleaved caspase-3水平显著升高;而与Axn组相比,LBer、Mber以及HBer组cleaved caspase-3水平则明显降低,且呈现显著的浓度依赖性,见图4。
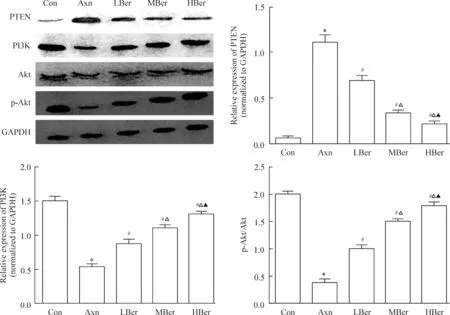
Figure 3.Comparison of PTEN/PI3K/Akt pathway activation among different groups.Mean±SD.n=3.*P<0.05vsCon group;#P<0.05vsAxn group;△P<0.05vsLBer group;▲P<0.05vsMBer group.
图3 各组细胞PTEN/PI3K/Akt通路活化情况的比较
5 小檗碱对损伤胰岛β细胞胰岛素分泌水平的影响
在四氧嘧啶的作用下,Axn组的基础胰岛素释放量及葡萄糖刺激胰岛素释放量均较Con组显著降低,而接受小檗碱处理的LBer、MBer及HBer组的基础胰岛素释放量及葡萄糖刺激胰岛素释放量均较Axn组显著改善,且呈明显的浓度依赖性,见表1。
6 小檗碱对损伤胰岛β细胞HNF-1α/PDX-1信号通路的影响
如图5所示,与Con组相比,Axn组的HNF-1α及PDX-1表达均显著下调;而与Axn组相比,LBer、MBer以及HBer组的HNF-1α及PDX-1表达均显著增加,且呈现明显的浓度依赖性。
讨 论
随着社会与经济的发展,现代社会营养过剩及运动减少等生活方式的转变,发达国家及发展中国家人群糖尿病发病率均呈现逐年显著升高的趋势。糖尿病的并发症,包括糖尿病心肌病、糖尿病肾病、糖尿病视网膜病变以及糖尿病周围神经病变等极大程度地降低患者生活质量甚至威胁患者的生命。作为一种多病因的代谢紊乱性疾病,虽然发病机制复杂,但胰岛β细胞绝对数量减少及分泌胰岛素功能障碍是导致糖尿病发病的根本原因。胰岛细胞代谢旺盛,相比于机体内其它组织细胞,β细胞对外界不良刺激的易感性更强。四氧嘧啶能够对β细胞产生特异性的细胞毒性,通过产生自由基等造成β细胞损伤[3]。本研究采用四氧嘧啶制作胰岛β细胞损伤模型,发现β细胞凋亡增多,且其胰岛素分泌功能下降,与既往研究相符。
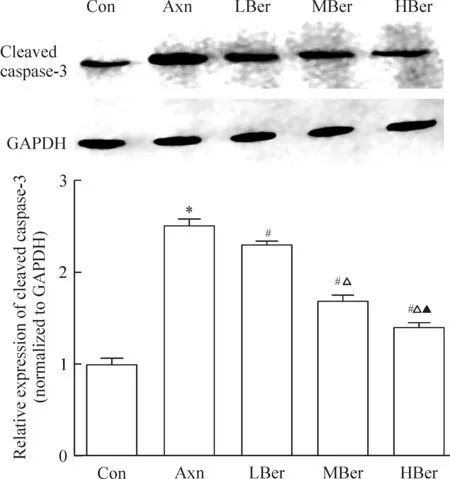
Figure 4.Comparison of the cleaved caspase-3 levels among different groups.Mean±SD.n=3.*P<0.05vsCon group;#P<0.05vsAxn group;△P<0.05vsLBer group;▲P<0.05vsMBer group.
图4 各组激活型caspase-3水平的比较
表1 各组基础及葡萄糖刺激胰岛素释放量的比较
Table 1.The basal insulin release and stimulated insulin release in different groups (Mean±SD.n=3)

GroupBasalinsulinrelease(mIU/L)Stimulatedinsulinrelease(mIU/L)Con2.25±0.314.86±0.17Axn0.89±0.10*1.14±0.09*LBer1.28±0.21#1.87±0.10#MBer1.79±0.20#△2.33±0.08#△HBer2.04±0.24#△▲3.27±0.11#△▲
*P<0.05vsCon group;#P<0.05vsAxn group;△P<0.05vsLBer group;▲P<0.05vsMBer group.
研究发现,小檗碱在包括细菌/病毒感染、血脂紊乱、炎症、恶性肿瘤、骨质疏松以及糖尿病等多种疾病中均具有显著的治疗作用。在我国传统中医中,糖尿病又被称为消渴症,而早在我国古代魏晋时期就已经有用中药黄连治疗消渴症的记载[4]。近年来的研究表明,小檗碱在治疗糖尿病时具有类似磺脲类药物的降血糖药理活性[5],但其机制尚未研究清楚。PTEN是上世纪90年代在肿瘤细胞内首先发现的一种抑癌因子,随后的研究表明其还在细胞生长、分化、凋亡、迁移及胚胎发育中扮演重要的角色。PI3K是PTEN下游的作用底物分子之一,PTEN以其PI3K酶活性抑制PI3K的作用,从而使PI3K下游的Akt分子磷酸化程度降低,上述3个分子构成PTEN/PI3K/Akt信号通路。PTEN表达增高后可抑制PI3K/Akt的活性而促进细胞凋亡,此时caspase瀑布级联反应被激活[6]。本研究发现,在四氧嘧啶作用后,INS-1细胞内PTEN表达升高,而PI3K/Akt信号则被抑制,同时激活型caspase-3水平增高,INS-1细胞凋亡率升高。而在小檗碱干预后,随着药物浓度的提高,INS-1细胞内PTEN表达水平降低,PI3K/Akt信号被激活,细胞凋亡率显著降低,表现为细胞内激活型caspase-3水平下降。上述结果表明小檗碱能够通过影响PTEN/PI3K/Akt信号通路对四氧嘧啶诱导的INS-1胰岛细胞凋亡起保护作用。

Figure 5.Comparison of HNF-1α/PDX-1 pathway activation among different groups.Mean±SD.n=3.*P<0.05vsCon group;#P<0.05vsAxn group; △P<0.05vsLBer group;▲P<0.05vsMBer group.
图5 各组HNF-1α/PDX-1信号通路活化情况的比较
如前所述,除了胰岛β细胞凋亡,糖尿病时β细胞分泌胰岛素功能也出现障碍。在INS-1胰岛素分泌实验中发现,四氧嘧啶导致的细胞损伤使INS-1基础胰岛素释放量及葡萄糖刺激下胰岛素释放量均显著降低。而使用小檗碱处理细胞后,随着小檗碱药物浓度的不断升高,INS-1细胞基础及葡萄糖刺激下的胰岛素释放量均显著升高。本研究结果初步显示这一作用机制与小檗碱对HNF-1α/PDX-1信号通路的激活作用有关。除了在脂肪酸代谢调节中的关键作用,HNF-1α基因表达的缺失被认为参与了胰岛β细胞胰岛素分泌障碍的发生,因而与糖尿病发病有关。因其直接参与启动胰岛素的转录与合成过程,PDX-1是经典的胰岛β细胞胰岛素分泌功能的分子标记物[7]。近期的数项研究均表明,PDX-1是HNF-1α的下游分子,后者能够通过与PDX-1基因启动区直接作用而促进PDX-1的分泌[8]。本研究发现,在四氧嘧啶损伤的INS-1细胞中,HNF-1α/PDX-1信号通路被显著抑制,而在小檗碱作用后,INS-1细胞HNF-1α/PDX-1信号通路出现显著的激活状态,最终表现为胰岛β细胞胰岛素分泌功能的恢复。
综上所述,小檗碱对四氧嘧啶损伤的INS-1胰岛β细胞具有保护作用,表现为对其凋亡的抑制与胰岛素分泌功能的恢复,分别与影响细胞内PTEN/PI3K/Akt及HNF-1α/PDX-1信号通路有关。
[1] Dalan R, Jong M, Choo R, et al. Predictors of cardiovascular complication in patients with diabetes mellitus:a 5-year follow-up study in a multiethnic population of Singapore: CREDENCE II study[J]. Int J Cardiol, 2013, 169(4):e67-e69.
[2] Singh IP, Mahajan S. Berberine and its derivatives: a patent review (2009-2012)[J]. Expert Opin Ther Pat, 2013, 23(2):215-231.
[3] 孙海峰,常 虹,郭雪莹,等. 胰岛细胞损伤体外模型的建立及在药物筛选中的应用[J].中医药学报,2012, 40(3):53-56.
[4] 李 波,朱维良,陈凯先. 小檗碱及其衍生物的研究进展[J]. 药学学报, 2008, 43(8):773-787.
[5] Yin J, Xing H, Ye J. Efficacy of berberine in patients with type 2 diabetes mellitus[J]. Metabolism, 2008, 57(5):712-717.
[6] Liu S, Ma X, Ai Q, et al. NOTCH1 functions as an oncogene by regulating the PTEN/PI3K/AKT pathway in clear cell renal cell carcinoma[J]. Urol Oncol, 2013, 31(6): 938-948.
[7] Shih DQ, Heimesaat M, Kuwajima S, et al. Profound defects in pancreatic beta-cell function in mice with combined heterozygous mutations inPdx-1,Hnf-1α, andHnf-3β[J]. Proc Natl Acad Sci U S A, 2002, 99(6):3818-3823.
[8] Boroujeni ZN, Aleyasin A. Insulin producing cells established using non-integrated lentiviral vector harboringPDX1 gene[J]. World J Stem Cells, 2013, 5(4):217-228.
Protective effects of berberine in pancreatic islet beta cells
WU Hui-ling
(DepartmentofEndocrinology,FirstHospitalofZiboCity,Zibo255200,China.E-mail:axemaxme@sina.com)
AIM: To explore the protective effects of berberine (Ber) on islet beta cells and related possible mechanisms. METHODS: The injury of INS-1 cells was induced by treatment with alloxan (Axn). Berverine was then given at serial concentrations. The cells were divided into control group (Con), injury group (Axn), low-dose berberine group (LBer), medium-dose berberine group (MBer) and high-dose berberine group (HBer). Flow cytometry was employed to detect the apoptosis. The activation of PTEN/PI3K/Akt and HNF-1α/PDX-1 pathways and the protein level of cleaved caspase-3 were evaluated by Western blotting. The insulin releases under normal or high-glucose stimulation were measured by ELISA. RESULTS: Compared with Con group, the apoptotic rate increased significantly in Axn group. Berberine treatment reduced the apoptotic rate in LBer group, MBer group and HBer group in a concentration-dependent manner. Compared with Con group, the protein levels of PTEN and cleaved caspase-3 increased, while PI3K and phosphorylation of Akt decreased significantly in Axn group. However, this effect was reversed by berberine in a concentration-dependent manner. Compared with Con group, the activation of HNF-1α/PDX-1 signaling pathway was inhibited in Axn group but recovered by berberine administration. The abilities of releasing insulin under normal or high-glucose stimulation were impaired in Axn group but recovered by berberine treatment in LBer group, MBer group and HBer group in a concentration-dependent manner.CONCLUSION: Berberine shows protective effects against alloxan-induced damage in beta cells by inhibiting apoptosis and recovering insulin secretion, thus attenuating the activation of PTEN/PI3K/Akt and HNF-1α/PDX-1 signaling pathways.
Berberine; β-cells; Apoptosis; Insulin
1000- 4718(2014)12- 2213- 06
2014- 07- 03
2014- 08- 03
R363.2
A
10.3969/j.issn.1000- 4718.2014.12.017
△通讯作者 Tel: 0533-4252412; E-mail: axemaxme@sina.com
