小檗碱与育亨宾对脓毒症小鼠脾细胞凋亡的影响及其机制研究*
2014-07-18贾宝银杨多猛李红梅余小慧吕秀秀陆大祥王华东
贾宝银, 杨多猛, 王 媛, 李红梅, 余小慧, 吕秀秀, 陆大祥, 王华东
(暨南大学医学院病理生理学系,国家中医药管理局三级科研实验室,广东 广州 510632)
小檗碱与育亨宾对脓毒症小鼠脾细胞凋亡的影响及其机制研究*
贾宝银, 杨多猛, 王 媛, 李红梅, 余小慧, 吕秀秀, 陆大祥, 王华东△
(暨南大学医学院病理生理学系,国家中医药管理局三级科研实验室,广东 广州 510632)
目的: 探讨小檗碱与育亨宾对脓毒症小鼠脾细胞凋亡的影响及其作用机制。方法: 采用盲肠结扎穿孔(CLP)构建小鼠脓毒症模型,分为假手术(sham)组、CLP组、CLP+小檗碱组、CLP+育亨宾组、CLP+小檗碱与育亨宾合剂组。CLP术后2 h灌胃给予相应药物,20 h后取脾脏,用TUNEL和流式细胞术检测小鼠脾细胞凋亡,酶荧光法检测caspase-3、caspase-8和caspase-9的活性变化,Western blotting检测凋亡相关蛋白Fas、Bim、Bcl-2和Bax的表达。结果: (1) CLP组脾脏TUNEL阳性细胞百分率显著高于sham组(P<0.05),CLP+育亨宾与小檗碱合剂组、CLP+育亨宾组凋亡细胞百分率显著低于CLP组(P<0.05)。(2) 流式细胞仪检测显示CLP组凋亡的脾细胞及T淋巴细胞明显多于sham组(P<0.05),CLP+育亨宾与小檗碱合剂组、CLP+育亨宾组凋亡的脾细胞及T淋巴细胞明显少于CLP组 (P<0.05) 。(3) CLP+育亨宾与小檗碱合剂组、CLP+育亨宾组脾细胞caspase-3、caspase-8、caspase-9的活性均低于CLP组(P<0.05);而CLP+小檗碱组脾细胞caspase-9活性也低于CLP组 (P<0.05)。(4) CLP+育亨宾与小檗碱合剂组胞浆Fas、Bim、Bax表达均低于CLP组,CLP+育亨宾组胞浆Fas表达低于CLP组,CLP+小檗碱治疗组胞浆Bim、线粒体Bax表达均低于CLP组。结论: (1) 小檗碱与育亨宾合用可通过阻断内、外源性凋亡途径抑制脓毒症小鼠脾细胞凋亡,特别是T淋巴细胞凋亡。(2) 育亨宾主要通过抑制Fas的表达、进而阻断内、外源性凋亡途径减少脓毒症诱导的脾细胞凋亡。(3) 小檗碱可抑制脓毒症小鼠脾细胞线粒体凋亡途径,但对脓毒症小鼠脾细胞凋亡的抑制作用并不明显。
小檗碱; 育亨宾; 细胞凋亡; 脓毒症; 脾淋巴细胞
脓毒症是重症监护室(intensive care unit, ICU)病人死亡的重要原因之一[1],脓毒症病人在脓毒症后期常常出现严重的免疫抑制,容易发生医院内二次感染[2]。目前的研究显示,大量的淋巴细胞凋亡导致机体抗感染能力降低以及免疫功能障碍、继而引发院内感染是脓毒症患者后期死亡的重要原因[3]。然而,目前临床治疗脓毒症的主要方法仍然是应用抗生素治疗相关感染以及血液动力学和器官支持等对症治疗。因此,寻求一种有效抑制脓毒症患者淋巴细胞凋亡的方法,对于改善脓毒症病人的免疫抑制状况和预后尤为重要。我们前期研究发现小檗碱(berberine, B)和α2-肾上腺素能受体(α2-adrenoceptor, α2-AR)阻断剂育亨宾(yohimbine,Y) 联合应用可显著降低脓毒症小鼠的死亡率[4],但是小檗碱和育亨宾联用是否能抑制脓毒症诱导的淋巴细胞凋亡?其机制如何?迄今尚缺乏深入的研究。因此,本研究观察小檗碱和育亨宾对脓毒症小鼠脾淋巴细胞凋亡的影响,并进一步研究其作用的分子机制,为阐明小檗碱和育亨宾联合应用治疗脓毒症的机制提供理论依据。
材 料 和 方 法
1 实验动物与分组
清洁级雄性C57BL/6小鼠,购自广东省医学实验动物中心,合格证编号为SCXK(粤)2008-0002:44007200005475,8~10周龄,体重20~25 g之间。小鼠每笼5只,分笼饲养于暨南大学动物实验中心,自由进食及饮水。待其适应环境1周后进行后续实验。饲养与实验环境温度控制在(25 ±2) ℃,湿度控制在60%~80%。小鼠进行分组处理:假手术组(sham组),术后2 h用超纯水(0.1 mL/10 g体重)灌胃;脓毒症模型组,即盲肠结扎穿孔(cecal ligation and puncture,CLP )组,CLP术后2 h用超纯水(0.1 mL/10 g体重)灌胃;CLP+小檗碱组(CLP+B),术后2 h用小檗碱(50 mg/kg,0.1 mL/10 g体重)灌胃;CLP+育亨宾组(CLP+Y),术后2 h用育亨宾(2 mg/kg,0.1 mL/10 g体重)灌胃;CLP+小檗碱与育亨宾合剂组(CLP+BY),术后2 h用小檗碱(50 mg/kg)与育亨宾(2 mg/kg)配制成BY合剂(0.1 mL/10 g体重)灌胃。所有实验过程符合暨南大学医学院实验动物伦理规定的要求。
2 主要试剂
中性硫酸小檗碱、育亨宾均购自Sigma;TUNEL试剂盒购自Roche;凋亡检测试剂盒:Annexin V-FITC Apoptosis detection Kit、T淋巴细胞特异性表面流式抗体Anti-Mouse CD3e APC、B淋巴细胞特异性表面流式抗体Anti-Human/Mouse CD45R PE-Cy7、封闭抗体Anti-Mouse CD16/32 Purified(FcR Block)均购自eBioscience;Apo-ONE Homogeneous Caspase-3/7 Assay Kit购自Promega;Caspase-8/FLICE Fluorometric Assay Kit、Caspase-9 Fluorometric Assay Kit均购自BioVision;线粒体提取试剂盒Mitochondria Isolation Kit for Cultured Cells、兔抗小鼠 Fas Antibody购自Santa Cruz;兔抗小鼠 Bim Antibody、兔抗小鼠 Bax Antibody、兔抗小鼠 Bcl-2 Antibody、兔抗小鼠GAPDH Antibody、兔抗小鼠VDAC Antibody均购自Cell Signaling。
3 主要方法
3.1 C57BL/6小鼠脓毒症模型的建立 小鼠麻醉后,对其腹部皮肤手术区进行消毒,沿腹白线行正中切口,开腹后,小心分离并提拉盲肠置于洞巾上,避开肠系膜大血管于盲肠末端约2/3处结扎盲肠,以12号针贯穿盲肠,来回穿刺5次,注意穿孔时避开肠壁血管,回纳肠管,依次关腹缝合,手术切口消毒,对合切口两侧边缘腹壁与皮肤。术后在小鼠背部皮下注射无菌生理盐水(0.3 mL /10 g)。
3.2 脾组织冰冻切片制备及TUNEL染色 术后20 h麻醉并处死小鼠,将脾脏组织置于4%多聚甲醛中固定24 h。再用冰PBS液冲洗后依次放于10%蔗糖溶液6 h,20%蔗糖溶液过夜,30%蔗糖溶液24 h进行脱水,PBS清洗组织后置于包埋盒中,加入OCT胶,调节切片厚度为5 μm,使用冰冻切片机,将组织块修整后切片。用防脱载玻片贴取组织切片放于37 ℃烤箱,12 h后将组织载玻片置于湿盒中,用0.3% PBST液室温孵育5 min,重复3次穿孔破膜,使用5% BSA室温孵育30 min进行封闭。PBST洗片3次后每张玻片上加125 μL TUNEL工作液,使其全部覆盖样本,37 ℃避光孵育1 h。PBST洗片3次, DAPI染核并滴加抗荧光淬灭剂,将盖玻片盖在载玻片上后做好标记,在盖玻片周围封指甲油,选取所需要的荧光通道,以及适合的激发波长,激光共聚焦显微镜观察。
3.3 脾脏T淋巴细胞、B淋巴细胞凋亡染色 CLP术后20 h,麻醉后处理小鼠,无菌取出脾脏立即放入盛有适量预冷的10% FCS RPMI-1640液中,运用冲洗法将脾细胞冲出并用200目滤网过滤,去除杂质,使用碧云天ACK红细胞裂解液裂解红细胞,用1 mL新鲜含10% FCS的RPM-I1640液重悬细胞,并细胞计数。调整细胞数为1.5×1010/L。从上述细胞悬液取200 μL,加入封闭抗体anti-mouse CD16/32,冰上孵育5~10 min后加入anti-mouse CD3e APC、anti-mouse CD45R PE-Cy7抗体混合液孵育抗体,4 ℃避光孵育30 min。保持细胞密度为2×108~5×108/L,离心去上清。加5 μL Annexin V及1 × binding buffer 195 μL,轻微吹打混匀后,室温避光孵育10 min。用1× binding buffer 200 μL洗去残留的Annexin V。再加1 × binding buffer 190 μL及10 μL PI,重悬后立即使用流式细胞仪检测。
3.4 脾细胞caspase-3、8、9活性测定 术后20 h处死小鼠,将1 mL脾细胞悬液每样本分为500 μL、250 μL、250 μL以分别测定caspase-3、8、9的活性。Caspase活性检测分别按照说明书依次检测,多功能酶标仪测定荧光值相对荧光单位(relative fluorescence units,RFU )。同时分别测定样品的蛋白浓度。
3.5 Western blotting检测脾细胞Fas、Bcl-2、Bim的表达以及线粒体Bax水平 术后20 h处死小鼠,制备脾细胞悬液,并应用线粒体试剂盒进行线粒体分离。然后将胞浆蛋白加入5 × loading buffer加热变性;而线粒体沉淀加入70 μL RIPA裂解液裂解之后加入5 × loading buffer加热变性。其中,胞浆蛋白用来检测Fas、Bim和Bcl-2,线粒体蛋白用来检测Bax。运用SDS凝胶电泳,采用恒流(35 mA/凝胶)电泳,根据蛋白分子量确定电泳时间,如小分子蛋白电泳时间最好30 min以内,20 kD以上蛋白电泳在30~40 min。转膜条件:18 V,7 min(蛋白分子量>20 kD);15 V,6 min(蛋白分子量<20 kD)。GAPDH作为胞浆蛋白内参照,线粒体蛋白内参照是VDAC。电泳后切取所需目的蛋白及内参照蛋白胶条,进行转膜、封闭、洗膜、抗体孵育、经过化学发光、显影、定影,用凝胶图像处理系统分析目标条带的灰度值。
4 统计学处理
所有实验数据使用均数±标准误(mean±SEM)表示,经SPSS 13.0统计软件进行统计学分析,多组间比较用单因素方差分析(One-way ANOVA),各组方差齐时,两两组间比较采用LSD法;各组方差不齐时,两两比较用Tamhane’s T2法。以P<0.05为差异有统计学意义。
结 果
1 TUNEL检测结果
术后20 h小鼠脾脏冰冻切片TUNEL染色,经激光共聚焦显微镜观察,各组结果如图1所示。蓝色为脾细胞核,绿色为TUNEL阳性细胞,二者重合代表细胞发生凋亡。对凋亡细胞进行统计,CLP术后20 h,脾脏组织凋亡细胞数明显高于假手术组(P< 0.05),CLP+Y组、CLP+BY组脾细胞凋亡数显著低于CLP组(P< 0.05),而CLP+B组与CLP组相比,脾细胞凋亡计数差异无统计学意义(P>0.05)。
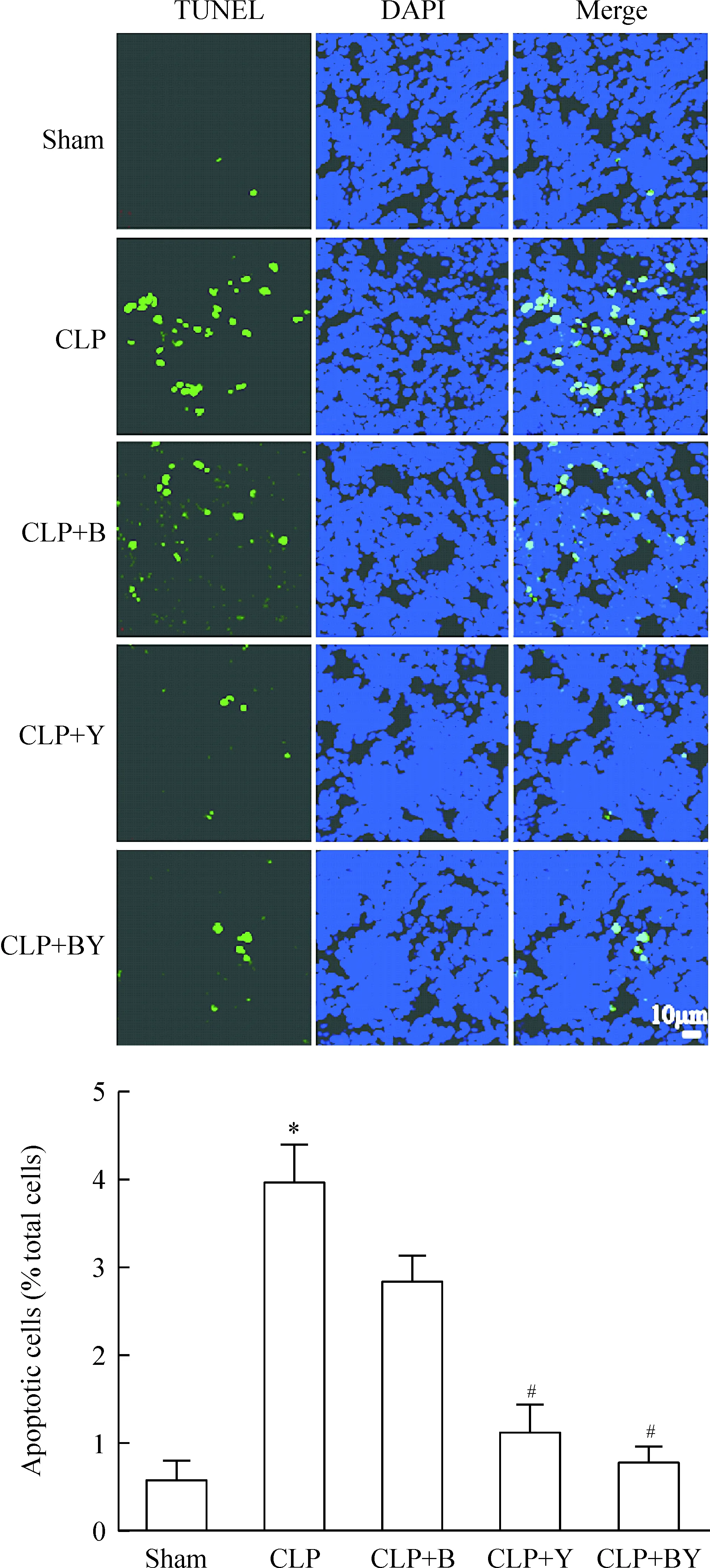
Figure 1.Effects of berberine (B) or/and yohimbine (Y) on sepsis-induced splenocyte apoptosis in C57BL/6 mice. Splenocyte apoptosis was detected by TUNEL 20 h after CLP. Mean ±SEM.n=10~12.*P<0.05vssham;#P<0.05vsCLP.
图1 小檗碱和(或)育亨宾对脓毒症术后20 h小鼠脾细胞凋亡的影响
2 小鼠脾脏T淋巴细胞、B淋巴细胞凋亡流式细胞仪检测结果
从图可以看出,CLP术后20 h, CLP组与假手术组相比,早期凋亡的脾细胞显著增多(P<0.05),CLP+Y组、CLP+BY组早期凋亡细胞的百分率均显著低于CLP组(P<0.05),而CLP+B组与CLP比较,早期凋亡细胞的百分率没有统计学差异(P>0.05)。对T淋巴细胞早期凋亡百分数进行统计学分析,CLP术后20 h, CLP组早期凋亡T淋巴细胞的百分率显著高于假手术组(P<0.05),CLP+Y组、CLP+BY组分别与CLP组比较,早期凋亡的T淋巴细胞均明显减少(P<0.05),而CLP+B组与CLP比较,早期凋亡的T淋巴细胞百分率没有统计学差异(P>0.05)。CLP术后20 h, CLP组早期凋亡的脾脏B淋巴细胞显著多于假手术组(P<0.05);CLP+Y组与CLP组比较,早期凋亡的B淋巴细胞明显减少(P<0.05),而CLP+B组、CLP+BY组分别与CLP组比较,早期凋亡的B淋巴细胞百分率没有统计学差异(P>0.05)。

Figure 2.Effects of berberine(B)or/and yohimbine(Y)on sepsis-induced splenocyte, T and B lymphocyte apoptosis in C57BL/6 mice. Lymphocyte apoptosis 20 h after CLP or sham operation was detected by flow cytometric analysis using staining with Annexin V-FITC/PI. Mean± SEM.n=12~15.*P<0.05vssham;#P<0.05vsCLP.
图2 小檗碱和(或)育亨宾对脓毒症小鼠脾细胞及脾T和B淋巴细胞凋亡的影响
3 各组小鼠脾细胞caspase-3、8和9活性的变化
由图3可以看出,CLP组与假手术组比较,caspase-3活性显著增高,差异有统计学意义(P<0.05)。 CLP+Y组、CLP+BY组分别与CLP组比较,caspase-3活性均显著降低(P<0.05),而CLP+B组与CLP组比较,caspase-3活性没有统计学差异(P>0.05)。CLP组与假手术组比较,脾细胞caspase-8的活性显著升高(P<0.05);CLP+Y组、CLP+BY组分别与CLP组比较,caspase-8酶活性均明显降低,差异均有统计学意义(P<0.05)。而CLP+B组与CLP组比较,脾细胞caspase-8的活性没有统计学差异(P>0.05)。 术后20 h,CLP组脾细胞caspase-9的活性明显高于假手术组(P<0.05),CLP+Y组、CLP+BY组、CLP+B组分别与CLP组比较,脾细胞caspase-9的活性均明显降低,差异均有统计学意义(P<0.05)。
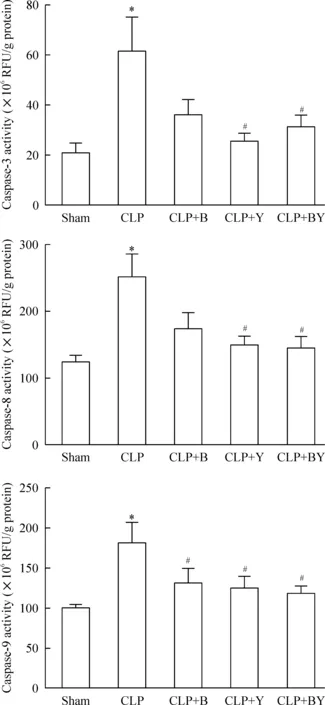
Figure 3.Effects of berberine (B) or/and yohimbine (Y) on caspase-3, caspase-8 and caspase-9 activities of splenocytes in C57BL/6 mice at 20 h after CLP. Mean±SEM.n=12~15.*P<0.05vssham;#P<0.05vsCLP.
图3 小檗碱和(或)育亨宾对脓毒症小鼠脾细胞caspase-3、8和9活性的影响
4 各组小鼠脾细胞Fas、Bcl-2、Bim的表达及线粒体Bax水平的变化
从图4可以看出,C57BL/6小鼠在复制脓毒症模型20 h后,脾细胞Fas蛋白表达明显高于假手术组(P<0.05)。CLP+Y组、CLP+BY组脾细胞Fas蛋白的表达均低于CLP组(P<0.05),而CLP+B组的Fas蛋白表达与CLP组比较没有统计学差异(P>0.05)。CLP组与假手术组相比,Bim表达量显著增加(P<0.05)。CLP+B组、CLP+BY组Bim表达量均明显低于CLP组(P<0.05),而CLP+Y组与CLP组相比,Bim表达没有显著差异(P>0.05)。CLP术后20 h,小鼠脾细胞Bcl-2 的表达显著低于假手术组(P<0.05)。应用小檗碱和(或)育亨宾治疗的CLP小鼠,CLP术后20 h脾细胞内Bcl-2 表达量与CLP组相比没有统计学差异(P>0.05)。CLP组脾细胞线粒体Bax蛋白含量与假手术组相比显著增高(P<0.05)。CLP+B组、CLP+BY组的脾细胞线粒体Bax蛋白含量均明显低于CLP组(P<0.05);CLP+Y组的脾细胞线粒体Bax蛋白含量与CLP组相比没有统计学差异(P>0.05)。
讨 论
脓毒症是一种感染引起的全身性炎症反应综合征[5]。虽然临床治疗措施不断改进,但是脓毒症患者的死亡率一直居高不下,因此脓毒症仍是极具挑战性的临床问题[5-6]。通常, 脓毒症患者的免疫功能受损,尤其在脓毒症后期,可出现脾脏与胸腺等器官淋巴细胞凋亡[7-8]。研究发现,脓毒症时 T淋巴细胞、B淋巴细胞等免疫细胞的凋亡严重影响患者的预后[9]。因此,通过某种手段调节脓毒症患者淋巴细胞凋亡将是具有价值的治疗方法。
我们先前研究发现,小檗碱与育亨宾联合应用能显著降低脓毒症小鼠的死亡率[4]。本研究采用CLP复制脓毒症模型,术后20 h观察这些药物对脾细胞凋亡的影响。结果发现,脓毒症术后20 h小鼠脾细胞出现明显凋亡,包括T、B淋巴细胞;单用育亨宾、育亨宾与小檗碱合剂均能明显抑制脓毒症引起的小鼠脾细胞凋亡、特别是T淋巴细胞凋亡。而单用小檗碱,并不能显著抑制脓毒症引起的脾细胞凋亡,也不能抑制脓毒症诱导的T、B淋巴细胞凋亡。同时,我们还发现,单用育亨宾可以抑制脓毒症诱导的B淋巴细胞凋亡。研究已经证实,淋巴细胞上存在α2肾上腺素能受体,育亨宾能阻断α2肾上腺素能受体的活化[10]。这些结果提示, 淋巴细胞上α2肾上腺素能受体可能直接或间接调节脓毒症诱导的淋巴细胞凋亡,阻断α2肾上腺素能受体活化可能是抑制脓毒症患者淋巴细胞凋亡的一种新策略。
很多研究表明,死亡受体(外源性)途径和线粒体(内源性)途径均参与了脓毒症诱导的淋巴细胞凋亡。例如,Fas蛋白可介导脓毒症诱导的CD4+T淋巴细胞凋亡[11];Schwulst等[12]发现抑制bim基因的表达可阻断脓毒症诱导的淋巴细胞凋亡,显著改善存活。此外,bcl-2转基因小鼠的脾淋巴细胞凋亡可以完全被抑制[13];IL-15可阻止NK细胞、树突细胞、CD8+T细胞的凋亡,并上调细胞内抗凋亡蛋白Bcl-2的表达,同时下调促凋亡蛋白Bim和PUMA的表达,提高脓毒症小鼠的生存率[14]。本研究进一步探讨了育亨宾和小檗碱对脓毒症小鼠脾细胞凋亡的作用机制。结果显示,脓毒症小鼠脾细胞Fas的表达明显上调,caspase-8的活性明显升高;同时,脓毒症小鼠脾细胞中Bim的表达上调、Bcl-2表达下调,线粒体Bax水平明显升高,脾细胞caspase-9活性增强。这些结果说明,脓毒症诱导脾细胞凋亡的发生机制与内、外源性凋亡途径有关。育亨宾单用可以显著降低脓毒症小鼠脾细胞中Fas的表达,并且caspase-8和caspase-3活性也显著降低,说明育亨宾可能通过作用于外源性凋亡途径发挥抗脓毒症淋巴细胞凋亡的作用。有趣的是,单用育亨宾后,脓毒症小鼠脾细胞caspase-9的活性也显著降低,但是育亨宾并不能抑制脓毒症诱导的脾细胞Bim的表达,也不能降低脓毒症小鼠脾细胞线粒体中Bax的水平,这可能是育亨宾在小鼠体内通过抑制caspase-8裂解Bid,从而导致caspase-9的活性显著降低。单用小檗碱后,脓毒症小鼠脾细胞Bim表达下调、线粒体Bax蛋白的含量降低,且caspase-9的活性也相应降低,但是对Fas蛋白的表达和caspase-8及caspase-3活性没有显著影响。这些结果提示:小檗碱仅仅抑制细胞内源性凋亡途径,对外源性凋亡途径没有影响,但总体上并不足以抑制脓毒症诱导的脾细胞凋亡。
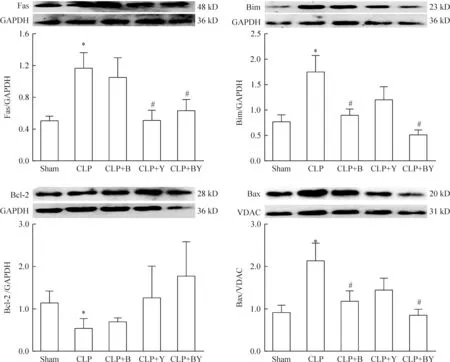
Figure 4.The effects of berberine (B) or/and yohimbine (Y) on Fas, Bim, Bcl-2 expression and mitochondrial Bax content of splenocytes in C57BL/6 mice at 20 h after subjected to CLP. Mean±SEM.n=12~15.*P<0.05vssham;#P<0.05vsCLP. GAPDH was used as the cytoplasm reference protein and voltage-dependent anion channel protein (VDAC) was used as the mitochondrial reference protein.
图4 小檗碱和(或)育亨宾对脓毒症小鼠脾细胞胞浆Fas、Bim、Bcl-2表达及线粒体Bax含量的影响
虽然,Chang等[15]发现在脓毒症引起的淋巴细胞凋亡中,内、外源性2条凋亡途径的交叉作用确实扮演了极其重要的角色, 但目前并没有确定内、外源性凋亡途径在脓毒症引起的脾细胞凋亡中发挥作用的程度。我们的研究发现,育亨宾单用可以显著降低脓毒症小鼠脾细胞中Fas的表达、caspase-8和caspase-3的活化和脾细胞凋亡,而小檗碱能抑制脓毒症引起的脾细胞caspase-9的活化,但不能显著抑制脓毒症引起的脾细胞caspase-3的活化和脾细胞凋亡。 这些结果提示,在脓毒症引起的脾细胞凋亡中,外源性凋亡途径(Fas的表达)的活化可能发挥更大程度的作用。
我们进一步观察发现,小檗碱与育亨宾合用后能显著抑制脓毒症小鼠脾细胞凋亡,不但能显著降低Fas的表达,而且显著降低Bim的表达、减少线粒体Bax的含量,显著降低caspase-8、9、3的活化,因而小檗碱与育亨宾合剂可能同时通过作用于内、外源性两条凋亡途径抑制脓毒症脾细胞的凋亡。
尽管本研究初步探讨了小檗碱与育亨宾发挥抗脓毒症淋巴细胞凋亡的作用机制, 但是本研究尚存在很多不足之处。例如,本研究仅限于内、外源性凋亡途径,而且2条途径的信号分子研究也不全面;脓毒症淋巴细胞的凋亡还涉及其它途径的作用,体内给予α2肾上腺素能受体阻断剂通过何种环节抑制脓毒症诱导的淋巴细胞凋亡,尚未阐明。因此,这些药物作用的具体机制还有待进一步研究。
[1] Mayr FB, Yende S, Angus DC. Epidemiology of severe sepsis[J]. Virulence, 2014, 5(1): 4-11.
[2] Hotchkiss RS, Karl IE. The pathophysiology and treatment of sepsis [J]. N Engl J Med,2003, 348(2): 138-150.
[3] Hotchkiss RS, Monneret G, Payen D. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach [J]. Lancet Infect Dis, 2013, 13(3): 260-268.
[4] Li H, Wang Y, Zhang H, et al. Yohimbine enhances protection of berberine against LPS-induced mouse lethality through multiple mechanisms [J]. PLoS One, 2012, 7(12): e52863.
[5] Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. ACCP/SCCM Con-sensus Conference Committee, American College of Chest Physicians/Society of Critical Care Medicine [J]. Chest, 1992, 101(6):1644-1655.
[6] Marshall JC. Clinical trials of mediator-directed therapy in sepsis: what have we learned? [J]. Intensive Care Med, 2000, 26 (Suppl 1): S75-S83.
[7] Perl M, Chung CS, Perl U, et al. Fas-induced pulmonary apoptosis and inflammation during indirect acute lung injury[J]. Am J Respir Crit Care Med, 2007, 176(6): 591-601.
[8] 栾樱译, 姚咏明. 脓毒症中免疫负调控途径的研究进展[J]. 中国病理生理杂志, 2011,27(3): 616-619,624.
[9] Hotchkiss RS, Tinsley KW, Swanson PE, et al. Sepsis-induced apoptosis causes progressive profound depletion of B and CD4+T lymphocytes in humans[J]. J Immunol, 2001, 166 (11): 6952-6963.
[10]Bao JY, Huang Y, Wang F, et al. Expression of alpha-AR subtypes in T lymphocytes and role of the alpha-ARs in mediating modulation of T cell function[J]. Neuroimmunomodulation,2007,14(6): 344-353.
[11]Ayala A, Chung CS, Xu YX, et al. Increased inducible apoptosis in CD4+T lymphocytes during polymicrobial sepsis is mediated by Fas ligand and not endotoxin[J]. Immunology, 1999, 97(1): 45-55.
[12]Schwulst SJ, Muenzer JT, Peck-Palmer OM, et al. Bim siRNA decreases lymphocyte apoptosis and improves survival in sepsis [J]. Shock, 2008, 30(2): 127-134.
[13]Hotchkiss RS, Swanson PE, Knudson CM, et al. Overexpression of Bcl-2 in transgenic mice decreases apoptosis and improves survival in sepsis [J]. J Immunol, 1999, 162(7): 4148-4156.
[14]Inoue S, Unsinger J, Davis CG, et al. IL-15 prevents apoptosis, reverses innate and adaptive immune dysfunction, and improves survival in sepsis [J]. J Immunol, 2010, 184(3): 1401-1409.
[15]Chang KC, Unsinger J, Davis CG, et al. Multiple triggers of cell death in sepsis: death receptor and mitochondrial-mediated apoptosis [J]. FASEB J, 2007, 21(3):708-719.
Effects of berberine and yohimbine on splenocyte apoptosis in septic mice
JIA Bao-yin, YANG Duo-meng, WANG Yuan, LI Hong-mei, YU Xiao-hui, LÜ Xiu-xiu, LU Da-xiang, WANG Hua-dong
(DepartmentofPathophysiology,SchoolofMedicine,JinanUniversity,KeyLaboratoryofPathophysiology,StateAdministrationofTraditionalChineseMedicineofThePeople’sRepublicofChina,Guangzhou510632,China.E-mail:owanghd@jnu.edu.cn)
AIM: To observe the effects of berberine and yohimbine on splenocyte apoptosis in septic mice and underlying mechanisms. METHODS: The mice were subjected to cecal ligature and puncture (CLP). The drugs or vehicle were given intragastrically 2 h after the surgery according to the following 5 groups: sham, CLP, CLP+berberine, CLP+yohimbine, and CLP+berberine+yohimbine. The apoptosis of splenocytes stained by TUNEL was observed under laser scanning confocal microscope 20 h after CLP. The splenic lymphocytes were isolated and observed using flow cytometry. The activities of caspase-3, caspase-8 and caspase-9 in splenic lymphocytes were detected, and the expression of Fas, Bim, Bcl-2 and Bax in the splenocytes was also determined by Western blotting. RESULTS: The TUNEL staining showed that the apoptotic rate of the splenocytes in septic mice 20 h after CLP was significantly higher than that in sham and CLP+yohimbine groups (P<0.05). Compared with CLP group, the proportion of apoptotic cells was decreased in septic mice in CLP+berberine+yohimbine and CLP+yohimbine groups (P<0.05). Flow cytometry analysis demonstrated the similar results in the apoptosis of splenocytes and T lymphocytes. However, only yohimbine treatment reduced the apoptosis of B lymphocytes in the spleen of sepsis-challenged mice. Compared with CLP group, caspase-9 activity was significantly reduced in CLP+berberine group (P<0.05), the activities of caspase-3, caspase-8 and caspase-9 were all statistically reduced (P<0.05) in CLP+yohimbine group and CLP+yohimbine+berberine group. CLP significantly increased the expression of cytosolic Fas, Bim and mitochondrial Bax in the splenocytes, and decreased Bcl-2 expression compared with sham group. Compared with CLP group, the expression of cytosolic Bim and mitochondrial Bax in CLP+berberine group were reduced (P<0.05). Fas expression decreased only in CLP+yohimbine group (P<0.05). Berberine combined with yohimbine reduced the expression of cytosolic Fas, Bim and mitochondrial Bax in the septic mouse splenocytes (P<0.05).CONCLUSION: Yohimbine reduces sepsis-induced splenic lymphocyte apoptosis in mice by inhibiting Fas expression and in turn blocking both extrinsic and intrinsic apoptosis pathways. Berberine reduces Bim expression and inhibits caspase-9 activation, but not caspase-3 activation and apoptosis in the septic mouse splenocytes. Berberine combined with yohimbine reduces splenocyte apoptosis in the septic mice by inhibiting both extrinsic and intrinsic apoptotic pathways.
Berberine; Yohimbine; Apoptosis; Sepsis; Splenocytes
1000- 4718(2014)12- 2206- 07
2014- 09- 09
2014- 10- 30
国家自然科学基金资助项目(No.30971191; No.81170222);广东省自然科学基金重点项目(No.S2011020005408);广州市科技计划项目(No.12C22071599)
R285.5; R163+.2
A
10.3969/j.issn.1000- 4718.2014.12.016
△通讯作者 Tel: 020-85220241; E-mail: owanghd@jnu.edu.cn
